盐溶液的酸碱性及原因
- 格式:doc
- 大小:79.00 KB
- 文档页数:7

盐溶液的酸碱性及原由【教课目的】知识与技术1.掌握盐类水解的观点;以CH3COONa、NH4Cl 为例理解盐类水解的原理。
2.理解盐类水解的特色和规律。
过程和方法1.经过实验研究、分组议论,进一步让学生掌握“提出问题-剖析问题 -理论解说 -解决问题”的科学方法。
2.经过问题研究,培育学生解决本质问题的能力。
感情、态度和价值观1.经过“盐溶液不必定显中性”的教课,让学生知道全面看事物的辩证思想。
2.培育学生脚踏实地、科学研究的精神。
【教课要点】盐类水解的观点、原理和规律【教课难点】理解盐类水解的原理教课过程:【引入】生活中常用的增添剂除了食盐(NaCl)外,还有味精 (C5H8NO4Na),苏打(Na2CO3),小苏打 (NaHCO3)等,这些都属于化学中的盐类。
这节课我们来学习有关盐类的一些知识——盐类的水解。
【知识回首】依据形成盐的酸、碱的强弱来分,盐能够分红哪几类酸 +碱=盐+水(中和反响)【思虑】酸溶液呈酸性,碱溶液呈碱性,那么盐溶液呈什么性呢【过渡】那么盐溶液的酸碱性有什么规律呢【板书】第三节盐类的水解一、研究盐溶液的酸碱性【找寻规律】研究盐溶液的酸碱性盐溶液酸碱性NaCl中性Na2SO4中性NaHCO3碱性Na2CO3碱性CH3COONa碱性NH4Cl酸性(NH4)2SO4酸性从以上的实验中,我们发现有的盐溶液呈中性,有的盐溶液呈酸性,有的盐溶液呈碱性。
【思虑】试用概括法找出盐的构成(分类)与盐溶液酸碱性的关系。
盐的种类与盐溶液酸碱性的关系:盐溶液构成分类酸碱性NaCl强酸强碱盐中性Na2SO4NaHCO3强碱弱酸盐碱性23Na CO3CH COONaNH4Cl强酸弱碱盐酸性(NH4)2SO4【小结】强酸强碱盐呈中性,强酸弱碱盐呈酸性,强碱弱酸盐呈碱性。
【思虑】为何盐溶液会体现不一样的酸碱性这节课我们就来研究这个问题。
【板书】二、盐溶液体现不一样酸碱性的原由【研究原由】盐溶液体现不一样酸碱性的原由纯水中,当分别加入CH3COONa、 NH4Cl、NaCl 形成溶液后,请思虑:、 NH4 Cl、NaCl 是什么种类的电解质2.它们在水中各以什么形式存在3.其水溶液中各存在哪些微粒4.这些微粒能互相反响吗5.若反响,结果怎么样【讲】以 CH3COONa溶液为例剖析强碱弱酸盐溶液呈碱性的原由。


强酸:氯离子、硫酸根、硝酸根(含有这些的就是强酸)弱酸:碳酸根(主要考察这一种)强碱:钠、钡、钾(含有这些金属离子的是强碱)弱碱:铜、铁、铵等进行组合,例如氯化钾是强酸强碱盐,水溶液显中性。
碳酸钡是强碱弱酸盐,水溶液显碱性。
氯化铁是强酸弱碱盐,水溶液显酸性。
如果盐水解呈碱性,那么酸碱指示剂显示碱性如果盐水解呈酸性,那么酸碱指示剂显示酸性如果盐水解呈中性,那么酸碱指示剂显示中性强酸根:SO4-,Cl-,NO3-等。
弱酸:S-,HS-,碳酸根等。
活泼金属:Na,K等。
较不活泼:Cu,Fe等强酸强碱盐是由活泼金属和强酸根组成的,如Na2SO4,溶于水后,呈中性。
强酸弱碱盐是由较不活泼金属和强酸根组成的,如FeCl3,溶于水后,呈现酸性。
弱酸强碱盐是由活泼金属和弱酸根组成,如Na2CO3,溶于水后,呈现碱性。
弱酸弱碱盐是有较不活泼的金属和弱酸根组成,如NH4CO3,溶于水后,可成酸,碱,中性。
口诀为:“谁强显谁性”,但对于弱酸弱碱盐就不能用了。
上面的还可以根据水解来判断。
如FeCl3水解:Fe3+ +3H20=Fe(OH)3+ 3H+,显酸性首先,要能够把盐看成是一种酸和一种碱中和生成的:如NaCl 是NaOH和HCl生成的,NaNO3 是NaOH和HNO3生成的,CuCl2 是Cu(OH)2和HCl生成的,CH3COONa是NaOH和CH3COOH生成的;其次是记住酸中哪些是强酸,哪些是弱酸:盐酸、硝酸、硫酸是强酸,醋酸、碳酸等是弱酸;碱中哪些是强碱,哪些是弱碱:氢氧化钾、氢氧化钠、氢氧化钡、氢氧化钙是强碱,其余的碱是弱碱.接下来就可以判断了:如NaCl 是NaOH【强碱】和HCl【强酸】生成的【强酸强碱盐】,NaNO3 是NaOH【强碱】和HNO3【强酸】生成的【强酸强碱盐】,CuCl2 是Cu (OH)2【弱碱】和HCl【强酸】生成的【强酸弱碱盐】,CH3COONa是NaOH【强碱】和CH3COOH【弱酸】生成的【强碱弱酸盐】.。

1像NaCl这样,盐中的阳离子【Na+】所对应的氢氧化物【NaOH】是强碱;盐中的酸根阴离子【Cl-】所对应的酸是强酸【HCl】,这种盐就叫做“强酸强碱盐”。
2同理,像NH4F这样,盐中的阳离子【NH4 +】所对应的氢氧化物【NH3·H2O】是弱碱;盐中的酸根阴离子【F-】所对应的酸是弱酸【HF】,这种盐就叫做“弱酸弱碱盐”。
3强酸强碱盐的水溶液一定是中性的,弱酸弱碱盐的水溶液不一定是中性-------------------------强酸强碱盐强酸强碱盐是强酸和强碱反应生成的盐,溶液呈中性比如:氯化钠,硫酸钠,硝酸钾NaOH+HCl=NaCl+H2O2NaOH+H2SO4=2H2O+Na2SO4-----------------------强酸弱碱盐强酸弱碱盐溶于水显酸性如Al2(SO4)3溶于水后,Al3+会发生如下水解反应Al3+ +3H2O = Al(OH)3 + 3H+你可以发现水解后得到了H+,说明溶液是酸性的强碱弱酸盐溶于水一般显碱性如Na2S溶于水发生如下水解反应S2- + H2O = HS - + OH-HS- + H2O = H2S + OH-强酸强碱盐一般是中性的,如氯化钠弱酸弱碱盐一般发生双水解Al2S3+6H2O=2Al(OH)3+3H2S1.强碱弱酸盐溶于水呈碱性,例如:碳酸钠,磷酸钠,氟化钠,硫化钠,次氯酸钠,醋酸钠等等弱酸的钾盐,钠盐,钙盐,钡盐等(如果能溶的话)。
2.强酸弱碱盐溶于水呈酸性,例如,硫酸铵,硫酸铁,硫酸铜,硫酸铝等等弱碱的硫酸盐,硝酸盐,氯化物,溴化物,碘化物等(如果能溶的话)3.部分酸式盐溶于水呈碱性,例如,碳酸氢钠,磷酸一氢钠,硫氢化钠。
部分酸式盐溶于水呈酸性,例如,硫酸氢钠,亚硫酸氢钠,磷酸二氢钠。
有些弱酸弱碱盐呈酸性,例如,草酸铵,氟化铵,亚硫酸铵有些弱酸弱碱盐呈碱性,例如,次氯酸铵,碳酸铵,硫化铵。
记住,比醋酸酸性弱的弱酸的铵盐呈碱性,比醋酸酸性强的弱酸的铵盐呈酸性。

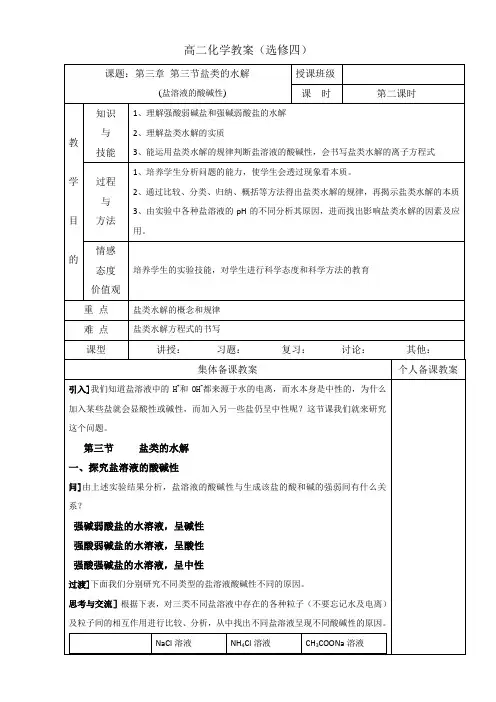
高二化学教案(选修四)C(H+)和C(OH-)相对大小C(H+)=C(OH-)C(H+)>C(OH-)C(H+)<C(OH-)溶液中的粒子Na+、Cl-、H+、OH-、H2O NH4+、Cl-、H+、NH3·H2O、OH-、H2OCH3COO H-、Na+、H+、OH-、H2O、CH3COOH有无弱电解质生成无有有相关化学方程式H2O H++OH-NaCl =Na+ + Cl-H2O H++OH-NH4++ OH-NH3·H2OH2O H++OH-CH3COO- + H+CH3COOH二、盐溶液呈现不同酸碱性的原因讲]CH3COONa溶于水之后,完全电离。
(因为CH3COONa是强电解质。
)投影]CH3COONa ═ CH3COO- + Na+………⑴问]把CH3COONa溶于水之后,溶液中存在哪些电离平衡?投影] H2O H+ + OH-………⑵讲]我们知道,CH3COOH是一种弱酸,在溶液中部分电离,溶液中既然存在CH3COO-和H+,根据,可逆反应,反应物和生成物同时共存,那么就一定有CH3COOH。
投影]CH3COO- + H+ CH3COOH………⑶讲]把⑴⑵⑶式联立,可得到投影]水解方程式:CH3COONa + H2O CH3COOH + NaOH讲]这说明CH3COONa溶于水后,反应有NaOH生成,所以溶液显碱性。
把上述化学方程式改写成离子方程式。
投影]CH3COO- + H2O CH3COOH + OH-讲]随着CH3COONa的加入,对水的电离有什么影响呢?促进了水的电离,可以看作是使水分解了。
醋酸钠与水反应的实质是:醋酸钠电离出的醋酸根离子和水电离出的氢离子结合生成弱电解质醋酸的过程。
投影]1、弱酸强碱盐,水解显碱性 CH3COONa = CH3COO−+ Na+投影]2、强酸弱碱盐,水解显酸性 NH4Cl = NH4+ + Cl−投影]3、强酸强碱盐:不水解4、弱酸弱碱盐:双水解,水解程度增大。

盐溶液的酸碱性归纳与分析要点一、盐类水解的实质1.定义⑴以CH3COONa为例探究盐类的水解CH3COONa溶于水之后,完全电离————强电解质CH3COONa ═ CH3COO- + Na+………① ————(电离出的离子既没有+,也没有OH-)H把CH3COONa溶于水之后,溶液中还存在的电离平衡: H2O H+ + OH-………②————(纯水中c(H+)=c(OH-)=1.0×10-7mol/L,显中性)CH3COOH是一种弱酸,在溶液中部分电离,溶液中既然存在CH3COO-和H+,根据可逆反应,反应物和生成物同时共存,那么就一定有CH3COOH。
CH3COO- + H+CH3COOH………③(CH3COONa电离产生的CH3COO-与水电离产生的H+)随着CH3COONa的加入,CH3COO-结合水电离出的H+,破坏了水的电离平衡,使水的电离平衡右移。
溶液中c(OH-)>1.0×10-7mol/L>c(H+),CH3COONa水溶液显碱性。
⑵盐类水解的定义在溶液中盐电离出来的离子跟水所电离出来的H+ 或 OH-结合生成弱电解质的反应,叫做盐类的水解。
(在溶液中由盐电离出的弱酸的阴离子或弱碱的阳离子跟水电离出的氢离子或氢氧根离子结合生成弱电解质(弱酸或弱碱),破坏了水的电离平衡,使其平衡向右移动,引起氢离子或氢氧根离子浓度的变化。
酸 + 碱盐 + 水2.实质在溶液中盐电离出来的弱酸的阴离子或弱碱的阳离子和水电离出的H+或OH-离子结合生成弱电解质,促进了水的电离。
注意:①只有弱酸的阴离子或弱碱的阳离子才能与H+或OH-结合生成弱电解质。
②盐类水解使水的电离平衡发生移动,促进水的电离,使水电离出的c(OH-)≠c(H+)并使溶液呈酸性或碱性。
③盐类水解反应是酸碱中和反应的逆反应。
水解程度很小,故水解产物极少,盐溶液的酸碱性极弱。
3.水解特征可逆:盐类水解和酸碱中和反应互为可逆反应。

盐的酸碱性强酸弱碱盐溶于水显酸性如Al2(SO4)3溶于水后,Al3+会发生如下水解反应Al3+ +3H2O = Al(OH)3 + 3H+你可以发现水解后得到了H+,说明溶液是酸性的强碱弱酸盐溶于水一般显碱性如Na2S溶于水发生如下水解反应S2- + H2O = HS - + OH-HS- + H2O = H2S + OH-强酸强碱盐一般是中性的,如氯化钠弱酸弱碱盐一般发生双水解Al2S3+6H2O=2Al(OH)3+3H2S1.强碱弱酸盐溶于水呈碱性,例如:碳酸钠,磷酸钠,氟化钠,硫化钠,次氯酸钠,醋酸钠等等弱酸的钾盐,钠盐,钙盐,钡盐等(如果能溶的话)。
2.强酸弱碱盐溶于水呈酸性,例如,硫酸铵,硫酸铁,硫酸铜,硫酸铝等等弱碱的硫酸盐,硝酸盐,氯化物,溴化物,碘化物等(如果能溶的话)3.部分酸式盐溶于水呈碱性,例如,碳酸氢钠,磷酸一氢钠,硫氢化钠。
部分酸式盐溶于水呈酸性,例如,硫酸氢钠,亚硫酸氢钠,磷酸二氢钠。
有些弱酸弱碱盐呈酸性,例如,草酸铵,氟化铵,亚硫酸铵有些弱酸弱碱盐呈碱性,例如,次氯酸铵,碳酸铵,硫化铵。
记住,比醋酸酸性弱的弱酸的铵盐呈碱性,比醋酸酸性强的弱酸的铵盐呈酸性。
常见强酸:硫酸,硝酸,盐酸,氢溴酸,氢碘酸,高氯酸。
常见强碱:氢氧化钠,氢氧化钾,氢氧化钙,氢氧化钡。
常见弱酸:亚硫酸,氢氟酸,磷酸,草酸,醋酸,碳酸,次氯酸,硅酸,氢硫酸。
常见弱碱:氨水,氢氧化铝,氢氧化铁,氢氧化铜,氢氧化亚铁,氢氧化镁。
【知识讲解】一、盐类水解的实质盐类在水溶液中电离出的离子跟水电离出的H+或OH-生成难电离的分子或离子,从而破坏了水的电离平衡,使水的电离度增大。
判断盐类水解能否水解的条件:一看能否溶,不溶不水解;二看有无弱,无弱不水解。
二、盐类水解的类型和规律判断盐类能否发生水解及水解后溶液显酸碱性要看盐电离的离子对应的酸或碱的相对强弱。
1、盐类水解的类型盐的类型是否水解常见能水解的离子溶液PH值一价:CH3COO-、HS-、AlO2-、ClO-、HCO-3 PH> 7强碱弱酸盐水解二价:S2-、CO32-、SiO32 -、HPO42-三价:PO43-、ASO43-一价:NH4+、Ag+ PH< 7强酸弱碱盐水解二价:Fe2+、Cu2+、Sn2+、Zn2+三价:Al3+、Fe3+强酸强碱盐不水解PH= 72、水解规律:有弱才水解,无弱不水解;谁弱谁水解,越弱越水解;三价阳离子都水解,多元弱酸根离子分步水解。

【盐类的水解知识大复习】一、探究盐溶液的酸碱性结论:强酸弱碱盐显酸性,强碱弱酸盐显碱性,强酸强碱盐显中性。
二、盐溶液呈现不同酸碱性的原因三、盐的水解原理1.泄义:在溶液中,盐电离出来的阴离子或阳离子与水所电离出来的H+或0H结合生成弱电解质,这种作用叫做盐类的水解。
2.实质及结果实质:促进水的电离平衡。
结果:盐的溶液呈现出不同程度的酸、碱性。
3.水解条件a.盐必须溶于水中b.生成盐的酸或碱是弱酸或弱碱(有弱才水解,无弱不水解,都弱双水解)4.水解特征水解是微弱、可逆的,用可逆符号“=”【小结】水解规律:有弱才水解,无弱不水解,都弱双水解,谁强显谁性,都强显中性5盐溶液中水的电离规律【例题】1、pH=3的HC1和pH=ll的NaOH溶液中由水电离出来的c(H+)*2、pH=3的NHQ 和pH=ll的CH3COONa溶液中由水电离出来的c(H+)水【小结】盐溶液中水的电离有如下规律:a.在强酸弱碱盐溶液中,盐的水解促进了水的电离,水的电离程度比纯水、酸或碱溶液(抑制水的电离)中水的电离程度大。
b.在酸或碱溶液中,c(HJ、c(OH)中小的那一个表示水的电离:在盐溶液中,c(H+)、c(OH) 中大的那一个反映了水的电离程度。
四、水解方程式的书写(1)判断能否水解;(2)水解是微弱的,用可逆符号表示。
通常不生成沉淀或气体,也不发生分解。
在书写离子方程式时一般不标“丨"或“ f ",也不把生成物(如H2CO3、NH)・FhO等)写成其分解产物的形式:(3)多元弱酸的盐分步水解,以第一步为主。
(4)多元弱碱盐的水解视为一步完成。
(5)双水解一一不完全双水解与完全双水解不完全水解用可逆符号,完全水解用等号表示。
五、盐类水解的影响因素1•内因——越弱越水解〔越热越水解,越稀越水解)以醋酸钠为例:CH3COO+H2O CHsCOOH+OH- K hK _ c(CH.COOH) c(OH ) _ c(CH.COOH) ・c(OH) • c(H ) »c(CH,COO ) c(CHCOO ) c(H )KA弱酸或弱碱的电离常数越(越弱),其所生成的盐水解的程度就越大。

盐溶液酸碱性的判断方法:
1.判断原则
①c(H+)=c(OH-),溶液显中性;
②c(H+)>c(OH-),溶液显酸性;
③c(H+)<c(OH-),溶液显碱性.
2.判断规律
①强酸强碱盐的水溶液显中性;
②强酸弱碱盐的水溶液显酸性;
③弱酸强碱盐的水溶液显碱性.
3.理论解析
①强酸强碱盐:是指由强酸与强碱发生中和反应而生成的盐,如Na Cl.它在水溶液中,阴、阳离子都不发生水解,溶液中c(H+)=c(OH-).因此,强酸强碱盐的水溶液显中性。
②强酸弱碱盐:是指由强酸与弱碱发生中和反应而生成的盐,如CuCl2.它在水溶液中,阳离子(Cu2+)能发生水解,与水电离出来的OH-结合生成弱电解质Cu(OH)2,从而促进水的电离,结果使溶液中c(H+)>c(OH-).因此,强酸弱碱盐的水溶液显酸性;
③弱酸强碱盐:是指由弱酸与强碱发生中和反应而生成的盐,如Na2CO3.它在水溶液中,阴离子(碳酸根离子即CO3 2-)能发生水解,与水电离出来的H+结合生成弱电解质HCO3-,从而促进水的电离,结果使溶液中c(H+)<c(OH-).因此,弱酸强碱盐的水溶液显碱性.
总之,“强强不水解(显中性),谁弱谁水解,谁强显谁性。
”。

盐溶液的酸碱性——盐类的水解1.盐类水解的重要应用:(1)判断离子能否共存:若阴、阳离子均发生水解反应,两者混合时,水解反应会相互促进,致使阴、阳离子的水解程度较大而不能大量共存,该过程称为双水解反应。
发生双水解反应的离子有Fe3+、Al3+与CO2-3、HCO-3、HS-等。
如Al3++3HCO3—→Al(OH)3↓+3CO2↑(泡沫灭火器工作原理),Al3++3HS-+3H2O→Al(OH)3↓+3H2S↑(2)判断盐溶液蒸干时所得的产物:①强碱弱酸或水解生成难挥发性酸的盐溶液,蒸干后一般得到原物质,如CuSO4溶液蒸干得到CuSO4;Na2CO3溶液蒸干得Na2CO3AlCl3溶液蒸干得到Al(OH)3,灼烧得Al2O3.Ca(HCO3)2、NaHCO3、KMnO4固体受热易分解,因此蒸干灼烧后分别为:Ca(HCO3)2变为CaCO3(CaO);NaHCO3变为Na2CO3;KMnO4变为K2MnO4和MnO2;弱酸的铵盐蒸干后无固体,如NH4Cl、NH4HCO3、(NH4)2CO3.④还原性盐在蒸干时会被O2氧化,如Na2SO3溶液蒸干得到Na2SO4(3)保存、配制某些盐溶液,如配制FeCl3溶液时,为防止出现Fe(OH)3沉淀,常加几滴盐酸来抑制FeCl3的水解;在实验室盛放Na2CO3、CH3COONa、Na2S等溶液的试剂瓶不能用玻璃塞,应用橡胶塞。
(4)利用盐类的水解反应制取胶体、净水,如实验室制备Fe(OH)3胶体的原理为:FeCl3+3H2O Fe(OH)3(胶体)+3HCl,明矾净水的原理为Al3+水解生成氢氧化铝胶体,胶体具有很大的表面积,吸附水中悬浮物而聚沉。
2.溶液中微粒浓度的大小比较:,掌握“三个守恒”(电荷守恒、物料守恒、质子守恒)3.电离理论——弱电解质的电离是微弱的(电离度一般不到1%):(1)弱电解质的电离是微弱的,电离产生的微粒都非常少,同时还要考虑水的电离。
如何判断盐溶液的酸碱性或pH?如相同的物质的量浓度的下列溶液:NaCl, KHSO4-, Na3PO4, Na2HPO4, CH3COOH, PH由大到小的顺序是怎样?要详细解。
(大致的顺序我能够判断,但是像这个:Na3PO4, Na2HPO4这两个要怎么判断呢?)这个要看这些盐会不会水解了,要水解的盐一般都是强酸和弱碱反映生成的盐或者是强碱和弱酸反映生成的盐,或者是弱酸和弱碱反映生成的碱,NaCl对应的酸是HCl,碱是NaOH,其中HCl是强酸,NaOH是强碱,因此,NaCl的水溶液是中性,KHSO4的电离是K+与H+与SO4 2-,类似与HCl,因为若都是1mol的话,都能电离出1mol的H+,故类似,因此,KHSO4可看作HCl;CH3COOH是弱电解质,相同的物质的量,与HCl相比电离出来的c(H+)少; Na3PO4对应的碱是NaOH,是强碱;H3PO4是中强酸,因而PO4 3-要水解,水解的方程式是PO4 3- +H2O=HPO4 2- +OH- ;HPO4 2-+H2O=H2PO4- +OH- ;H2PO4- +H2O=H3PO4+OH- ,在这里,不管是PO4 3- 还是HPO4 2- 还是H2PO4-对应的盐,都是如上水解,要判断PO4 3- 还是HPO4 2- 还是H2PO4-对应的盐的水解,就看它们要几步水解才能变成该酸根对应的酸,PO4 3-水解需要3步,HPO4 2-需要2步。
若都是相同的物质的量,1mol的PO4 3-能水解出3mol的OH- ,1mol的HPO4 2- 能水解出2mol的OH-,因此,这些盐的PH由小到达是PH(KHSO4)<PH(CH3COOH)<PH(NaCl)<PH(Na2HPO4)<PH(Na3PO4)第一,看所含OH-多少c(OH-)=c(NaOH)c(OH-)=2*c(Ba(OH)2)第二,看构成如果是强碱弱酸盐会水解,按照酸根水解情况看(一般按照酸性强弱看也可以),哪个厉害哪个的碱性强如pH Na2SO3>Na2Ac>Na2CO3同理弱碱强酸盐,按照碱根水解情况,哪个水解强哪个酸性强pH NaCl>NH4Cl弱碱弱酸盐,一般会双水解。
课题:盐类的水解反应基础自测盐类的水解1.盐溶液呈酸碱性的原因 (1)盐的类型和溶液的酸碱性探究 ①实例:盐溶液 NaCl Na 2CO 3 NH 4Cl CH 3COONa AlCl 3溶液的酸碱性 中性 碱性 酸性 碱性 酸性 盐的类型 强酸强碱盐弱酸强碱盐强酸弱碱盐弱酸强碱盐强酸弱碱盐并不是所有的盐溶液都呈中性,通常强酸强碱盐的溶液呈中性,强酸弱碱盐的溶液呈酸性,弱酸强碱盐的溶液呈碱性。
(2)盐溶液酸碱性的理论分析 ①NH 4Cl 溶液: 图示解释 NH +4结合H 2O 电离产生的OH -生成弱电解质NH 3·H 2O ,使水的电离平衡正向移动,使c (H +)>c (OH -),溶液呈酸性 表示NH +4+H 2ONH 3·H 2O +H +②CH 3COONa 溶液: 图示解释 CH 3COO -结合H 2O 电离产生H +生成弱电解质CH 3COOH ,使水的电离平衡正向移动,使c (H +)<c (OH -),溶液呈碱性 表示CH 3COO -+H 2OCH 3COOH +OH -③NaCl 溶液:⎭⎪⎬⎪⎫NaCl===Na ++Cl -H 2O OH -+H + 2.盐类水解的概念和本质(1)概念: 在水溶液中盐电离产生的离子与水电离产生的H +或OH -结合生成弱电解质溶液中无弱电解质生成,水的电离平衡未被破坏,溶液中c (H +)=c (OH -),呈中性的反应,叫做盐类的水解。
(2)实质:盐电离产生的阳离子或阴离子能结合水电离产生的OH-或H+生成弱电解质,从而促进水的电离平衡朝着电离方向移动。
(3)特征①一般是可逆反应,在一定条件下达到化学平衡。
②盐类水解反应是中和反应的逆反应。
③盐类水解是吸热反应。
[特别提醒]HF、CH3COOH均为弱酸,且酸性HF>CH3COOH,依据越弱越水解可知,等浓度的CH3COONa的碱性强于NaF。
盐类水解离子方程式1.盐类水解离子方程式的书写规律(1)一般盐类水解程度很小,水解产物很少,通常不生成沉淀和气体,也不发生分解,因此盐类水解的离子方程式中不标“↑”或“↓”,也不把生成物(如NH3·H2O、H2CO3等)写成其分解产物的形式。
盐溶液的酸碱性及原因
【教学目标】
知识与技能
1.掌握盐类水解的概念;以CH3COONa、NH4Cl为例理解盐类水解的原理。
2.理解盐类水解的特点和规律。
过程和方法
1.通过实验探究、分组讨论,进一步让学生掌握“提出问题-分析问题-理论解释-解决问题”的科学方法。
2.通过问题探索,培养学生解决实际问题的能力。
情感、态度和价值观
1.通过“盐溶液不一定显中性”的教学,让学生知道全面看事物的辩证思想。
2.培养学生实事求是、科学探索的精神。
【教学重点】盐类水解的概念、原理和规律
【教学难点】理解盐类水解的原理
教学过程:
【引入】生活中常用的添加剂除了食盐(NaCl)外,还有味精(C5H8NO4Na),苏打(Na2CO3),小苏打(NaHCO3)等,这些都属于化学中的盐类。
这节课我们来学习有关盐类的一些知识——盐类的水解。
【知识回顾】
根据形成盐的酸、碱的强弱来分,盐可以分成哪几类
酸+ 碱=盐+ 水(中和反应)
【思考】酸溶液呈酸性,碱溶液呈碱性,那么盐溶液呈什么性呢【过渡】那么盐溶液的酸碱性有什么规律呢
【板书】第三节盐类的水解
一、探究盐溶液的酸碱性
【寻找规律】探究盐溶液的酸碱性
盐溶液酸碱性
NaCl中性
Na2SO4中性
NaHCO3碱性
Na2CO3碱性
CH3COONa碱性
NH4Cl酸性
从以上的实验中,我们发现有的盐溶液呈中性,有的盐溶液呈酸性,有的盐溶液呈碱性。
【思考】试用归纳法找出盐的组成(分类)与盐溶液酸碱性的关系。
盐的类型与盐溶液酸碱性的关系:
【小结】强酸强碱盐呈中性,强酸弱碱盐呈酸性,强碱弱酸盐呈碱性。
【思考】为什么盐溶液会呈现不同的酸碱性这节课我们就来研究这个问题。
【板书】二、盐溶液呈现不同酸碱性的原因
【探究原因】盐溶液呈现不同酸碱性的原因
纯水中,当分别加入CH3COONa、NH4Cl、NaCl形成溶液后,请思考:
、NH4Cl、NaCl是什么类型的电解质
2.它们在水中各以什么形式存在
3.其水溶液中各存在哪些微粒
4.这些微粒能相互反应吗
5.若反应,结果怎么样
【讲】以CH3COONa溶液为例分析强碱弱酸盐溶液呈碱性的原因。
我们把
CH3COONa溶于水之后,溶液中存在以下两个电离平衡:
【投影】H 2O H+ + OH-(1)
CH3COONa ═CH3COO- + Na+(2)
【讲】我们知道,CH3COOH是一种弱酸,在溶液中部分电离,溶液中既然存在CH3COO-和H+,那么就一定有CH3COOH生成,消耗了水中的H+,促进了水的电离,溶液中的C(H+)<C(OH-),溶液呈碱性。
【投影】1、弱酸强碱盐,水解显碱性
CH3COONa = CH3COO−+ Na+
+
H2O H++ OH−
CH3COOH
水解方程式:CH3COONa + H23COOH + NaOH
离子方程式:CH3COO−+ H23COOH + OH−
【讲】从离子方程式可知,醋酸钠与水反应的实质是:醋酸钠电离出的醋酸根离
子和水电离出的氢离子结合生成弱电解质醋酸的过程。
【思考与交流】NH4Cl溶液中存在那些电离溶液中那些离子间相互作用使溶液呈酸性
【投影】2、强酸弱碱盐水解
NH4Cl = NH4+ + Cl−
+
H2O OH−+ H+
NH3·H2O
水解方程式:NH4Cl + H2O NH3·H2O + HCl
离子方程式:NH4+ + H2O NH3·H2O + H+
【问】由上可知,强碱弱酸盐水解使溶液显碱性,强酸弱碱盐水解使溶液显酸性。
那么强酸强碱盐会发生水解吗
【讲】说得好!是不会。
因为强酸强碱盐所电离出来的离子都不会和水电离出来的H+或OH-发生反应,比如NaCl,电离出来的Na+和Cl-都不会与水电离出来的
H+或OH-反应,对水的电离平衡没有影响,C(H+)=C(OH-),溶液呈中性。
【投影】3、强酸强碱盐:不水解
【讲】根据刚才我们一起分析的各种盐在水溶液在的情况,大家思考:什么是盐的水解
【板书】1、盐类水解:在溶液中盐电离出来的弱离子跟水所电离出来的H+或
OH–结合生成弱酸、弱碱的反应,叫做盐类的水解。
【讲】在溶液中盐电离出来的弱离子跟水所电离出来的H+或OH-结合生成弱酸弱碱的反应,叫做盐类的水解。
这就是盐溶液呈现不同酸碱性的原因。
【思考】结合盐类水解的定义及盐的组成、盐溶液的酸碱性分析盐类水解的条件、实质是什么有什么规律
【板书】2.水解的条件:易溶于水、在水溶液中电离出弱酸阴离子或弱碱阳离子。
3.盐类水解的实质:破坏了水的电离平衡,促进了水的电离。
4.盐类水解的规律:
有弱才水解,无弱不水解,越弱越水解,都弱都水解;谁强显谁性,同强显中性。
【小结】本节课我们学习了盐类溶液呈酸碱性的原因及盐类水解的概念、条件及水解的规律。
板书设计
第三节盐类的水解
一、探究盐溶液的酸碱性
强酸强碱盐呈中性,强酸弱碱盐呈酸性,强碱弱酸盐呈碱性。
二、盐溶液呈现不同酸碱性的原因
1.盐类水解:在溶液中,由于盐的离子与水电离出来的H+或OH-结合生成弱电解质的过程中。
2.水解的条件:易溶于水、在水溶液中电离出弱酸阴离子或弱碱阳离子。
3.盐类水解的实质:破坏了水的电离平衡,促进了水的电离。
4.盐类水解的规律:有弱才水解,无弱不水解,越弱越水解,都弱都水解;谁强显谁性,同强显中性。