高一化学气体摩尔体积
- 格式:doc
- 大小:82.50 KB
- 文档页数:5

第2课时气体摩尔体积知识要点气体摩尔体积的涵义及适用范围1.气体摩尔体积:单位物质的量气体所占的体积叫做气体摩尔体积。
符号为V m ,数学表达式为V m =n V ,单位为L /mol 或m 3/mol 。
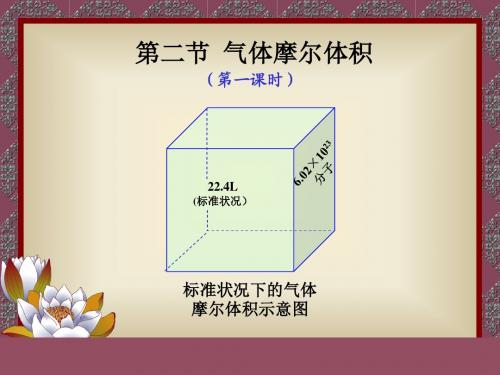
2.标准状况下的气体摩尔体积:是指在标准状况下,1 mol 任何气体所占的体积都约是22.4 L 。
气态物质分子间距离较大,大约是其分子直径的10倍,所以决定气体体积大小的因素主要是分子间的平均距离。
在同温同压下,不同气体分子间的平均距离几乎是相等的,所以任何气态物质的摩尔体积在标准状况下都是22.4 L /mol 。
在非标准状况下,由于气体分子之间平均距离的大小与温度、压强有关,所以22.4 L 只局限于在标准状况下才能使用。
标准状况是指0℃、101 kPa ,注意通常状况并不是标准状况,它是指20℃左右、101 kPa 。
气体摩尔体积是指气态物质,可以是纯净物,也可以是混合物。
基础训练(时间20分钟,分值40分)1.(4分)在标准状况下,相同质量的下列物质占体积最大的是()A.H 2SO 4B.NaOHC.CO 2D.NH 3答案:D 标况下H 2SO 4为液体 NaOH 为固体 CO 2、NH 3为气体 NH 3式量比CO 2小,相同质量时NH 3物质的量较大,体积较大。
2.(5分)在标准状况下,1.6 L 氮气含m 个分子,则阿伏加德罗常数为()A.14mB.28mC.m /28D.7m答案:A m =4.226.1×N A ∴N A =14m 3.(5分)将H 2,O 2,N 2三种气体分别装在三个容器中,当温度和密度相同时,三种气体压强(p )的大小关系正确的是() A.p H2=p O2=p N2 B.p H2>p N2>p O2C.p O2>p N2>p H2D.p O2>p H2>p N2答案:B PV =nRT =Mm RT PM =ρRT 当温度和密度相同时,压强与摩尔质量成反比。

高一化学气体摩尔体积知识点
嘿,同学们!今天咱就来聊聊高一化学超级重要的气体摩尔体积这个知识点呀!比如说咱平常吹气球,那气球能吹多大,和气体摩尔体积可大有关系呢!
你想啊,气体摩尔体积就好像是气体们的一个“小团体标准”。
咱可以把气体想象成一群调皮的小精灵,它们到处乱跑,占的空间也不太一样。
但有了气体摩尔体积,咱就有个统一的标准来衡量它们啦。
就好比不同的小精灵都有了自己的“帮会规则”一样!比如,在标准状况下,1 摩尔任何气体所占的体积都约是升呢。
你说神奇不神奇?
咱再想想看哦,为啥同样是 1 摩尔的氧气和 1 摩尔的氢气,它们体积差不多呢?这就是气体摩尔体积在起作用呀!这就像是不同班级的同学,都要遵守学校的统一规定一样。
所以呀,大家一定要好好理解这个知识点,它可是在好多化学问题里都超级重要的呢!咱得把这个“小精灵帮会规则”搞得清清楚楚的,才能在化学的世界里畅游无阻呀!结论就是:气体摩尔体积是高一化学中超关键的知识点,一定要掌握好哟!。



气体摩尔体积(8)一、选择题(本题包括10小题,每小题2分,共20分。
每小题有一个选项符合题意) 1.相同条件下,下列各组中分子数相同的是( )A. 14gN2与32gNO2B. 34gNH3与4gH2C. 2LCO2与2LH2OD. 11.2LCO与0.5molO22.在同温同压下,甲容器的H2和乙容器的NH3所含的氢原子个数相等,则这两容器的体积比为( )A. 3:2B. 2:3C. 1:1D. 3:13.150℃时,(NH4)2CO3完全分解,生成的气态混合物其密度是相同条件下H2密度的( )倍A. 96B. 48C. 24D. 124.液态二硫化碳(CS2)能够在氧气中燃烧生成CO2和SO2。
今用0.228gCS2在448mL氧气(标准状况)中完全燃烧,反应后气体混合物在标准状况时的体积是( )A. 112mLB. 224mLC. 336mLD. 448mL5.将①氢气;②氧气;③甲烷三种气体分别盛放在三个容器中,并保持三个容器内气体的温度和密度均相等,这三种气体对容器所施加压强的大小关系是( )A. ①>②=③B. ①<②<③C. ①>③>②D. ①<③<②6.影响一定量气体占有气体大小的主要因素是( )A. 气体分子的微粒数B. 微粒本身的大小C. 微粒的质量D. 微粒间的平均距离7.一定质量的无水乙醇完全燃烧时放出的热量为Q,它所生成的CO2用过量的饱和石灰水完全吸收可得100gCaCO3沉淀,则完全燃烧1mol无水乙醇时放出的热量是( )A. 0.5QB. QC. 2QD. 5Q8.在273℃、101kPa下,将1.40gN2、1.60gO2和4.00gAr混合,该混合气体的体积约为( )A. 3.36LB. 6.72LC. 8.96LD. 4.48L9.实验测得氮气和氧气的混合气体的密度是氢气的14.5倍,可知其中氮气的质量分数为( )A. 25.0%B. 27.6%C. 72.4%D. 75%10.19世纪,化学家对氧化锆的化学式有争议。
后经化学实验测定,锆(Zr)的相对原子质量约为91,其氯化物蒸气的密度是同温同压下H2密度的116~117倍。
试推断与氯化物价态相同的氧化锆的化学式为( )A. ZrOB. Zr2OC. Zr2O3D. ZrO2二、选择题(本题包括7小题,每小题4分,共28分。
每小题有一至二个选项符合题意,少选扣2分,多选、错选均不给分)11.在相同条件下,物质的量相同的两种气体必须( )A. 体积相同B. 体积均为22.4LC. 原子数相同D. 分子数相同12.相同状态下,两个容积一样的容器,一个装满NO,另一个装满N2和O2混合气体,两个容器中一定相等的是( )A. 原子数B. 质子数C. 分子数D. 质量13.同温同压下,等质量的O2和SO2的( )A. 密度比为1:2B. 体积比为2:1C. 分子个数比为1:2D. 所含原子个数比为1:114、今有H2、CO(体积比为1:2)的混合气体VL,当其完全燃烧时所需O2体积为( )A. 3VLB. 2VLC. VLD. 0.5VL15、下列叙述错误的是( )A. 标准状况下任何气体的摩尔体积都约是22.4LB. 1mol气体的体积若为22.4L,它必定处于标准状况C. 两种气体的物质的量之比等于其分子个数比D. 标准状况下的气体摩尔体积实际上是阿伏加德罗定律的特例16、标准状况下有①6.72LCH4;②3.01×1023个HCl;③13.6gH2S(g);④0.2molNH3(g)。
下列对四种气体的关系从小到大表示不正确的是( )A. 体积:④<①<②<③B. 密度:①<④<③<②C. 质量:④<①<③<②D. 氢原子数:④<②<③<①17、设N A表示阿伏加德罗常数,下列说法正确的是( )A. 2.4g金属镁变成镁离子时失去的电子数目为0.1N AB. 2g氢气所含分子数目为N AC. 在25℃,1.01×105Pa时,11.2L氮气所含的原子数目为N AD. 标准状况下,以任意比混合的氦气和氧气混合物22.4L,所含的分子数为N A 18.在标准状况下,下列气体混合后所得混合气体的平均相对分子质量可能为40的是( )A. H2和O2B. F2和HClC. SO2和HBrD. N2和Cl219.已知阿伏加德罗常数、物质的摩尔质量及摩尔体积,尚不能全部计算出其近似值的物理量是( )A. 固体物质分子的大小和质量B. 液态物质分子的大小和质量C. 气体物质分子的大小和质量D. 气体物质分子的质量20.1L甲气体和1L乙气体恰好完全反应生成2L丙气体(所有气体的体积均在标准状况下测定)。
若丙气体的分子式是YX2,则甲、乙的分子式分别是( )A. X2和Y2B. XY和Y2C. X2和XYD. YX2和Y221.X2气和Y2气共100mL,通过光照使它们充分反应,恢复到原状况时,发现体积仍是100mL,这说明( )A. X2气过量B. X2气和Y2气各50mLC. 产物是双原子分子D. 无法作出上述判断22.将50mLH2、CO和CO2的混合气体,与20mLO2(过量)于某容器中混合,引燃后冷却,当恢复至原室温时,测得气体体积为37mL,通过NaOH溶液后剩余的气体为3mL,则原50mL混合气体中CO2、CO、H2的体积(mL)依次是( )A. 16、16、18B. 16、18、16C. 18、16、16D. 18、14、18三、填空题(本题包括10小题,共31分)23.(7分)为了测定某气体样品C4H10(并含有少量C3H8,均不溶于水)的平均相对分子质量,设计了下面的实验:①取一个配有合适胶塞的洁净、干燥的锥形瓶,准确称量,得到质量m1;②往锥形瓶中通入干燥的该气体样品,塞好胶塞,准确称量,重复操作,直至前后两次称量结果基本相同,得到质量m2;③往锥形瓶内加满水,塞好胶塞,称量,得到质量m3。
已知实验时的温度为T(K),压强为p(kPa),水的密度为ρ水(g/L),空气的相对平均分子质量为29.0,密度为ρ空气(g/L)。
回答下列问题:⑴本实验的原理是(具体说明)_________________________________________________。
⑵步骤②中为什么要重复操作,直至前后两次称量结果基本相同?答:______________________________________________________________________。
⑶具体说明本实验中怎样做到每次测量都是在相同体积下进行的?答:______________________________________________________________________。
⑷本实验中收集气体样品的操作,可选用的方法是(填下图中标号)___________。
⑸锥形瓶中空气的质量(m空气)是___________________________(列出算式)。
⑹锥形瓶中样品的质量(m样品)是___________________________(列出算式)。
⑺由实验测得该气体样品的平均相对分子质量是________________________(列出算式)。
24.(2分)标准状况下,2gH2与16gO2混合后,其体积是__________L,密度是________g/L。
25.(1分)在28%的KOH水溶液中,OH-与水分子数之比是____________。
26.(3分)在KCl和CaCl2所组成的某混合物中,K+与Ca2+的物质的量之比为2:1,则该混合物中含CaCl2的质量分数为__________,KCl与CaCl2的物质的量之比为_________,含1molCl-的该混合物的质量是__________g。
27.(8分)现有一份CuO和Cu2O混合物,用H2还原法测定其中CuO的质量x(g)。
实验中可以测定如下数据:w—混合物的质量(g)、w(H2O)—生成H2O的质量(g)、w(Cu)—生成Cu的质量(g)、V(H2)—消耗的H2的体积(L)。
⑴为了计算x,至少需要测定上述四个数据中的______个,这几个数据的组合共有_____种,请将这些组合一一填入下表空格中。
说明:①选用w、w(H2O)、w(Cu)、V(H2)表示,不必列出具体计算式。
⑵从上述组合中选写一个含w的求x的计算式:x=____________________。
28.(1分)加热分解5g某固体化合物,得到0.7L(标准状况)A气体和4g残渣,则A的式量是______________。
29.(5分)常温下A和B两种气体组成混合气体(A的式量小于B的式量),经分析混合气体只含有氮和氢两种元素,而且,不论A和B以何种比例混合,氮和氢的质量比值总大于14/3。
由此可确定A为__________,B为___________,其理由是____________________________________________________。
若上述混合气体中氮和氢的质量比为7:1,则在混合气体中A和B的物质的量之比为_________,A在混合气体中的体积分数为___________。
30.(2分)实验测得CO、N2和O2等三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为_________。
若其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为__________。
31.(2分)相同条件下,某Cl2与O2混合气体100mL恰好与150mL氢气化合生成HCl和H2O,则混合气体中Cl2与O2的体积比为__________,混合气体的相对分子质量为__________。
四、简答题(本题共3分)32.(3分)在等物质的量的常见金属单质A和B中,分别加入足量的盐酸,在A中加入盐酸,B中加入稀硫酸,反应完全后,生成氢气的体积分别为V A和V B,而且V A≠V B。
若要确定反应生成物中A和B的化合价,有下列数据供选择:①V A/V B的值;②V A或V B 的值;③A(或B)的物质的量。
你的选择是______________。
简要地说明你选择后推导A、B化合价的过程。
五、计算题(本大题包括2小题,共22分)33.(10分)现有镁、铝合金5.1g完全溶于稀硫酸中,在标准状况下共收集到氢气5.6L,计算这种合金的百分组成。
34.(12分)将炭粉与w g氧气置于密闭容器中,经高温充分反应Array后,恢复到初始温度,测得反应前后压强分别为P0、P。
已知P=nP0,且加入的炭粉质量x(g)与n的关系如图所示。