气体摩尔体积的计算
- 格式:ppt
- 大小:70.50 KB
- 文档页数:9



气体摩尔体积计算
气体摩尔体积是指在标准大气压和常温下,一摩尔气体所占据的体积大小。
其计算式为:
V_m = V/n
其中,V_m表示气体摩尔体积,V表示气体的体积,n表示气体的摩尔数(单位为mol)。
在标准大气压和常温下,每摩尔气体所占据的体积大小为22.4 L,因此,可以通过以下公式计算气体的摩尔数:
n = V/22.4
例如,如果一个气体占据的体积大小为44.8 L,则其所含摩尔数为:
n = 44.8/22.4 = 2 mol
因此,该气体的摩尔体积为:
V_m = V/n = 44.8/2 = 22.4 L/mol
需要注意的是,气体摩尔体积的计算式仅适用于标准大气压和常温下的气体。
如果气体的温度或压力发生变化,则其摩尔体积也会发生变化,需要使用相应的公式进行计算。

化学气体摩尔体积知识点化学气体摩尔体积是指在一定的温度和压力下,气体的摩尔体积与气体的摩尔数之间的关系。
摩尔体积是指单位摩尔气体所占据的体积,通常用升或立方米表示。
在理想气体状态方程中,PV = nRT,其中P表示气体的压力,V表示气体的体积,n表示气体的摩尔数,R是理想气体常数,T表示气体的温度。
根据这个方程,我们可以推导出气体的摩尔体积的计算公式。
我们需要知道气体的摩尔质量。
摩尔质量是指1摩尔气体的质量,在化学中常用g/mol表示。
例如,氧气的摩尔质量是32g/mol,氮气的摩尔质量是28g/mol。
我们需要知道气体的密度。
密度是指单位体积内的质量,常用g/L 或kg/m³表示。
通过知道气体的摩尔质量和密度,我们可以计算出气体的摩尔体积。
计算公式如下:摩尔体积 = 密度 / 摩尔质量举个例子来说明。
假设我们知道氧气的密度是1.43 g/L,摩尔质量是32 g/mol。
那么,我们可以计算出氧气的摩尔体积:摩尔体积 = 1.43 g/L / 32 g/mol = 0.0447 L/mol这意味着在给定的条件下,1摩尔的氧气占据0.0447升的体积。
需要注意的是,摩尔体积受温度和压力的影响。
根据理想气体状态方程,当温度或压力发生变化时,摩尔体积也会相应改变。
在实际应用中,我们常常需要根据实验条件来计算气体的摩尔体积。
需要注意的是,摩尔体积只适用于理想气体。
理想气体是指在一定温度和压力下,气体分子间无相互作用力,体积可以忽略的气体。
在实际情况中,气体分子间会存在相互作用力,摩尔体积的计算会受到影响。
对于非理想气体,摩尔体积的计算需要考虑更多的因素。
总结起来,化学气体摩尔体积是指在一定条件下,单位摩尔气体所占据的体积。
通过摩尔质量和密度的关系,可以计算出气体的摩尔体积。
然而,摩尔体积受温度和压力影响,只适用于理想气体。
对于非理想气体,需要考虑更多的因素。
了解气体的摩尔体积有助于我们在化学实验和工业生产中的气体计量和控制。

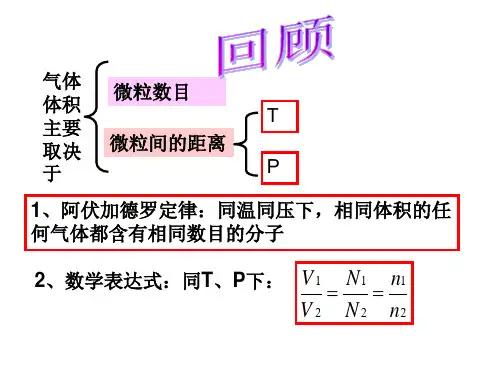
气体摩尔体积1、气体摩尔体积的含义:在一定温度和压强下,单位物质的量的气体所占的体积叫做气体摩尔体积,符号是V m ,它的常用单位是L·mol -1和m 3·mol -1。
关于物质的量(n )、气体的体积(V )和气体摩尔体积(V m )之间的计算公式为m V V n =。
可变形为V=n·V m 与mV n V =。
2、标准状况下气体摩尔体积:在标准状况(指0℃、101 kPa ,记作:STP )下,气体摩尔体积约为22.4 L·mol -1。
要点诠释:①气体摩尔体积和标准状况下气体摩尔体积是两个不同的概念。
前者是指单位物质的量气体所占的体积。
后者是指标准状况下,1 mol 气体所占的体积,这个体积数值约为22.4 L 。
所以用到22.4 L·mol -1时,通常是标准状况下的气体。
②气体摩尔体积中的气体指任意气体,该气体可以是纯净物,也可以是混合物;纯净物中,可以是单质,也可以是化合物。
如标准状况下。
1 mol 氢气和氯气的混合气体的体积约为22.4 L ,所含的分子总数为N A 个。
③在掌握气体摩尔体积时要注意4个要点:A 、标准状况;B 、1mol ;C 、任何气体,(包括单一气体或混合气体);D 、约22.4L 。
3、气体体积(V )、气体摩尔体积(V m )、气体的物质的量(n )之间关系为:由n=N/N A 和n=V/Vm ,可将气体分子数与宏观气体体积之间联系起来。
如标准状况下,11.2 L H 2所含分子数为:。
由一定条件下的密度和气体摩尔体积可以求出气体的摩尔质量:M=V m ·ρ 如标准状况下,ρ(O 2)=1.429 g·L ―1,则M (O 2)=V m ·ρ(O 2)=22.4 L·mol ―1×1.429 g·L ―1=32 g·mol ―1。
4、标准状况下的相关计算。

气体的摩尔体积与分压气体是一种无固定形状和体积的物质,具有压力、温度和体积等性质。
在研究气体性质时,我们经常会遇到两个重要概念,即摩尔体积和分压。
本文将从理论和实验角度介绍气体的摩尔体积与分压的相关原理和实验方法。
一、摩尔体积的定义和计算方法摩尔体积,也称为摩尔容积,是指气体在标准温度和压力下所占据的体积。
通常以单位摩尔气体的体积表示。
在理想气体状态下,摩尔体积可以用理想气体状态方程来计算。
理想气体状态方程为 PV = nRT其中,P为气体的压强,V为气体的体积,n为气体的物质量(以摩尔为单位),R为气体常数,T为气体的绝对温度。
根据理想气体状态方程,我们可以推导得出摩尔体积的计算公式:V = (nRT) / P通过该公式,我们可以计算出气体在不同温度、压力下的摩尔体积。
二、摩尔体积与气体性质的关系摩尔体积与气体的性质密切相关。
根据理想气体状态方程可以得知,摩尔体积与温度、压力和物质量有关。
下面我们将分别探讨这些关系。
1. 温度与摩尔体积的关系根据理想气体状态方程可知,温度越高,气体的摩尔体积越大。
这是因为温度的增加会使气体分子的平均动能增加,分子的活跃程度增加,导致气体占据的空间增大。
2. 压力与摩尔体积的关系根据理想气体状态方程可知,压力越高,气体的摩尔体积越小。
这是因为压力的增加会使气体分子之间的碰撞更加频繁,导致气体分子占据的空间减小。
3. 物质量与摩尔体积的关系根据理想气体状态方程可知,在相同的温度和压力下,物质量越多,气体的摩尔体积越大。
这是因为摩尔体积是气体的体积与物质量之比,物质量的增加会导致气体占据的体积增大。
三、分压的定义和计算方法分压是指多种气体混合体系中每种气体所产生的压强。
在混合气体中,每种气体都按其分子数所占总分子数的比例对总压进行贡献。
根据道尔顿定律,多种理想气体混合体系的总压等于各气体的分压之和。
计算分压的方法如下:1. 假设混合气体中有n种气体,其分压分别为P1、P2、...、Pn,总压为P,则有:P = P1 + P2 + ... + Pn2. 若知道混合气体中每种气体的物质量mi和总物质量M,可以通过如下公式计算每种气体的分压:Pi = (mi / M) * P通过以上计算方法,我们可以得到混合气体中每种气体的分压值。

气体的摩尔体积与摩尔质量气体是一种无固定形状和体积的物质,其分子之间存在大量的空隙。
在研究气体性质时,摩尔体积和摩尔质量是两个重要的概念。
摩尔体积是指气体中1摩尔(即约6.02 x 10^23个分子)所占据的体积,摩尔质量则是指1摩尔气体的质量。
本文将从这两个方面介绍气体的摩尔体积和摩尔质量的概念和计算方法。
一、摩尔体积的概念和计算方法摩尔体积是指气体中1摩尔所占据的体积,通常以单位体积中所含摩尔数来表示。
在标准温度和压力下,1摩尔任何气体的摩尔体积是相等的,约为22.4升。
这个数值被称为摩尔体积的标准值。
对于非标准温度和压力下的气体,我们可以利用理想气体状态方程来计算摩尔体积。
理想气体状态方程为P V = n R T,其中P为气体的压力,V为气体的体积,n为气体的摩尔数,R为气体常数,T为气体的温度。
从该方程可以推导出摩尔体积的计算公式为V = V' / n,其中V'为气体的体积,n为气体的摩尔数。
举例来说,假设有一定质量的气体,其体积为V',摩尔质量为M。
我们可以通过如下的计算步骤来求得该气体的摩尔体积:1. 计算气体的摩尔数n。
根据摩尔质量M和气体的质量m之间的关系,可以得到n = m / M。
2. 根据理想气体状态方程,利用V = V' / n的公式计算摩尔体积。
通过上述计算,我们可以得到该气体的摩尔体积。
二、摩尔质量的概念和计算方法摩尔质量是指1摩尔气体的质量,单位为克/摩尔。
对于单质气体来说,摩尔质量可以直接由原子量得到。
例如,氧气(O2)的摩尔质量为32克/摩尔,氮气(N2)的摩尔质量为28克/摩尔。
对于化合物气体来说,摩尔质量则是由组成该化合物的各种元素的原子量之和得到。
例如,二氧化碳(CO2)的摩尔质量为44克/摩尔,由碳的原子量12克/摩尔和氧的原子量16克/摩尔之和得到。
在实际计算中,我们可以用化学式和元素原子量的相对数来计算摩尔质量。
通过将各个元素的原子量相加,乘以其在分子中的个数,再将这些结果相加,就可以得到化合物气体的摩尔质量。

重难点八气体摩尔体积及相关计算【要点解读】1.气体摩尔体积的正确理解2.气体摩尔体积的适用范围气体摩尔体积的适用范围是气体,可以是单一气体,也可以是混合气体,如0.2 mol H2与0.8 mol O2的混合气体在标准状况下的体积约为22.4 L。
3.气体摩尔体积相关计算①气体的物质的量n=V Vm②气体的摩尔质量M=Vm·ρ=22.4ρ(标准状况下)③气体的分子数N=n·NA =VVm·NA④气体的质量m=n·M=VVm ·M【特别提醒】(1)气体摩尔体积与温度、压强有关,标准状况下的气体摩尔体积为22.4 L·mol-1,非标准状况下的气体摩尔体积也有可能是22.4 L·mol-1。
(2)使用22.4 L·mol-1时的注意事项①条件:必须为标准状况,因此使用时,一定要看清气体所处的状况。
②物质状态:必须为气体。
如水、酒精、四氯化碳等物质在标准状况下不是气体。
③数值:22.4 L·mol-1是近似值。
【重难点指数】★★★【重难点考向一】气体摩尔体积概念理解 【例1】下列说法中正确的是( )A .1 mol O 2和1 mol N 2所占的体积约为22.4 LB .标准状况下,H 2的气体摩尔体积约为22.4 LC .在标准状况下,1 mol H 2和1 mol H 2O 所占的体积都约为22.4 LD .在标准状况下,22.4 L 由N 2、N 2O 组成的混合气体中所含有的N 原子的物质的量约为2 mol【重难点点睛】气体摩尔体积使用时注意(1)1个条件:必须指明条件。
非标准状况下,1 mol 气体的体积不一定是22.4 L 。
(2)1种状态:必须为气态。
如水、酒精、SO 3、CCl 4等物质在标准状况下不是气体。
(3)1个单位:气体摩尔体积单位是L·mol -1,而不是L 。
【重难点考向二】气体摩尔体积的相关应用【例2】如图两瓶体积相等的气体,在同温、同压时瓶内气体的关系一定正确的是A .所含原子数相等B .所含分子数相等C .气体质量相等D .所含C 原子数相等 【重难点特训】1.如果ag 某气体中含有的分子数为b ,则cg 该气体在标准状况下的体积是( )A .22.4b ac A N LB .22.4ab c A N LC .22.4ac b A N LD .22.4bca A N L 2.一定温度和压强下,用mg 的CH 4、CO 2、O 2、SO 2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是( )A .气球②中装的是O 2B .气球①和气球③中气体分子数相等C .气球①和气球④中气体物质的量之比为4∶1D .气球③和气球④中气体密度之比为2∶13.如图所示实验装置用于测定气体摩尔体积,相关叙述正确的是( ) A .用CCl4代替水,测得氢气的体积更准确B .量气管压入漏斗的水过多而溢出,会导致测定失败C .必须待体系温度降低到0℃时才可进行读数D .上提水准管,量气管液面高度不断改变,说明装置漏气 4.下列说法正确的是( )A .同温同压下甲烷和氧气的密度之比为2∶1B .1 g 甲烷和1 g 氧气的原子数之比为5∶1C .等物质的量的甲烷和氧气的质量之比为2∶1D .在标准状况下等质量的甲烷和氧气的体积之比为1∶2重难点八气体摩尔体积及相关计算【要点解读】1.气体摩尔体积的正确理解2.气体摩尔体积的适用范围气体摩尔体积的适用范围是气体,可以是单一气体,也可以是混合气体,如0.2 mol H2与0.8 mol O2的混合气体在标准状况下的体积约为22.4 L。


气体摩尔体积百科名片摩尔体积的计算在标准状况(STP)0℃( 273K)、1.01×10^5Pa下,1摩尔任何理想气体所占的体积都约为22.4升,这个体积叫做该气体的摩尔体积,单位是L/ mol(升/摩尔),即标准状况下(STP)气体摩尔体积为22.4L/mol。
目录简介解释阿伏加德罗定律推论为什么气体有摩尔体积而固液体没有展开简介定义:一单位物质的量(1mol)的气体所占的体积,叫气体摩尔体积。
使用时应注意:①必须是标准状况(0℃,101kPa)。
在高中化学学习中取22.4L/mol。
②“任何理想气体”既包括纯净物又包括气体混合物。
③22.4升是个近似数值。
④单位是L/mol,而不是L。
⑤决定气体摩尔体积大小的因素是气体分子间的平均距离及气体的物质的量;影响因素是温度,压强。
⑥在标准状况下,1mol H2O的体积也不是22.4L。
因为,标准状况下的H2O 是冰水混合物,不是气体。
⑦气体摩尔体积通常用Vm表示,计算公式n=V/Vm,Vm表示气体摩尔体积,V表示体积,n表示物质的量。
⑧标况下,1mol的任何气体的体积是22.4L,但22.4L的气体不一定是1mol单位物质的量的理想气体所占的体积叫做气体摩尔体积。
相同体积的气体其含有的粒子数也相同。
气体摩尔体积不是固定不变的,它决定于气体所处的温度和压强。
如在25度101KPa时气体摩尔体积为24.5L/mol。
定义:在相同的温度和压强下,1mol任何气体所占的体积在数值上近似相等。
人们将一定的温度和压强下,单位物质的量的气体所占的体积叫做气体摩尔体积。
公式:n=m/M=N/NA=V/Vm解释体积与物质粒子的关系(1)总结规律:①相同条件下,相同物质的量的不同物质所占的体积:固体<液体<气体[水除外]。
②相同条件下,相同物质的量的气体体积近似相等,而固体、液体却不相等。
(2)决定物质体积大小的因素:①物质粒子数的多少;②物质粒子本身的大小;③物质粒子之间距离的大小。
化学vm的数值
化学中的Vm,全称为气体摩尔体积,是指单位物质的量的气体所占的体积。
其数值为22.4L/mol,这是在标准状况下的数据。
气体摩尔体积的定义是:单位物质的量的气体所占的体积叫做气体摩尔体积。
这意味着,如果气体的物质的量是n,气体的体积是V,那么他们的关系可以表示为:n = V/Vm。
这个公式是气体摩尔体积的基本定义。
当给定气体的体积和摩尔质量时,就可以求出气体的物质的量(摩尔数)。
同样,如果已知气体的物质的量和体积,也可以求出气体摩尔体积。
值得注意的是,气体摩尔体积的数值在不同的温度和压力条件下可能会有所不同。
在标准状况(0℃,101.3kPa)下,气体摩尔体积的数值为22.4L/mol。
这个数值是固定的,因为标准状况的定义就是这样的。
另外,气体摩尔体积的计算可以帮助我们了解物质在气态时的性质,这对于化学反应的研究、气体混合物的计算、气体吸附等许多领域都有重要的应用。
总的来说,化学中的Vm是一个非常重要的概念,它描述了气体物质的基本属性。
气体摩尔体积的数值是一个具体的数值,为22.4L/mol,这是在标准状况下的结果。
气体的摩尔体积公式好嘞,以下是为您生成的关于“气体的摩尔体积公式”的文章:在我们学习化学的奇妙世界里,有一个非常重要的概念,那就是气体的摩尔体积公式。
这玩意儿就像是一把神奇的钥匙,能帮我们打开理解气体行为的大门。
咱先来说说啥是气体的摩尔体积。
想象一下,气体分子就像一群调皮的小精灵,在空间里自由自在地飞来飞去。
它们之间的距离相对较大,不像固体和液体那样紧密排列。
而气体的摩尔体积呢,简单说就是在特定条件下,一摩尔气体所占的体积。
那气体的摩尔体积公式到底是啥呢?它就是 Vm = V / n 。
这里的Vm 表示气体摩尔体积,V 是气体的体积,n 是气体的物质的量。
还记得我之前给学生们讲这部分内容的时候,有个小同学瞪着大眼睛,一脸迷茫地问我:“老师,这公式到底咋用啊?”我笑着跟他说:“别着急,咱们一起来看看。
”比如说,咱们知道了某气体的体积是 22.4 升,物质的量是 1 摩尔,那用这个公式一计算,气体的摩尔体积不就正好是 22.4 升/摩尔嘛。
这就像是你知道了走的路程和花费的时间,就能算出速度一样。
咱们再深入点说,这个公式在实际生活中也挺有用的。
就拿给气球充气来说吧。
假设你要给一个大气球充满氢气,让它能飘起来。
你得先知道需要多少氢气,这时候就得用气体的摩尔体积公式来算一算啦。
还有啊,在化学实验里,要是想控制气体的产生量或者消耗量,也得靠这个公式来帮忙。
说到这,我想起有一次在实验室里,同学们分组做实验,计算某种气体产生的体积。
有一组同学怎么算都不对,急得满头大汗。
我过去一看,原来是他们把物质的量给算错了。
我引导他们重新梳理思路,最后终于得出了正确的结果,那几个孩子高兴得直拍手。
总之,气体的摩尔体积公式虽然看起来简单,但是作用可大着呢。
只要咱们认真理解,多多练习,就能用它解决好多和气体相关的问题。
所以啊,同学们,可别小看这个公式,它就像是我们在化学世界里的好帮手,能让我们更清楚地了解气体的奥秘。
好好掌握它,咱们就能在化学的知识海洋里畅游得更畅快啦!。
气体摩尔体积★知识要点1.气体摩尔体积(1)决定物质体积的因素。
①微粒数的多少;①微粒之间的距离;①微粒本身的大小。
在固体和液体中,决定体积大小的主要因素是①和①。
而在气体中,决定体积大小的因素是①和①。
(2)气体摩尔体积的概念。
单位物质的量气体所占的体积叫做气体摩尔体积。
单位:L/mol ,物理量符号:V m ,计算公式:V m =V/n 。
在标准状况下(273K 、1.01×105Pa ),1mol 任何气体的体积都约为22.4L 。
2.阿伏加德罗定律(1)定义:同温同压同体积的气体含有相同的分子数。
(2)推论:①同温同压下,V 1/V 2=n 1/n 2①同温同体积时,p 1/p 2=n 1/n 2=N 1/N 2①同温同压等质量时,V 1/V 2=M 2/M 1①同温同压同体积时,M 1/M 2=ρ1/ρ2(注:V -体积 p -压强 n -物质的量 N -分子个数 M -摩尔质量 ρ-密度)◆学法指导理想气体状态方程与阿伏伽德罗定律1. 理想气体状态方程a. 公式:。
式中T 表示绝对温度,单位为开(K ),摄氏温度与绝对温度的换算关系为;p 表示大气压,单位为帕(Pa );V 表示气体的体积,单位为升(L );n 表示理想气体的物质的量;R 为常数。
(注:高中阶级不要求掌握理想气体状态方程,但用它可以更好地理解和应用阿伏加德罗定律。
)b. 推导阿伏加德罗定律。
由,可推知:、。
当p 、V 、T 均相同时,。
如何计算混合气体的摩尔质量(或相对分子质量)(1)已知标况下密度,求相对分子质量。
相对分子质量在数值上等于气体的摩尔质量,若已知气体在标准状况下的密度ρ,则M =ρ·22.4L/molnRT pV =t 273T +=1111RT n V p =2222RT n V p =1111RT V p n =2222RT V p n =21n n =(2)已知相对密度,求相对分子质量若有两种气体A 、B 将)()(B A ρρ与的比值称为A 对B 的相对密度,记作D B ,即 D B =)()(B A ρρ,由推论三,)()()()(B A B M A M ρρ==D B ⇒ M(A)=D B ·M(B) 以气体B (M 已知)作基准,测出气体A 对它的相对密度,就可计算出气体A 的相对分子质量,这也是测定气体相对分子质量的一种方法.基准气体一般选H 2或空气。
标准状态下气体的摩尔体积气体是物质存在的一种状态,它具有可压缩性、扩散性和容易受温度影响的特点。
在一定的条件下,气体的摩尔体积是研究气体性质的重要参数之一。
本文将围绕标准状态下气体的摩尔体积展开讨论。
首先,我们需要了解什么是标准状态。
标准状态是指气体的温度为0摄氏度(273.15K),压强为1标准大气压(101.325kPa)时的状态。
在这种状态下,气体的摩尔体积被称为标准摩尔体积。
标准摩尔体积的大小是一个固定值,对于理想气体来说,其标准摩尔体积为22.414L/mol。
接下来,我们来探讨气体摩尔体积的计算方法。
根据理想气体状态方程PV=nRT(P为气体压强,V为气体体积,n为气体摩尔数,R为气体常数,T为气体温度),我们可以推导出气体摩尔体积的计算公式为V=nRT/P。
在标准状态下,压强P=1标准大气压,温度T=0摄氏度,代入公式中可得V=nR。
由此可见,标准状态下气体的摩尔体积与气体的摩尔数成正比。
那么,气体摩尔体积的大小受到哪些因素的影响呢?首先是气体的摩尔数,摩尔数越大,气体摩尔体积也越大。
其次是气体的温度,根据理想气体状态方程可知,温度越高,气体摩尔体积越大。
最后是气体的压强,压强越大,气体摩尔体积越小。
这些因素共同影响着气体的摩尔体积,使得气体在不同条件下具有不同的摩尔体积。
除了理想气体,实际气体在标准状态下的摩尔体积也有所不同。
由于实际气体分子之间存在一定的相互作用力,导致实际气体的摩尔体积略小于理想气体。
因此,在实际应用中,需要对气体的摩尔体积进行修正,以得到更准确的结果。
总结一下,标准状态下气体的摩尔体积是指气体在0摄氏度、1标准大气压下的摩尔体积。
通过理想气体状态方程,我们可以计算出气体的摩尔体积,并了解到摩尔体积受到摩尔数、温度和压强的影响。
在实际应用中,需要注意实际气体摩尔体积与理想气体的差异,并进行修正。
通过对标准状态下气体摩尔体积的研究,我们可以更深入地了解气体的性质和行为,为相关领域的研究和应用提供理论支持。
化学标准状况下气体摩尔体积公式下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!化学标准状况下气体摩尔体积公式详解引言在化学领域,气体的性质是研究的重点之一。