共轭二烯烃的结构和特性.
- 格式:ppt
- 大小:3.08 MB
- 文档页数:6






一二烯烃分子中含有不止一个双键的开链烃,按照双键数目的多少,分别叫做二烯烃,三烯烃.....至多烯烃等。
其中以二烯烃最为重要。
而根据二烯烃中双键位置的不同,又可以分为三类:a 累积二烯烃:两个双键连接在同一个碳原子上。
B 共轭二烯烃:两个双键之间,有一个单键相隔。
C 隔离二烯烃:两个双键之间,有两个或以上的单键相隔。
在这里主要介绍共轭二烯烃的性质。
1共轭二烯烃的结构以及共轭效应:1,3—丁二烯是最简单的共轭二烯烃,下面就以它为例来说明共轭二烯烃的结构。
在丁二烯分子中,四个碳原子和六个氢原子都处在同一个平面上。
其每一个碳原子都是sp2杂化,它们以sp2杂化轨道与相邻的碳原子相互交盖形成碳碳单键,与氢原子的1S轨道形成碳氢单键。
分子中一共形成了三个碳碳单键和六个碳氢单键,sp2杂化碳原子的三个σ键指向三角形的三个顶点,三个σ键相互之间的夹角都接近120°。
由于每一个碳原子的σ键都排列在一个平面上,所以就形成了分子中所有σ键都在一个平面的结构,此外,每一个碳原子都有一个未参与杂化的p轨道,它们都和丁二烯分子所在的平面垂直,因此这四个p轨道互相平行,在四个碳原子之间都有电子云交盖,从而电子也并不固定在两个原子之间,从而发生离域。
也就是说四个电子在四个原子轨道形成的共轭体系中流动,并不固定在某一位置。
2 共轭二烯烃的性质A 1,2—加成和1,4—加成共轭二烯烃和卤素,氢卤酸等都容易发生亲电加成,但可产生两种加成产物,如下所示:(1,2—加成产物和1,4—加成产物的键线式)1,2—加成产物是一分子试剂在同一个双键的两个碳原子上的加成,而1,4—加成产物则是一分子试剂加载共轭双键的两端碳原子上,同时原来的双键变为单键,而双键之间的单间变为双键。
1,3—丁二烯之所以有这两种加成方式,与其共轭结构有密切关系。
下面以溴化氢与丁二烯的加成来说明这一原理。
丁二烯与溴化氢的加成第一步也是H+的进攻,加成反应可能发生在C(1)或者C(2)上,然后生成相应的碳正离子(I)和(II)对于这两种碳正离子来说,双键上的碳原子,以及带有正电荷(在键线式中所表达出来的)的碳原子都是sp2杂化,而在(I)碳正离子中,三个碳原子剩余的p轨道均平行于三个碳原子锁组成的平面,因此它们之间存在共轭效应,从而正电荷并不只是单纯的聚集在同一个碳原子上,电荷因共轭效应而被分配到三个碳原子上,并且在C(2)和C(4)上的正电荷相对较多,从而分子比较稳定,生成(I)碳正离子所需要的活化能相对更低,而(II)碳正离子则没有共轭效应,因此反应总是向着(I)碳正离子的方向进行。


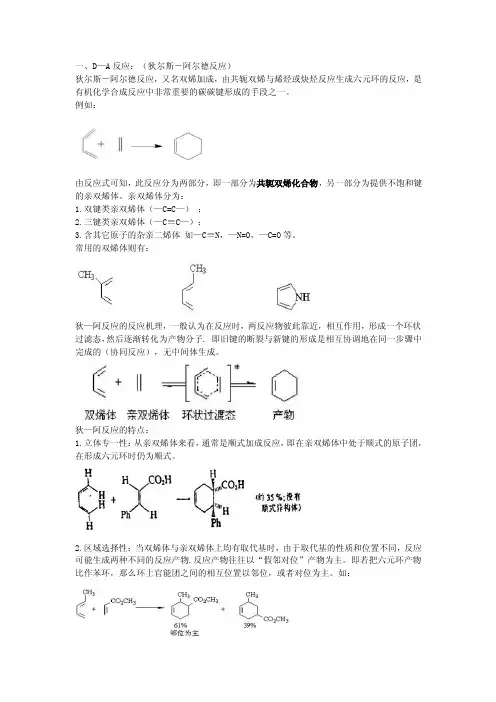
一、D—A反应:(狄尔斯-阿尔德反应)狄尔斯-阿尔德反应,又名双烯加成,由共轭双烯与烯烃或炔烃反应生成六元环的反应,是有机化学合成反应中非常重要的碳碳键形成的手段之一。
例如:由反应式可知,此反应分为两部分,即一部分为共轭双烯化合物,另一部分为提供不饱和键的亲双烯体。
亲双烯体分为:1.双键类亲双烯体(—C=C—);2.三键类亲双烯体(—C≡C—);3.含其它原子的杂亲二烯体如—C≡N,—N=O,—C=O等。
常用的双烯体则有:狄—阿反应的反应机理,一般认为在反应时,两反应物彼此靠近,相互作用,形成一个环状过滤态,然后逐渐转化为产物分子. 即旧键的断裂与新键的形成是相互协调地在同一步骤中完成的(协同反应),无中间体生成。
狄—阿反应的特点:1.立体专一性:从亲双烯体来看,通常是顺式加成反应,即在亲双烯体中处于顺式的原子团,在形成六元环时仍为顺式。
2.区域选择性:当双烯体与亲双烯体上均有取代基时,由于取代基的性质和位置不同,反应可能生成两种不同的反应产物.反应产物往往以“假邻对位”产物为主。
即若把六元环产物比作苯环,那么环上官能团之间的相互位置以邻位,或者对位为主。
如:3.催化剂对D—A反应的影响:D—A反应中主要使用的催化剂多为路易斯酸和布鲁斯酸,比如,金属氯化物,碘化物,三氟甲磺酸盐,烷基金属化合物,三氟化硼的乙醚溶液,二氟化芳基硼等。
如lewis 酸,对该反应能显示出一种强的的催化效应,而且Lewis酸催化的D 一A反应较之未被催化反应而言,不仅反应快,而且有更好的立体选择性和区域选择性. 对区域选择性的影响:狄—阿反应由于一次生成两个碳碳键和最多四个相邻的手性中心,所以在合成中很受重视。
如果一个合成设计上使用了狄尔斯-阿尔德反应,则可以大大减少反应步骤,提高了合成的效率。
此反应用来合成各种类型的含六元环的有机化合物,并广泛用于精细合成化工产品及中间体的合成.应用举例:农药氯丹的合成:二、二烯烃和共轭体系一类含碳-碳双键的烯烃分子。
1. 共轭二烯不同于单烯和隔离二烯的性质:(1)键参数H HHH H H 1234◆1,3-丁二烯分子中,双键的键长(137pm )比乙烯分子中的双键(134pm )稍长;◆C2-C3单键的键长(147pm )则比乙烷分子中的C-C 单键(154pm )短一些;4.1.2共轭二烯烃的结构(2)氢化热◆共轭的1,3-丁二烯在结构上比非共轭的1,4-戊二烯更稳定。
∆H 0= -254 kJ/molCH 2CHCH 2CH CH 2+ 2H 2PtCH 3(CH 2)3CH 31,4-戊二烯1,4-pentadiene∆H0= -226 kJ/molCH 2CHCH + 2H 2PtCH 3(CH 2)3CH 3CHCH 31,3-戊二烯1,3-pentadiene1. 共轭二烯不同于单烯和隔离二烯的性质:4.1.2共轭二烯烃的结构(3)加成和聚合反应1,2-加成(1,2-Addition )1,4-加成(1,4-Addition )CH 2CH CH CH 2+ HBr CH 3CH CH CH 2Br CH 3CH CH CH 2Br3-溴-1-丁烯(3-bromo-1-butene )1-溴-2-丁烯(1-bromo-2-butene )1 2 3 4H 2CH CH CH2+ HBr CH 3CH CH CH 2BrCH 3CH CH CH 2Br3-溴-1-丁烯(3-bromo-1-butene )1-溴-2-丁烯(1-bromo-2-butene )1 2 3 4H 2CH CH CH 2+ HBr CH 3CH CH CH 2Br CH 3CH CH CH 2Br 3-溴-1-丁烯(3-bromo-1-butene )1-溴-2-丁烯(1-bromo-2-butene )1 2 3 41. 共轭二烯不同于单烯和隔离二烯的性质:4.1.2共轭二烯烃的结构CH 2CH CH CH 2CH 2CH CH CH 2n 1,2-加聚产物n 顺-1,4-加聚产物反-1,4-加聚产物1 2 3 4CH 2H CH 2H n H CH 2CH 2H H 2CH CH CH 2CH 2CH CH CH 2n 1,2-加聚产物n 顺-1,4-加聚产物反-1,4-加聚产物1 2 3 4CH 2H CH 2H n H CH 2CH 2H H 2CH CH CH 2CH 2CH CH CH 2n 1,2-加聚产物n顺-1,4-加聚产物反-1,4-加聚产物1 2 3 4CH 2H CH 2H nH CH 2CH 2HH 2CH CH 2CH 2CH CH CH 2n 1,2-加聚产物n 顺-1,4-加聚产物反-1,4-加聚产物1 2 3 4CH 2H CH 2H n H CH 2CH 2H H 2CH CH CH 2CH 2CH CH CH 2n 1,2-加聚产物n 顺-1,4-加聚产物反-1,4-加聚产物1 2 3 4CH 2H CH 2H n H CH 2CH 2H (3)加成和聚合反应1. 共轭二烯不同于单烯和隔离二烯的性质:4.1.2共轭二烯烃的结构(4)Diels –Alder reaction◆Diels-Alder 反应于1928年被发现,并于1950年获诺贝尔化学奖。