酸碱盐专题3:常见离子检验与鉴别
- 格式:pptx
- 大小:388.44 KB
- 文档页数:23


苏版初三下册化学酸碱盐章节教案,酸碱盐之离子鉴定、共存1. 把握常见离子鉴定的方法,CO32-、OH-、H+2. 把握离子共存的解题方法3. 初步学会酸碱盐基础实验的解题方法4. 熟练把握酸碱盐基础知识的综合应用一、酸碱盐的简单识记性内容 考试中常涉及到酸碱盐的一样识记性的内容,酸碱盐的读法和分类以及在水中的溶解性(会查溶 解性表)等,同时要求学生记住某些酸碱盐的物理性质或者俗称。
【摸索】 【解析】 二、酸碱指示剂的应用 学会应用酸碱指示剂辨别物质的酸碱性,或者是已知物质的酸碱性来判定酸碱指示剂的变色情形。
紫色石蕊 无色酚酞酸 遇酸变红 遇酸无色碱 遇碱变蓝 遇碱变红三、溶液酸碱度的表示法——pH 的应用物质名称 碳酸氢钠 硫酸 化学式 Fe(OH)3 NH 4Cl种类 俗称 消石灰 生石灰 化学式 NaOH Na 2CO 3 种类 物质名称 氢氧化铁 碳酸氢钠 氯化铵 硫酸 Fe(OH)3 NaHCO 3 NH 4Cl H 2SO 4盐盐 酸 俗称 消石灰 烧碱 纯碱 生石灰化学式 Ca(OH)2NaOH Na 2CO 3 CaO 种类 碱 碱 氧化物 化学小故事知识导航模块一 酸碱盐基础知识综合课程目标漫画释义 满分晋级酸碱盐1级 初步认识酸碱盐酸碱盐2级 有关酸碱盐的简单综合酸碱盐3级 酸碱盐的综合应用 化学老师智破名画失窃案李老收藏着一幅宝贵的好画,价值连城。
他逢人就夸,作为炫耀的资本。
一天,有三位古董商来访,李老把三人迎入收藏室,只见古玩陈设架上端端正正地放着一只檀木珍宝箱,健谈的主人边介绍,边打开箱子,那幅名画使来客们赞叹不已。
随后,主人合上珍宝箱,用一张涂满浆糊的白色封条封好,然后邀请三位来客到客厅叙谈。
言谈间,李老发觉三位来客有一惊奇的巧合一三个人的右手指上都有点小小的毛病,A 的食指也许是发炎,涂上紫药水,B 的拇指明显是被划破,涂上红药水;C 的拇指大致被毒虫咬肿,搽上碘酒。

初中化学酸碱盐知识归纳总结酸碱盐是化学最后一部分内容,也是中考的重中之重,各大方程式更是考卷的常客。
这里豆姐详细地总结了这一专题的重点知识,如果你还有任何疑问的话,一定要仔细阅读。
一、酸及酸的通性酸的定义,电离时生成的阳离子全部都是H+。
酸是由氢离子和酸根离子构成。
1.浓盐酸、浓硫酸的物理性质、特性、用途2.酸的通性:盐酸HCl 硫酸H2SO4酸使紫色石蕊试液变红,使无色酚酞试液不变色。
金属+酸→盐+氢气Zn+2HCl=ZnCl2+H2↑Zn+ H2SO4 =ZnSO4+H2↑碱性氧化物+酸→盐+水Fe2O3+6HCl=2FeCl3+3H2OFe2O3+3H2SO4=Fe2(SO4)3+3H2O碱+酸→盐+水NaOH+HCl=NaCl+ H2OCu(OH)2+H2SO4= CuSO4+2H2O盐+酸→另一种盐+另一种酸AgNO3+HCl=AgCl↓+HNO3BaCl2+H2SO4=BaSO4↓ +2HCl注意:(1)在‘金属+酸→盐+氢气’中,酸通常指的是稀硫酸和稀盐酸,不能是浓硫酸或硝酸。
因为浓硫酸或硝酸都有强氧化性,与金属反应时不能生成氢气而生成了水。
(2)通过金属跟酸的反应情况导出金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属活动性由强逐渐减弱金属活动性顺序中,金属位置越靠前,活动性越强,反应越剧烈,所需时间越短。
(3)浓硫酸具有吸水性,通常用它作为干燥剂。
硫酸还具有脱水性,它对皮肤或衣服有很强的腐蚀性。
稀释浓硫酸时一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,切不可把水倒进浓硫酸里,如果把水注入浓硫酸里,水的密度较小,会浮在硫酸上面,溶解时放出的热会使水立刻沸腾,使硫酸液向四处飞溅,容易发生事故。
二、碱及碱的通性定义:电离时生成的阴离子全部是OH-离子。
碱是由金属离子(或铵根离子)和氢氧根离子构成。
1.氢氧化钠、氢氧化钙的物理性质、用途2.碱的通性碱使紫色石蕊试液变蓝,使无色酚酞试液变红。


初三化学专题复习—酸碱盐的鉴别
作业:
常见离子的鉴定
一. 多种试剂分步鉴别法(分组法)
物理方法(色、味、溶解性等)
1、先用酸碱指示剂分成酸性、中性、碱性几组;
2、再根据物质的特性选择合适的试剂.
1:鉴别NaOH 、Na 2CO 3、KNO 3、HCl 、H 2SO 4五种溶液。
NaOH
Na 2CO 3
KNO 3
HCl
H 2SO 4
用一种试剂鉴别多种物质,通常有以下几种类型:
Ø用紫色石蕊试液鉴别酸性、中性、碱性溶液
Ø加一种试剂与各待测物可出现不同现象而加以鉴别
Ø用一种试剂和待测物之间相互反应而加以鉴别
1用一种试剂鉴别下列各组物质 :
用一种试剂鉴别HCl 、NaCl 、Na 2CO 3 三种无色溶液
HCl
NaCl
Na 2CO 32:用一种试剂鉴别MgCl 2 、BaCl 2 、KOH 三种无色溶液
MgCl BaCl 2 KOH
3:用酚酞试液鉴别稀硫酸、Ba(OH)2、稀盐酸、NaCl 四种无色溶液。
H 2SO Ba(OH)
2HCl
NaCl
不用任何试剂,可根据待测物质的物理性质(如颜色、气味、溶解性)先鉴别出其中的一种物质,再利用该物质鉴别其他物质。
Ø若几种待测物质没有明显特征,则可将待测物质两两混合,根据相互反应的不同情况加以鉴别。
1:不用试剂鉴别出下列五种溶液①FeCl 3② NaOH ③Ba(NO 3)2 ④MgSO 4和⑤KCl ,顺序是( )
2:不用试剂鉴别稀盐酸、 Na 2CO 3、 KCl 和Ca(NO 3)2四种无色溶液。
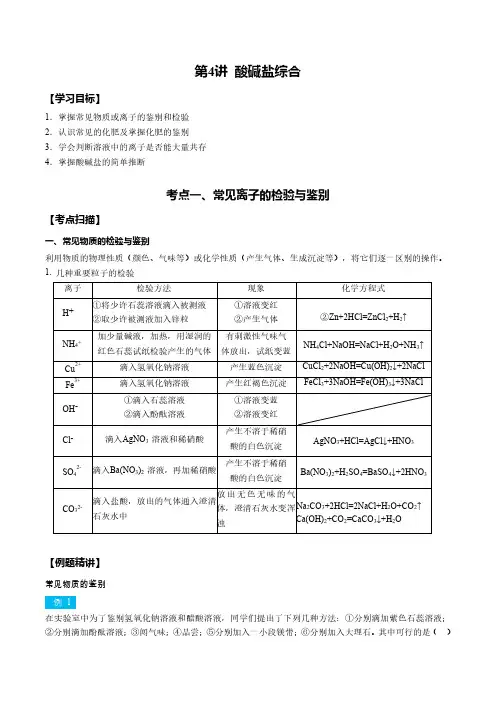
第4讲酸碱盐综合【学习目标】1.掌握常见物质或离子的鉴别和检验2.认识常见的化肥及掌握化肥的鉴别3.学会判断溶液中的离子是否能大量共存4.掌握酸碱盐的简单推断考点一、常见离子的检验与鉴别【考点扫描】一、常见物质的检验与鉴别利用物质的物理性质(颜色、气味等)或化学性质(产生气体、生成沉淀等),将它们逐一区别的操作。
1.几种重要粒子的检验【例题精讲】常见物质的鉴别例1在实验室中为了鉴别氢氧化钠溶液和醋酸溶液,同学们提出了下列几种方法:①分别滴加紫色石蕊溶液;②分别滴加酚酞溶液;③闻气味;④品尝;⑤分别加入一小段镁带;⑥分别加入大理石。
其中可行的是()A.都可以B.①②③④C.①②③⑤⑥D.①③④⑤⑥答案:C一次性鉴别和组内鉴别2(1)有三瓶失去标签的无色溶液,只知道它们分别是稀盐酸、澄清石灰水和氯化钠溶液中的各一种。
下列四种试剂中,能将上述三种无色溶液一次鉴别出来的是()A.Na2CO3溶液B.MgCl2溶液C.KNO3溶液D.NaOH溶液答案:A(2)现有①石蕊、②盐酸、③氢氧化钙、④氢氧化钠、⑤碳酸钠五种溶液,不用其他试剂就可将它们逐一鉴别出来,其鉴别顺序是()A.①②③⑤④B.②③⑤④①C.①②⑤③④D.③④①⑤②答案:C3下列各组物质的溶液不用其他试剂就可鉴别的是()①NaOH、MgCl2、FeCl3、K2SO4;②Ba(OH)2、Na2CO3、H2SO4、CuSO4③HNO3、Na2CO3、NaHSO4、NaCl;④(NH4)2CO3、BaCl2、MgSO4、NaOHA.①②B.①③C.①②④D.①③④答案:C酸碱盐的鉴别及应用4现有盐酸、氢氧化钠、氢氧化钙三瓶遗失标签的溶液,为了鉴别这些溶液,将它们编号为A、B、C,并按如图步骤进行实验,观察到以下现象:(1)写出试剂的名称①是;②是;(2)写出三种溶液的化学式:A、B、C;(3)写出生成白色沉淀的反应的化学方程式:;(4)写出A与B反应的化学方程式:;(5)本实验如果将步骤①与步骤②颠倒,能否达到实验目的?。

常见离子检验方法离子检验是一种常用的化学分析方法,用于确定物质中存在的离子种类和浓度。
通过离子检验,我们可以快速准确地分析出溶液中的离子组成,并判断样品的物质成分和性质。
下面将介绍一些常见的离子检验方法。
1.pH检验pH是指溶液的酸碱度,可通过酸碱指示剂或pH电极来测定。
常见的方法有酸碱指示剂比色法和pH电极法。
酸碱指示剂比色法是根据指示剂在不同pH范围内的颜色变化来判断溶液的酸碱性质;pH电极法是用pH电极测定溶液的pH值,通过电位变化计算出溶液的酸碱度。
2.盐酸试验盐酸试验主要用于检测碳酸根离子的存在。
在有HCl存在的条件下,碳酸根离子与HCl反应生成二氧化碳气体,从而产生气泡。
通过观察气泡的生成情况,可以判断溶液中是否含有碳酸根离子。
3.硫酸铜试验硫酸铜试验常用于检测硫酸根离子的存在。
在硫酸铜溶液中加入硫酸根离子含量较高的溶液,会观察到溶液由蓝色变为浑浊绿色,同时有沉淀物生成。
通过观察颜色变化和沉淀的生成情况,可以判断溶液中是否含有硫酸根离子。
4.硫化氢气体试验硫化氢气体试验用于检测金属离子,特别是有色金属离子的存在。
在含有金属离子的溶液中通入H2S气体,会观察到溶液的颜色变化,出现气味和沉淀物生成。
通过观察颜色的变化和沉淀的生成,可以判断溶液中是否含有特定金属离子。
5.水合物生成试验水合物生成试验可用于检测一些特定离子的存在。
当一些离子与水分子结合形成水合物时,会观察到溶液的颜色变化和沉淀物生成。
常见的水合物生成试验有硫酸铜与无水碱直接反应生成蓝色的CuSO4·nH2O、硝酸银与氢氯酸反应生成白色的AgCl·nH2O等。
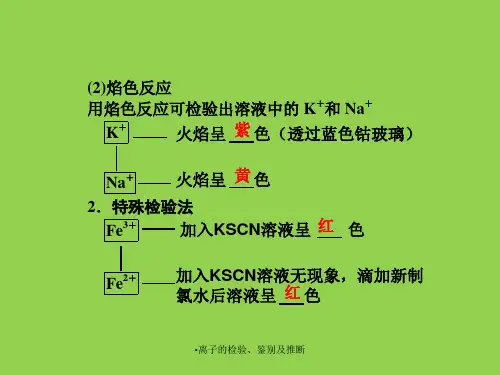
6.火焰试验火焰试验用于检测阳离子的存在。
当一些金属离子通过加热放入火焰中时,会产生特定的颜色。
不同金属离子产生的颜色不同,通过观察火焰颜色可以判断溶液中的金属离子种类。
以上是一些常见的离子检验方法。
这些方法都比较简便易行,可以快速准确地检测离子的存在。

酸碱盐专题之离子检验和鉴别
引言
酸碱盐是化学中最基础的三类化合物,因此学习酸碱盐相关知识和技巧对化学学习有着至关重要的意义。
其中,酸碱盐的离子检验和鉴别则是化学实验中的常见内容。
本文旨在介绍离子检验和鉴别方面的基本方法和步骤。
离子检验
检验离子的通用方法
将待检的离子和某一特定离子,如NH4+,Na+或Al3+等,反应得到明显的物理化学现象,如烟雾、沉淀等等,以确定待检离子是否存在、存在的量以及离子的化学性质(酸、碱、还是盐等)。
下面着重讲解三种常见离子的检验方法:
1. 检验铁离子
将FeSO4溶液滴加到NaOH溶液中,当加至一定量时出现深绿色到棕色的沉淀。
2. 检验钠离子
将NaCl溶液滴加至BaCl2溶液中,当加至一定量时出现白色的沉淀。
3. 检验铜离子
将CuSO4溶液滴加至NH3.H2O溶液中,当加至一定量时出现蓝色的沉淀。
离子鉴别
鉴别银离子和铜离子
银离子和铜离子的离子半径相近,且其化学性质有些相似,因此在实验中要分别鉴别这两种离子。
银离子鉴别
将待检悬浮于水中的物质滴加一定量的HNO3溶液,并加热,若悬浮物质总离子中含有高量的Cl-和Ag+,则会产生白色沉淀。
铜离子鉴别
将蒸馏水加入测试管中并加热至70℃,将待检化合物加入,然后再加入NaOH 溶液和K4[Fe(CN)6]溶液,若出现红色沉淀则为Cu2+离子,否则为其它离子。
离子检验和鉴别是化学实验中不可缺少的一环,其技巧和方法能够帮助我们更清晰地认识和了解化学物质的化学性质。
熟练运用离子检验和鉴别技巧,能够为我们的化学实验研究和工作提供重要的帮助。

重要离子的检验(难点)酸碱盐在水溶液中能发生电离,电离产生的离子将反映出它们的性质,酸碱盐的鉴别与推断依赖构成它们的离子。
重要离子的鉴别与推断无疑是中考考察的热点。
初中范围内,这里包含的重要离子有:H+、Ba2+、Ag+、NH4+、Ca2+、Cu2+、Fe3+、OH-、SO42-、Cl-、CO32-等。
在这里,我们要对初中重要离子的检验来做一次分析与总结,让大家在理解离子检验基本思想的基础上,熟悉离子检验的各种题型,提高相关的解题能力。
总体思路首先我们来看一下物质检验(包括离子检验)的定义:物质的检验是指根据物质具有的不同的特性,利用这种特性上的差异,选择适当的试剂、采用一定的方法,将物质区分或鉴定,要求反应灵敏、现象明显、操作简便、结论清晰可靠。
鉴定:指根据物质的某一特性,用化学方法来确定其中的成分。
鉴别:指利用物质的特性,用物理或化学方法将若干种区分开来的操作。
推断:指根据已经进行的检验步骤,反应现象和物质的性质,分析推断被检验的是什么物质,并判断什么物质可能存在、一定不存在。
接下来,我们来总结一下常见离子的检验方法:思考1:离子在溶液中能否共存下列各组中的物质,能在溶液中大量共存的是()A. KNO3 NaCl NaOHB. KOH Na2CO3 HClC. KNO3 NaOH FeCl3D. AgNO3 BaCl2 HNO3体验思路:能否共存就是离子间能否反应,离子的鉴定也是利用其发生的复分解反应,B项CO32-和盐酸电离的H+反应放出气体,C项Fe3+和NaOH电离的OH-反应产生红褐色沉淀,D 项Ag+和Cl-反应产生白色沉淀,故答案为A。
思考2:推断可能存在的离子有一包白色固体,可能含有Na2CO3、CuSO4、CaCl2、Na2SO4、NaCl等物质中的一种或几种,现取部分该固体溶于水,可得到澄清的无色溶液,再向其中加入BaCl2产生白色沉淀,再加入足量HNO3沉淀部分消失,回答:(1)该固体一定含有、一定不含、可能含;(2)写出其中两个反应的化学方程式。

※常见离子的鉴别:一、H+的鉴别方法有:1、加入紫色石蕊,现象是变红。
2、用pH试纸,现象是变红或pH小于73、加入锌粒等较活泼的金属于,现象是有气泡冒出。
4、加入氧化铁(或氧化铜),现象是固体溶解,溶液变黄(或变蓝)。
5、加入氢氧化铁(或氢氧化铜),溶液变黄(或变蓝)。
6、加入碳酸钙,现象是固体溶解,冒气泡。
二、OH-的鉴别方法有:1、加入紫色石蕊,现象是变蓝。
2、加入无色酚酞,现象是变红。
3、用pH试纸,现象是变红或ph大于74、加入铁离子(如硫酸铁、氯化铁、硝酸铁溶液),现象是出现红褐色沉淀。
或加入铜离子(如硫酸铜、氯化铜、硝酸铜溶液),现象是出现蓝色沉淀。
5、加入铵根离子,(硫酸铵、氯化铵、硝酸铵溶液),现象是产生有氨味的气体。
三、CO32- 的鉴别方法:滴加稀盐酸溶液,,生成的气体使澄清的石灰水变浑浊四、Cl- 的鉴别方法:加入硝酸银溶液和稀硝酸,出现白色沉淀。
五、SO42-的鉴别方法:加入氯化钡或硝酸钡溶液和稀硝酸,出现白色沉淀。
六、NH4+的鉴别:鉴别方法:加入氢氧化钠溶液,现象是有氨味的气体产生(或使湿润的红色石蕊试纸变蓝)。
注明:同时存在Cl-和SO42-时,因为硫酸银微溶,所以应该先鉴别SO42-后鉴别Cl-※初中常见的有颜色的溶液:黄色溶液:氯化铁溶液、硫酸铁和硝酸铁溶液浅绿色溶液:氯化亚铁溶液、硫酸亚铁溶液蓝色溶液:硫酸铜溶液、氯化铜溶液紫红色溶液:石蕊试液、高锰酸钾溶液※初中常见的有颜色的固体:红色固体:Cu、Fe2O3 黄色固体:硫粉蓝色固体: Cu(OH)2红褐色固体:Fe(OH)3黑色固体:C、CuO 、Fe3O4、MnO2、生铁白色固体:AgCl BaSO4 CaCO3 Ba CO3Al(OH)3 Mg(OH)2 P2O5 CaO MgO等※初中常见的八种沉淀:AgCl BaSO4白色沉淀既不溶于水也不和酸反应CaCO3 Ba CO3白色沉淀不溶于水但和酸反应Al(OH)3 Mg(OH)2白色沉淀不溶于水但和酸反应Cu(OH)2蓝色沉淀不溶于水但和酸反应Fe(OH)3红褐色沉淀不溶于水但和酸反应※离子共存问题溶液共存就是在溶液中不能存在相互结合生成气体、水和沉淀的物质。
酸碱盐的鉴别常见离子的鉴别离子鉴别试剂(方法)鉴别操作鉴别现象H+酸碱指示剂/ Zn /Na2CO3溶液取少量样品于试管中,加入适量的酸碱指示剂/ Zn / Na2CO3溶液变色/ 有H2/ 有CO2OH-酸碱指示剂/ Cu2+/ Fe3+溶液取少量样品于试管中,加入适量的酸碱指示剂/ CuCl2 / FeCl3溶液变色/ 蓝↓/ 红褐色↓CO32-稀盐酸,澄清的石灰水取少量样品于试管中,加入适量的稀盐酸,再将产生的气体通入澄清的石灰水产生大量气泡,石灰水变浑SO42-硝酸钡溶液,稀硝酸取少量样品溶液于试管中,加入适量的硝酸钡溶液,再加入稀硝酸,振荡产生的白色沉淀不溶于稀硝酸Cl-硝酸银溶液,稀硝酸取少量样品溶液于试管中,加入适量的硝酸银溶液,再加入稀硝酸,振荡产生的白色沉淀不溶于稀硝酸NH4+氢氧化钠(溶液)或熟石灰,红色石蕊试纸取少量样品于试管中,加入氢氧化钠(溶液)或熟石灰,微热,再将湿润的红色石蕊试纸放在试管口产生的刺激性气味的气体能使红色石蕊试纸变蓝Ag+稀盐酸,稀硝酸取少量样品溶液于试管中,加入适量的稀盐酸,再加入稀硝酸立即产生白色沉淀且不溶于稀硝酸Ba2+稀硫酸,稀硝酸取少量样品溶液于试管中,加入适量的稀硫酸,再加入稀硝酸立即产生白色沉淀且不溶于稀硝酸(注意物质的干扰:1、Na2CO3与NaOH2、Ca(OH)2与NaOH 3、NaCl与Na2SO4)强化训练1、(07茂名)(8分)化学兴趣小组发现一瓶标签破损的无色溶液A(如右图),老师告诉他们这是初中实验常用的药品,不会是NaHCO3、Na2SO4、Na2SiO3等。
它是什么药品呢?同学们进行了如下探究:[查阅资料]AgCl、BaSO4是不溶于稀硝酸的白色固体;BaCO3溶于稀硝酸。
(1)小明:我猜想A是__________溶液。
(填化学式)[实验验证]取A溶液放入试管中,滴加硝酸银和硝酸的混合液。
若有白色沉淀生成,则猜想正确。
物质的除杂、共存、鉴别知识点1:物质的除杂物质的除杂(提纯):“除杂”即“提纯”,方法很多,常用的有(1)物理方法①沉淀过滤法:即通过过滤,除去不溶性杂质。
例如除去粗盐中混有少量的泥沙。
可将粗盐溶解于水,充分搅拌,然后过滤,再把滤液蒸发至干,即可得到不含泥沙的食盐。
再如KCl(MnO2)②结晶法:见当两种固体物质的溶解度相差很大时,可利用结晶的方法将杂质除掉。
例如硝酸钾中混有少量的氯化钠。
(2)化学方法①沉淀法:加入某种试剂,跟杂质反应形成沉淀,滤去沉淀,即可除掉杂质。
例如,要除掉NaOH溶液中少量的Na2CO3,可加入适量的石灰水,滤去CaCO3沉淀,即可达到除去Na2CO3的目的。
有关的化学方程式:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;②化气法:加入某种试剂,跟杂质反应,化为气体逸出,即可除掉杂质。
例如,用盐酸除去NaCl中的Na2CO3。
Na2CO3+2HCl=2NaCl+H2O+CO2↑;③吸收法:用某种物质做吸收剂,把杂质吸收。
例如,实验室用锌跟盐酸反应制取氢气时,氢气中常含有少量氯化氢气体和水蒸气,欲得纯净干燥的氢气,可用下列洗气装置将氯化氢和水蒸气吸收,以达到除杂的目的。
再如H2(CO2、HCl、水蒸气)分别将气体通过盛有浓氢氧化钠溶液的洗气瓶,除去 CO2、HCl ;和盛有浓硫酸的洗气瓶,除去水蒸气。
④溶解法:将杂质用化学方法溶解。
例如用化学方法除去铜粉中的少量铁粉,可往混合物中加入少量盐酸,充分反应后过滤即得不含铁的铜粉。
有关的化学方程式:Fe+2HCl=FeCl2+H2↑;再如CuSO4(CuO)加稀H2SO4有关的化学方程式: CuO+H2SO4=CuSO4+H2O;⑤加热法:通过加热,使杂质分解,从而除掉杂质。
例如,要除掉Na2CO3中混有的NaHCO3,就可以用加热的方法。
有关的化学方程式:2 NaHCO3∆====Na2CO3+H2O+CO2↑(3)除杂的原则:不增,不减,易分不增——在除掉杂质的同时,不得引入新杂质;还要防止在被提纯的物质中引入新的杂质。
初中化学知识点归纳常见离子的检验和鉴别方法初中化学知识点归纳:常见离子的检验和鉴别方法在初中化学学习中,我们常常会遇到需要检验和鉴别离子的情况,本文将对常见离子的检验和鉴别方法进行归纳总结。
了解这些方法可以帮助我们更好地理解离子和化学反应的特性,提高化学实验的准确性。
一、阴离子的检验和鉴别方法1. 碳酸根离子(CO3^2-)的检验和鉴别方法碳酸根离子与酸反应会产生气体,可以进行气体的检验。
通常用酸来进行检验,如加入稀盐酸或稀硫酸,如果产生了气泡,则可以确定溶液中存在碳酸根离子。
2. 氯离子(Cl-)的检验和鉴别方法氯离子与银离子反应会生成不溶于水的白色沉淀物氯化银(AgCl),可以通过观察出现白色沉淀物来检验和鉴别氯离子的存在。
3. 硫酸根离子(SO4^2-)的检验和鉴别方法硫酸根离子与钡离子反应会生成不溶于水的白色沉淀物硫酸钡(BaSO4),可以通过观察出现白色沉淀物来检验和鉴别硫酸根离子的存在。
二、阳离子的检验和鉴别方法1. 铜离子(Cu2+)的检验和鉴别方法铜离子可以通过加入氨水或氢氧化钠溶液,观察颜色的变化来检验和鉴别。
当加入氨水后,溶液由蓝色变为深蓝色,而加入氢氧化钠溶液后,溶液由蓝色变为蓝绿色。
2. 铁离子(Fe2+和Fe3+)的检验和鉴别方法铁离子可以通过加入硫氰化钾溶液进行检验和鉴别。
当加入硫氰化钾溶液后,溶液会由无色变为鲜红色。
而在区分Fe2+和Fe3+时,可以在酸性条件下加入亚硫酰胺(亚硫酸氨水),Fe3+会由浅黄变为深红褐色。
3. 铅离子(Pb2+)的检验和鉴别方法铅离子与碘离子反应会生成不溶于水的黄色沉淀物碘化铅(PbI2),可以通过观察出现黄色沉淀物来检验和鉴别铅离子的存在。
综上所述,通过对常见离子的检验和鉴别方法的归纳总结,我们可以更好地理解化学反应的特性,提高化学实验的准确性。
在实验过程中,我们应该严格按照实验步骤进行操作,并注意观察实验结果的变化,以确保实验结果的可靠性。
一、知识梳理1.“提纯题”的方法和原则(1)提纯的一般原则:“不增、不减、易分、简单、环保”①除杂过程中不能引进新的杂质。
例如,除掉NaOH溶液中的Na2CO3,只能用石灰水:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH而不能用CaCl2溶液:CaCl2+ Na2CO3=CaCO3↓+2NaCl,所以如果用了CaCl2溶液,虽然除掉了Na2CO3,但又使NaOH溶液中增添了新的杂质NaCl。
物质的分离、提纯、检验和鉴别第一部分:知识梳理第二部分:题型突破第三部分:专题过关第四部分:课后作业②加入的试剂一般只与杂质反应,不能与所需要提纯的物质反应,被提纯物质不能改变(质量可增加但不减少)。
例如要除掉二氧化碳中混有的少量氯化氢,应用NaHCO3溶液吸收氯化氢:NaHCO3+HCl=NaCl+H 2O+CO2↑,而不能用NaOH溶液,因为NaOH溶液不仅能吸收氯化氢气体,也能吸收二氧化碳:NaOH+HCl=NaCl+H2O 2NaOH+CO2=Na2CO3+H2O那么能否用Na2CO3除去氯化氢呢?也不能;因为Na2CO3与CO2和HCl都能反应。
反应方程式如下:Na2CO3+2HCl=2NaCl+H2O+CO2↑,Na2CO3+H2O+CO2=2NaHCO3③生成的物质与被提纯物质易分离,杂质应转化为沉淀、气体或水等易分离的物质④步骤简单、操作简便;⑤污染最小或不污染环境。
(2)提纯的注意问题:①分离提纯的方法中优先考虑物理方法;②所选试剂或方法能将杂质除尽,不能带入新的杂质;③提纯过程中,若被提纯的物质已转化为其他物质,分离后应将其复原。
(3)提纯的基本方法:①物理方法2.“分离题”的解题思路分离是指把混合物里的各个成分分开,它是在除杂题的基础上进一步发展的一类题型,其常见的解法如下:分离方法⎪⎪⎪⎪⎩⎪⎪⎪⎪⎨⎧⎪⎪⎩⎪⎪⎨⎧--------------------再分别复原为原物质。