第20章(5)-四个量子数
- 格式:ppt
- 大小:1.17 MB
- 文档页数:25

四个量子数及其取值范围量子数是描述原子或分子量子态的参数,它们的取值范围决定了电子在原子中的能级和轨道结构。
在量子力学中,有四个重要的量子数,分别是主量子数、角量子数、磁量子数和自旋量子数。
本文将依次介绍这四个量子数及其取值范围。
一、主量子数(n)主量子数决定了电子所处的能级,也即电子离原子核的距离。
主量子数的取值范围为正整数,从1开始递增。
当n为1时,表示电子在最内层能级;当n为2时,表示电子在第二层能级;以此类推。
主量子数越大,电子离原子核越远,能级也越高。
二、角量子数(l)角量子数决定了电子在原子中的轨道形状。
角量子数的取值范围与主量子数有关,即0 ≤ l ≤ n-1。
角量子数为0时,表示s轨道,形状是球对称的;角量子数为1时,表示p轨道,形状是两个相互垂直的球面;角量子数为2时,表示d轨道,形状是复杂的双球面等等。
三、磁量子数(ml)磁量子数决定了电子在原子中轨道的方向。
磁量子数的取值范围与角量子数有关,即-l ≤ ml ≤ l。
对于每个角量子数l,磁量子数ml 的取值个数为2l+1。
例如,对于角量子数l为1的p轨道,磁量子数ml的取值范围为-1、0、1,共有3个取值。
四、自旋量子数(ms)自旋量子数描述了电子的自旋状态。
自旋量子数的取值范围为±1/2,分别表示电子的自旋向上和向下。
自旋量子数是量子力学中唯一一个可以观测到的量子数。
主量子数、角量子数、磁量子数和自旋量子数是描述原子或分子量子态的四个重要参数。
它们的取值范围决定了电子在原子中的能级、轨道形状、轨道方向和自旋状态。
这些量子数的不同取值组合产生了多样的原子结构,为我们理解和研究原子的性质提供了重要的理论基础。
通过研究量子数的取值范围,我们可以了解电子在原子中的分布规律和能级结构。
这对于理解化学反应、原子结构及物质性质等方面都具有重要意义。
同时,量子数的研究也为制定新材料、开发新技术提供了理论指导。
随着量子力学的发展,量子数的概念不仅适用于原子和分子,也适用于更复杂的体系。

【高中化学】高中化学知识点:四个量子数四个量子数:
(1)主量子数n:描述原子中电子出现几率最大区域离核的远近(电子层数);决定电子能量高低。
值域:n=123456……
电子层符号klmnop……
对于氢原子其能量多寡依赖于n
但对于多电子原子,电子的能量除受电子层影响,还因原子轨道形状不同而异,(即受角量子数影响)
(2)角量子数l:它同意了原子轨道或电子云的形状或则表示电子亚层(同一n层中相同分层)意义:在多电子原子中,角量子数与主量子数一起同意电子的能量。
之所以表示l 为角量子数,是因为它与电子运动的角动量m有关。
如m=0时,说明原子中电子运动情况同角度无关,即原子轨道或电子云形状是球形对称的。
角量子数,l只能取一定数值。
(3)磁量子数m:同意波函数(原子轨道)或电子云在空间的弯曲方向,同意角动量在空间的取值方向上的分量大小。
(4)自旋量子数ms:ms=±1/2,表示同一轨道中电子的二种自旋状态
ms表示磁矩量子数值域:ms=±1/2,即为仅有两种运动状态。
(↑↓)
用分辨力较强的光谱仪观察氢原子光谱,发现,大多数谱线是由靠得很近的两条谱线组成的。
这是因为同一空间运动状态,即同一轨道中,可能有两种电子运动状态,即电子还有自身旋转运动,(类似于地球绕太阳转,自转)其自旋角动量沿外磁场方向的分量为
综合所述,若叙述核电子的运动状态,须要四个量子数,即n、l、m、ms。
注意:n、l、m可描述核外电子的一种空间运动状态,即一个原子轨道。
每个原子轨道中能容纳两个自旋相反的电子。

原子轨道及四个量子数原子轨道及四个量子数【一】原子轨道:原子中单个电子的空间运动状态函数,叫做原子轨道。
原子轨道的含义与玻尔轨道的含义完全不同,也不是经典意义上的固定轨迹,原子轨道由三个量子数(n/l/m)确定。
【二】四个量子数【1】主量子数(电子层数)nn 1 2 3 4 5 6 7 符号 K L M N O P Q从左向右,离原子核越来越远,一般地说,原子轨道能量越来越高。
对单电子原子来说,原子轨道的能量只取决于主量子数。
【2】角量子数(电子亚层数)l(是小写的L)n=1 l=0(s)n=2 l=0(s);1(p)n=3 l=0(s);1(p);2(d)n=4 l=0(s);1(p);2(d);3(f)n=5 l=0(s);1(p);2(d);3(f)n=6 l=0(s);1(p);2(d)n=7 l=0(s);1(p)l=0(s),有一个原子轨道;l=1(p),有三个原子轨道;l=2(d),有五个原子轨道;l=3(f),有七个原子轨道。
〖※〗能级:原子轨道能量的数值,对氢原子来说只有n决定,对其它原子来说有n和l决定。
能级大小约为E = n + 0.7 l。
【3】磁量子数(磁场存在时,轨道的空间伸展方向)ml=0 m = 0l=1 m = ,1 0 ,1m = ,2 ,1 0 ,1 ,2 l=2l=3 m = ,3 ,2 ,1 0 ,1 ,2 ,3【4】自旋量子数msms = ,1/2(?) ,1/2(?)处于同一原子轨道上的电子自旋运动状态只有两种,分别用符号?和?来表示。
即同一原子轨道上最多容纳自旋方向相反的两个电子。
附:n值所对应的能级、原子轨道和最多容纳电子数。
量子数符能级原子原子轨道最多原子轨道数号种类轨道总数容纳电子数 n1 K s 1s 1 1 2s 2s 1 2 L 4 8 p 2p 3s 3s 13 M p 3p 3 9 18d 3d 5s 4s 1p 4p 3 4 N 16 32 d 4d 5f 4f 7s 5s 1p 5p 3 5 O 16 32 d 5d 5f 5f 7… … … … … … …。

氢原子基态的四个量子数
氢原子是能在自然界中容易观察到的最小的原子,关于它包含的量子数,物理学家做了研究,表明氢原子基态的四个量子数是n,l,m 和s,n表示原子的能量档次,l表示原子的角动量的大小,m表示角动量的方向,而s则表示原子的自旋状态。
n是氢原子基态的量子数之一,表示原子能量档次,它用字母n 表示,又叫作Principle Quantum Number(主量子数)。
它决定了氢原子能出现的最高能量状态,也决定了氢原子状态的总能量。
实际上,n的值决定了原子几层电子结构有多稳定,因此可以推断,n越大说明原子结构稳定性越好,从而说明原子总能量越高。
l是氢原子基态的量子数之二,也叫作角动量粒子数,用字母l 表示,又叫作Angular Momentum Quantum Number(角动量量子数)。
它反映了电子角动量的大小,决定原子电子自旋和轨道所占空间,从而决定了原子形状和大小,也影响了原子能级排列。
从l的值可以看出,角动量越大(当l=3时),说明空间的大小也越大,轨道的扩展更加明显,因此能级排列也就越混乱。
m是氢原子基态的量子数之三,也叫作角动量分量,用字母m表示,又叫作Magnetic Quantum Number(磁量子数)。
- 1 -。

1.描述单个电子的四个量子数,其物理意义是什么?量子数是量子力学中表述原子核外电子运动的一组整数或半整数。
因为核外电子运动状态的变化不是连续的,而是量子化的,所以量子数的取值也不是连续的,而只能取一组整数或半整数。
量子数包括主量子数n 、角量子数l 、磁量子数m 和自旋量子数s 四种,前三种是在数学解析薛定谔方程过程中引出的,而最后一种则是为了表述电子的自旋运动提出的。
(1). 主量子数n① 它决定了能量En 的大小和量子:eV nZ n Z me E n 6.13822222204⋅-=⋅-= ε ② 简并度:21012n l g n l =+=∑-=③ 决定了原子状态波函数的总节面数为n-1个.(2). 角量子数l222)1()2)(1( +=+=l l h l l M π 即: )1(||+=l l M l=0,1,2, ……, n-1① 角量子数l 决定了角动量的大小.② 决定了磁矩的大小:B ee l l m eh l l h l l m eμππμ)1(4)1(2)1(2||+=⋅+=⋅+= ③ 在多电子原子中也决定了轨道的能量。
(3).磁量子数m⋅=π2h m M Z m=0,±1,±2,……±l ① m 决定了电子的轨道角动量在Z 轴方向得分量z M 的量子化,角动量在磁场中可有(2l+1)种取向,即角动量方向量子化。
② 也决定了轨道磁矩在磁场方向的分量Z μ的量子化。
B Z m μμ-=③ 有外加磁场时决定体系的能量。
2.描述原子整体状态的四个量子数是什么?其光谱项及光谱支项符号是什么? 可以用表征原子内各种相互作用的四个量子数L,S,J 和MJ 来标记原子的状态。
原子的状态可用L,S,J 和MJ 来标记,光谱学上常写成符号L s 12+,L s 12+称为光谱项,J s L 12+为光谱支项,用S,P,D,F,G,H 分别代表,3,2,1,0=L 等状态。

H原子的四个量子数
原子质量数为1的氢原子有4个量子数:原子核电荷量子数n、轨道角量子数l、轨道角动量量子数ml、总正负量子数ms。
原子核电荷量子数n是描述原子的最重要的一个量子数,它代表的是原子的能量水平和最大的电荷数,也叫外层电子配置的第一量子数,n在氢原子中取值为1,表示原子的能量最低水平位于一能级,最大的电荷数也只有一个电子。
轨道角量子数l又称为角动量量子数,它是描述原子在第n能级内各轨道中电子态势型与此能级性质之间的关系,当n=1时,l只可取0,表明原子在一能级中,其单电子只可分布在1s轨道中,也就是氢原子只有1s轨道。
最后是总正负量子数ms,它是描述原子轨道中电子状态势型的非旋转对称性,即电子有正转和负转两种可能。
在氢原子中,只有一个电子,n=l=ml=0,ms的取值范围为-
1/2到+1/2,且在实际上只取正值,即ms=+1/2。

无机化学教案说明一、课程教学的基本要求本课程的教学环节包括课堂讲授,学生自学,讨论课、实验、习题、答疑和期中、期末考试。
通过本课程的学习使学生掌握物质结构、元素周期律、化学热力学、化学平衡(酸碱平衡、沉淀溶解平衡、?氧化还原平衡,配合离解平衡)和化学反应速率等基本概念和基本理论知识;理解和掌握重要元素及其化合物的结构、性质、反应规律和用途,训练和培养学生科学思维能力和分析问题解决问题的能力,指导学生掌握正确的学习方法和初步的科学研究方法,帮助学生树立辨证唯物主义观点,为后继课程的学习打下坚实的基础。
二、教学方法、手段主要运用启发式教学方法,注重在教学中实践“以学生为主体,以教师为主导”的素质教育指导思想,充分运用多媒体教学、网络教学等多元化、全方位的教学手段,努力提高教学质量。
三、考核方式本课程分两学期讲授,第一学期讲授化学基础理论,第二学期讲授元素化学,每学期考核一次,考核成绩由平时成绩20%+期末考试(闭卷)成绩80%组成。
四、学时分配(共计144学时)五、目录绪论 (4)第1章原子结构和元素周期律 (4)第2章分子结构 (9)第3章晶体结构 (13)第4章化学热力学基础 (23)第5章化学平衡 (30)第6章化学动力学基础 (32)第7章水溶液 (36)第8章酸碱平衡 (41)第9章沉淀平衡 (51)第10章电化学基础 (56)第11章配合物与配位平衡 (66)第12章氢和稀有气体 (73)第13章卤素 (74)第14章氧族元素 (80)第15章氮磷砷 (87)第16章碳硅硼 (97)第17章非金属元素小结 (103)第18章金属通论 (104)第19章S区金属 (105)第20章P区金属 (109)第21章ds区金属 (114)第22章d区金属(一) (121)课程的主要内容绪论学时1[教学基本要求]介绍本课程的学习内容、目的、任务和方法。
[重点与难点]介绍本课程的学习内容[教学内容]一、化学研究对象化学是研究物质组成、结构、性质和变化的科学;无机化学研究的对象、发展和前景,化学研究内容包括对化学物质的(1)分类(2)合成(3)反应(4)分离(5)表征(6)设计(7)性质(8)结构(9)应用。


用四个量子数描述基态be原子外层-概述说明以及解释1.引言1.1 概述概述:原子的外层电子运动状态是由一组四个量子数来描述的,这些量子数包括主量子数、角量子数、磁量子数和自旋量子数。
在本文中,我们将着重讨论基态be原子的外层电子状态,并通过这四个量子数来描述其运动状态。
通过对这些量子数的分析,我们可以更好地理解原子的电子结构以及如何影响原子的化学性质。
本文旨在深入探讨这些量子数在描述基态be 原子外层电子时的重要性,以便更好地理解原子物理学的基本概念。
1.2 文章结构文章结构部分将主要包括以下几个部分:1. 引言:介绍文章的背景和意义,阐述研究目的以及文章结构安排。
2. 量子数的概念:对量子数的概念进行介绍和解释,为后续对基态be原子外层电子描述做铺垫。
3. 基态be原子的外层电子:简要介绍基态be原子的外层电子的组成和特点,为接下来详细描述做准备。
4. 用四个量子数描述基态be原子外层:详细描述四个量子数是如何用来描述基态be原子外层电子的,对每个量子数的意义和作用进行详细解析。
5. 结论:总结全文,重申文章的核心内容和研究成果,展望未来的研究方向和应用领域。
通过以上结构安排,读者可以清晰地了解文章的逻辑结构和内容安排,有助于理解和阅读全文。
1.3 目的本文旨在通过对基态be原子外层电子的研究,探讨如何用四个量子数来描述其特征。
通过深入分析量子数的概念及基态be原子的外层电子结构,我们希望能够揭示这一体系的内在规律和特点。
同时,通过这一研究,我们也可以更深入地了解量子力学理论对原子结构和性质的影响,为量子物理学领域的发展做出贡献。
通过本文的研究,读者将能够了解基态be原子外层电子的特点和行为,并理解如何通过四个量子数来描述和解释这些特征。
这将有助于拓展我们对原子结构的认识,以及量子力学理论在描述微观世界中的应用。
通过深入研究和探讨,我们希望能为量子物理学领域的研究和发展提供新的思路和方法。
2.正文2.1 量子数的概念光的波动性在早期量子力学的发展中引起了许多困惑,直到20世纪初,爱因斯坦和普朗克的理论为解释这种现象提供了新的思路。
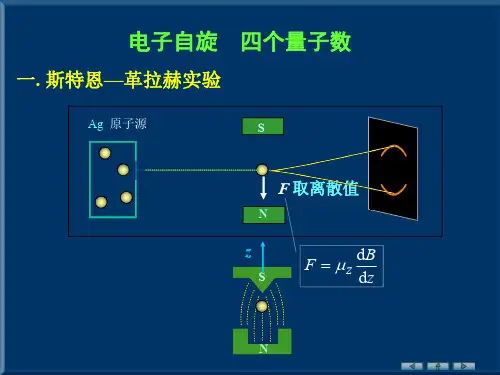
第40卷第5期大 学 物 理Vol.40No.52021年5月COLLEGE PHYSICSMay2021 收稿日期:2020-06-13;修回日期:2014-02-14 基金项目:西安交通大学“名师、名课、名教材”建设工程项目(校2018);西安交通大学第二批“课程思政”示范课项目(校2019)资助 作者简介:黄永义(1978—),男,安徽阜阳人,西安交通大学物理学院副教授,博士,主要从事原子物理教学和研究工作.原子中电子的四个量子数黄永义(西安交通大学物理学院,陕西西安 710049)摘要:较详细地阐述了原子中电子的4个量子数的来源,简要介绍了原子的电子壳层结构和泡利不相容原理.关键词:玻尔-索末菲理论;4个量子数;原子壳层结构;泡利不相容原理中图分类号:O4-1 文献标识码:A 文章编号:1000 0712(2021)05 0008 05【DOI】10.16854/j.cnki.1000 0712.200272原子中电子的4个量子数是大家熟知的,它们的引入过程也是很熟悉的.通过求解氢原子的定态薛定谔方程得到电子的3个量子数,分别是主量子数n,轨道角动量量子数l,轨道磁量子数ml,它们的取值为n=1,2,…;l=0,1,2,…,n-1;ml=0,±1,±2,…,±l,再加上乌伦贝克和哥德斯密特引入的自旋磁量子数ms=±1/2,共4个量子数(n,l,ml,ms).如果考虑到自旋轨道相互作用,需要使用新的4个量子数(n,l,j,mj),其中j为总角动量量子数,mj为总磁量子数.实际上原子中电子的4个量子数在1922年已经提出了,比1926年的波动力学早了好几年,本文就来谈谈4个量子数是怎样提出的,简要介绍它们的应用:原子的电子壳层结构和泡利不相容原理.1 4个量子数1913年玻尔在定态假设和跃迁假设的基础上利用对应原理提出了氢原子理论,给出了氢原子的能级公式En=-hcRZ2n2(1)式中Z为类氢离子的核电荷数,n是取自然数的主量子数,它决定了原子的主要能量,是原子中电子的第一个量子数[1].1916年索末菲就将玻尔的圆轨道推广到椭圆轨道,进一步又考虑电子运动的相对论效应给出了氢原子能级的精细结构[2].如图1所示.电子绕核在一个平面上作椭圆运动是二自由度的运动,极坐标零点在核的位置,坐标是r和φ,对应的动量为沿矢径r方向为pr=mr·和垂直于r方向图1 电子绕核运动的椭圆轨道的角动量pφ=mr2φ·.对极角动量和极径动量分别使用量子化通则∮pφdφ=k1h,∮prdr=nrh,由有心力作用下的角动量守恒可得pφ=k1,ba=k1nr+k1≡k1n,式中 =h/2π()为约化普朗克常量,a为椭圆半长轴,b为椭圆半短轴,n即为主量子数,nr=0,1,2,3,…n-1,k1=1,2,3,…n被称为方位角量子数,它决定了椭圆的形状.nr最小值可以为零,表示没有径向运动,但k1最小值只能为1,如果为0,则电子没有轨道运动,这种情况不会出现.进一步考虑到电子运动的相对论效应,利用量子化通则可得氢原子的能级E=-hcRZ2n2-hcRZ4α2n4nk1-34()+…(2)式中α≈1/137为精细结构常数,而氢原子的能级依赖于主量子数n,还依赖于方位角量子数k1,因此方位角量子数k1是原子中电子的第二个量子数[3].对比碱金属原子的光谱线系的跑动项,k1=1,2,3,…n第5期黄永义:原子中电子的四个量子数9 也可以用英文字母为s、p、d、f、g…,其中前4个字母有确切的含义,为sharp(锐线系),principal(主线系),diffuse(漫线系),fundamental(基线系)的首个字母.如果原子处于磁场中,电子的轨道运动不再是平面,而是三维空间的曲线.磁场不是很强,它对电子运动的影响不是很大,电子的运动仍可以近似地看作是一个平面上的运动,轨道平面绕着磁场方向缓慢旋进,此时三维运动实际上是研究在磁场下电子轨迹的取向问题.如图2所示,Ze表示原子核,-e表示电子,电子的位置可以用3个球坐标r,θ,ψ()表示,对应的线动量角动量分别为pr,pθ,pψ(),它们满足的量子化条件为∮prdr=nrh,∮pθdφ=nθh,∮pψdψ=nψh,量子数nr、nθ、nψ都取整数.图2 有磁场时电子做三维运动,摘自[4]显然角动量pψ为上文极角动量的分量pψ=pφcosα(3)由于电子运动的哈密顿量H=12m(p2r+1r2p2θ+1r2sin2θp2ψ)-Ze24πε0r不含ψ,由正则方程p·ψ=- H/ ψ=0得pψ=常量.考虑到量子化条件∮pψdψ=nψh,得pψ=nψ[4].将此结果代入(3)式:cosα=nψ/k1(4)式中k1=nθ+nψ,由-1≤cosα≤1,得nψ=-k1,-k1+1,…, ,…,k1-1,k1(5)nψ共有2k1+1个取值.nψ=0时电子轨道平面包含了磁场方向,1918年玻尔认为这种情况电子轨道平面不稳定,nψ=0被禁止,因此nψ共有2k1个取值[5].极角动量pφ在磁场方向的分量pψ=nψ 取2k1分立的值的现象被称为角动量的空间量子化.而玻尔的主张也十分重要,后文会看到四个量子数的取值如果不考虑玻尔的意见就得不到正确的结果.基态银原子束的施特恩-盖拉赫实验结果也能得到巧合的解释,基态银原子两个量子数n=5,k1=1,则nψ=±1,银原子束在非均匀磁场中受力Fz= B zμz=B znψμB=± BzμB,μB=e /2me()为玻尔磁子,银原子束就经过非均匀磁场后分裂为两束.由实验参数测量的玻尔磁子和理论预测的一致,这使得一度怀疑玻尔氢原子理论的施特恩也不得不承认玻尔理论的正确.1916年 拜和索末菲使用玻尔-索末菲理论引入磁量子数成功解释了正常塞曼效应,这个磁量子数恰好就是nψ[6,7].磁量子数的引入使得人们认识到仅有两个量子数还不能完全描述电子的状态,碱金属原子的光谱更能说明这一点.到1922年通过高分辨率光谱仪观察到光谱人们已经很清楚知道了元素原子的能级重数,如碱金属原子是双重态,碱土金属原子是单态和三重态,第三列元素原子是双重态和四重态等等.光谱证据表明并不是所有的光谱线都满足频率的里兹组合定律,如碱金属原子的漫线系光谱项d向光谱项p跃迁,应该有4条光谱,而实验只观察到3条谱线.而这些未出现的谱线给索末菲提供了重要的线索:应该还存在某种选择定则禁止了那些未出现的光谱线。
创作编号:GB8878185555334563BT9125XW创作者: 凤呜大王*1-4. 四个量子数 1.主量子数n描述原子中电子出现几率最大区域离核的远近(电子层数); 决定电子能量高低。
取值: n=1 2 3 4 5 6 …… 电子层符号 K L M N O P…… 对于氢原子其能量高低取决于n但对于多电子原子,电子的能量除受电子层影响,还因原子轨道形状不同而异,(即受角量子数影响)(2) 角量子数l ,它决定了原子轨道或电子云的形状或表示电子亚层(同一n 层中不同分层)意义: 在多电子原子中,角量子数与主量子数一起决定电子的能量。
之所以称l 为角量子数,是因为它与电子运动的角动量M 有关。
如 M=0时,说明原子中电子运动情况同角度无关,即原子轨道或电子云形状是球形对称的。
.角量子数,l 只能取一定数值l = 0 1 2 3 4 ……(n-1)电子亚层 s p d f g说明M 是量子化的,具体物理意义是:电子云(或原子轨道)有几种固定形状,不是任意的。
如: s p d f球形对称 哑铃形 花瓣形 180︒,90︒棒锤形 第一电子层 仅有 l s 电子,(l =0) 第二电子层 有 2s ,2p 电子(l =0, 1)第三电子层 有 3s, 3p, 3d 电子 (l =0, 1, 2…) 依此类推。
见p76表3-2 .对H 和类氢离子来说: E1s <E2s <E3s <E4s E4s =E4p =E4d =E4f但对多电子原子来说:存在着电子之间的相互作用,n 相同,l 不同时,其能量也不相eV nE n 26.13-=)1(2+=l l h M π等。
一般应为:Ens <Enp <End <Enf也就是说:同一电子层上不同亚层能量也不相同,或说同一电子层上有不同能级. ∴2s ,2p 又称能级。
线状光谱在外加强磁场的作用下能发生分裂,显示出微小的能量差别,即,3个2p 轨道,或同是5个d 轨道,还会出现能量不同的现象,由此现象可推知,某种形状的原子轨道,可以在空间取不同的伸展方向,而得到几个空间取向不同的原子轨道,各个原子轨道能量稍有差别。
四个量子数四个量子数组成的空间,现在却只剩下了一个……黑暗将一切吞噬,是毁灭还是新生?为什么要丢弃那唯一一个活着的灵魂。
天使有洁白无瑕的羽翼,有纯净的心灵,而她却是灰色的……我对我自己说:“别紧张,别慌乱!坚强点儿,勇敢点儿,不要放弃希望,更不能放弃自己……”“救命——”第三次梦境开始,再次经历了人类与非人类之战后,满地的残肢断臂……从那以后每当夜晚降临时,我都会做同样的噩梦,醒来后发觉枕头湿透了,泪水浸润了眼眶,脑海中依旧回荡着刚才的画面和声音。
但奇怪的事情并没有出现,也许真如老师所言,这仅仅是一场梦吧。
可是,它总让我感到莫名其妙的恐惧,仿佛身边就站着一群恶魔般的存在,随时准备把我拖入深渊。
啊!好痛苦!又是这种令人窒息的感受,难道这就是传说中的死亡吗?我已记不清上一次被疼痛折磨得晕过去是多久前的事了,或者根本就忘掉了。
我蜷缩起双腿,尽力减少体内的温度流失,然而此刻的大脑早已混沌一片,思维变得迟钝麻木,甚至连呼吸都显得困难。
我用手捂住耳朵,想阻止噪杂的声响钻进我的耳膜里;我闭上眼睛,试图屏蔽外界刺目的光线;我伸直脖颈,企图躲避窗户玻璃反射的阳光。
终于,我承认自己太累了,便昏睡过去。
“你们这些人,快给我滚出去!”尖锐、愤怒的女高音穿破云霄,震撼整座城市。
我睁开朦胧的双眸,看见两位长相酷似芭比娃娃的小姐妹正在向我走近。
她俩脸颊微红,嘴唇轻抿,略带羞涩的表情惹人怜爱。
她们手持利剑,浑身散发着浓烈的杀气,仿佛要择人而食。
我顿时吓傻了,颤抖着问:“你们究竟是谁?”她们冷笑几声,突然加速冲向我,挥舞着锋利的宝剑砍向我的胸膛。
我拼命挣扎,却怎么也逃脱不了她们的束缚。
最后,我倒在血泊中,鲜血染红了周围的土壤,顺着伤口汩汩涌出。
“哈哈哈哈!”她们狂妄地仰天大笑,肆意嘲讽着我的愚蠢。
忽然,她们停止了动作,转身离去。
留下呆若木鸡的我独自躺在冰凉的泥土上,任凭寒风吹打着我单薄的躯壳。