高效液相色谱法测定依达拉奉注射液中依达拉奉及有关物质的含量
- 格式:doc
- 大小:33.50 KB
- 文档页数:6

依达拉奉注射液的质量标准
依达拉奉注射液是一种用于治疗风湿性关节炎和类风湿性关节炎的药物。
为了保证患者的用药安全和疗效,制定一份严格的质量标准至关重要。
下面是一份关于依达拉奉注射液的质量标准的示范,包括药物的外观、成分、纯度、稳定性以及生产工艺等方面的要求。
1. 外观要求
依达拉奉注射液应该是一种清澈、无色透明的液体,不得有悬浮物或沉淀物。
瓶身应干净完整,无破损或渗漏。
2. 成分及含量测定
(1)依达拉奉注射液的主要成分为依达拉奉。
(2)依达拉奉的含量应符合国家药典中规定的标准要求。
3. 纯度要求
(1)依达拉奉注射液中有关杂质的含量应符合国家药典中规定的限量要求。
(2)微生物限度应符合国家药典中规定的要求。
4. 稳定性
依达拉奉注射液在常温下应该能保持稳定,不分解、不氧化或不发生其他化学变化。
5. 生产工艺要求
(1)生产车间应符合GMP标准。
(2)所有原辅料应当有详细的质量控制记录。
(3)生产过程中的所有关键步骤均应定期进行验证。
(4)设备应当定期维护、清洁,并进行有效的验证。
6. 包装要求
依达拉奉注射液的包装材料应符合药物包装的相关要求,确保能有效地保护药品的质量和稳定性。
总结
依达拉奉注射液的质量标准应当覆盖药品的外观、成分、纯度、稳定性和生产工艺等方面,并严格按照国家药典的要求进行检测和验证。
生产企业在生产过程中应该始终遵守GMP等相关质量标准,并建立健全的质量管理体系。
这样才能确保依达拉奉注射液的质量稳定可靠,从而在临床应用中发挥出预期的疗效。


苏州沪云肿瘤研究中心有限公司标准依达拉奉Yi da la fengEdaravoneC10H10N2O 174.20本品为3-甲基-1-苯基-2-吡唑啉-5-酮。
按干燥品计算,含C10H10N2O 不得少于98.5%。
【性状】采用目测法对物质的外观进行测定。
本品在水中极微溶解,在乙醚中微溶,在稀盐酸中略溶,在乙醇、氯仿中溶解,在氢氧化钠试液中易溶。
本品的熔点127.0~129.0℃(中国药典2010年版二部附录Ⅵ C)【鉴别】(1)取本品100mg。
加稀盐酸5mL溶解,加碘化鉍钾试液数滴,即产生砖红色沉淀。
(2)本品红外吸收图谱主峰应与对照品图谱一致。
(3)取本品适量,用水制成浓度为每1mL含6μg的溶液,照分光光度法(中国药典2010年版二部附录Ⅳ A)测定。
在240nm处有最大吸收,在220nm处有最小吸收。
(4)在含量测定项下记录的色谱图中,供试品溶液色谱图主峰的保留时间应与对照品一致。
【检查】【溶液澄清度和颜色】取本品在水浴条件下加水溶解并稀释成每1mL中约含1.5mg的溶液,溶液应澄清无色,如显浑浊,与1号浊度标准液(中国药典2010年版二部附录Ⅸ B)比较,不得更浓;如显色,与黄色或黄绿色2号标准比色液(中国药典2010年版二部附录Ⅸ A第一法)比较,不得更深。
【pH 】取本品30mg,加水20mL在水浴条件下溶解后,依法测定(中国药典2010年版二部附录Ⅵ H),pH应在4.5-6.0之间。
【有关物质】参照高效液相色谱法(中国药典2010年版二部附录V D)测定。
取本品约30mg,精密称定,臵100mL容量瓶中,用流动相适量溶解并稀释至刻度,摇匀,作为供试品溶液。
精密量取供试品溶液1mL,臵100mL容量瓶中,用流动相稀释至刻度,摇匀,作为对照品溶液。
照含量测定的色谱条件,精密量取对照品溶液20μL,注入液相色谱仪中,调节仪器灵敏度使对照溶液主峰高度为满刻度量程的10%-15%,记录色谱图。

国内外标准测定依达拉奉注射液含量结果的对比研究作者:孙莹林大专孙全乐张凌赢来源:《中国实用医药》2014年第14期【摘要】目的验证国内标准测定依达拉奉注射液中依达拉奉含量与日本标准的一致性, 确定国内标准的可行性。
方法采用高效液相色谱法按照日本标准(内标法)和国内标准(外标法)分别测定含量。
结果国内外两个标准测定同一厂家三批依达拉奉注射液中依达拉奉的平均含量分别为95.0%、(RSD为0.122%)和98.2%(RSD为0.305%)。
结论国内外两个标准含量测定结果一致, 差异无统计学意义。
【关键词】依达拉奉注射液;高效液相色谱法;含量测定依达拉奉注射液是日本三菱东京制药株式会社开发的中枢神经系统用药, 于2001年在日本首次上市, 随后国内多家企业相继上市仿制药。
在质量标准的含量测定项下, 国内外标准均采用高效液相色谱法, 但日本标准采用的是内标法, 国内标准采用的是外标法, 为了比较国内外标准测定依达拉奉注射液中依达拉奉含量结果的一致性, 我们按照日本标准和国内标准分别对同一厂家的三批依达拉奉注射液中依达拉奉的含量进行了测定, 以其确定国内标准的可行性。
1仪器与试药1. 1主要仪器Agilent 1200高效液相色谱仪(Agilent 1200可变波长检测器(VWD), Agilent 1200数据站, P/N-7725i手动进样器, G1354A四元梯度泵及G1316A柱温箱(美国Agilent公司产品)。
1. 2主要试药依达拉奉对照品(南通飞宇生物科技有限公司, 批号FY24810511, 规格:100mg, 含量≥99%);依达拉奉注射液(吉林省某药业股份有限公司:2013063001、2013063002、2013063003);甲醇(美国Fisher公司, 色谱纯);醋酸铵(北京化工厂, 分析纯);乙腈(美国Fisher公司, 色谱纯);醋酸(北京化工厂, 分析纯);氨水(北京化工厂, 分析纯);对氨基苯甲酸乙酯(阿拉丁化学试剂上海有限公司, 分析纯)。
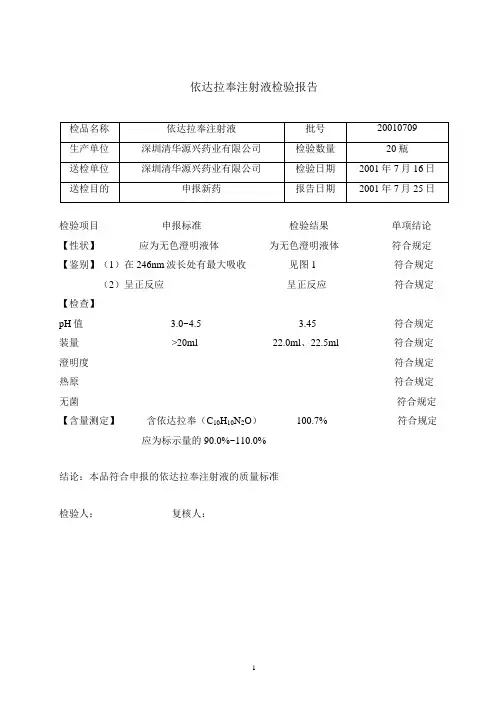
依达拉奉注射液检验报告检验项目申报标准检验结果单项结论【性状】应为无色澄明液体为无色澄明液体符合规定【鉴别】(1)在246nm波长处有最大吸收见图1 符合规定(2)呈正反应呈正反应符合规定【检查】pH值 3.0~4.5 3.45 符合规定装量 >20ml 22.0ml、22.5ml 符合规定澄明度符合规定热原符合规定无菌符合规定【含量测定】含依达拉奉(C10H10N2O) 100.7% 符合规定应为标示量的90.0%~110.0%结论:本品符合申报的依达拉奉注射液的质量标准检验人:复核人:依达拉奉注射液检验报告检验项目申报标准检验结果单项结论【性状】应为无色澄明液体为无色澄明液体符合规定【鉴别】(1)在246nm波长处有最大吸收见图2 符合规定(2)呈正反应呈正反应符合规定【检查】pH值 3.0~4.5 3.50 符合规定装量 >20ml 21.8ml、22.2ml 符合规定澄明度符合规定热原符合规定无菌符合规定【含量测定】含依达拉奉(C10H10N2O) 100.5% 符合规定应为标示量的90.0%~110.0%结论:本品符合申报的依达拉奉注射液的质量标准检验人:复核人:依达拉奉注射液检验报告检验项目申报标准检验结果单项结论【性状】应为无色澄明液体应为无色澄明液体符合规定【鉴别】(1)在246nm波长处有最大吸收见图3 符合规定(2)呈正反应呈正反应符合规定【检查】pH值 3.0~4.5 3.53 符合规定装量 >20ml 20.6ml、21.5ml 符合规定澄明度符合规定热原符合规定无菌符合规定【含量测定】含依达拉奉(C10H10N2O) 100.2% 符合规定应为标示量的90.0%~110.0%结论:本品符合申报的依达拉奉注射液的质量标准检验人:复核人:。



依达拉奉注射液的质量标准依达拉奉注射液(Yidalaofeng Injection)是一种常用的中成药,主要适用于治疗支气管炎、肺炎、急性喉炎、支气管扩张等呼吸系统疾病。
作为一种注射剂,依达拉奉注射液的质量标准至关重要,下面将详细介绍。
首先,依达拉奉注射液的外观要求清澈无悬浮物,并且颜色应为无色或微黄色。
若出现混浊、沉淀或颜色变化等异常情况,则表示质量不符合标准,不宜使用。
其次,依达拉奉注射液的溶解度应符合规定。
一般来说,该药品在水中的溶解度应不低于规定的限值,以保证药物在体内的有效性和注射液的稳定性。
第三,依达拉奉注射液的pH值应在规定的范围内。
药物的pH值与其稳定性和药效息息相关,如果pH值超出规定范围,就可能导致药物分解或不稳定等问题,从而影响疗效。
第四,依达拉奉注射液的总含量和规定的有关物质的含量,如铁的含量等,应符合规定的限值。
这些限值是为了保证药物的安全性和有效性,避免剂量过高或过低等问题。
另外,依达拉奉注射液的有关杂质也需要进行检查。
相关杂质的含量应低于规定的限值,以确保药物的纯度和安全性。
此外,注射液还应符合相关的贮存条件,例如温度和光照等。
对于依达拉奉注射液来说,应存放在干燥、阴凉和避光的地方,以免药物的质量受到影响。
最后,依达拉奉注射液还需要进行微生物限度测试,以确保注射液中没有细菌、霉菌或其他的微生物污染。
这是为了保证药物的安全性和无菌性。
总结起来,依达拉奉注射液的质量标准包括外观要求、溶解度、pH值、总含量和有关物质的含量、有关杂质的含量、贮存条件以及微生物限度。
这些标准的制定旨在确保药品的质量和安全性,为患者提供高效、安全的治疗。

依达拉奉注射液质量标准草案及起草说明#优选.依达拉奉注射液质量标准草案及起草说明8.1、临床用质量标准草案依达拉奉注射液Yidalafeng zhusheyeEdaravone Injection本品为依达拉奉的灭菌水溶液,含依达拉奉(C10H10N2O)应为标示量的90.0%~110.0%。
【性状】本品为无色澄明液体。
【鉴别】(1)取本品,加乙醇制成每1ml中含6μg的溶液,照分光光度法(中国药典2000版二部附录IV A)测定,在246nm波长处有最大吸收。
(2)取本品约2ml,加重氮苯磺酸试液2ml,立即呈黄色。
【检查】pH值应为3.0~4.5(中国药典2000版二部附录VI H)。
其它应符合注射剂项下有关的各项规定。
【含量测定】照高效液相色谱法(中国药典2000年版二部附录V D)测定。
色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂(4.6mm2×150mm);以0.02mol/L的磷酸二氢钠溶液(用NaOH调pH7.0)-甲醇(70:30)为流动相;流速为1ml/min;检测波长为244nm。
理论塔板数按依达拉奉峰计算应不低于1500。
精密量取本品5ml,置25ml量瓶中,并用流动相稀释至刻度,摇匀,作为供试品溶液;取经105℃干燥至恒重的依达拉奉对照品适量,加流动相制成每ml中含依达拉奉300μg的溶液,作为对照品溶液。
精密量取供试品溶液及对照品溶液各10μl注入液相色谱仪,记录色谱图。
按外标法以峰面积计算,即得。
【类别】脑保护剂。
【规格】20ml:30mg【贮藏】室温、密闭保存。
8.2、床用质量标准草案起草说明根据本品质量研究试验及稳定性试验结果并按注射剂的制剂通则制定本标准。
各项说明如下:【性状】本品三批检测结果为无色的澄明液体。
【鉴别】紫外分光光度法取本品对照品及三批样品适量,加乙醇制成每1ml约含6μg的溶液,按分光光度法(中国药典2000年版二部附录IVA)测定,均在246nm波长处有最大吸收。


依达拉奉在不同注射液中配伍稳定性的研究陈 进(安徽省合肥市第二人民医院药剂科,安徽合肥 230011)摘要:目的 考察依达拉奉注射液分别与0.9%氯化钠注射液、葡萄糖氯化钠注射液、5%葡萄糖注射液、10%葡萄糖注射液配伍的稳定性。
方法 应用高效液相色谱仪测定依达拉奉注射液中的含量,考察依达拉奉注射液与常用注射液配伍后的p H值的变化。
结果 与4种注射液配伍后8h内,其外观无变化,但p H值、含量在1h后有显著变化。
结论 此4种输液于20℃下配伍,绝不能在1h外使用,1h内使用临床上也需谨慎观察。
关键词:依达拉奉注射液;配伍;稳定性S t a b i l i t y o f e d a r a v o n e i n j e c t i o n m i x e dw i t h4i n f u s i o n sC H E NJ i n(D e p a r t m e n t o f P h a r m a c y,T h e S e c o n dP e o p l e′s H o s p i t a l,H e f e i230011)A b s t r a c t:O b j e c t i v e T o t e s t t h e s t a b i l i t y o f e d a r a v o n e i n j e c t i o n m i x e dw i t h4i n f u s i o n s.Me t h o d s E d a r a v o n e i n j e c t i o nw a s m i x e d w i t h0.9%s a l i n e i n f u s i o n,g l u c o s e-s a l i n e i n f u s i o n,5%a n d10%g l u c o s e i n f u s i o n s a t20℃r e s p e c t i v e l y,w i t h i n8h a f t e r w h i c ht h e c h a n g e s o fa p p e a r a n c e a n dp Hv a l u e o f t h e m i x t u r e s o l u t i o n s w e r e ob s e r v e d.I t w a s d e t e r m i n e db y H P L C.R e s u l t s T h e r e a r e s i g n i f ic a n t c h a n g e s i n p H v a l u eo f t h em i x t u r es o l u t i o n s a n dc o n t e n t s i nt h e m a f t e r1h.C o n c l u s i o n Ed a r a v o n ei n je c t i o nc a nb em i x e dw i t h t h ea b o v e-m e n-t i o n e d4i nf u s i o n s f o r c l i n i c a l u s ew i t h i n1ha t20℃.K e yw o r d s:e d a r a v o n e i n j e c t i o n;s t a b i l i t y;i n f u s i o n 依达拉奉是一种脑保护剂(自由基清除剂)。
依达拉奉的质量标准制定主要依据其化学性质和药效性质。
其质量标准通常包括以下方面:
1. 性状:依达拉奉为无色或几乎无色的澄明液体,有特臭。
2. 鉴别:采用薄层色谱法进行鉴别,主要通过对照品和样品的色谱行为进行比对。
3. 检查:对其pH值、相对密度、折光率、重金属、炽灼残渣、干燥失重、有关物质等进行检查,以符合药典规定。
4. 含量测定:采用高效液相色谱法进行含量测定,一般选用适当的对照品进行比对。
以上信息仅供参考,如需了解更多信息,建议查阅药典或咨询专业人士。
依达拉奉注射液的质量标准
依达拉奉注射液是一种用于治疗急性脑梗死和脑水肿的药物,其质量标准包括以下几个方面:
1. 外观:应为无色至微黄色的澄明液体。
2. pH 值:应为
3.0-5.0。
3. 鉴别:应符合规定的鉴别方法。
4. 检查:应符合规定的检查项目,如装量、可见异物、不溶性微粒、无菌检查等。
5. 含量测定:应符合规定的含量测定方法,依达拉奉注射液的含量应为标示量的90.0%-110.0%。
6. 有关物质:应符合规定的有关物质检查方法,杂质总量不得超过2.0%。
7. 重金属:应符合规定的重金属检查方法,重金属含量不得超过百万分之十。
8. 细菌内毒素:应符合规定的细菌内毒素检查方法,细菌内毒素含量不得超过0.5EU/ml。
以上是依达拉奉注射液的质量标准的主要内容,具体的质量标准还可能根据不同的生产厂家和国家的要求而有所不同。
在使用依达拉奉注射液时,应按照医生的建议使用,并严格按照药品说明书中的用法用量使用。
浅谈依达拉奉注射液的临床应用范围
黄马羊
【期刊名称】《内蒙古中医药》
【年(卷),期】2010(029)006
【摘要】@@ 必存(依达拉奉注射液)是一种针对脑梗死急性期的新型自由基清除剂.研究证明,自由基在缺血后脑损伤中起着关键作用,自由基清除剂作为脑梗死急性期的治疗方法之一,已引起医学界的广泛关注.必存(依达拉奉注射液)通过捕获羟自由基、抑制脂质过氧化作用、抑制脑细胞(血管内皮细胞、神经细胞)的过氧化作用,从而减轻脑水肿和脑组织损伤.
【总页数】2页(P42-43)
【作者】黄马羊
【作者单位】江西省胸科医院,330006
【正文语种】中文
【中图分类】R969.3
【相关文献】
1.高效液相色谱法测定依达拉奉注射液中依达拉奉及有关物质的含量
2.丹红注射液联合依达拉奉注射液治疗老年脑梗死的临床疗效
3.银杏内酯注射液与丁苯酞氯化钠注射液分别联合依达拉奉治疗急性缺血性脑卒中的对比观察
4.神经节苷脂注射液联合依达拉奉注射液治疗未溶栓急性脑梗死患者的效果观察及对认知功能、日常生活能力的影响
5.神经节苷脂注射液联合依达拉奉注射液治疗未溶栓急性脑梗死患者的效果观察及对认知功能、日常生活能力的影响
因版权原因,仅展示原文概要,查看原文内容请购买。
高效液相色谱法测定依达拉奉注射液的含量及有关物质
付桂英;温明铃;贾立华;左秀萍
【期刊名称】《解放军药学学报》
【年(卷),期】2006(22)6
【摘要】目的建立依达拉奉注射液含量测定的HPLC.方法采用Hypersil ODS-C18(4.6μm250mm,5μm)色谱柱,1%醋酸水溶液-甲醇(40∶ 60)为流动相,检测波长243nm,柱温25℃.结果在该色谱条件下,依达拉奉与有关物质可完全分离,依达拉奉在6~150μg·ml-1范围内具有良好线性关系,r=0.999 9.结论该方法操作简便,结果准确,专属性强,可用于依达拉奉注射液的含量及有关物质测定.
【总页数】3页(P458-460)
【作者】付桂英;温明铃;贾立华;左秀萍
【作者单位】中国人民解放军第307医院,药剂科,北京,100071;中国人民解放军第307医院,药剂科,北京,100071;中国人民解放军第307医院,药剂科,北京,100071;中国人民解放军第307医院,药剂科,北京,100071
【正文语种】中文
【中图分类】R9
【相关文献】
1.高效液相色谱法测定依达拉奉注射液的含量及其有关物质 [J], 汤海燕;朱正怡;叶肖栗
2.反相高效液相色谱法分离依达拉奉有关物质及其注射液含量测定 [J], 沈卫阳;陶
一飞;赵海龙
3.高效液相色谱法测定依达拉奉注射液中依达拉奉及有关物质的含量 [J], 谷铁波;陈贵平
4.高效液相色谱法测定依达拉奉注射液中有关物质含量 [J], 杨清举;张弘
5.用高效液相色谱法测定多索茶碱注射液中有关物质及含量的效果分析 [J], 李新军;王晓光;董宏伟
因版权原因,仅展示原文概要,查看原文内容请购买。
反相高效液相色谱法分离依达拉奉有关物质及其注射液含量测定沈卫阳;陶一飞;赵海龙【期刊名称】《中国新药杂志》【年(卷),期】2003(012)011【摘要】目的:建立依达拉奉有关物质及其注射液含量测定的RP-HPLC法.方法:色谱柱为岛津ShimpackODS柱(150mm×6mm,5μm),流动相为甲醇-0.05mol·L-1的磷酸二氢钾缓冲液(用磷酸调pH3.0)(50:50),检测波长为241nm,流速为1.0mL·min-1.结果:建立的色谱方法使依达拉奉与有关物质完全分离;制剂中辅料对主药无干扰,依达拉奉在3~45μg·mL-1浓度范围内,峰面积与浓度线性关系良好,相关系数r=0.9998.平均回收率为99.48%.结论:本法简便,准确,专属性强,可用于依达拉奉的有关物质检查及其注射液的含量测定.【总页数】3页(P928-930)【作者】沈卫阳;陶一飞;赵海龙【作者单位】中国药科大学分析化学教研室,南京,210009;东吴医药化工技术开发有限公司,常州,213022;东吴医药化工技术开发有限公司,常州,213022【正文语种】中文【中图分类】R927.2;R971【相关文献】1.反相高效液相色谱法测定多索茶碱注射液的有关物质 [J], 邢海燕;刘建军;杨永2.反相高效液相色谱法测定复方己酸羟孕酮注射液的有关物质 [J], 左志辉;唐素芳3.高效液相色谱法测定依达拉奉注射液中依达拉奉及有关物质的含量 [J], 谷铁波;陈贵平4.用反相高效液相色谱法测定克林霉素磷酸酯注射液中克林霉素及有关物质含量的效果分析 [J], 董宏伟;李新军;王晓光5.反相高效液相色谱法测定异咯嗪类S_(10)注射液的有关物质 [J], 李娜;杨建云;肖炳坤;黄荣清因版权原因,仅展示原文概要,查看原文内容请购买。
处方因素对依达拉奉注射剂稳定性的影响
付桂英;温明铃;贾立华;王世岭
【期刊名称】《中国新药杂志》
【年(卷),期】2005(14)6
【摘要】目的:研究处方的组成和制备工艺对依达拉奉注射剂稳定性的影响.方法:采用高效液相色谱法测定注射剂的含量和有关物质,考察pH值、抗氧剂、助溶剂和制备工艺对注射剂含量的影响.结果:加入抗氧剂、助溶剂、将溶液pH调节为3.0~4.5可增加依达拉奉注射液的稳定性.结论:改变处方和工艺可以获得稳定的依达拉奉注射剂.
【总页数】3页(P726-728)
【作者】付桂英;温明铃;贾立华;王世岭
【作者单位】解放军307医院,北京,100039;解放军307医院,北京,100039;解放军307医院,北京,100039;解放军307医院,北京,100039
【正文语种】中文
【中图分类】R972.1;R543
【相关文献】
1.圣肤霜中地塞米松稳定性的影响因素及处方工艺优化 [J], 赵维娟;张梅;王金萍
2.剂型因素对中药注射剂输液配伍后稳定性的影响 [J], 李汉成;刘金坤
3.影响中药注射剂稳定性因素的探讨 [J], 宋秋香;张克臣
4.影响中药注射剂稳定性因素的探讨 [J], 宋秋香;张克臣
5.影响中药注射剂稳定性的相关因素研究 [J], 黄江虹
因版权原因,仅展示原文概要,查看原文内容请购买。
高效液相色谱法测定依达拉奉注射液中依达拉奉及有关物质的含量目的建立测定依达拉奉注射液中依达拉奉及有关物质含量的高效液相色谱法(HPLC)。
方法采用Cromasil C18柱(250 mm×4.6 mm,5 μm),流动相:甲醇-0.05 mol/L磷酸二氢铵溶液(50:50)[用20%磷酸调节pH值至(3.5±0.1)];流速:1.0 ml/min;检测波长:239 nm;柱温:30℃。
结果在该色谱条件下,依达拉奉与样品中杂质可完全分离;在6.024~54.216 μg/ml 范围内,峰面积与其浓度线性关系良好(r = 0.9997,n = 5),平均回收率为100.34%(RSD = 0.55%,n = 9),最低检出量为12.1 ng。
结论本法操作简便快速,准确可靠,专属性强,可用于依达拉奉注射液中依达拉奉及有关物质的测定。
标签:依达拉奉;HPLC;含量测定;有关物质依达拉奉(edaravone,3-甲基-1-苯基-2-吡唑啉-5-酮)为强效自由基清除剂,于2001年在日本上市,临床上主要用于治疗急性缺血性脑卒中[1]。
作为第1个新型氧自由基清除剂,具有清除自由基、抑制脂质过氧化及减轻缺血脑细胞、血管内皮细胞、神经细胞的氧化和再灌注损伤的作用,并可阻止脑水肿和脑梗死进展,改善因急性脑梗死所致的神经症状、日常生活活动能力和功能障碍[2]。
近年来,有关依达拉奉治疗肌萎缩侧索硬化症、帕金森病等的临床研究正在进行中,抗癫痫和抗类风湿性关节炎在临床实践中被发现,其对人类多种疾病的有效性说明此药具有广阔的开发前景[3]。
本研究根据依达拉奉的结构特点和化学性质,参考相关文献[4-7],建立了高效液相色谱法(high performance liquid chromatography,HPLC)测定依达拉奉注射液中依达拉奉及有关物质的含量,本方法能将供试品中主峰与有关物质峰完全分离,且能有效检出依达拉奉注射液中所含杂质,具有专属性强、灵敏度高、选择性好、简便、准确等特点,可有效地应用于依达拉奉注射液的质量控制。
1 仪器与试药1.1 仪器岛津LC-15C高效液相色谱仪,SPD-15C紫外-可见光检测器(日本岛津公司),CTO-15C色谱柱柱温箱(日本岛津公司),Lcsolution 15C 工作站(日本岛津公司),SIL-10AF自动进样器(日本岛津公司);UV-2450紫外分光光度计(日本岛津公司)、AUW120D 岛津分析天平。
1.2 试药甲醇为色谱纯,其他试剂均为分析纯。
依达拉奉对照品(批号:100620-200401;含量100%,中国药品生物制品检定所);依达拉奉注射液(福寿堂制药有限公司;规格:20 ml∶30 mg;批号:110911、110913、110915)。
2 方法与结果2.1 色谱条件和系统适用性试验色谱柱:Cromasil C18柱(250 mm×4.6 mm,5 μm);流动相:甲醇-0.05 mol/L 磷酸二氢铵溶液(50∶50)[用20%磷酸调节pH值至(3.5±0.1)];流速1.0 ml/min;检测波长:239 nm;柱温:30℃;进样量:20 μl[8-9]。
2.1.1 对照品溶液的制备取依达拉奉对照品适量,精密称定,用流动相溶解并定量稀释制成每毫升中约含30 μg的溶液。
2.1.2 供试品溶液的制备精密量取依达拉奉注射液(批号:110911)2.0 ml,置100 ml量瓶中,用流动相稀释至刻度,摇匀。
2.1.3 空白辅料溶液的制备按处方制备不含依达拉奉的溶液。
取空白辅料溶液2.0 ml,置100 ml量瓶中,用流动相稀释至刻度,摇匀。
2.1.4 系统适用性试验在上述色谱条件下,分别精密吸取空白辅料溶液、依达拉奉对照品溶液及依达拉奉供试品溶液各20 μl进样。
理论板数以依达拉奉峰计算应不低于1000。
结果提示,理论板数以依达拉奉峰计为2500,空白辅料对测定无干扰(图1)。
2.2 破坏性试验在杂质或降解产物不能获得的情况下,对本品进行酸、碱、热、光、氧强制降解试验。
2.2.1 样品的制备2.2.1.1 破坏前样品的制备精密量取110911批次的依达拉奉注射液2.0 ml,置10 ml量瓶内,用流动相稀释至刻度,摇匀,滤过,即得。
2.2.1.2 酸破坏样品的制备精密量取依达拉奉注射液2.0 ml,置10 ml量瓶内,加入0.1 mol/L的盐酸溶液2 ml,室温下静置4 h后,加0.1 mol/L的氢氧化钠溶液适量中和,用流动相稀释至刻度,摇匀,滤过,即得。
2.2.1.3 碱破坏样品的制备精密量取110911批次的依达拉奉注射液2.0 ml,置10 ml量瓶内,加入0.1 mol/L的氢氧化钠溶液2 ml,室温下静置4 h后,加适量0.1 mol/L的盐酸溶液中和,用流动相稀释至刻度,摇匀,滤过,即得。
2.2.1.4 热高温破坏样品的制备精密量取110911批次的依达拉奉注射液2.0 ml,置10 ml量瓶内,150℃高温加热1 h后取出,放至室温,用流动相稀释至刻度,摇匀,滤过,即得。
2.2.1.5 光照破坏样品的制备精密量取110911批次的依达拉奉注射液2.0 ml,置10 ml量瓶内,用流动相稀释至刻度,在强光(4500±500)Lx下放置4 h 后,摇匀,滤过,即得。
2.2.1.6 氧化破坏样品的制备精密量取110911批次的依達拉奉注射液2.0 ml,置10 ml量瓶内,加入10%的过氧化氢2 ml,室温放置2 h,用流动相稀释至刻度,摇匀,滤过,即得。
精密量取上述样品溶液各20 μl,注入液相色谱仪,记录色谱图。
2.2.2 破坏性试验的结果本品在酸、碱、热条件下较稳定,但是在氧化和光条件下有明显的降解产物生成。
本品溶液在酸、碱、氧化、光照及高温条件下进行破坏所产生杂质在本色谱条件下均能与依达拉奉良好分离,因此可以采用上述色谱条件测定本品的有关物质(图2)。
2.3 线性关系考察取依达拉奉对照品,精密称定,置容量瓶中,加流动相溶解使成约0.3 mg/ml 溶液,作为贮备溶液。
分别精密量取上述贮备溶液 1.0、3.0、5.0、7.0、9.0 ml 置入50 ml容量瓶中,用流动相稀释至刻度。
精密量取上述溶液各20 μl,注入液相色谱仪,记录色谱图及峰面积。
以溶液浓度(X)为横坐标,以相应峰面积(Y)为纵坐标进行线性回归,回归方程Y = 151 629X+839 53(r = 0.9997)。
结果提示,依达拉奉溶液在6.024~54.216 μg/ml范围内,峰面积与浓度呈良好的线性关系。
2.4 检出限取依达拉奉对照品溶液(0.3 mg/ml),用流动相进行逐级稀释,按“2.1”项下色谱条件进样20 μl,以信噪比为3∶1的进样浓度为最低检出限,依达拉奉溶液的最低检出限为12.1 ng/ml。
2.5 精密度试验精密量取110911批次的依达拉奉注射液2.0 ml,置100 ml量瓶中,用流动相稀释至刻度,摇匀,作为供试品溶液。
精密量取上述样品溶液各20 μl,连续测定6次,记录各次测定的主成分峰面积,按峰面积计算,RSD值为0.64%,表明本方法进样精密度良好。
2.6 稳定性试验取“2.5”项下供试品溶液,分别于0、1、2、4、6、8、12 h内进样测定,记录色谱图及峰面积,结果提示,供试品的峰面积稳定性良好,按峰面积计算,RSD值为0.81%,表明本品溶液在室温下放置12 h内稳定。
2.7 重复性试验取110911批次的依达拉奉注射液,按“2.1”项下供试品及对照品溶液制备方法,配制6份供试品溶液,按“2.1”项下色谱条件进样测定,按外标法计算供试品的含量,结果提示,6份样品溶液的平均标示含量为100.2%,RSD值为0.90%,表明本方法重复性良好。
2.8 加样回收率试验精密量取9份已知含量的依达拉奉注射液(批号:110911;依达拉奉含量为1.503 mg/ml),每份为1.0 ml,置入100 ml量瓶中,分别精密加入依达拉奉对照品溶液(1.01 mg/ml)1.0、1.5、2.0 ml,按供试品溶液制备方法制备成高、中、低3个浓度的溶液,各3份,按“2.1”项下方法进样测定,计算回收率。
结果提示,平均回收率为100.34%(n = 9),RSD值为0.55%,表明本方法准确度良好(表1)。
表1 加样回收率试验(n = 9)2.9 供试品含量及有关物质的测定2.9.1 供试品含量的测定取3批依达拉奉注射液(批号:110911、110913、110915),按“2.1.1”及“2.1.2”项下方法制备对照品溶液和供试品溶液,按“2.1”项下色谱条件进行测定,记录峰面积,按外标法以峰面积计算样品中依达拉奉的含量。
结果提示,3批依达拉奉注射液所含依达拉奉的含量分别为1.503 mg/ml(占标示量的100.2%)、1.505 mg/ml(占标示量的100.3%)、1.500 mg/ml(占标示量的100.0%)。
2.9.2 有关物质的测定取3批依达拉奉注射液(批号:110911、110913、110915),分别精密量取样品2.0 ml(约相当于依达拉奉3 mg),置10 ml量瓶中,用流动相稀释至刻度,摇匀,作为供试品溶液;精密量取供试品溶液1.0 ml,置100 ml量瓶中,用流动相稀释至刻度,摇匀,作为对照溶液。
按“2.1”项下条件,取对照溶液20 μl注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高为满量程的10%~30%;再精密量取对照品溶液及供试品溶液各20 μl注入液相色谱仪,记录色谱图至主成分色谱峰保留时间的3倍,按不加校正因子主成分自身对照法计算供试品溶液中有关物质的含量。
结果提示,3批依达拉奉注射液的有关物质含量分别为0.17%、0.18%、0.18%。
3 讨论3.1 检测波长的选择取依达拉奉对照品溶液(约30 μg/ml)及空白辅料溶液(按处方比例配制),在200~500 nm波长范围内依法进行紫外扫描,结果表明依达拉奉在239 nm的波长处有最大吸收,而辅料在239 nm处无吸收,因而选择239 nm作为依达拉奉的检测波长。
3.2 流动相的选择本研究考察了甲醇-乙酸铵、甲醇-磷酸二氢铵两种流动相系统,结果提示,依达拉奉在两种流动相系统下峰形均良好,但是后者效果更佳,且出峰时间适宜。
进一步考察甲醇和磷酸二氢铵溶液的比例,研究表明,采用甲醇-0.05 mol/L磷酸二氢铵溶液(50∶50)[用20%磷酸调节pH值至(3.5±0.1)]为流动相,能够有效地检测出依达拉奉注射液中所含的有关物质。
3.3 流动相pH的选择流动相的pH值对依达拉奉峰的出峰时间和峰形影响不大,但是影响依达拉奉与其降解杂质的分离效果,本研究将流动相的pH值调节至(3.5±0.1),依达拉奉与其降解杂质能够较好地分离。