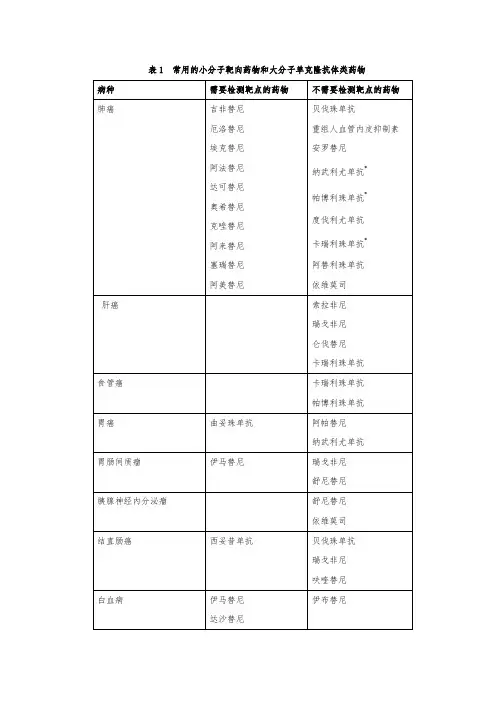
肿瘤小分子靶向药物分类
- 格式:docx
- 大小:10.87 KB
- 文档页数:5
化学抗肿瘤药物经过半个多世纪的发展,已经进入靶向治疗药物时代。
小分子靶向药物在临床上的应用日益增多,在一些肿瘤类别中已经进入一线用药地位,比如肾癌、慢粒白、多发性骨髓瘤等。
本文对小分子靶向治疗药物做一综述。
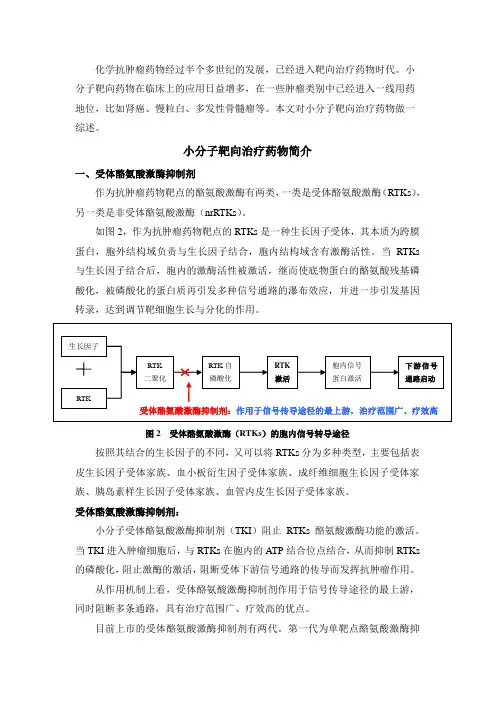
小分子靶向治疗药物简介一、受体酪氨酸激酶抑制剂作为抗肿瘤药物靶点的酪氨酸激酶有两类,一类是受体酪氨酸激酶(RTKs),另一类是非受体酪氨酸激酶(nrRTKs)。
如图2,作为抗肿瘤药物靶点的RTKs是一种生长因子受体,其本质为跨膜蛋白,胞外结构域负责与生长因子结合,胞内结构域含有激酶活性。
当RTKs 与生长因子结合后,胞内的激酶活性被激活,继而使底物蛋白的酪氨酸残基磷酸化,被磷酸化的蛋白质再引发多种信号通路的瀑布效应,并进一步引发基因转录,达到调节靶细胞生长与分化的作用。
图2 受体酪氨酸激酶(RTKs)的胞内信号转导途径按照其结合的生长因子的不同,又可以将RTKs分为多种类型,主要包括表皮生长因子受体家族、血小板衍生因子受体家族、成纤维细胞生长因子受体家族、胰岛素样生长因子受体家族、血管内皮生长因子受体家族。
受体酪氨酸激酶抑制剂:小分子受体酪氨酸激酶抑制剂(TKI)阻止RTKs酪氨酸激酶功能的激活。
当TKI进入肿瘤细胞后,与RTKs在胞内的ATP结合位点结合,从而抑制RTKs 的磷酸化,阻止激酶的激活,阻断受体下游信号通路的传导而发挥抗肿瘤作用。
从作用机制上看,受体酪氨酸激酶抑制剂作用于信号传导途径的最上游,同时阻断多条通路,具有治疗范围广、疗效高的优点。
目前上市的受体酪氨酸激酶抑制剂有两代。
第一代为单靶点酪氨酸激酶抑制剂,如吉非替尼、厄洛替尼。
表已上市的酪氨酸激酶抑制剂注:EGFR:表皮生长因子受体,属HER家族;VEGFR:血管内皮生长因子;PDGFR:血小板衍生因子;HER2:HER家族的一种受体;Abl-Bcr:一种非受体酪氨酸激酶;Raf:酪氨酸激酶的下游信号通路中的一种蛋白;Flt-3:Src:一种非受体酪氨酸激酶;c-kit:Ret:胶质细胞源性神经营养因子的受体吉非替尼为EGFR酪氨酸激酶抑制剂,主要用于非小细胞肺癌,对酪氨酸激酶基因编码区突变型肿瘤的有效率高达80%以上。

靶向药物的分类和作用机理
一、概念:所谓靶向药物,就是以参与肿瘤发生发展过程的重要分子作为靶点,通过抑制或阻断该靶点,而发挥治疗作用的药物。
二、机理:靶点通常是与肿瘤细胞的增殖、抗凋亡、迁移和转移、以及血管生成等相关的分子。
在众多的靶点中,与肿瘤细胞增殖密切相关的驱动基因,往往是最好的靶点,比如表皮生长因子受体抑制剂,用于治疗EGFR基因突变的肺腺癌患者,获得了比传统细胞毒性药物治疗更好的疗效,且毒性反应轻微。
与传统化疗药物相比,靶向药物具有特异性、个体化、疗效高和对正常组织损伤小的特点。
三、分类:靶向药物按照分子结构和作用机制,可以分为两大类:单克隆抗体类和小分子化合物类。
单克隆抗体属于生物大分子,无法穿透细胞膜,主要通过与细胞外或胞膜上的抗原结合发挥作用。
抗体类包括裸抗体和修饰抗体。
裸抗体抑制肿瘤细胞增殖的主要机制包括:抗体依赖的细胞毒性作用、补体依赖的细胞毒性作用以及通过受体——配体的相互作用诱导细胞凋亡等。
修饰抗体可通过特异性的抗原抗体反应,将偶联上的放射性核素、毒素、药
物、酶等带至肿瘤局部或肿瘤细胞内,起到杀伤肿瘤细胞的作用。

肿瘤靶向治疗经典药物
EEGFR(表皮生长因子)抑制剂:
(1)单克隆抗体:Erbitux(爱必妥。
西妥昔单抗,IMC-C225)
(2)作用于TPK系统的小分子靶向药物:
①IreSSa(gefitinib,ZD1839)(易瑞沙,吉非替尼片)可抑制EGFR酪氨酸激酶;是肺癌生物靶点治疗中较为成熟的药物,公认适用于复发、晚期NSCLC二线、三线治疗;IrSSSa治疗临床观察:女性,腺癌,年龄>68岁,不吸烟者疗效较好;
②TarCeVa(erlotinib,0SI-774)(特罗凯,盐酸厄洛替尼片)酪氨酸酶抑制剂。
认为主要对细支气管肺泡癌最有活力,而且在不吸烟中有较好RR;
2、其他酪氨酸激酶抑制剂:
①GIiVeC(格列卫)针对BCR-ABL基因靶目标治疗慢性粒细胞白血病,针对C-Kit基因靶目标从而治疗GlST(胃肠道间质瘤)。
通过与ATP竞争性结合酪氨酸激酶催化部位的核甘酸结合位点,使得激酶不能发挥催化活性,底物的酪氨酸残基不能被磷酸化,使其不能与下游的效应分子进一步作用,导致细胞增殖受抑,诱导细胞凋亡。
②SOrafenib(多激酶抑制剂)索拉非尼
③SUtent(多个受体TK抑制剂)舒尼替尼
3、其他单克隆抗体:
①HerCePtin:赫赛汀,抗HER-2受体单抗;
②Mabthera(美罗华,rituximab利妥昔单抗)抗CD20受体单抗。
4、血管生长抑制剂:AVaStin(贝伐单抗制抗VEGF单抗。
沙利度胺(反应停)。


1230.[19] CostaBM,SmithJS,ChenY,etal.ReversingHOXA9oncogeneactivationbyPI3Kinhibition:Epigeneticmechanismandprognos ticsignificanceinhumanglioblastoma[J].CancerRes,2010,70(2):453-462.[20] VerhaakRG,HoadleyKA,PurdomE,etal.Integratedgenomicanalysisidentifiesclinicallyrelevantsubtypesofglioblastomachar acterizedbyabnormalitiesinPDGFRA,IDH1,EGFR,andNF1[J].CancerCell,2010,17(1):98-110.[21] PojoM,GoncalvesCS,Xavier-MagalhaesA,etal.AtranscriptomicsignaturemediatedbyHOXA9promoteshumanglioblastomainitiation,aggressivenessandresistancetotemozolomide[J].On cotarget,2015,6(10):7657-7674.[22] OtaT,KlausenC,ClaraSalamancaM,etal.ExpressionandfunctionofHOXAgenesinnormalandneoplasticovarianepithelialcells[J].Differentiation,2009,77(2):162-171.[23] KoSY,BarengoN,LadanyiA,etal.HOXA9promotesovariancancergrowthbystimulatingcancer-associatedfibroblasts[J].JClinicalInvestigation,2012,122(10):3603-3617.[24] KoSY,NaoraH.HOXA9promoteshomotypicandheterotypiccellinteractionsthatfacilitateovariancancerdisseminationviaitsin ductionofP-cadherin[J].MolCancer,2014,13:170.[25] WrangleJ,MachidaEO,DanilovaL,etal.Functionalidentificationofcancer-specificmethylationofCDO1,HOXA9,andTAC1forthediagnosisoflungcancer[J].ClinCancerRes,2014,20(7):1856-1864.[26] HwangJ,LeeBB,KimY,etal.HOXA9inhibitsmigrationoflungcancercellsanditshypermethylationisassociatedwithrecurrenceinnon-smallcelllungcancer[J].MolecularCarcinogenesis,2015,54(S1):E72-E80.[27] ReynoldsPA,SigaroudiniaM,ZardoG,etal.Tumorsuppressorp16INK4Aregulatespolycomb-mediatedDNAhypermethylationinhumanmammaryepithelialcells[J].JBiolChem,2006,281(34):24790-24802.[28] ParkSY,KwonHJ,LeeHE,etal.PromoterCpGislandhypermethylationduringbreastcancerprogression[J].VirchowsArch,2011,458(1):73-84.[29] SunM,SongCX,HuangH,etal.HMGA2/TET1/HOXA9signalingpathwayregulatesbreastcancergrowthandmetastasis[J].ProceedingsoftheNationalAcademyofSciences,2013,110(24):9920-9925.[30] LvJ,CaoXF,JiL,etal.Associationofbeta-catenin,Wnt1,Smad4,Hoxa9,andBmi-1withtheprognosisofesophagealsquamouscellcarcinoma[J].MedOncol,2012,29(1):151-160.[31] SunX,LiuB,JiW,etal.TheroleofHOXA9inhumanlaryngealsquamouscellcarcinoma[J].OncologyResearchFeaturingPre clinicalandClinicalCancerTherapeutics,2012,20(10):467-472.[32] KimY,YoonH,KimJS,etal.HOXA9,ISL1andALDH1A3methylationpatternsasprognosticmarkersfornonmuscleinvasivebladdercancer:Array-basedDNAmethylationandexpressionprofiling[J].InternationalJCancer,2013,133(5):1135-1142.[33] KuoC,LinC,ShihY,etal.FrequentmethylationofHOXA9geneintumortissuesandplasmasamplesfromhumanhepatocellularcarcinomas[J].ClinicalChemistryandLaboratoryMedicine(CCLM),2014,52(8):1235-1245.(编校:张西敏)抗肿瘤靶向药物的分类张百红1,岳红云2AnewclassificationfortargetedanticanceragentsZhangBaihong1,YueHongyun21DepartmentofOncology;2DepartmentofOphthalmology,LanzhouGeneralHospital,LanzhouMilitaryAreaCommand,PLA,GansuLanzhou730050,China.【Abstract】Theclassificationoftargetedanticanceragentsiselusive.Accordingtotherapeutictargets,weproposeanewclassificationfortheseagentstoevaluatethem:Moleculartargetedagents,vasculartargetedagents,immunomodu latoryagentsandcellulartargetedagents.Thisclassificationfortargetedagentsaccountingforoptimaltargetsandpre cisionmechanisms,couldprovideeffectivetoolsforclinicians.【Keywords】neoplasms,targetedanticancertherapies,targetedagents,classificationModernOncology2017,25(02):0299-0303【收稿日期】 2016-06-07【修回日期】 2016-07-11【基金项目】 甘肃省自然科学基金项目(编号:1308RJZA181)【作者单位】 1兰州军区兰州总医院肿瘤科;2眼科,甘肃 兰州 730050【作者简介】 张百红(1970-),男,河南陕县人,副主任医师,副教授,主要从事消化道肿瘤的基础和临床研究。


福建医科大学基础临床——恶性肿瘤靶向分子治疗3,分子靶向治疗药物按分子量大小可分为哪两类,以抗EGFR为例说明两类药物的作用机制,临床运用等方面的差别第一种答案:3.1 EGFR的单克隆抗体(mAbs)直接作用于EGFR的细胞外配体结合区,阻滞配体与EGFR 的结合,抑制生长因子激活细胞有丝分裂信号的下传,抑制肿瘤细胞增殖。
这类抗体主要有:西妥昔单抗(Cetuximab,Erbitux IMC C225嵌和型单抗)[8]、曲妥珠单抗(Trastuzumab)[9]、ABX EGFR(人源化单抗)[10]和EMD72000(人化的单克隆抗体)等。
3.2 EGFR的小分子抑制物这些小分子可逆的与ATP竞争结合EGFR胞内区激酶催化位点,抑制信号的下传达到抗肿瘤作用。
此类已经进行临床研究的小分子化合物有:ZD1839(易瑞沙)[11]、OSI774(它赛瓦)[12]、CI1033(PD183805)、PKI166等。
第二种答案:随着针对实体肿瘤治疗的分子靶点研究的深入,目前已经可以通过多种途径抑制这些靶点:一种是利用单克隆抗体等主要作用于胞外途径的大分子物质(相对分子质量为150000)与靶点结合,阻断胞外信号分子与靶点的结合;另一种是利用小分子抑制物(相对分子质量通常为500)直接进入细胞内封闭受体,干扰细胞内信号的传递。
目前用于EGFR靶向性治疗肿瘤的药物主要分为两类: EGFR单克隆抗体和小分子化合物酪氨酸激酶拮抗剂。
酪氨酸激酶拮抗剂主要为小分子喹啉类化合物,能够竞争性抑制ATP与EGFR胞内酪氨酸激酶结构域的结合,进而影响酪氨酸残基磷酸化,抑制EGFR下游的信号转导。
酪氨酸激酶拮抗剂的抗EGFR单克隆抗体治疗肿瘤进展临床疗效有很大的个体差异,使治疗剂量的确立存在困难。
EGFR单克隆抗体是与内源性配体竞争结合EGFR,通过抑制酪氨酸激酶的激活、促进EGFR内化等作用产生抗肿瘤效应。
目前已有3种抗EGFR单克隆抗体上市,与其他化疗药相比,这些抗体作用特异性强,副作用小,在临床上取得了较好的疗效。


靶向药物的分类小分子药物靶向药物小分子药物通常是信号传导抑制剂,它能够特异性地阻断肿瘤生长、增殖过程中所必需的信号传导通路,从而达到治疗的目的。
例如诺华制药生产的用于治疗慢性粒细胞白血病和肠胃基质瘤的格列卫Gleevec,通用名Imitinib、以EGFR表皮生长因子受体为靶点的用于治疗非小细胞肺癌NSCLC的阿斯利康生产的易瑞沙Iressa,通用名Gefitinib和德国默克的特罗凯tarceva,通用名Erlotinib均属此类,并已进入临床应用。
美国千年制药公司生产的Velcade通用名bortezomib是细胞凋亡诱导剂,也属于小分子药物。
单克隆抗体例如用于治疗HER2基因阳性过量表达的乳腺癌的赫塞汀Herceptin,通用名Trastuzumab、以EGFR为靶点的结肠癌和非小细胞肺癌治疗药物爱必妥Erbitux,通用名Cetuximab等。
这类药物是通过抗原抗体的特异性结合来识别肿瘤细胞的。
从通用名的后缀上来看,单克隆抗体类靶向药物以“-mib”为后缀,而酪氨酸激酶类靶向药物以“-nib”为后缀。
除上述列举的已经进入临床使用的靶向药物外,另外还有多种靶向药物正在开发中。
靶向药物的使用靶向药物一般单独使用或和化疗药物配合使用。
对于已经经过充分临床验证的靶向药物,在临床上可用作一线、二线、三线治疗,而对于新的靶向药物,尽管已有资料表明其有效性,但还未经过充分的临床验证,一般用于二线、三线治疗即常规化疗无效后的治疗。
靶向药物的使用,应该在医生的指导下科学用药。
当临床上已经显示靶向药物已经没有明显效果时例如连续用药一年后,说明癌细胞已经产生了耐药性,这时应停止使用靶向药物或更换治疗方案。
靶向药物的价格仍高于常规化疗药物,这在一定程度上限制了靶向药物的推广。
但相信随着科技的进步,其价格会降低,种类会增加,靶向药物将会成为一类能够带来更好疗效、更少痛苦的癌症治疗药物。
靶向药物的机理根据靶向机理的不同,药物靶向可分为被动靶向、主动靶向、物理靶向等几类:1、被动靶向被动靶向制剂是指利用特定组织、器官的生理结构特点,使药物在体内能够产生自然的分布差异,从而实现靶向效应。
什么是小分子靶向药物?展开全文生物大分子药物(包括多肽、蛋白质、抗体、聚糖与核酸等)多用于治疗肿瘤、艾滋病、心脑血管病、肝炎等重大疾病。
小分子靶向药物:通常是信号传导抑制剂,它能够特异性地阻断肿瘤生长、增殖过程中所必需的信号传导通路,从而达到治疗的目的。
小分子药物具有使用广泛、理论成熟等优势。
常用药物,小分子药物的数量占总量的98%。
截至2016年7月,FDA一共批准了43个抗肿瘤小分子靶向药物,其中有2个是不用于肿瘤治疗的替尼类药物,分别是治疗类风湿关节炎的托法替尼和治疗骨髓纤维化的鲁索替尼。
这45个小分子靶向药物中,治疗肺癌和白血病的最多,各有8个,其次是肾癌,有7个。
目前,小分子化学药物仍然是当前药物设计的主要方向。
治疗肿瘤的小分子靶向药物多为口服药,方便,对正常细胞损伤小,具有特异性,也是抗肿瘤药研发的热点。
下面整理了最新小分子靶向药物,以及详细的分析介绍。
肺癌。
用于治疗肺癌的小分子靶向药物有8种,见下表。
肺癌的治疗靶点主要有两类,一类是表皮生长因子受体(EGFR),以吉非替尼、厄洛替尼为代表;另一类是间变性淋巴瘤激酶(ALK),主要是克唑替尼、色瑞替尼等。
目前在我国上市的品种有原研进口的吉非替尼、厄罗替尼、克唑替尼,及我国自主研发的埃克替尼。
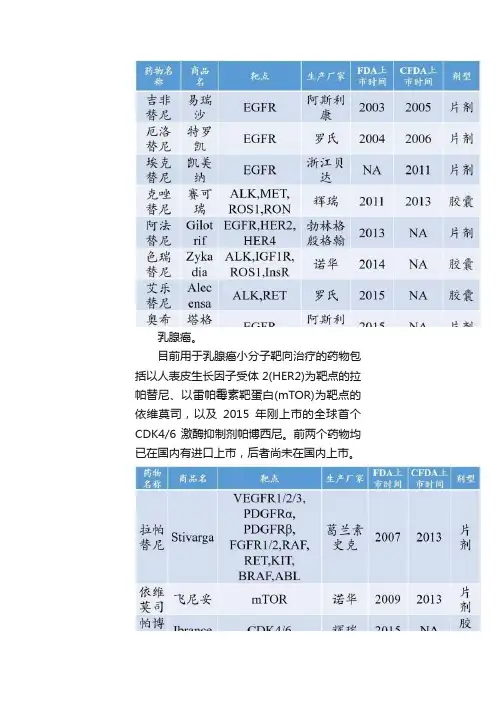
乳腺癌。
目前用于乳腺癌小分子靶向治疗的药物包括以人表皮生长因子受体2(HER2)为靶点的拉帕替尼、以雷帕霉素靶蛋白(mTOR)为靶点的依维莫司,以及2015年刚上市的全球首个CDK4/6激酶抑制剂帕博西尼。
前两个药物均已在国内有进口上市,后者尚未在国内上市。
胃癌&胃肠道间质瘤。
胃癌靶向治疗起步较晚,小分子靶向药物较少,治疗靶点目前主要集中在VEGFR。
伊马替尼除了是白血病的一线用药,也可以治疗胃肠道间质瘤;舒尼替尼和瑞戈非尼属于多靶点药物。
值得一提的是,阿帕替尼是中国自主研发的一种小分子 VEGF 受体抑制剂。
除了瑞戈非尼,其他三个小分子靶向药在中国均有上市;伊马替尼国内仿制药有正大天晴、江苏豪森、石药欧意三家。
肿瘤的靶向药物选择——国内外已经上市的分子靶向(MTT)药物...一、靶向药物(targete d medicin e)简介靶向药物是目前最先进的用于治疗癌症的药物,是随着当代分子生物学、细胞生物学的发展产生的高科技药物。
靶向药物与常规化疗药物最大的不同在于其作用机理:常规化疗药物通过对细胞的毒害发挥作用,由于不能准确识别肿瘤细胞,因此在杀灭肿瘤细胞的同时也会殃及正常细胞,所以产生了较大的毒副作用。
而靶向药物是针对肿瘤基因开发的,它能够识别肿瘤细胞上由肿瘤细胞特有的基因所决定的特征性位点,通过与之结合(或类似的其他机制),阻断肿瘤细胞内控制细胞生长、增殖的信号传导通路,从而杀灭肿瘤细胞、阻止其增殖。
由于这样的特点,靶向药物不仅效果好,而且副作用要比常规的化疗方法小得多。
靶向药物可以分为以下几类:(一)小分子药物小分子药物通常是信号传导抑制剂,它能够特异性地阻断肿瘤生长、增殖过程中所必需的信号传导通路,从而达到治疗的目的。
例如诺华制药生产的格列卫(G leevec,通用名Imitinib)、阿斯利康生产的易瑞沙(Iressa,通用名Gefi t inib)均属此类;(二)细胞凋亡诱导药物通过特异性地诱导肿瘤细胞凋亡,达到治疗的目的。
如美国千年制药公司生产的V e lcade (通用名bort e zomib)、Genta公司生产的Gen asense(oblimer sen);(三)单克隆抗体例如赫塞汀(Hercept in,通用名Tras tuzumab),用于治疗HER2基因阳性(过量表达)的乳腺癌。
这类药物是通过抗原抗体的特异性结合来识别肿瘤细胞的。
除上述列举的已经进入临床使用的靶向药物外,另外还有多种靶向药物正在开发中。
二、肿瘤的靶向药物上市历史回顾:■白血病费城染色体开启靶向治疗之门早在1960年,美国费城的研究者发现慢性髓性白血病(CML)患者中存在一个染色体异常。
抗肿瘤分子靶向药物分类与特点近年来,伴随着分子生物学的发展,高效低毒的分子靶向治疗成为肿瘤治疗的研究热点,并在治疗肝癌、非小细胞肺癌以及其他恶性肿瘤方面取得了显著的疗效。
广义的靶向治疗包括药效学靶向药物与药动学靶向药物。
采用靶向性强的药物载体提高抗肿瘤有效利用率的药物为药动学靶向药物,如白蛋白结合型紫杉醇、多柔比星脂质体等。
本文所涉及的药物主要指的是通过干扰或阻断与肿瘤发生、进展有关的特异性分子和相关信号通路,从而阻断肿瘤生长和扩散的药效学靶向药物。
分子靶向药物的分类肿瘤的分子靶向治疗是一个飞速发展的领域,随着人类对肿瘤发生、发展认识的深入,有效的治疗靶点不断被发现,新结构、新机制的抗肿瘤分子靶向药物陆续被研发。
根据作用靶点不同,抗肿瘤分子靶向药物可以分为EGFR、VEGFR、HER-2等药物。
根据药物结构分类,临床最常见的为小分子靶向药物和单克隆抗体类药物。
多数分子靶向药物使用前应进行相应靶点状态的检测,以期获得更好的治疗效果。
分子靶向药物的作用机制目前上市的分子靶向药物作用机制非常复杂,而其药物疗效和不良反应都与药物机制密切相关。
分子靶向药物的作用机制简单概括为:①作用于细胞膜的药物主要是针对跨膜生长因子受体,例如作用于表皮生长因子受体(EGFR)的小分子酪氨酸激酶抑制剂吉非替尼、厄洛替尼和埃克替尼,作用于EGFR的单克隆抗体西妥昔单抗,作用于HER-2受体的单克隆抗体曲妥珠单抗等;②作用于细胞质的药物靶向于细胞内信号转导过程,如mTOR抑制剂依维莫司等;③作用于细胞核的药物靶向于DNA或RNA,例如针对细胞依赖性激酶的AZD5438和针对组蛋白去乙酰化酶抑制剂的西达本胺等;④作用于癌细胞外环境的药物,目前临床使用较为广泛的靶向于肿瘤相关血管的药物就属于此类,如血管内皮生长因子单克隆抗体贝伐珠单抗、重组人血管内皮抑制素等。
分子靶向药物的适应证分子靶向药物的治疗不是以病理类型为导向,而是以靶点为指征。
小分子药物与靶向治疗随着科技的进步和医学研究的不断深入,人类已经取得了许多惊人的成就,其中之一就是在药物研发方面。
随着研究的不断深入,人们对小分子药物的重视也越来越高。
本文将就小分子药物和靶向治疗进行简要的介绍和分析。
一、小分子药物的定义和分类小分子药物是一类分子量较小、通常小于1000的化合物,具有特殊的药理学作用。
目前,小分子药物分类的方法有很多种,常见的分类方法包括生化特征分类法、靶向分类法、药物分子类别分类法和药物作用分类法。
其中,生化特征分类法将小分子药物按其分子结构或化学特征进行分类。
例如,氨基甲酸酯类、酰胺类、环丙素类、吲哚类、芳香烃类、咪唑类、嘧啶类药物等等。
靶向分类法根据小分子药物作用的靶向进行分类,主要包括蛋白质靶向药、DNA/RNA靶向药、激素类药物、免疫抑制剂、细胞毒性药物等。
药物分子类别分类法将小分子药物分为酰胺和酰氨等多种类别,这一方法主要的依据是药物分子的形态。
药物作用分类法根据小分子药物的作用分类,例如对中枢神经系统、心血管系统、抗病毒等。
二、小分子药物的优缺点小分子药物有其独特的优点和不足之处。
首先,小分子药物分子小,在药物研究和制备方面有计算量小、合成周期短、产出易于规模化等诸多优势。
此外,小分子药物吸收快,治疗效果迅速见效;对机体毒副作用相对较小,并且在药物的开发和生产方面成本相对较低。
其次,小分子药物的不足主要在于其不靶向性相对较强,即该药不仅靶向病变部位,也会靶向正常细胞,从而产生毒性副作用。
三、靶向治疗相对于小分子药物的不足之处,靶向治疗则更具优势。
靶向治疗通常会选定和病变相关的蛋白作为靶分子。
一旦靶分子被锁定,制定治疗方案便变得更加准确。
靶向治疗主要包括特异性抗体、小分子靶向药物、刺激性剂、或是锁定细胞癌变偶联受体所需的分子药物等。
尽管靶向治疗在治疗疾病方面非常有效,但它也存在不能治愈但可缓解的问题。
由于治疗仅针对特定的蛋白,在病毒发生变异时可能无法进行修正,从而产生耐药性。
最热门抗肿瘤靶点及小分子靶向药物全景报告抗肿瘤靶点是指对肿瘤生长、转移等过程具有重要调控作用的蛋白分子或通路。
小分子靶向药物是一类能够专一靶向抗肿瘤靶点并抑制其活性的化学物质。
随着抗肿瘤研究的不断深入,越来越多的抗肿瘤靶点及小分子靶向药物被发现并应用于临床。
以下将介绍一些当前最热门的抗肿瘤靶点及小分子靶向药物:1.EGFR(表皮生长因子受体):EGFR是一种跨膜酪氨酸激酶受体,参与肿瘤细胞的生长和分化等过程。
一些小分子靶向药物如吉非替尼和厄洛替尼等通过抑制EGFR的酪氨酸激酶活性,抑制肿瘤细胞生长。
2.HER2(人表皮生长因子受体2):HER2是一种细胞表面受体,参与调节细胞增殖和存活等过程。
一些小分子靶向药物如曲妥珠单抗和拉普替尼等能够靶向结合HER2,抑制其信号传导,减少肿瘤细胞的增殖。
3.ALK(酪氨酸激酶受体):ALK是一种重排基因,其突变被发现与多种肿瘤的发生和发展相关。
小分子靶向药物如克唑替尼和艾尔莎替尼能够抑制ALK的活性,阻断肿瘤细胞的生长和转移。
4.BRAF(B型RAF激酶):BRAF是一种信号转导分子,突变导致了多种恶性黑色素瘤的发生。
例如,维米非尼和达替尼等小分子靶向药物能够抑制BRAF的活性,减少肿瘤细胞的增殖和转移。
5.PD-1(程序性死亡受体1)和PD-L1(程序性死亡配体1):PD-1和PD-L1参与抑制免疫系统对肿瘤的攻击,突变导致肿瘤逃避免疫监视。
一些免疫检查点抑制剂如伊普替尼和纳武利尼等能够靶向PD-1或PD-L1,恢复免疫系统的抗肿瘤活性。
除了上述靶点外,还有许多其他热门的抗肿瘤靶点及小分子靶向药物,如PI3K、FLT3、VEGFR等。
这些靶点及药物的发现和应用为肿瘤治疗提供了新的进展和希望。
需要注意的是,虽然靶向药物在抗肿瘤治疗中具有重要作用,但并非适用于所有患者。
个体化治疗是当前的研究热点,通过检测患者的肿瘤基因和蛋白表达水平来选择最合适的靶向药物,以提高治疗效果和减少不良反应。
小分子药物的分类小分子药物是指由较小分子构成的的药物,其具有疗效确切、安全性高、稳定性好等优点,在临床治疗中发挥着重要作用。
根据其作用机制和用途,小分子药物主要分为以下几类:1.抗生素类抗生素类药物是一类由微生物产生的具有抗病原微生物作用的物质,主要通过抑制细菌、病毒等病原体的生长繁殖来发挥治疗作用。
常见的抗生素类药物包括青霉素类、头孢菌素类、大环内酯类、氨基糖苷类等。
2.消炎止痛药消炎止痛药是一类能够抑制炎症反应、减轻疼痛的药物,主要通过抑制前列腺素等炎症介质的合成来发挥治疗作用。
常见的消炎止痛药包括阿司匹林、布洛芬、吲哚美辛等。
3.抗肿瘤药物抗肿瘤药物是一类能够抑制肿瘤生长、扩散和转移的药物,主要通过干扰肿瘤细胞的增殖过程、诱导细胞凋亡或抑制肿瘤血管生成等途径来发挥治疗作用。
常见的抗肿瘤药物包括化疗药物、靶向治疗药物和免疫治疗药物等。
4.免疫调节剂免疫调节剂是一类能够调节机体免疫功能的药物,主要通过调节免疫细胞的增殖、分化、活化等过程来增强机体的免疫力或抑制过度免疫反应。
常见的免疫调节剂包括糖皮质激素、细胞因子、免疫球蛋白等。
5.心血管药物心血管药物是一类能够治疗心血管疾病的药物,主要通过调节血压、血脂、血糖等心血管相关指标来改善心血管功能。
常见的心血管药物包括降压药、降脂药、抗心律失常药等。
6.治疗神经系统疾病的药物治疗神经系统疾病的药物主要通过调节神经递质、保护神经元、抗炎等机制来治疗神经系统疾病,如帕金森病、阿尔茨海默症、癫痫等。
常见的治疗神经系统疾病的药物包括抗癫痫药物、抗抑郁药物、抗精神病药物等。
7.抗病毒药物抗病毒药物是一类能够抑制病毒复制或破坏病毒颗粒的药物,主要通过干扰病毒的复制过程或增强机体免疫应答来发挥治疗作用。
常见的抗病毒药物包括抗流感药物、抗疱疹药物、抗肝炎药物等。
以上是小分子药物的主要分类,各类药物在临床治疗中发挥着不同的作用,针对不同的疾病类型和病情严重程度,医生会选择相应的药物进行治疗。
肿瘤小分子靶向药物分类
肿瘤小分子靶向药物分类
如今肿瘤的治疗手段多元化,其中靶向治疗为较新兴的治疗方式,由于毒副作用较小,疗效较突出,使得靶向治疗的成本也相对高昂。
分子靶向药物是在分子生物学、分子遗传学理论基础上出现的新药, 因其精确的靶向治疗作用,相对于传统化疗药物有很多优势, 形成了一门治疗肿瘤的新领域,为肿瘤的治疗提供了一种不良反应较小的方法。
近20 年来,随着医学科学的发展,大量以肿瘤细胞水平表达为靶点的新的抗肿瘤药物不断问世,并逐渐走向临床, 主要包括细胞信号转导分子抑制剂、新生血管抑制剂、靶向端粒酶抑制剂以及针对肿瘤耐药的逆转剂。
攻击肿瘤的靶点有多方面, 目前研究较成熟的主要有肿瘤细胞表面的靶点(抗原或抗体), 如细胞膜分化相关抗原(CD13,CD20,CD22,CD33,CD52,CD117 等),细胞信号转导分子如表皮生长因子(EGF及其受体(EGFR和血管内皮生长因子(VEGF及其受体上的酪氨酸激酶,以及法尼基转移酶,基质金属蛋白酶等。
分子靶向药物目前尚无统一的分类方法。
根据作用靶点不同,可分为以下
4 类。
•蛋白激酶细胞的分化信号传导因子中, 含有大量的蛋白激酶家族。
在细胞信号传导过程中, 蛋白酪氨酸激酶十分重要, 它可催化ATP 上的磷酸基转移到许多重要蛋白质酪氨酸残基上使其磷酸化, 导致传导支路的活化, 影响细胞生长、增殖和分化,
而许多肿瘤细胞中酪氨酸激酶活性异常升高。
超过50% 的癌基因及其产物具有蛋白酪氨酸激酶活性, 它们的异常表达将导致肿瘤的发生。
此外, 该酶的异常表达还与肿瘤转移、肿瘤新生血管生成、肿瘤对化疗耐药有关。
研究能阻断或修饰由信号传导失常引起疾病的选择性蛋白激酶抑制剂, 被认为是有希望的药物开发途径。
目前, 已经发现了一些蛋白激酶抑制剂和针对不同蛋白激酶ATP结合位点的小分子治疗剂,并已
进入临床研究,如酪氨酸激酶抑制剂吉非替尼、厄洛替尼等及法尼基转移酶抑制剂安卓健等。
•肿瘤血管生成因子正负调控子的平衡控制着肿瘤血管的生成,由此促进肿瘤的生长和转移,开发血管生成抑制剂是肿瘤研究最为活跃的领域之一。
临床试验中的血管生成抑制剂有以下4 类。
①调节基质反应,抑制基底膜降解的药物:Marimastat、BMS-275291等。
基质蛋白酶(MMP )是一种蛋白水解酶,可使细胞外基质降解,它在肿瘤浸润、转移和血管形成过程中发挥关键作用。
基质蛋白酶抑制剂(MMPI)可以通过抑制金属蛋白酶起到抗肿瘤生长与转移的作用。
BMS-275291 是一种MMPI, 它与化疗联合用于晚期非小细胞肺癌的治
疗,目前已进入U /川期临床试验;Col-3是MMP-2 和MMP-9 抑制剂(I / U 期临床);AE941 是MMP-2、MMP-9 和MMP-12 抑制剂,它可以封闭VEGF和它受体的结合汕期临床试验治疗多发性骨髓瘤,川期临床试验用于肾癌和非小细胞肺癌的治疗。
②直接抑制内皮细胞的药物:沙立度胺(Thalidomide)、烟曲霉素衍生物
(TNP470)恩度(Endostatin)等。
TNP 470 是第一个进入临床试验的抑血管药物, 它对内皮细胞增殖和新生血管形成都具有强烈抑制作用,它与吉西他滨或顺铂联合使用,川期临床用于宫颈癌、胃癌、前列腺癌、乳腺癌和肺癌等实体瘤治疗显示出了明显的抗肿瘤活性。
内源性血管生成抑制因子:血管抑素(an giostati n)和内皮抑素(en dostat in) 都对老鼠肿瘤新生血管生成有强烈抑制作用, 且没有发现耐药现象, 联合使用这两种抑制因子可以彻底根除小鼠体内的移植瘤,但临床有待进一步验证。
目前两药均已在美国进行临床试验。
③抑制内皮细胞特异性整合素的药物:Vitaxin/ a V B 3人源化单克隆抗体、
EMD121974/ a V B 3小分子拮抗剂。
肿瘤细胞的粘附性在肿瘤侵袭和转移中起着极为重要的作用。
粘附分子如整合素可以促进肿瘤转移, 另外它还可启动某些细胞逃逸机制抑制细胞凋亡。
因此抑制了粘附分子/整合素的信号传导就可起到抗肿瘤作用。
Vitaxin 是一种抗a V B 3 的单克隆抗体,I / U期临床试验用于治疗晚期直肠癌;EMD121974是一个抗a V B 3的小分子,进入了川期临床试验,也有很好的疗效。
④抑制血管生长因子活化的药物:VEGF单克隆抗体等。
近几年抗肿瘤血管药研究进展非常迅速, 全世界大约有75 种抗血管药物
进入了临床试验阶段,大多数处于I期或U期临床试验阶段,但至少有12种已进入或已完成了川期临床试验。
已发现特异性调控表皮特异受体酪氨酸激酶的配体蛋白是一类前血管生
成因子,如VEGF/ VEGF系统,被认为是肿瘤药物很好的作用靶点。
VEGFs是一类蛋白,为高度特异的血管内皮细胞有丝分裂原,通过与受体结合激
活后发挥作用。
VEGF可促进内皮细胞的有丝分裂、延长细胞的存活期,提高基质降解过程中所需酶的表达,增加血管的通透性等。
VEGF对体积超过2mm 的实体瘤的快速生长发挥作用。
VEGFR是一类重要的酪氨酸激酶,许多研究表明,其信号转导途径失调在肿瘤的发生、生长和转移中有重要作用。
VEGFR主要有VEGFR-1( Flt-1)、VEGFR-2( KDR /Flt-1)和VEGFR-3( Flt-4),均属酪氨酸激酶受体。
VEGF通过与两种跨内皮细胞膜受体结合发挥生物学功能。
•DNA 拓扑异构酶
真核细胞的DNA拓扑异构酶在DNA的复制、转录、重组以及在形成正确的染色体结
构、染色体分离、浓缩中发挥重要作用。
拓扑异
构酶抑制剂已经成为抗肿瘤药物研究开发最重要的靶点之一。
•其他
DNA复制是肿瘤细胞增殖的关键。
抑制DNA引物酶,使引物的合成受阻,
DNA 复制受到抑制,肿瘤细胞不能增殖,从而达到抗肿瘤的目的。
因此,
DNA引物酶是抗肿瘤药物研究的一个理想靶点。
细胞周期调控、凋亡、分化等大量的生物过程都依赖于不同蛋白的调控表达和降解, 其中许多反应物下调作用是通过泛素依赖性水解毁坏完成的。
已发现在整个泛素化过程中的许多水平可被调控, 寻找靶向该途径中不同因子的药物有很好的前景。
在肿瘤
治疗中, 泛素-蛋白酶途径抑制剂可作为一种新型的抗肿瘤药物。
组蛋白的乙酰化是基因表达的主要调节因子, 它通过改变转录因子与
DNA的接近性以激活基因表达。
组蛋白去乙酰化酶(histo ne deacetylase, HDA基因表达的抑制作用为肿瘤治疗提供了新的靶标。
HDA抑制剂能引起
细胞周期阻断和凋亡基因的激活, 该作用可用于肿瘤的治疗。