全内反射荧光成像基本原理
- 格式:ppt
- 大小:1.37 MB
- 文档页数:30

storm显微镜原理
Storm显微镜是一种高分辨率成像技术,它基于荧光单分子图像
技术和TIRFM(全内反射荧光显微镜)技术。
Storm显微镜原理主要包
括以下几个步骤:
1.样品制备:将待观察的样品标记上荧光染料,通常使用的是有
机荧光染料或荧光蛋白。
荧光染料或荧光蛋白应该和包含它们的蛋白
或细胞贴附在基质表面的液体溶液浓度低于饱和浓度(占据至少50%的荧光单分子需要被激活和荧光)。
2.激活:将样品放在显微镜下,使用激光器让少数荧光染料或荧
光蛋白处于激发态,激发态的荧光分子发出荧光,达到表亮状态。
会
分析适当的荧光染料或荧光蛋白激发光波长。
例如,for Alexa Fluor 647, the absorbance maximum is 650 nm, so exciting at 647 nm
is optimal. 对于Alexa Fluor 647,吸收最大值是650nm,因此在
647nm处激发是最佳选择。
3.收集荧光图像:收集这些表亮状态的荧光分子发出的单个光子
的位置,之后对大量的单个荧光分子位置进行组合,就得到了样品的
高分辨率荧光图像。
为了获得高分辨率的图像,重复这个过程很多次,然后将所有单个荧光分子位置的信息聚合起来。
通过这些步骤,可以在细胞和分子水平上研究和观察细胞和分子
的生物活动和组织结构。





各荧光检测方法简介(流式、荧光显微镜、共聚焦、全内反射与双光很多细胞实验都要检测荧光,为方便大家选择合适的方法,在此简单说一下各种荧光检测方法的特点。
不足的地方,欢迎大家补充:1、流式,优点是速度快,非常适合做大数量统计,且样品只被检测一次,完全不用担心荧光淬灭的问题。
缺点是只能检测荧光的有无、强度大小,无法提供空间定位信息,无法做荧光定位变化的实验;由于样品只被检测一次,因此无法对同一个样品进行连续观察。
例如,做膜蛋白定位时会得到这么一个结果——用流式可以检测出信号,但是用显微镜却看不到东西,排除仪器和滤光片选择问题,很可能是核的自发荧光或非特异标记造成流式的假阳性结果。
2、荧光显微镜,刚好与流式互补,可很好地进行空间观察,判断目标蛋白的定位,但是不适合做大流量检测,估计没人能经得起时间的考验。
有不同倍率的物镜选择,可以使用高倍物镜看精细结构,或用小倍率物镜做少量统计。
与之搭配的CCD和软件,是系统能否发挥性能的关键。
尤其是CCD,从那么多商品里选一款合适的不容易,需要了解很多知识否则只能听别人忽悠。
3、共聚焦,荧光显微镜的升级产品,具有很好的光学层切效果,能得到很好三维定位信息。
但是,如果使用共聚焦的目的仅仅是为你的样品拍一张靓照,取得一张好看的图片,就让人觉得可惜了。
共聚焦基本都是全自动系统,可随意定义照明区域、选择多个荧光通路和设定定时取图,所以,做Time-laps、FRAP和FRET有其独到的优势。
另外,4Pi和 STED又是其中的极品,具有超高的空间分辨率,只是使用不方便,未必适合做生物实验。
4、全内反射,荧光显微镜的另一种升级产品,属于近场光学范畴,只适合且最适合做膜研究,无法看到胞内信息。
也是用CCD成像,但是对CCD的要求更高——个人甚至觉得对CCD的要求是没有上限的。
5、双光子,另一种共聚焦,因使用长波激发荧光,故能做深层检测(突破共聚焦的100微米极限),最典型的应用是观察活体脑组织。
荧光成像的原理与方法荧光成像在基因组学和蛋白质组学等生物学领域应用中的独特优势:高灱敏度:灱敏度进超比色法,在大部分应用中其灱敏度近乎放射性同素。
多组样品一次成像:将不同样品(如:对照、处理)通过不同发射波长的荧光素标记(如 Cy3或 Cy5等)可以同时检测多样品荧光信号。
稳定性高:较放射性同位素相比,荧光素标记的抗体、杂交探针、PCR引物等的信号稳定性优势明显,可稳定存在数月以上,这使需要大规模标记并多阵列之间的标准化比较成为了可能。
低毒性成本低:多数情况下,荧光标记和检测的全过程试验用手套即可对实验者提供足够的保护。
易于运输和实验后处理,多数情况下实验成本低于放射性同位素。
商业可获得性:许多重要的荧光标记型生物大分子如各种单抗、多抗、CAT等及荧光标记用试剂盒都可以方便获得,同时一些公司提供荧光标记的外包服务。
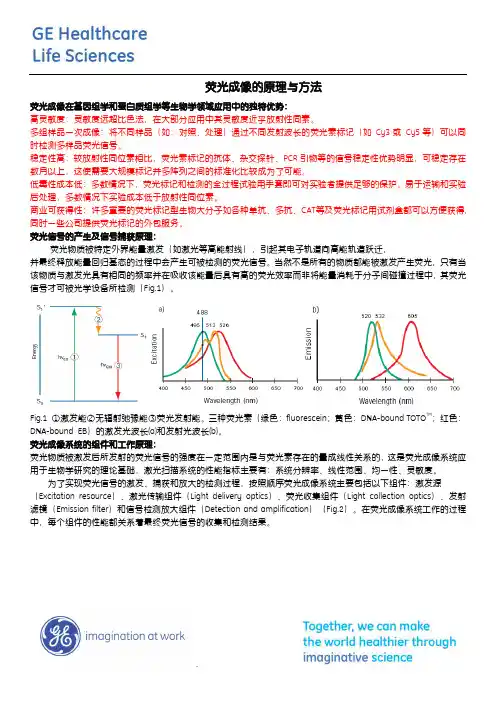
荧光信号的产生及信号捕获原理:荧光物质被特定外界能量激发(如激光等高能射线),引起其电子轨道向高能轨道跃迁,并最终释放能量回归基态的过程中会产生可被检测的荧光信号。
当然不是所有的物质都能被激发产生荧光,只有当该物质与激发光具有相同的频率并在吸收该能量后具有高的荧光效率而非将能量消耗于分子间碰撞过程中,其荧光信号才可被光学设备所检测(Fig.1)。
Fig.1 ①激发能②无辐射弛豫能③荧光发射能。
三种荧光素(绿色:fluorescein;黄色:DNA-bound TOTO TM;红色:DNA-bound EB)的激发光波长(a)和发射光波长(b)。
荧光成像系统的组件和工作原理:荧光物质被激发后所发射的荧光信号的强度在一定范围内是与荧光素存在的量成线性关系的,这是荧光成像系统应用于生物学研究的理论基础,激光扫描系统的性能指标主要有:系统分辨率、线性范围、均一性、灱敏度。
为了实现荧光信号的激发、捕获和放大的检测过程,按照顺序荧光成像系统主要包括以下组件:激发源(Excitation resource)、激光传输组件(Light delivery optics)、荧光收集组件(Light collection optics)、发射滤镜(Emission filter)和信号检测放大组件(Detection and amplification)(Fig.2)。


全内反射荧光显微术原理与应用1. 引言全内反射荧光显微术(Total Internal Reflection Fluorescence Microscopy,TIRFM)是一种基于全内反射原理的显微技术,利用全内反射限制激光光束的传播范围,使其仅激发样品表面附近的荧光染料,并通过荧光显微镜观察和记录表面附近的高分辨荧光信号。
该技术具有高灵敏度、高空间分辨率和实时监测能力等优点,广泛应用于生命科学研究中。
本文将详细介绍TIRFM的原理和应用。
2. 全内反射原理光在由一个折射率较大的介质(如光具)射入折射率较小的介质(如空气)时,当入射光线的入射角大于一个特定的临界角时,光线将会完全发生反射,不再穿透进入折射率较小的介质中。
这个现象被称为全内反射(Total Internal Reflection,TIR)。
当一个光束从高折射率的物质射入低折射率的物质时,入射角大于临界角时,发生全内反射。
通过调控入射角,可以使光线沿着介面传播,从而形成衰减系数很小的光束。
这个现象可以被用来实现TIRFM的照明光路。
3. 全内反射荧光显微术系统TIRFM系统主要由以下几个部分组成:激光光源、调制器、目标镜、物镜、荧光滤光片、成像系统和数据采集分析系统等。
激光光源:一般使用高功率激光器,如氩离子激光器或二极管激光器。
激光通过光纤输入到光路系统中。
调制器:用于控制激光的工作模式,常用的包括振荡镜或振荡腔。
目标镜:一般是具有高折射率的玻璃片或光具,用于实现全内反射,常用的目标镜材料有石英、玻璃等。
物镜:用于聚焦激光到样品表面,并收集荧光信号。
物镜的选择要考虑到激光的聚焦效果和空间分辨率。
荧光滤光片:用于选择性地阻挡激发光和透射荧光信号。
成像系统:一般是荧光显微镜或全内反射显微镜。
能够观察并记录样品表面的荧光信号。
数据采集分析系统:可以对观察到的荧光图像进行实时处理和分析,如图像增强、图像叠加、荧光强度计算等。
4. TIRFM原理TIRFM的原理可以通过以下步骤进行解释:1.激光从物镜聚焦到样品表面。


2012年10月内蒙古科技与经济Octo ber2012 第19期总第269期Inner M o ngo lia Science T echnolo gy&Economy N o.19T o tal N o.269膜片钳技术结合全内反射荧光成像技术在单细胞胞吐活动研究中的应用维力斯(中南民族大学电子信息工程学院,湖北武汉 430074) 摘 要:介绍了膜片钳和全内反射荧光成像的工作原理、实验技术,以及这两种技术的结合在单细胞胞吐研究中的应用,并对其发展前景进行了展望。
关键词:生物物理学;膜片钳技术;全内反射荧光成像技术 中图分类号:Q6-33 文献标识码:A 文章编号:1007—6921(2012)19—0096—03 生物物理学(Biophysics)是生物学与物理学相结合的一门交叉学科,是生命科学的重要分支,其应用现代物理学的实验方法和测量技术,并结合化学、电子学等技术,阐明生物在一定的空间、时间内相关物质、能量与信息的运动规律。
生物物理技术根据生命机体从微观到宏观的不同水平可分为分子、细胞、组织和器官生物物理技术;以物理学分支或实验技术各自对生命机体的研究,又可以划分为生物电、生物磁、生物声、生物光等技术。
目前,在生物物理学研究中,最常用的技术方法主要有功能分析技术[1~3]和形态分析技术[4,5],这两类技术各有优缺点。
目前,在生物物理学的研究中,膜片钳技术和全内反射荧光成像技术分别是两种最常用的功能分析和形体分析技术。
膜片钳技术可以获得生物信号发生、转导的信息,但无法得知生物信号发生源的蛋白表达和结构变化。
全内反射荧光成像技术能够方便、准确地观察、定位细胞内外结构变化及蛋白在细胞内的表达,但是无法对生理变化时的组织及细胞进行同步信号变化(如生物电信号)分析。
因此,将功能分析与形体分析相结合,成为生物物理技术发展的重要方向。
下面笔者对以上两种技术,及这两种技术的结合在单细胞胞吐活动研究的应用做一介绍。
全内反射荧光显微镜单分子荧光能量共转移1. 引言1.1 概述本文旨在介绍全内反射荧光显微镜和单分子荧光能量共转移技术,并探讨它们在生物医学领域的应用。
全内反射荧光显微镜是一种基于全内反射现象的高分辨率显微镜,可以实现非常高的空间分辨率和极低的背景噪音,因此被广泛应用于生物体系中超分辨率成像的研究。
而单分子荧光能量共转移是一种用来研究生物体系中分子之间相互作用和结构动态变化的方法,在生命科学领域具有重要意义。
1.2 文章结构本文主要分为五个部分:引言、全内反射荧光显微镜、单分子荧光能量共转移、实验结果与讨论以及结论。
在引言部分,我们将对本篇文章进行简要介绍,并概述全内反射荧光显微镜和单分子荧光能量共转移技术的背景和意义。
随后,在接下来的几个部分,我们将逐步深入探讨这两项技术的原理、发展历程、应用领域以及实验方法与技术要点。
最后,我们将介绍相关的实验结果,并进行结果讨论与解释。
在结论部分,我们将对本文进行总结回顾,并探讨存在的问题及未来展望。
1.3 目的本文旨在全面介绍全内反射荧光显微镜和单分子荧光能量共转移技术的原理和应用,并通过实验结果与讨论来验证这两项技术在生物医学领域中的有效性。
通过本文的阐述,读者可以了解到这些重要技术在研究生物体系中起到的关键作用,并对未来发展方向有所启示。
2. 全内反射荧光显微镜部分的内容如下:2.1 原理介绍全内反射荧光显微镜(Total Internal Reflection Fluorescence Microscopy,TIRFM)是一种基于全内反射原理的高分辨率荧光显微技术。
其原理是利用高折射率物质与低折射率域之间的全内反射现象,将激发光只聚焦在非常薄的表面层上,进而使得观察对象处于极低背景的强照射区域。
相比传统荧光显微镜,TIRFM 具有更高的信噪比和更好的空间分辨率。
在TIRFM中,通过特定角度入射到玻璃-样品界面上的激发光会被全内反射。
当样品中存在荧光探针时,这些探针会受到入射激发光的刺激并发生荧光发射。
全内反射荧光成像基本原理全内反射是光线从密度较高的介质(例如玻璃)射向密度较低的介质(例如空气)时发生的一种现象。
当光线在接触面的入射角大于一个临界角时,光线会全部反射回原始介质中,而不会折射进入次级介质。
这一现象被称为全内反射。
在全内反射条件下,介质表面和内部的荧光物质可以被激发并发出荧光信号。
全内反射荧光成像的基本原理是:首先,通过荧光激发源(例如激光器)发射一束脉冲激光通过透镜和反射镜,在接触面处以一个大于临界角的入射角射向样品。
然后,当入射光经过接触面进入样品中时,发生全内反射现象,并被样品内部的荧光物质吸收和激发。
激发后,荧光物质发出特定波长的荧光信号,进一步在样品内部发生传播。
接下来,通过特殊的数码相机或光学探测器将样品中发出的荧光信号收集起来。
相机或探测器可以通过透镜、滤光片等光学元件来选择性地记录特定波长的荧光信号。
然后,将收集到的荧光信号转化为电信号,并通过一些图像处理算法对信号进行处理和分析。
最后,根据处理得到的数据,生成显示样品内部结构和特性的显微图像。
全内反射荧光成像具有很多应用研究领域。
例如,它可以用于生物医学研究,用于观察细胞和组织的内部结构和功能。
此外,它还可以用于纳米材料的表征和研究,用于观察微观尺度下的材料结构和相互作用。
此外,全内反射荧光成像还被广泛应用于材料科学、化学分析等领域。
综上所述,全内反射荧光成像利用全内反射现象和荧光物质的特性,通过激发和探测荧光信号,实现对材料内部结构和特性的成像。
其基本原理涉及激发源、光学元件、荧光信号收集和处理等方面。
全内反射荧光成像在生物医学、材料科学等领域有广泛的应用前景。