上海初三化学计算题例题与练习
- 格式:doc
- 大小:21.00 KB
- 文档页数:6

上海金杨中学中考化学计算题试卷(含答案)一、初中化学计算题1.过氧化钠(Na2O2)可用作防毒面具和潜艇等的供氧剂,其反应的原理是过氧化钠与二氧化碳反应生成碳酸钠和氧气。
为了模拟该过程,小丽将二氧化碳和氧气的混合气体34.4g 通过足量的过氧化钠吸收后,固体质量增加了5.6g。
(1)写出该反应的化学方程式_____________。
(2)原混合气体中CO2和O2的质量比为_____________。
2.草木灰的主要成分是碳酸钾。
某化学兴趣小组取100g草木灰于烧杯中,不断滴入稀盐酸溶液,当滴入40g稀盐酸时,不再有气泡产生,此时烧杯中的残余混合物质量为K CO+2HC1=2KC1+H O+CO (假设137.8g。
碳酸钾与盐酸反应的化学方程式为2322草木灰的其他成分不与酸反应)。
请计算草木灰样品中碳酸钾的质量(要求写出计算过程)。
3.Cu-Mg合金具有优良的导电性,常用作飞机导线。
现要测定该合金的组成,进行如下实验:取Cu-Mg合金20g放入烧杯中,将280g稀H2SO4分4次分别加入烧杯。
充分反应后,测得剩余固体的质量记录如下表所示:次数1234加入稀H2SO4的质量 /g7*******剩余固体的质量/g18.216.414.613.2求:(1)20g合金中铜(Cu)、镁(Mg)的质量。
(2)所用稀H2SO4 中溶质的质量分数。
(3)第1次反应后所得溶液中溶质的质量分数。
(计算结果精确到0.1%)4.氯化钙钾石的化学式为KCl·xCaC12(x是CaCl2的系数)。
它是一种天然的钾肥,溶于水后得到KCl与CaCl2的混合溶液。
某化学兴趣小组为了测定氯化钙钾石中钾元素的质量分数,称取样品18.55g加水完全溶解得到KCl与CaCl2的混合溶液,向该溶液中逐滴加入Na2CO3溶液,产生的沉淀与加入Na2CO3溶液的质量关系如下图所示。
请回答下列问题:(1)写出Na2CO3与CaCl2反应的化学方程式______。
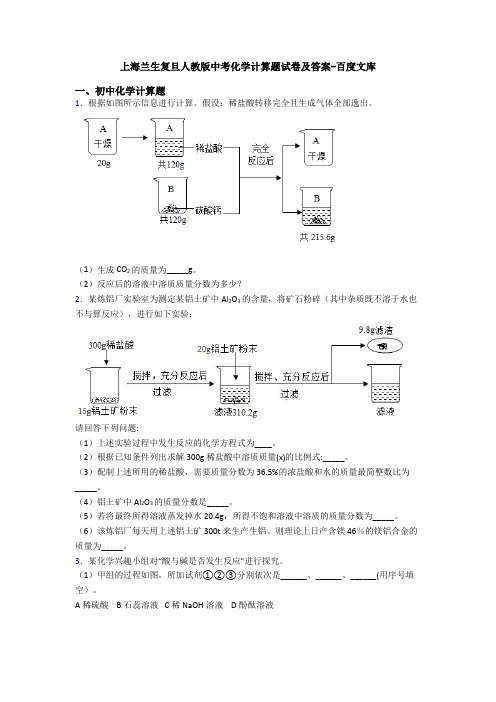
上海兰生复旦人教版中考化学计算题试卷及答案-百度文库一、初中化学计算题1.根据如图所示信息进行计算。
假设:稀盐酸转移完全且生成气体全部逸出。
(1)生成CO2的质量为_____g。
(2)反应后的溶液中溶质质量分数为多少?2.某炼铝厂实验室为测定某铝土矿中Al2O3的含量,将矿石粉碎(其中杂质既不溶于水也不与算反应),进行如下实验:请回答下列问题:(1)上述实验过程中发生反应的化学方程式为____。
(2)根据已知条件列出求解300g稀盐酸中溶质质量(x)的比例式:_____。
(3)配制上述所用的稀盐酸,需要质量分数为36.5%的浓盐酸和水的质量最简整数比为_____。
(4)铝土矿中Al2O3的质量分数是_____。
(5)若将最终所得溶液蒸发掉水20.4g,所得不饱和溶液中溶质的质量分数为_____。
(6)该炼铝厂每天用上述铝土矿300t来生产生铝。
则理论上日产含镁46%的镁铝合金的质量为_____。
3.某化学兴趣小组对“酸与碱是否发生反应”进行探究。
(1)甲组的过程如图。
所加试剂①②③分别依次是______、______、______(用序号填空)。
A稀硫酸 B石蕊溶液 C稀NaOH溶液 D酚酞溶液该小组同学反应的化学方程式为______。
(2)乙组同学在做该实验时忘了滴加指示剂,下列实验能证明两者恰好完全中和的是______。
A滴入适量FeCl3溶液,溶液变黄,但无沉淀生成B滴入几滴酚酞试液,酚酞试液不变色C用pH计测得反应后溶液pH为7D滴入适量Ba(NO3)2溶液和稀硝酸,观察到有白色沉淀(3)丙组同学将m1g 3.65%HCl溶液和m2g未知浓度的NaOH稀溶液混合均匀,并测量记录混合溶液的温度,实验中始终保持m1+m2=50g。
实验结果如图所示。
①该实验说明该反应是______(选填“放热”或“吸热”)反应。
②NaOH溶液的浓度为______。
4.向盛有100g稀硫酸的烧杯中加入一定量的镁粉,固体完全溶解后,再向所得溶液中加入NaOH溶液,所得沉淀质量与加入NaOH溶液的质量关系如图所示(1)计算氢氧化钠溶液的溶质质量分数;(要求写出计算过程)(2)与氢氧化钠溶液反应所消耗硫酸溶质的质量为克。

一、初中化学计算题1.把250g稀盐酸加入盛有60g石灰石的烧杯中,恰好完全反应,反应后称量,烧杯中剩余物质的质量为288g。
试计算:(1)生成二氧化碳的质量;(2)60g石灰石中碳酸钙的质量。
2.某化学兴趣小组用化学方法测定铜、锌合金样品中铜的含量,称取了10g样品,投入装有50g稀硫酸(足量)的烧杯(烧杯质量也为10g)中。
在化学反应过程中对烧杯(包括溶液和残余固体)进行了四次称量,记录如下表:反应时间/s T0T1T2T3烧杯和药品质量/g7069.969.869.8(1)共生成氢气 g。
(2)计算铜.锌合金样品中铜的质量分数(写出计算过程)。
3.(1)工业上若要炼出含2%杂质的生铁1600t,则理论上需要氧化铁质量分数为80%的赤铁矿的质量为_________。
(2)取8g含杂质的锌粒于烧杯中,向其中加入稀硫酸至恰好完全反应,共用去稀硫酸100g,实验结束后,称得烧杯中物质的总质量为107.8g。
(杂质不溶于水也不与稀硫酸反应)请计算:①产生氢气的质量为_______g。
②所用锌粒中锌的质量分数。
(写出计算过程)二、中考化学流程题4.高氯酸钠晶体(NaClO4·H2O)可用于制备高氯酸。
粗盐除去泥沙等不溶性杂质后得到“精盐”(只含MgCl2、CaCl2两种杂质)。
以“精盐”为原料制备高氯酸钠晶体的流程如下:(资料)高氯酸钠在较高温度下易分解。
请回答下列问题:(1)滤液中溶质除NaCl外还含有___________。
(2)ClO2中氯元素的化合价是___________。
(3)通入SO2是为了除去NaClO4溶液中少量的NaClO3,该反应的化学方程式为___________。
(4)“气流干燥”时,温度应控制在75°C ~95°C ,其原因是___________。
5.工业上利用氟碳铈矿(主要成分为 CeFCO 3)提取 CeCl 3的一种工艺流程如图:(1)流程中 Ce(BF 4)3转化成 KBF 4的基本反应类型是______。

一、中考初中化学计算题1.现有10%的Na2CO3溶液,请按下面要求计算:(1)106 g上述溶液中所含溶质量为 g;(2)106 g 上述溶液与足量10%的盐酸反应,最多可生成CO2多少克?(3)向106 g 上述溶液中逐滴加入10%的盐酸并不断搅拌,此时发生的反应为:Na2CO3 + HCl =NaHCO3+ NaCl;当Na2CO3 全部转化为NaHCO3后,再加入盐酸才开始放出CO2 。
请在“题25图”中画出产生气体的曲线。
(4)另取10% Na2CO3溶液边搅拌边加入10%的盐酸,有关反应物与生成物的量如下表:物质Na2CO3HCl X NaCl CO H2O质量/g31.814.616.823.4 4.4m则m=;该反应的化学方程式为。
【答案】(1)10.6 g;(2)4.4g;(3);(4)1.8;3Na2CO3+ 4HCl=2NaHCO3+4NaCl+H2O + CO2↑【解析】【分析】【详解】(1)106g溶液中所含溶质的质量=106g×10%=10.6g,故填:10.6。
(2)设生成二氧化碳的质量为x,消耗的盐酸溶液中溶质的质量为a,则有2322Na CO +2HCl =2NaCl+H O+CO 106734410.6g 10610.6g =7310610.6g =44ax axx =4.4g ,a =7.3g ;答:最多生成二氧化碳的质量为4.4g 。
(3)设全部转化为碳酸氢钠需要盐酸溶液中溶质的质量为y 233Na CO +HCl =NaHCO +NaCl10636.510.6g 10610.6g =36.5y y y =3.65g盐酸溶液的质量为3.65g =36.5g 10%碳酸钠完全反应消耗盐酸的质量为:7.3g =73g 10% 故碳酸氢钠完全反应生成二氧化碳消耗盐酸的质量为73g-36.5g=36.5g ,故曲线为:。
(4)根据表格提供的数据,生成4.4g 二氧化碳,需要碳酸钠的质量是10.6g ,生成氯化钠的质量是11.7g ,说明给出的碳酸钠有一部分转化生成了碳酸氢钠和氯化钠,X 为NaHCO 3,碳酸钠和HCl 是反应物,碳酸氢钠、氯化钠、二氧化碳和水是生成物,根据质量守恒定律可得31.8g+14.6g=16.8g+23.4g+4.4g+m ,m=1.8g ;设反应方程式为aNa 2CO 3+bHCl ═cNaHCO 3+dNaCl+eH 2O+fCO 2↑31.6g 14.6g 16.8g 23.4g 1.8g 4.4g a:b:c:d:e:f=:::::=3:4:2:4:1:110635.58458.51844方程式为3Na 2CO 3+4HCl ═2NaHCO 3+4NaCl+H 2O+CO 2↑。

2024-2025学年沪教版化学初三上学期自测试卷(答案在后面)一、单项选择题(本大题有12小题,每小题3分,共36分)1、下列物质中,不属于纯净物的是()A、氧气B、水C、空气D、二氧化碳2、下列物质在常温下呈液态的是()A、氧气B、氢气C、水D、氮气3、下列物质中,不属于氧化物的是:A. 水 (H₂O)B. 二氧化碳 (CO₂)C. 氧化钙 (CaO)D. 氢氧化钠 (NaOH)4、下列说法正确的是:A. 活泼金属的金属活动性顺序表中的位置越靠前,其还原性越弱。
B. 非金属元素的非金属性越强,其氧化性越强。
C. 酸性溶液的pH值一定小于7。
D. 难溶于水的物质不一定是碱性物质。
5、在下列变化中,属于物理变化的是:A. 铁生锈B. 纸张燃烧C. 水结成冰D. 食物腐烂6、下列关于溶液的说法正确的是:A. 溶液一定是无色透明的液体。
B. 溶液中溶质的质量分数越大,溶液的浓度越高。
C. 温度升高,所有物质的溶解度都会增加。
D. 饱和溶液降温后一定会析出晶体。
7、下列物质中,不属于纯净物的是:A. 纯水B. 纯氧C. 纯盐酸D. 纯硫酸8、下列哪个化学符号表示的是一氧化碳?A. COB. CO2C. H2OD. O29、下列物质中,属于纯净物的是:A、空气B、矿泉水C、液氧D、土壤11、下列物质中,不属于碱的是()A、氢氧化钠B、氢氧化钙C、硫酸钠D、氢氧化钾二、多项选择题(本大题有3小题,每小题3分,共9分)1、下列关于原子结构的说法中,正确的是()A. 原子由质子和电子组成B. 质子和中子位于原子中心的原子核内C. 电子带正电荷,在原子外围绕着原子核运动D. 所有元素的原子都含有相同数量的质子2、下列物质属于纯净物的是()A. 空气B. 海水C. 冰水混合物D. 铁锈3、下列关于物质的组成和结构的描述正确的是()A. 氢分子由两个氢原子构成,因此氢分子是由氢元素组成的B. 氧化钙(CaO)是一种离子化合物,由钙离子和氧离子构成C. 氯化钠(NaCl)是一种共价化合物,由钠离子和氯离子构成D. 水(H2O)是一种分子晶体,由水分子构成三、填空题(本大题有5小题,每小题6分,共30分)1、根据质量守恒定律,在一个封闭系统中,不论发生何种化学变化,反应前后系统的总质量保持不变。

25基础计算1.在一个实验室中发现一橡胶球可以漂浮在0.5mol/L的NaCl溶液表面,求该NaCl溶液的密度。
答案:1.018g/mL。
解析:根据阿威休斯定律得到:Fb=FgρVg=m*gρ=m/V=(Vg*g)/V=(Fg/Ag*g)/V=(4πr^3/3*g)/[(4/3)*π*r^3]=3/4*r*g=7.35*10^-5*g其中,Ag为橡胶球跟水接触的面积,r为橡胶球半径,g为重力加速度。
因此,NaCl溶液的密度为:ρNaCl=ρwater+ρball=1.000g/mL+7.35*10^-5*g/mL=1.018g/mL。
2.一种饱和食盐水的密度为1.20g/mL,问在哪个温度下它的浓度为26%。
答案:56.8°C。
解析:首先,要知道饱和食盐水在不同温度下的密度变化情况,参考表格得出如下数据:温度(°C)密度(g/mL)01.091101.078201.064301.049401.033501.015600.996700.975800.951900.9241000.895然后,根据浓度的定义可知:浓度=质量/总质量总质量=质量/浓度因为食盐水是饱和的,所以其浓度为100%。
设实验时食盐水的质量为m,则总质量为m/1.20,其中1.20为食盐水的密度。
根据题意,浓度为26%,所以食盐的质量为0.26*(m/1.20)。
由此0.26*(m/1.20)=m/(1.20+Δρ)其中Δρ为实验时食盐水的密度与需要求的密度的差值。
将参考表格中的数据代入上式计算,得到Δρ为0.325g/mL。
解方程得出:Δρ=0.325=0.26*m/(1.20+Δρ)m=68.45g因此,实验时食盐水的质量为68.45g。
而在哪个温度下其密度为1.20*0.26=0.312g/mL呢?查表可得,在56.8°C时,食盐水的密度约为0.312g/mL,因此答案为56.8°C。
沪教版九年级上化学计算题(真题汇编)一、计算题(本大题共20小题,共100.0分)1.测定石灰石中的碳酸钙的含量,取出克石灰石样品,逐渐加入稀盐酸,充分反应后测得剩余固体质量与加入稀盐酸的质量关系如图所示.已知杂质不参与反应,也不溶于水石灰石样品中碳酸钙的质量是______g;石灰石样品中碳酸钙的质量分数是______;计算稀盐酸溶质的质量分数.2.某化学兴趣小组欲测定一瓶过氧化氢溶液中溶质的质量分数,实验操作及相关数据如图所示:生成氧气的质量______g这瓶过氧化氢溶液中溶质的质量分数是多少?写出计算过程3.我州石灰石资源丰富,某课外小组同学为了测定石灰石中碳酸钙的质量分数,取某地石灰石样品于烧杯中,将50g稀盐酸分5次加入烧杯中,充分反应后杂质不与稀盐酸反应,测得剩余固体的质量记录如下。
请计算:的值为______。
该石灰石样品中碳酸钙的质量分数为______。
所用稀盐酸溶质的质量分数。
写出计算过程4.断血流滴丸主含有木犀草素化学式为,等黄酮类活性成分,具有止血、抗菌、抗炎及免疫等药理活性。
已知木犀草素的相对分子质量为286,请计算的值为______;木犀草素中碳元素的质量分数为______结果精确到。
5.实验室用68g过氧化氢溶液和2g二氧化锰制取氧气,实验的相关数据如图。
请回答:二氧化锰作为催化剂在化学反应前后本身的______都没有发生变化;反应生成氧气的质量为______g;参加反应过氧化氢溶液的质量分数是多少?6.今天是某校实验室开放日,晓明同学用锌和稀硫酸反应制取氢气.先向气体发生装置60每次生成气体的质量如下表:试计算:共制得氢气______实验所用稀硫酸中溶质的质量分数.写出计算过程7.某钢铁厂高炉炼铁的主要原料是焦炭,赤铁矿石主要含、空气等,主要反应过程如下:请回答:的化学式______.反应 的化学方程式______.反应 的化学方程式______.向硝酸银和硝酸铜的混合溶液中,加入一定量的铁粉,反应停止后过滤,得到滤渣和滤液.向滤渣中滴加稀盐酸,无气泡产生,则滤渣中一定含有______填化学式,滤液中一定含有的溶质是______填化学式.用含杂质的铁杂质不溶于水,也不参加反应与100g稀硫酸恰好完全反应,滤去杂质,得到滤液质量为,则含杂质的铁中铁的质量分数为______.8. 化学兴趣小组用一瓶久置的过氧化氢溶液制取氧气并测量过氧化氢质量分数。
2025年上海市化学中考自测试卷(答案在后面)一、单项选择题(本大题有12小题,每小题3分,共36分)1、下列关于水的说法中,正确的是:A、水在常温下是气体B、水是电的良导体C、水的化学式是H2D、水分子由一个氧原子和两个氢原子构成2、下列物质中,不属于有机化合物的是:A、甲烷B、二氧化碳C、乙醇D、葡萄糖3、下列物质中,不属于纯净物的是:A、水(H₂O)B、二氧化碳(CO₂)C、空气D、氯化钠(NaCl)4、在一定条件下,将5.6g的铁(Fe)与足量的硫酸(H₂SO₄)反应,生成硫酸亚铁(FeSO₄)和氢气(H₂)。
已知铁的相对原子质量为56,硫酸的相对分子质量为98,硫酸亚铁的相对分子质量为152。
则生成氢气的质量为:A、0.2gB、0.4gC、0.6gD、0.8g5、下列物质中,不属于氧化物的是:A、水(H2O)B、二氧化碳(CO2)C、氢氧化钠(NaOH)D、硫酸(H2SO4)6、在一定条件下,下列哪种反应属于放热反应?A、燃烧反应B、中和反应C、酸碱反应D、酸碱中和反应7、下列物质中,不属于有机高分子化合物的是:A. 聚乙烯B. 氮气C. 聚氯乙烯D. 聚苯乙烯8、在下列反应中,不属于氧化还原反应的是:A. 2H2 + O2 → 2H2OB. Cu + 2AgNO3 → Cu(NO3)2 + 2AgC. Fe2O3 + 3CO → 2Fe + 3CO2D. 2KClO3 → 2KCl + 3O29、下列关于溶液的说法正确的是:A、溶液一定是由溶质和溶剂组成的均一、稳定的混合物。
B、溶液的浓度越高,其密度一定越大。
C、所有的溶液都是无色的。
D、溶液的稳定性取决于溶质的溶解度。
10、下列物质中,不属于酸的是:A、盐酸(HCl)B、硫酸(H2SO4)C、氢氧化钠(NaOH)D、硝酸(HNO3)11、下列关于物质的分类,正确的是:A. 氧化物一定是化合物B. 纯净物一定是由同种元素组成的C. 混合物一定是由不同种物质组成的D. 有机物一定含有碳元素12、在下列反应中,属于氧化还原反应的是:A. 2H2 + O2 = 2H2OB. 2HCl + 2NaOH = 2NaCl + 2H2OC. CaCO3 = CaO + CO2D. H2SO4 + 2NaOH = Na2SO4 + 2H2O二、多项选择题(本大题有3小题,每小题3分,共9分)1、以下物质中,属于有机高分子化合物的是:A、NaCl(氯化钠)B、C6H12O6(葡萄糖)C、H2O(水)D、Fe(铁)2、在下列化学反应中,属于置换反应的是:A、2H2 + O2 → 2H2O(氢气与氧气反应生成水)B、CaCO3 → CaO + CO2(碳酸钙分解生成氧化钙和二氧化碳)C、2KCl + 2AgNO3 → 2AgCl↓ + 2KNO3(氯化钾与硝酸银反应生成氯化银沉淀和硝酸钾)D、C + O2 → CO2(碳与氧气反应生成二氧化碳)3、下列物质中,既能与盐酸反应又能与氢氧化钠溶液反应的是:A. Na2CO3B. Al(OH)3C. MgOD. CuSO4三、填空题(本大题有5小题,每小题6分,共30分)1、在实验室里,常用的气体干燥剂有浓硫酸、氧化钙等。
上海初三化学试题及答案一、选择题(每题2分,共20分)1. 下列物质中,属于混合物的是()A. 空气B. 二氧化碳C. 氧气D. 水答案:A2. 根据质量守恒定律,下列化学反应中,反应前后物质的总质量不变的是()A. 镁条燃烧B. 铁丝在氧气中燃烧C. 蜡烛燃烧D. 碳酸氢铵受热分解答案:B3. 下列物质中,属于单质的是()A. 氢气B. 氧气C. 二氧化碳D. 碳酸钙答案:A4. 根据化学方程式,下列反应中生成物的质量比正确的是()A. 2H2 + O2 → 2H2OB. 4P + 5O2 → 2P2O5C. 2CO + O2 → 2CO2D. 2H2O → 2H2 + O2答案:B5. 下列物质中,属于化合物的是()A. 氢气B. 氧气C. 二氧化碳D. 空气答案:C6. 根据化学方程式,下列反应中生成物的质量比不正确的是()A. 2H2 + O2 → 2H2OB. 4P + 5O2 → 2P2O5C. 2CO + O2 → 2CO2D. 2H2O → 2H2 + O2答案:D7. 下列物质中,属于氧化物的是()A. 氢气B. 氧气C. 二氧化碳D. 碳酸钙答案:C8. 根据化学方程式,下列反应中反应物的质量比不正确的是()A. 2H2 + O2 → 2H2OB. 4P + 5O2 → 2P2O5C. 2CO + O2 → 2CO2D. 2H2O → 2H2 + O2答案:A9. 下列物质中,属于酸的是()A. 碳酸B. 碳酸钠C. 碳酸氢钠D. 碳酸钙答案:A10. 下列物质中,属于碱的是()A. 氢氧化钠B. 氢氧化钙C. 碳酸钠D. 碳酸氢钠答案:A二、填空题(每空1分,共20分)11. 根据化学方程式,下列反应中生成物的质量比正确的是()A. 2H2 + O2 → 2H2OB. 4P + 5O2 → 2P2O5C. 2CO + O2 → 2CO2D. 2H2O → 2H2 + O2答案:B12. 根据化学方程式,下列反应中反应物的质量比不正确的是()A. 2H2 + O2 → 2H2OB. 4P + 5O2 → 2P2O5C. 2CO + O2 → 2CO2D. 2H2O → 2H2 + O2答案:A13. 根据化学方程式,下列反应中生成物的质量比不正确的是()A. 2H2 + O2 → 2H2OB. 4P + 5O2 → 2P2O5C. 2CO + O2 → 2CO2D. 2H2O → 2H2 + O2答案:D14. 根据化学方程式,下列反应中反应物的质量比不正确的是()A. 2H2 + O2 → 2H2OB. 4P + 5O2 → 2P2O5C. 2CO + O2 → 2CO2D. 2H2O → 2H2 + O2答案:A15. 根据化学方程式,下列反应中生成物的质量比不正确的是()A. 2H2 + O2 → 2H2OB. 4P + 5O2 → 2P2O5C. 2CO + O2 → 2CO2D. 2H2O → 2H2 + O2答案:D三、实验题(每题10分,共20分)16. 实验室制取氧气的实验中,需要使用的药品是()A. 过氧化氢溶液和二氧化锰B. 高锰酸钾C. 氯酸钾和二氧化锰D. 过氧化氢溶液答案:C17. 实验室制取二氧化碳的实验中,需要使用的药品是()A. 碳酸钙和盐酸B. 碳酸钠和盐酸C. 碳酸氢钠和盐酸D. 碳酸钙和硫酸答案:A四、计算题(每题10分,共20分)18. 计算下列化学反应中生成物的质量:2H2 + O2 → 2H2O已知氢气的质量为2g,氧气的质量为16g,求生成水的质量。
专题复习化学计算(注:* 表示适合新教材所用)一、有关化学式的计算1、计算物质的式量(摩尔质量)根据物质的化学式计算它的式量:* 摩尔质量的数值与该物质的式量数值相等,单位为:g / mol例1 硝酸铵的式量为___________。
*摩尔质量为__________________。
胆矾的式量为____________。
*摩尔质量为_________________。
2、计算原子个数比:(物质的量之比)根据化学式计算分子中原子的个数之比。
(原子个数之比就等于物质的量之比)。
例2 酒精(CH3CH2OH)分子中各原子的个_________________。
*酒精(CH3CH2OH)分子中各原子物质的量比是__________________。
3、计算化合物中各元素的质量比。
化合物中各元素的质量比,既等于化合物中各元素的原子个数比乘以该原子的相对原子质量的最简比。
例3碳酸氢铵中各元素的质量比______________________。
4、计算化合物中各元素的质量分数(1)根据化合物的化学式计算化合物中各元素的质量分数。
例:计算硝酸铵中氮元素的质量分数________________。
(2)根据化合物的质量,求它们所含元素的质量例:64克二氧化硫中硫元素的质量为___________克。
80克三氧化硫中氧元素的质量为_________克。
M克二氧化硫与N克三氧化硫含相同质量的硫元素,则M ________N ( 填< = > )。
(3))根据化合物中某元素的质量,求相应的化合物的质量例:如果服用碳酸钙补钙,那么补钙0.5g 钙元素,需碳酸钙________克。
**二、有关物质的量的计算A . 物质的量与微粒数的关系例: 2 mol 二氧化碳含分子数________________个,含碳原子________mol ,含氧原子__________________个。
B.物质的量、质量和摩尔质量之间的关系例:3 mol 水为__________克,80克氢氧化钠是________摩尔。
上海初三化学计算题例题与练习
一、差量法
例1、用氢气还原10克CuO,加热片刻后,冷却称得剩余固体物质量为8.4克,则参加反应CuO的质量是多少克?
例2、将CO和CO2的混合气体2.4克,通过足量的灼热的CuO后,得到CO2的质量为3.2克,求原混合气体中CO和CO2的质量比?
例3、将30克铁片放入CuSO4溶液中片刻后,取出称量铁片质量为31.6克,求参加反应的铁的质量?
例4、已知同一状态下,气体分子间的分子个数比等于气体间的体积比。
把30mL 甲烷和氧气的混合气体点燃,冷却致常温,测得气体的体积为16mL,则原30mL中甲烷和氧气的体积比?
例5、给45克铜和氧化铜的混合物通入一会氢气后,加热至完全反应,冷却称量固体质量为37克,求原混合物中铜元素的质量分数?
答案:1、8克 2 、7∶5 3 、11.2克4、8∶7 、7∶23 5 、28.89%
练习1、将盛有12克氧化铜的试管,通一会氢气后加热,当试管内残渣为10克时,这10克残渣中铜元素的质量分数?
练习2、已知同一状态下,气体分子间的分子个数比等于气体间的体积比。
现有CO、O2、CO2混合气体9ml,点火爆炸后恢复到原来状态时,体积减少1ml,通过氢氧化钠溶液后,体积又减少3.5Ml,则原混和气体中CO、O2、CO2的体积比?
练习3、把CO、CO2的混合气体3.4克,通过含有足量氧化铜的试管,反应完全后,将导出的气体全部通入盛有足量石灰水的容器,溶液质量增加了4.4克。
求⑴原混合气体中CO的质量?
⑵反应后生成的CO2与原混合气体中CO2的质量比?
练习4、CO和CO2混合气体18克,通过足量灼热的氧化铜,充分反应后,得到C O2的总质量为22克,求原混合气体中碳元素的质量分数?
二、离子守恒法
例题:1、一块质量为4克的合金,与足量的盐酸反应,产生0.2克氢气。
则该合金的组成可能为()
A Fe Mg
B Fe Al
C Fe Zn
D Mg Al
2、测知CO和M的混合体气体中,氧的质量分数为50% 。
则M气体可能是()
A CO2
B N2O
C SO2
D SO3
3、某硝酸铵(NH4NO3)样品,测知含氮量为37%,则该样品中含有的杂质可能是()
A (NH4)2SO4
B CO(NH2)2
C NH4HCO3
D NH4Cl
4、有Zn和另一种金属组成的混合物4。
5克,与足量的盐酸反应,放出所氢气
0.2克,则另一种种种金属可能是()
A Al
B Mg
C Zn
D Cu
分反应,得到14·4克氯化银沉淀,则可能混有的盐(山西省中考)()
A CaCl2
B KCl
C BaCl2
D MgCl2
6、今取12·7克氯化亚铁样品,完全溶于水制成溶液然后加入足量的硝酸银溶液,使其充分反应,得氯化银沉淀,经干燥后称量质量为30克,已知,样品内杂质为氯化物,则该杂质可能是()
A KCl
B NaCl
C ZnCl2
D BaCl2
答案:1:A B2:B3:B4:A B 5 、A D 6 、B
练习题:
1、测知Fe2O3和另一种氧化物的混合物中氧的含量为50%,则加一种氧化物可能是:()
A MgO
B Na2O
C CO2
D SO2
2、有两种金属组成的合金6。
8克与足量的硫酸溶液反应,产生氢气0.4克,则该合金的组成可能为:()
A、Al Mg B 、Na Fe C 、Al Cu D 、Mg Zn
3、测知由两种氮肥组成的混合物中,含氮量为40%,则混合物中一定含有下列氮肥中哪一种:()
A NH4Cl
B CO(NH2)2
C NH4HCO3
D (NH4)2SO4
4、两种氧化物的混合物共5·6克跟足7·3%的盐酸100克完全反应,则混合物可能是:()
A MgO和ZnO
B CaO和CuO
C MgO和CuO
D CaO和MgO
三、假设极限法
例1、某不纯的烧碱样品中含有Na2CO33.8%、Na2O 5.8% 、NaOH 90.4%。
取M克样品,溶于质量分数为18.75%的盐酸溶液100克中,并用30%的NaOH%溶液来中和剩余的盐酸至中性。
把反应后的溶液蒸干后可得到固体质量多少克(29.2 5克)
例2、向一定量的Fe(OH)2溶液中加入200克4.9%的硫酸充分反应后,向溶液中加入一定量的铁正好完全反应,蒸发冷却可得到晶体(不含结晶水)多少克(1 5.2克)
例3 、现有不纯的金属M(含有不溶于水也不溶于酸的杂质),取该金属样品4.0克,投入19.45 克20%的稀盐酸中,恰好完全反应,测得该金属与盐酸生成的氯化物中含氯50%,则该金属样品中金属M的质量分数为多少?(97.25%)
例4、取镁粉、铝粉、铁粉、锌粉组成的混合物M克,跟一定量的溶质质量分数为30%的稀硫酸恰好完全反应,经蒸干水分后得到固体物质N克,(不含结晶水),求生成氢气多少克?
[(N—M)/48 克]
练习1、有一部分变质的KOH样品,含H2O:7.62%;K2CO3:2.38%;k2O:10%;KOH:80%;取该样品W克加入98克质量分数为20%的稀硫酸充分反应后,再加入20克质量分数为10%的KOH溶液恰好呈中性,把反应后所得溶液小心蒸干得到固体(不含结晶水)多少克(34.8克)
练习2、向一定量的Mg(OH)2溶液加入200克36.5%盐酸完全反应后再向溶液中加入一定量的镁正好完全反应,蒸干冷却得到固体(不含结晶水)多少克?(9 5克)
练习3 、把一定量的氯酸钾充分加热到再不放出气体为止,向剩余固体中加入足量的水配成溶液,向该溶液中加入足量的硝酸银溶液,过滤,干燥,得到固体物质143. 5克,求放出氧气多少克(48克)
练习4、将5克含Cu的金属R样品放入25克20%稀盐酸中,恰好完全反应测得R 的氯化物中氯元素为52·5%,则样品中金属R的质量分数为多少(88%)
五、质量守怛定律运用
例1、镁铝合金M克和足量的盐酸反应生成H20·1克,则M可能是()
A 、0·8
B 、1
C 、1·5D、无法确定
例2、20克H2、O2混合气体点燃充分燃烧生成18克水,则原混合气体中氢气和氧气的质量比为()
A 4∶1
B 1∶1C9∶1D2∶3
例3、将10克KClO3、MnO2的混合物装入大试管中,加热使之分解,冷却向试管中加入4克水,振荡后仍有4.24克未溶解。
再加入2克水,振荡后仍有3.28克固体未溶解,计算原混合物中氯酸钾的质量分数?
例4、NaOH和H2O的混合物中,氧元素的质量分数为W%,则W的范围是
某种氢氧化钠溶液中含氧元素80%,该溶液中含氢氧化钠的质量分数
为。
答案:1、B 2 、A C 3 、67.2%98% 4 、0%88.89%18.18%
练习1 、铁铝合金M克和足量的硫酸反应生成H2 2克,则M可能是()
A 15B75 C 30 D 58
练习2、现有25克CO和O2的混合气体充公燃烧,将生成的气体通入足量的石灰水,发现烧杯内的物质增重22克,则原合气体中CO质量可能是()
A17 B 14 C8D22
练习3、将一定量的碳和氧气放入一密闭的容器中,得到10克气体,将气体通过足量的石灰水后,气体剩余5.6克,计算反应物中碳和氧气的质量比
答案:1 C2AB33.6克与6.4克1.2克与8.8克
六、无数据计算
例1、将某BaCl2溶液加入一定量的稀硫酸中,可恰好完全反应,.滤出沉淀后的滤液与原BaCl2的质量相等。
求所加硫酸溶液中溶质的质量分数。
(42.1%)
例2、若于克木炭—碳酸钙混合物在空气中受强热后碳酸钙可完全分解,木炭全氧化。
生成的气体的质量等于原混合物的总质量。
求原混合物中的木炭的质量分数。
(1 7.4%)
例3、充分煅烧某碳酸镁和碳酸钙混合物,可得到由两种氧化物组成的固体残留物。
固体残留物无损失,经称量知其质量是原混合物质量的一半。
求残留物中镁元素与钙元素的最简整数比。
(9∶5)
例4、向稀硫酸和硫酸铜混合液中加入足量的铁粉,完全反应后剩余固体物质的质量与所加铁粉的质量相待。
求原混合液中硫酸和硫酸铜的质量比。
(7∶80)
例5、向由硫酸钠和氯化钠组成的混合物中加入足量的氯化钡溶液,过滤、干燥后发现所得沉淀的质量与原混合物的质量相等,求原混合物中氯化钠的百分含量。
(3 9.1%)
例6、一定量的炭粉与氧气组成的混合物在一定条件下可完全反应,生成体积相等的一氧化碳和二氧化碳,原混合物中炭粉与氧气的质量比(1∶2)
例7、若同质量、同浓度的氯化钡溶液可使同质量的硫酸铁和硫酸铜两种溶液中的S O42—离子全部沉淀出来,则两种溶液的质量分数之比(5∶6)
例8、等质量的CaCO3、MgCO3、Na2CO3、NaHCO3分别与足量的稀盐酸反应,生成的二氧化碳的质量由大到小的顺序为。
(MgCO3=NaHCO3>CaCO3>Na2CO
)
3
例9、有铜和锌的混合物,与足量的稀盐酸反应后,过滤,干燥、冷却称量,得知固体质量与原混合物的质量相等,求原混合物中锌的质量分数(20%)
例10、在天平两边的托盘上各放一只等质量的烧杯,烧杯中各盛主放等质量、等浓度的稀硫酸。
向两烧杯中分别放入一块镁片和铝片(均与硫酸完全反应)天平平衡是放入的镁片和铝片的比是(4∶3 )。