分子极性及其判断规律(精)
- 格式:doc
- 大小:51.00 KB
- 文档页数:1

分子极性巧判断有关“分子的极性”的判断,大多数同学们感觉到内容较为抽象,比较难理解,在判断时也常常出现错误。
对于共价型分子如何判断分子的极性,作者提出一些方法,供参考。
1、单原子分子:单原子分子一般指由稀有气体元素原子构成的分子,都为非极性分子,如He、Ne、Ar等。
2、双原子分子;双原子分子可以从单质和化合物两个方面去考虑。
(1)单质:由于形成的化学键为非极性键,故形成的分子为非极性分子。
(2)化合物:对于化合物的极性,我们可以从四个方面去分析。
①从分子中的化学键的种类去判断如果分子中的化学键全部为非极性键,则该分子为非极性分子;若分子是以以极性键结合而形成的分子,那么既可能是极性分子,又可能是非极性分子,这时就必须看分子空间构型。
分子的空间构型均匀对称的是非极性分子,如AB2型的直线形分子CO2,AB3型的平面正三角锥形分子BF3,AB4型的正四面体结构分子CH4等;分子的空间构型不对称的多原子分子为极性分子,如V型的H2O,三角锥型的NH3,不规则四面体分子CH3Cl等。
②从分子中中心原子所形成共价键的数目去判断凡是多原子的共价分子中中心原子最外层电子全部成键,且连接相同的原子或原子团,则在中学阶段该分子一定是非极性分子。
否则为非极性分子。
③从分子中中心元素的化合价去判断若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子;若不等,则为极性分子。
如BF3、CO2等为非极性分子,NH3、H2O、SO2等为极性分子。
④从分子在某溶剂中的溶解性去判断极性分子易溶于极性分子溶剂中(如HCl易溶于水中),非极性分子易溶于非极性分子溶剂中(如碘易溶于苯中,白磷易溶于CS2中)。
【典例】下列各组物质中,都是由极性键构成的极性分子的一组是()A、CH4和Br2B、NH3和H2OC、H2S和CCl4D、CO2和HCl【解析】Br—Br为非极性键;CH4、CCl4、CO2虽然由极性键形成,但它们为对称结构,C的化合价的数值与C原子的最外层电子数相同,为非极性分子;NH3、H2O由极性键形成,H2O 空间构型为“V”型,NH3的空间构型为三角锥型,结构不对称,N、O的化合价的数值与最外层电子数不相等,故为极性键形成的极性分子,选B。

对于分子电性结构的判断摘要本文是在选修3新教材的基础上,对于分子极性这一教学内容进行的研究和探索。
在考量了学生接受能力和理解能力后,从概念的理解到实例分析,对分子极性的判断方法和技巧进行了多角度的解读与归纳。
关键词分子;性质;极性;方法;概念;实例在选修3《分子的性质》这节课的教学过程中,通过研究教材我发现课本中对于该内容的文字描述很简练,而对同学们在接触到有关分子极性的判断时,大多数都会感到内容较为抽象,较难理解,在判断时也常常会出现错误。
为了扫除同学们在判断分子极性这一问题上可能存在的“障碍”,本文在此对分子极性的判断方法和技巧进行了多角度的解读与归纳。
一、判断分子极性的方法(一)化学方法1.概念解读化学方法——正负电荷中心是否重合(在任何一个分子中都可以找到一个正电荷中心和一个负电荷中心,根据正负电荷中心是否重合来判断);如图1所示2.实例分析正负电荷中心重合与否不仅与化学键的极性有关,还与分子的立体结构(即键的空间位置)有关。
例一、水分子有四对核外电子,6个来自氧原子,2个来自氢原子。
水分子包含4个杂化轨道,呈四面体构型,其中2个轨道用于形成O—H共价键,另2个轨道由氧的孤对电子占用,氧原子位于水分子四面体的中心,形成O—H共价键的2个电子对偏向于O原子一方,若用化合价描述就应显—2价。
共用电子对偏离于左右两个氢原子时,左右两个氢原子上就相当于带部分单位的正电荷δ+,用化合价描述分别显+1价。
H2O分子中成键电子的偏移示意图及化合价的图示说明如下:H2O分子中,正电荷中心在左右两氧原子(+1价)连线的中点上,负电荷中心在中间的氧原子(-2价)上。
正负电荷中心不重合,因此,H2O是极性分子,而不是非极性分子。
例二、CO2分子中,C原子和两个O原子相连。
这个分子是直线型结构,CO2分子的结构如下图所示:在CO2分子结构中,O=C=O键角为1800,C=O键长为116pm。
该分子中,两个氧原子上呈负电性(δ-),负电荷的中心在两个氧原子连线的中点上,中间的碳原子上呈正电性(δ+),正电荷中心就在落在碳原子上,显然正负电荷的中心重合于一点。

极性与非极性是针对分子说的。
首先化学共价键分为极性键与非极性键。
非极性键就是共用电子对没有偏移,出现在单质中比如O2;极性键就是共用电子对有偏移比如HCl。
而当偏移的非常厉害之后,看上去一边完全失电子另一边得到了电子,就会变成离子键了,如NaCl再说极性分子与与非极性分子。
由于极性键的出现,所以就使某些分子出现了电极性,但是并不是说所有有极性键的分子都是极性分子。
比如CH4,虽然含有4个极性的C-H键,但是因为其空间上成对称的正四面体结构,所以键的极性相消,整个分子没有极性对与H2O,虽然与CO2有相同类型的分子式,也同样有极性共价键,但二者分子的极性却不同。
CO2是空间对称的直线型,所以分子是非极性分子,H2O是折线型,不对称,所以是极性分子,作为溶剂称为极性溶剂常用溶剂的极性顺序:水(最大) > 甲酰胺> 乙腈> 甲醇> 乙醇> 丙醇> 丙酮>二氧六环> 四氢呋喃> 甲乙酮> 正丁醇> 乙酸乙酯> 乙醚> 异丙醚> 二氯甲烷>氯仿>溴乙烷>苯>四氯化碳>二硫化碳>环己烷>己烷>煤油(最小)常见问题1:两个相同的原子之间形成的共价键一定是非极性键吗?问题:两个相同的原子之间形成的共价键一定是非极性键吗?解答:两个相同的原子之间形成的共价键不一定是非极性键.例如乙醇分子:两个碳原子两边结构不对称,两边对共用电子对的吸引能力不同,则共用电子对不在两个C原子之间的中心位置,即偏向一方,因而形成的共价键不是非极性键.常见问题2:键的极性和分子的极性问题:键的极性和分子的极性解答:1.键的极性键的极性取决于成键的两原子非金属性强弱.一般说,成键的两原子是同种元素的原子,键为非极性键.如果成键的两原子是不同种元素的原子,键为极性键.2.分子的极性在同一分子中,可以同时存在极性键和非极性键.分子的极性取决于键的极性和分子中的键的空间排列.双原子分子的极性与键的极性是一致的,即以极性键结合的双原子分子一定是极性分子.以非极性键结合的双原子分子一定是非极性分子.对于多原子分子的极性除与键的极性有关系外,还与键的空间排列有关.若键的空间排列对称,为对称分子,分子中正、负电荷重心重合,则是非极性分子.如二氧化碳,四氯化碳等.若键的空间排列不对称,分子中正、负电荷重心不重合,分子中出现了带部分正、负电荷的两极,则是极性分子,如水分子.常见问题3:分子极性的判断问题:分子极性的判断解答:判断是否极性分子,进行判断可从分子空间构型是否对称,即分子中各键的空间排列是否对称,若对称,则正负电荷重心重合,分子为非极性分子,反之,是极性分子。

2.3.1 键的极性和分子的极性【学习目标】1、区分键的极性和分子的极性;2、掌握判断键的极性和分子的极性的方法;3、了解分子极性的应用。
【课前案——温故而知新】一、电负性1、含义:用来描述不同元素的原子对键合电子的大小。
2、递变规律:在元素周期表中,同主族元素,由上到下,原子的电负性依次;同周期元素,由左到右,原子的电负性依次。
3、判断化学键的类型:一般来说,当键合原子的电负性差值大于时,形成离子键;当键合原子的电负性差值小于时,形成共价键。
二、键的极性按照共价键中,将共价键分为极性共价键和非极性共价键。
1、非极性共价键:由(“相同”或“不同”)种原子形成的共价键,电子对(“有”或“无”)偏移。
2、极性共价键:由(“相同”或“不同”)种原子形成的共价键,电子对(“有”或“无”)偏移,极性键中的两个键合原子,电负性较大的原子呈(“正”或“负”,下同)电性,电负性较小的呈电性。
【课前检测】1、写出下列物质的电子式:① CCl4;②NH3;③H2O ;④CO2;⑤Na2O2;⑥Mg(OH)2。
2、有下列物质:①O2;②CO2;③NH3;④Na2O;⑤Na2O2;⑥NaOH;⑦CaBr2;⑧H2O2;⑨NH4Cl;⑩HBr,回答下列问题:(1)只含有极性键的是;(2)只含有非极性键的是;(3)含有极性键和非极性键的是;(4)只含有离子键的是;(5)含有非极性键的离子化合物是。
【课中案】一、分子的极性对于一个分子来说,可以设想它的全部正电荷集中于一点,叫做正电荷中心,它的全部负电荷集中于一点,叫做负电荷中心,但分子是电中性的。
1、极性分子:分子中正电中心和负电中心(“不重合”或“重合”),使分子的某一部分呈正电性(δ+),另一部分呈负电性(δ—)。
2、非极性分子:分子中正电中心和负电中心(“不重合”或“重合”)。
【注意】极性分子、非极性分子都显电中性,都不带电荷。
二、分子极性的判断方法1、物理模型法AB n分子,A-B键看作AB原子间的相互作用力,根据中心原子A所受合力是否为零来判断, F合=0,为非极性分子(极性抵消);F合≠0,为极性分子(极性不抵消)。

极性分子与非极性分子你知道冰为什么在4℃时密度最大吗?这就是本讲所学内容——分子间作用力和氢键的有关知识。
由于水分子间有氢键缔合这样的特殊结构。
根据近代X射线的研究,证明了冰具有四面体的晶体结构。
这个四面体是经过氢键形成的,是一个敞开式的松弛结构,因为5个水分子不能把全部四面体的体积占完,在冰中氢键把这些四面体联系起来,成为一个整体。
这种通过氢键形成的定向有序排列,空间利用率较小,约占34%,因此冰的密度较小。
液态水不像冰那样完全是有序排列了,而是有一定程度的无序排列,即水分子间的距离不像冰中那样固定,H2O分子可以由一个四面体的微晶进入另一微晶中去。
这样,分子间的空隙减少,密度就增大了。
温度升高时,水分子的四面体集团不断被破坏,分子无序排列增多,使密度增大。
但同时,水分子的热运动也增加了分子间的距离,使密度又减小。
这两个矛盾的因素在4℃时达到平衡,因此,在4℃时水的密度最大。
过了4℃后,分子的热运动使分子间的距离增大的因素,就占优势了,水的密度又开始减小。
知识延伸一、分子间作用力分子型物质无论是气态、液态或固态,都是由许多分子组成的,在分子间存在着一种较弱的作用力叫分子间作用力,也叫做范德华力。
它比分子内原子间的作用力(化学键)要小。
分子间的作用力是一个总的提法,按作用力产生的原因和特性可分为三种力:l.取向力当两个极性分子靠近时,同极相斥,异极相吸,产生相对转动,最后必然是异极相对,同极尽量远离,这叫做分子的取向。
这种由于极性分子取向而产生的力叫取向力。
2.诱导力当极性分子接近非极性分子时,极性分子的偶极电场使非极性分子发生极化从而产生正、负电荷重心不相重合,这种由于外来的影响而产生的偶极叫诱导偶极,诱导偶极与固有偶极产生的力称为诱导力。
一般说来,极性分子的极性越大,诱导力越大。
分子的变形性越大,诱导力也越大。
3.色散力非极性分子之间也存在着相互吸引力,非极性分子内部的原子核和电子都在不断地运动,不断地改变它们相对的位置。



第2课时分子的极性与手性分子目标与素养:1.初步认识分子的极性、手性分子等概念。
(微观探析)2.认识分子的空间构型与分子极性的关系。
(宏观辨识)一、分子的极性1.极性分子与非极性分子(1)极性分子:正电荷重心和负电荷重心不相重合的分子。
(2)非极性分子:正电荷重心和负电荷重心相重合的分子。
2.分子极性的判断方法分子的极性是由分子中所含共价键的极性与分子的空间构型两方面共同决定的。
判断分子极性时,可根据以下原则进行:(1)只含有非极性键的双原子分子或多原子分子大多是非极性分子,如O2、H2、P4、C60。
(2)含有极性键的双原子分子都是极性分子,如HCl、HF、HBr。
(3)含有极性键的多原子分子,空间结构中心对称的是非极性分子;空间结构中心不对称的是极性分子。
3.分子的极性对物质溶解性的影响——相似相溶规则非极性分子构成的物质一般易溶于非极性溶剂,极性分子构成的物质一般易溶于极性溶剂。
二、手性分子1.观察比较下图所示两种分子的结构(1)相同点是分子组成相同、都是CHFClBr,从平面上看相似。
(2)不同点是在空间上不同,它们构成实物和镜像关系。
(3)具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能重叠,互称为手性异构体。
有手性异构体的分子叫做手性分子。
2.手性分子的判断判断一种有机物是否具有手性异构体,关键是看其含有的碳原子是否连有4个不同的原子或基团,即有机物分子中是否存在手性碳原子,如,R1、R2、R3、R4互不相同,含有手性碳原子,该有机物分子具有手性。
3.手性分子的重要用途由于手性分子对生命及生理活动有其特殊的活性,化学工作者期望可以找到对癌症和一些目前的疑难杂症有治疗作用的手性药品;同时也期望早日实现“手性分子”的合成和分离的工业化;期望能制造出可以利用的“手性分子”作为高分子聚合物的单体,用以合成易降解的高分子化合物,减少环境污染。
(1)手性异构体(又称对映异构体、光学异构体)的两个分子互为镜像关系,即分子形式的“左撇子和右撇子”。

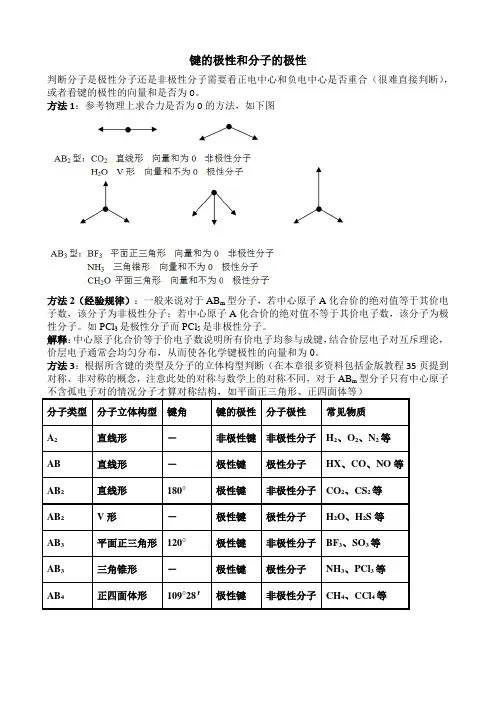
键的极性和分子的极性判断分子是极性分子还是非极性分子需要看正电中心和负电中心是否重合(很难直接判断),或者看键的极性的向量和是否为0。
方法1:参考物理上求合力是否为0的方法,如下图方法2(经验规律):一般来说对于AB m型分子,若中心原子A化合价的绝对值等于其价电子数,该分子为非极性分子;若中心原子A化合价的绝对值不等于其价电子数,该分子为极性分子。
如PCl3是极性分子而PCl5是非极性分子。
解释:中心原子化合价等于价电子数说明所有价电子均参与成键,结合价层电子对互斥理论,价层电子通常会均匀分布,从而使各化学键极性的向量和为0。
方法3:根据所含键的类型及分子的立体构型判断(在本章很多资料包括金版教程35页提到对称、非对称的概念,注意此处的对称与数学上的对称不同,对于AB m型分子只有中心原子化学键类型和物质类别的关系:1.不含有化学键的物质:稀有气体分子。
2.只含非极性键的物质:同种非金属元素构成的单质。
H2、P4、金刚石等3.只含极性键的物质:一般是不同非金属元素构成的共价化合物。
HCl、NH3等4.含非极性键和极性键的物质:H2O2、C2H2、CH3CH3、C6H6等5.只含离子键的物质:活泼金属与活泼非金属元素形成的化合物。
MgCl2、K2O等6.含离子键和非极性键的物质:Na2O2、CaC2等7.含离子键和极性键的物质:NaOH等8.含离子键、极性键和非极性键的物质:CH3COONa等9.只含金属键的物质:金属和合金(第三章内容)10.含金属键和共价键的物质:石墨(第三章内容)分子极性与键的极性的关系:1.只含非极性键的物质一定是非极性分子(除O3外的单质分子。
O3分子是V形结构,存在一个大π键,从而导致整个分子正电中心与负电中心不重合。
有时候题中会考查O3的分子构型,可根据O3与SO2互为等电子体判断)。
2. AB型的双原子分子只含一个极性键,一定是极性分子。
3.只含极性键的AB m型分子可能是极性分子(如H2O、NH3等),也可能是非极性分子(如CO2、BF3、CCl4等)。

极性键和极性分子思考:什么叫极性键?什么叫非极性键?如何判断?由不同原子形成的电子对会发生偏移的共价键,是极性键。
极性键中的两个键合原子,一个呈正电性,另一个呈负电性。
如HCl分子中的H—Cl键。
由同种原子形成的电子对不发生偏移的共价键,是非极性键。
非极性键中的两个键合原子不显电性。
如H2分子中的H—H键。
判断方法:不同原子形成的共价键是极性键;同种原子形成的共价键是非极性键。
小结:(1)非极性键和极性键都是共价键。
(2)极性键与离子键没有绝对的界限,极性键的极性强到一定程度就成为离子键。
(3)非极性键和极性键的判断:由同种元素的原子形成的共价键是非极性键;由不同元素的原子形成的共价键是极性键。
①单质分子中只有非极性键。
如:H2、O2、N2、Cl2、O3、P4。
②有的共价化合物中只有极性键。
如:HCl、H2O、H2S、CO2、NH3、PCl3、PCl5、CH4。
③有的共价化合物中既有极性键,又有非极性键。
如:H2O2、C2H2、C2H4、CH3CH2OH。
④有的离子化合物中还存在极性键或非极性键。
如:NaOH、Na2SO4中存在极性键,Na2O2存在非极性键。
思考:判断H2、Cl2、N2、HCl、CO2、H2O分子中键的极性。
1、极性分子和非极性分子的概念极性分子:正电中心和负电中心不重合,使分子的某一部分呈正电性(δ+),另一部分呈负电性(δ-)的分子。
非极性分子:正电中心和负电中心重合的分子。
常见的极性分子和非极性分子:讨论:(1)以下双原子分子中,哪些是极性分子?哪些是非极性分子?H2 O2 Cl2 HCl(2)以下非金属单质分子,是极性分子还是非极性分子?P4 C60(3)下列哪些化合物分子是极性分子?什么是非极性分子?CO2 HCN H2O NH3 BF3 CH4CH3Cl思考:(1)由非极性键形成的分子是否都为非极性分子?为什么?都为非极性分子,因为分子中正电中心和负电中心重合。
(2)由极性键形成的分子是否都为极性分子?试举例说明。
分子极性分子的极性取决于两个因素:一是分子中每一个键两端的原子的电负性的差异,差异越大的,键的极性越强;另一个因素就是每个键极性向量的向量和,其向量和不为零的分子就是极性分子。
极性分子间有偶极-偶极作用力,非极性分子间则只有London dispersion forces(即瞬间偶极-感应偶极作用力),后者是所有分子间都有的作用力。
而偶极-偶极作用力与London dispersion forces通称为范德华力。
氢键可视为极性分子的一个极端,因为H-F, H-O, H-N的键中,氢原子的唯一一个电子几乎被电负性极强的F、O和N拉走,所以氢原子上带有相当的正电荷,比如HF分子,其上的氢原子相当于带有+0.45电子电荷,而氟原子上带有-0.45电子电荷。
这氢原子与旁边的另一个F, O, 或N原子就会有极强的作用力,即是氢键。
当一个键两端的原子的电负性的差异大到非常大,则形成离子键。
“分子的极性相近,互溶的效果较佳”是极性分子间作用力的很好例子,不过溶解是溶质、溶剂分子间,溶质、溶质分子间,溶剂、溶剂分子间作用力的比较,可以扩大到其它的分子间作用力,如氢键、离子与极性分子间作用力。
其它相关作用力的例子,如表面张力, 粘度, 附着力等。
极性分子间的作用力较非极性者为高,因此分子量相同的两化合物,极性高者沸点与熔点较高。
分子的极性运用在溶解度上是最重要的,例如要从天然植物萃取天然物时,常由极性低的溶剂开始萃取,依次用极性越来越高的溶剂,在不同极性的萃取液中会得到不同的化合物。
做再结晶时常用一可溶的溶剂搭配一不可溶的溶剂,当然也是靠着溶剂极性的差异。
做管柱层析时,也常利用极性不同的溶剂来冲洗,达成分离的效果。
有些时候重要的并非整个分子的极性,而是区域性的极性,例如肥皂就是很好的例子,肥皂分子的一端是极性很高的,具有亲水性,另一端则是极性很低的,具有亲油性,因此造成了肥皂的清洁效果。
实际上细胞膜也是由类似肥皂般的分子构成,细胞膜的内表面与外表面是极性端可与水亲和,内外表面之间则是排列着非极性的长链烷类,是憎水的,阻挡了水中的极性分子任意进出。
分子概述 如果分子的构型不对称,则分子为极性分子。
如:氨气分子,HCl分子等。
区分极性分子和非极性分子的方法: 非极性分子的判据:中心原子化合价法和受力分析法1、中心原子化合价法: 组成为ABn型化合物,若中心原子A的化合价等于族的序数,则该化合物为非极性分子.如:CH4,CCl4,SO3,PCl52、受力分析法: 若已知键角(或空间结构),可进行受力分析,合力为0者为非极性分子.如:CO2,C2H4,BF33、非极性分子: 同种原子组成的双原子分子都是非极性分子。
不是非极性分子的就是极性分子了! 高中阶段知道以下的就够了: 极性分子:HX,CO,NO,H2O,H2S,NO2,SO2,SCl2,NH3,H2O2,CH3Cl,CH2Cl2,CHCl3,CH3CH2OH 非极性分子:Cl2,H2,O2,N2,CO2,CS2,BF3,P4,C2H2,SO3,CH4,CCl4,SiF4,C2H4,C6H6,PCl5,汽油 简单判断方法 对于AnBm型 n=1 m>1 若A化合价等于主族数 则为非极性有机极性判断弱极矩μ 有机化合作大多难溶于水,易溶于汽油、苯、酒精等有机溶剂。
原因何在?中学课本、大学课本均对此进行了解释。
尽管措词不同,但中心内容不外乎是:有机化 合物一般是非极性或弱极性的,它们难溶于极性较强的水,易溶于非极性的汽油或弱极性的酒精等有机溶剂。
汽油的极性在课本中均未做详细说明,故而在教学中常 常做如下解释:所有的烷烃,由于其中的O键的极性极小,以及结构是对称的,所以其分子的偶极矩为零,它是一非极性分子。
烷烃易溶于非极性溶剂,如碳氢化合 物、四氯化碳等。
以烷烃为主要成分的汽油也就不具有极性了。
确切而言,上述说法是不够严格的。
我们知道,分子的极性(永久烷极)是由其中正、负电荷的“重心”是否重合所引起的。
根据其分子在空间是否绝对对称来判定极性,化学键极性的向量和——弱极 矩μ则是其极性大小的客观标度.分析1 常见烷烃中,CH4、C2H6分子无极性,C3H8是 折线型分子,键的极性不能相互完全抵消,其μ≠为0.084D。
分子极性及其判断规律
张素琳
分子的极性及其判断是中学化学的一个难点,对于这一难点的理解,同学们可以从以下三个方面着手。
一. 分类
按照分子的极性,可把分子分为两类:
1. 非极性分子:电荷在分子中的分布对称。
如、、、、、、222222CO Br Cl N O H
342BF CH CS 、、等。
2. 极性分子:电荷在分子中的分布不对称。
如2232O H HCl NH O H 、、、等。
二. 掌握常见分子的极性及其空间构型
三. 分子极性的判断规律
1. 双原子单质分子都是非极性分子。
如22222Br Cl N O H 、、、、等。
2. 双原子化合物分子都是极性分子。
如HI HBr l HC 、、等。
3. 多原子分子的极性要看其空间构型是否对称,对称的是非极性分子,否则是极性分子。
如32232232CHCl Cl CH Cl CH O H HCl NH O H 、、、、、、等是极性分子;
3442BF CCl CH CO 、、、等是非极性分子。
4. 判断n AB 型分子的极性还有一个巧妙的方法:价态电子法。
首先确定中心原子A 的化合价和A 原子的最外层电子数,然后根据两者是否相等进行判断。
如果A 的化合价等于A 原子的最外层电子数,则该分子为非极性分子;如果A 的化合价不等于A 原子的最外层电子数,则该分子为极性分子。
另外,从表中还可以看出分子的极性或非极性与键的极性或非极性没有必然联系。
含有极性键的分子不一定是极性分子,含有非极性键的分子不一定是非极性分子。
同学们在进行有关分子极性的判断时,一定要具体情况具体分析。