分子的极性和分子间作用力
- 格式:ppt
- 大小:774.50 KB
- 文档页数:37

分子间的作用力上面已经讨论了三种基本类型的化学键,它们都是分子内部原子间较强的结合力,是决定分子化学性质的主要因素。
在分子与分子之间还存在着较弱的作用力,它是决定物质的沸点、熔点、溶解度等物理性质的重要因素。
为了更好地说明分子间作用力,先谈一下分子极化的问题。
一、分子极化任何分子都有正、负电重心,任何分子又都有变形的性能。
因而在外电场的作用下,分子的电荷重心可发生相对的位移,即分子发生变形,这个过程就叫分子的极化(被极化)。
例如非极性分子,正、负电重心是重合的,但在外电场作用下,正负电重心可被拉开,发生变形并产生偶极(图3-59),这叫诱导偶极(外电场除去,偶极也消除)。
对于极性分子,其本身具有偶极这叫固有偶极,在没有外电场作用时极性分子的固有偶极由于热运动,而杂乱排列。
但在外电场作用下杂乱无章的极性分子可按电场方向定向排列起来,同时由于电场的作用而使偶极加大(固有偶极加诱导偶极)产生一定的变形(图3-60)。
由上可看出,无论非极性分子还是极性分子在外电场作用下都可发生极化作用。
二、分子间力的形成如果将外电场换成极性分子自身所产生的电场,这就与上述情况相似,彼此有相互作用,也就产生了分子间力,下面就分别来分析这方面的情况。
1.取向力当极性分子和极性分子相互接近时,它们的固有偶极的同极相斥而异极相吸,就使得极性分子按一定方向排列(图3-61),因而产生了分子间的作用力,这种力叫取向力。
显然,极性分子的偶极矩越大,取向力越大。
这种力只存在于极性分子与极性分子之间。
2.诱导力当极性分子和非极性分子相接近时,非极性分子在极性分子的固有偶极的作用下,发生极化,而产生诱导偶极,然后诱导偶极与极性分子固有偶极相互吸引(图3——62)。
这种由于诱导偶极而产生的作用力,称为诱导力。
这种力产生于极性分子与非极性分子之间,当然极性分子与极性分子之间也互相诱导,因而也有这种力。
3.色散力非极性分子与非极性分子之间有无作用力?实验指出,N2、O2、H2……等气体,只要充分降温,都可以转变成液态和固态。


影响分子间作用力的因素分子间作用力是指分子之间的相互作用力,包括分子间的吸引力和排斥力。
这些作用力对物质的性质和行为有着重要的影响。
影响分子间作用力的因素有很多,下面将详细介绍。
1. 分子间距离分子间距离是影响分子间作用力的重要因素之一。
当分子间距离较近时,分子间的吸引力会增强,而当分子间距离较远时,分子间的吸引力会减弱。
这是因为分子间作用力是由分子间的电荷分布所产生的,当分子间距离较近时,分子间的电荷分布会更加接近,从而增强分子间的吸引力。
2. 分子间电荷分布分子间电荷分布是影响分子间作用力的另一个重要因素。
分子间作用力是由分子间的电荷分布所产生的,当分子间的电荷分布不同或不对称时,分子间的作用力也会不同。
例如,极性分子之间的作用力比非极性分子之间的作用力强,因为极性分子具有不对称的电荷分布。
3. 分子间极性分子间极性也是影响分子间作用力的因素之一。
极性分子具有不对称的电荷分布,其中一部分分子带有正电荷,另一部分带有负电荷。
这种电荷分布会导致分子间的吸引力增强,从而增加分子间作用力。
4. 分子间氢键氢键是一种特殊的分子间作用力,它是由氢原子与较电负的原子(如氧、氮、氟)之间的相互作用所产生的。
氢键是分子间作用力中最强的一种,它可以影响分子的物理和化学性质。
例如,水分子之间的氢键是导致水的高沸点和高表面张力的主要原因。
5. 温度温度是影响分子间作用力的因素之一。
当温度升高时,分子的热运动会增强,分子间的距离会增大,从而减弱分子间的作用力。
相反,当温度降低时,分子的热运动会减弱,分子间的距离会缩小,从而增强分子间的作用力。
6. 压力压力也是影响分子间作用力的因素之一。
当压力增大时,分子间的距离会减小,分子间的作用力会增强。
相反,当压力减小时,分子间的距离会增大,分子间的作用力会减弱。
7. 溶剂溶剂是影响分子间作用力的因素之一。
溶剂可以影响分子间的距离和电荷分布,从而影响分子间的作用力。
例如,极性溶剂可以增强极性分子之间的作用力,从而增加溶解度。

分子的极性极性与分子间力的关系分子的极性与分子间力的关系分子的极性是指分子中正电荷和负电荷的分布不均匀,导致分子整体呈现正电荷和负电荷的分布情况。
而分子间力是指分子之间相互作用的力量。
分子的极性与分子间力之间存在密切的关系,下面将对这两者之间的关系进行探讨。
一、极性分子与分子间力的关系极性分子是指由于分子内部的化学键以及原子团的不对称性,使得分子整体呈现正负电荷不均匀分布的特性。
这种不均匀的电荷分布导致极性分子之间会存在分子间力作用。
1.氢键氢键是极性分子之间的一种较强的分子间力。
在氢键中,部分氢原子与高电负性的氧、氮或氟原子结合,形成了较强的键能。
这种键能较大的氢键作用使得极性分子之间的吸引力增强,因此在极性分子之间形成了较为稳定的分子间力。
例如,水分子就是一种极性分子,其中的氢原子与氧原子之间形成氢键。
由于水分子之间的氢键作用较强,使得水分子相互吸引,并且在常温下呈现液体状态。
2.静电吸引力极性分子中电荷的不均匀分布导致极性分子之间存在着静电吸引力。
正电荷与负电荷之间的相互吸引力使得极性分子相互吸引,形成分子间力。
例如,氯化钠(NaCl)是一种离子化合物,其中的钠离子和氯离子之间通过静电力相互吸引,形成离子晶体。
这种分子间力使得氯化钠具有较高的熔点和沸点。
二、非极性分子与分子间力的关系与极性分子不同,非极性分子的电荷分布相对均匀,导致分子间存在较弱的分子间力。
1.范德华力范德华力是非极性分子之间的一种相互作用力。
它是由于分子内部的电子在不同位置的瞬时分布而引起的,是一种短程力。
这种力是瞬时诱导出来的,对分子间力的贡献较小。
例如,氧气(O2)是一种非极性分子,其中的氧原子与氧原子之间通过范德华力相互吸引。
由于氧气分子的范德华力较弱,因此氧气具有较低的沸点和熔点。
2.分散力非极性分子之间也存在着一种称为分散力的分子间力。
分散力是非极性分子中不均匀的电子云分布导致的相互作用力。
例如,苯(C6H6)是一种非极性分子,其中的碳原子与碳原子之间通过分散力相互吸引。

《分子间作用力影响因素》嘿,咱今天就来唠唠分子间作用力这事儿。
这分子间作用力啊,听上去挺玄乎,其实就在咱身边呢。
先说说分子大小吧。
这就好比两个人,个头大的家伙一般力气也大点儿。
分子也一样,个头大的分子,它们之间的作用力往往也会强一些。
为啥呢?你想啊,大分子有更多的地方可以和别的分子勾勾搭搭,相互拉扯的力量自然就大啦。
就像两个大胖子挤在一起,那感觉肯定比两个小瘦子挤在一起更有“压迫感”。
再讲讲分子的形状。
有的分子长得怪模怪样,有的分子就规规矩矩。
这形状可重要啦。
要是分子长得歪七扭八的,和别的分子接触的地方就不一样,作用力也就跟着变了。
比如说,一个长得像章鱼的分子和一个长得像球的分子,它们之间的作用力肯定和两个圆球形状的分子之间的作用力不一样。
章鱼形状的分子可以伸出好多“触手”去抓住别的分子,那力量可就复杂多啦。
还有分子的极性也很关键。
啥是极性呢?就像人有脾气好坏一样,分子也有极性大小。
极性大的分子,就像脾气火爆的人,容易和别的分子起反应,作用力也强。
极性小的分子呢,就比较“温和”,和别的分子的作用力也就相对弱一些。
比如说水,它就是极性分子,所以水分子之间的作用力就比较大,能把它们紧紧地拉在一起。
而一些油类分子,极性比较小,它们之间的作用力就小,所以油总是浮在水面上。
温度也会影响分子间作用力哦。
天气热的时候,大家都懒洋洋的不想动,分子也一样。
温度高了,分子运动得快,就没那么容易紧紧地靠在一起,作用力就会变小。
就像夏天的时候,大家都想离得远点,凉快凉快。
冬天呢,分子们也会冷得缩成一团,作用力就会变大。
压力也不能忽视。
要是给分子们加点压力,就像把一群人挤在一个小房间里,它们之间的距离就更近了,作用力也就更大了。
比如说,在深海里,水压很大,分子间的作用力就比在海平面上的时候大得多。
总之啊,分子间作用力的影响因素还挺多呢。
分子大小、形状、极性、温度和压力都能让分子间的作用力发生变化。
咱了解了这些,就能更好地理解很多现象啦。

分子间作用力的种类
分子间作用力实际上是一种电性的吸引力,从这个意义上讲,分子间作用力可以分为以下三种力:
(1)取向力:发生在极性分子与极性分子之间。
由于极性分子的电性分布不均匀,一端带正电,一端带负电,形成偶极。
因此,当两个极性分子相互接近时,由于它们偶极的同极相斥,异极相吸,二个分子必将发生相对转动。
这种偶极子的相互转动,就使偶极子的相反的极相对,叫做“取向”。
这种由于极性分子的取向而产生的分子间的作用力,叫做取向力。
(2)诱导力:发生在极性分子与非极性分子之间以及极性分子之间。
在极性分子和非极性分子间,由于极性分子的影响,会使非极性分子的电子云与原子核发生相对位移,产生诱导偶极,与原极性分子的固有偶极相互吸引,这种诱导偶极间产生的作用力叫诱导力。
同样地极性分子间既具有取向力,又具有诱导力。
(3)色散力:当非极性分子相互接近时,由于每个分子的电子不断运动和原子核的不断振动,经常发生电子云和原子核之间的瞬时相对位移,产生瞬时偶极。
而这种瞬时偶极又会诱导邻近分子也产生和它相吸引的瞬时偶极。
由于瞬时偶极间的不断重复作用,使得分子间始终存在着引力,因其计算公式与光色散公式相似而称为色散力。

化学键的极性与分子间相互作用力分子是由原子通过化学键连接而成的,而化学键的性质决定了分子的物理和化学性质。
在分子中,化学键的极性和分子间的相互作用力起着重要的作用,对于分子的化学性质、物理性质和相变等都有很大影响。
化学键的极性是指在共价键中电子的共享程度不均匀,导致相对正电荷和相对负电荷在分子内部分布不对称的现象。
根据化学键的极性,可以把分子分为两种类型:极性分子和非极性分子。
极性分子是指具有永久电偶极矩的分子,其中正电荷和负电荷在分子中心没有完全重叠,从而产生电荷分离。
这种电荷分离导致了分子间的吸引力,并使极性分子在物理和化学性质上与非极性分子有所不同。
极性分子在溶解性、沸点、熔点、表面张力等方面表现出很强的极性效应。
在极性分子中,极性键的极性强度也会对分子间的相互作用力产生影响。
根据电负性差异的大小,可以将极性键分为纯共价键、极性共价键和离子键。
纯共价键是指两个原子中的电子完全相等地共享,如氢气(H2)中的两个氢原子通过共价键连接。
由于电子分布对称,纯共价键没有极性,因此纯共价键所形成的分子是非极性分子。
极性共价键是指化学键中原子的电负性存在一定差异,导致电子不均匀地分布在两个原子之间。
如在氯化氢(HCl)分子中,氢原子的电负性较小,电子往氯原子偏移,形成极性共价键。
这种极性共价键使HCl分子成为极性分子,产生较强的分子间相互作用力。
离子键是由电子从一个原子完全转移到另一个原子,形成具有正电荷和负电荷的离子阵列。
正负离子之间的静电吸引作用形成离子键。
例如,在氯化钠(NaCl)中,钠离子失去一个电子而氯离子获得一个电子,通过离子键连接。
离子键是一种强有力的相互作用力,使离子晶体具有高沸点、高熔点和脆性等性质。
分子间的相互作用力也被称为非共价键(弱化学键),与极性共价键和离子键相比,非共价键的作用力较弱。
然而,在分子间存在的大量非共价键相互积累时,它们的累积效应会导致较强的分子间相互作用力。
常见的非共价键包括静电作用力、取代力、诱导力和范德华力。

分子间作用力的类型
分子间作用力的类型包括以下几种:
1. 范德华力:是分子之间产生的短程力,可以被看作是由于分子极化或诱导极化引起的电荷分布不均而产生的吸引力。
范德华力较弱,只在非常接近的分子之间起作用。
2. 氢键:是一种特殊的范德华力,通常发生在氢原子与高电负性原子(如氧、氮和氟)之间。
氢键的形成使得分子之间的结合更强,常见于水分子之间以及含有氢键的有机分子中。
3. 极性相互作用:是极性分子之间的相互作用力。
极性分子由于电荷分布的不均匀而具有正负电荷区域,这些电荷区域之间会发生吸引作用。
极性相互作用比范德华力强,但仍比化学键弱。
4. 离子键:是由于正负离子之间的电荷相互作用而形成的化学键。
离子键较强,通常发生在金属和非金属之间,形成离子化合物。
5. 高分子间作用力:高分子间的作用力主要有两种类型,一种是由于范德华力、极性相互作用和氢键等非共价键作用力导致的物理交联;另一种是由于共价键的形成产生的化学交联,如交联聚合物。
这些作用力可以使高分子在溶液或固体中形成稳定的结构。
需要注意的是,这些作用力通常是同时存在的,不同类型的作用力在不同的情况下可能有不同的相对重要性。


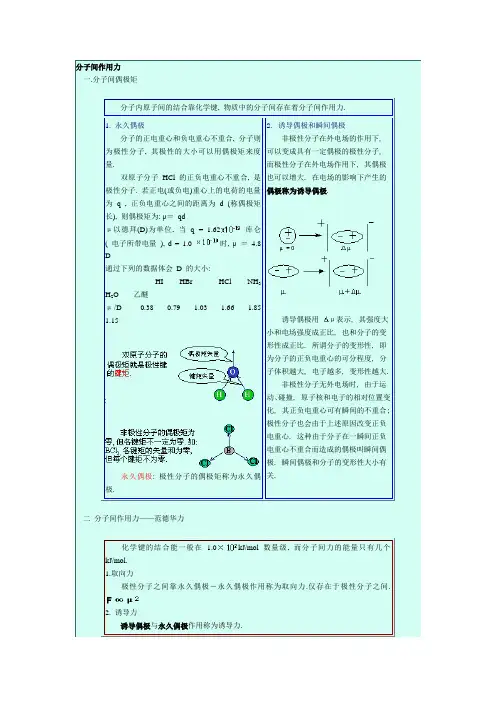
分子间的作用力上面已经讨论了三种基本类型的化学键,它们都是分子内部原子间较强的结合力,是决定分子化学性质的主要因素。
在分子与分子之间还存在着较弱的作用力,它是决定物质的沸点、熔点、溶解度等物理性质的重要因素。
为了更好地说明分子间作用力,先谈一下分子极化的问题。
一、分子极化任何分子都有正、负电重心,任何分子又都有变形的性能。
因而在外电场的作用下,分子的电荷重心可发生相对的位移,即分子发生变形,这个过程就叫分子的极化(被极化)。
例如非极性分子,正、负电重心是重合的,但在外电场作用下,正负电重心可被拉开,发生变形并产生偶极(图3-59),这叫诱导偶极(外电场除去,偶极也消除)。
对于极性分子,其本身具有偶极这叫固有偶极,在没有外电场作用时极性分子的固有偶极由于热运动,而杂乱排列。
但在外电场作用下杂乱无章的极性分子可按电场方向定向排列起来,同时由于电场的作用而使偶极加大(固有偶极加诱导偶极)产生一定的变形(图3-60)。
由上可看出,无论非极性分子还是极性分子在外电场作用下都可发生极化作用。
二、分子间力的形成如果将外电场换成极性分子自身所产生的电场,这就与上述情况相似,彼此有相互作用,也就产生了分子间力,下面就分别来分析这方面的情况。
1.取向力当极性分子和极性分子相互接近时,它们的固有偶极的同极相斥而异极相吸,就使得极性分子按一定方向排列(图3-61),因而产生了分子间的作用力,这种力叫取向力。
显然,极性分子的偶极矩越大,取向力越大。
这种力只存在于极性分子与极性分子之间。
2.诱导力当极性分子和非极性分子相接近时,非极性分子在极性分子的固有偶极的作用下,发生极化,而产生诱导偶极,然后诱导偶极与极性分子固有偶极相互吸引(图3——62)。
这种由于诱导偶极而产生的作用力,称为诱导力。
这种力产生于极性分子与非极性分子之间,当然极性分子与极性分子之间也互相诱导,因而也有这种力。
3.色散力非极性分子与非极性分子之间有无作用力?实验指出,N2、O2、H2……等气体,只要充分降温,都可以转变成液态和固态。
分子的极性与分子间力在化学中,分子的极性是指分子中正电荷和负电荷的离散程度。
分子的极性与分子间力之间存在着密不可分的关系。
本文将探讨分子的极性对分子间力的影响,并进一步分析分子间力的种类和性质。
一、分子的极性分子的极性是由分子内部化学键的极性所决定的。
根据分子中不同原子的电负性差异,可以将分子分为极性分子和非极性分子两种。
1. 极性分子极性分子中的原子具有明确的正负电性,且分子整体呈现出正负电荷的分布差异。
例如,水分子(H2O)中的氧原子对电子的亲和力更强,因而呈现出部分负电荷;而氢原子对电子的亲和力较弱,相对呈现出部分正电荷。
这种分子的极性导致水分子之间的吸引相对较强。
2. 非极性分子非极性分子中的化学键相对电性相等或相近,导致没有明确的正负电荷分布。
例如,二氧化碳(CO2)中的碳氧键是非极性的,因此CO2分子整体上是非极性的。
在非极性分子中,由于没有明显的电荷差异,分子之间的吸引力较弱。
二、分子间力分子间力是指分子之间的相互作用力,决定了物质的性质和相互作用方式。
分子间力可以分为三种主要类型:静电力、偶极-偶极相互作用力和范德华力。
1. 静电力静电力是由分子中的正负电荷相互作用而产生的力。
在极性分子中,由于正负电荷之间的吸引作用,静电力比较明显。
例如,水中的氧原子带负电荷,氢原子带正电荷,因此水分子之间的静电力较强。
2. 偶极-偶极相互作用力偶极-偶极相互作用力是指极性分子之间的力。
这种相互作用是由于分子的极性导致正负电荷之间的相互吸引。
具有较大极性的分子会显示出较强的偶极-偶极相互作用,例如氯化氢(HCl)分子。
3. 范德华力范德华力是非极性分子之间的相互作用力。
这种力是由于分子中的临时极化而产生的。
即使非极性分子本身没有明确的正负电荷,但在某些情况下,分子中的电子分布可以产生暂时的电荷差异,从而引发范德华力。
丙烷(C3H8)就是一个例子,它是由非极性分子组成的,并且分子之间的吸引是由范德华力主导的。
分子间作用力和氢键我们已讨论了三类化学键(离子键、共价键、金属键),它们都是分子内部原子间的作用力。
原子通过这些化学键组合成各种分子和晶体。
除此之外,分子与分子之间还存在着一种较弱的相互作用,大约只有几个到几十个KJ·mol-1,比化学键小一、二个数量级,这种分子间的作用力称为范德华尔力。
它是决定物质熔点、沸点、溶解度等物理化学性质的一个重要因素。
【分子的极性】分子极性的强弱,可以用偶极矩(μ)表示。
分子偶极矩定义为:偶极长(极性分子正负电荷之重心间的距离d与偶极电荷q的乘积,即:μ=q ×d◆分子的偶极矩是个矢量,正偶极子指向负偶极子。
对双原子分子而言,分子偶极矩等于键的偶极矩;对多原子分子而言,分子偶极矩则等于各个键的偶极矩的矢量和。
◆多原子分子的极性不但取决于键的极性,而且取决于分子的几何形状,例如:SO2、CO2中S=O键、C=O都是极性键,但因为CO2是直线型结构,键的极性相互抵消,正负电荷重心重叠,所以,CO2是非极性分子。
相反,SO2为V 型结构,正负电荷重心不能重合,因而SO2是极性分子。
◆具有对称结构(直线型、平面三角形、正四面体)的多原子分子,偶极矩为零,为非极性分子;结构不对称(V型、四面体、三角锥型)的多原子分子,偶极矩不为零,为极性分子◆单质分子的偶极距不一定为0,如O3◆键的偶极长不是核间距,HF、HCl、HBr、HI的偶极长降低(两原子电负性差值越大,键的偶极长越大)◆CO分子中,C原子有一个空的2p z轨道,接受了O原子的一对电子,从而使分子的负电重心移向了C原子因为一个电子所带电量为4.8×10-10静电单位,而偶极长d相当于原子间距离,其数量级为10-8 cm。
通常把10-18厘米·静电单位作为偶极矩μ的单位,称为“德拜”(Debye)用D表示。
偶极矩是一个矢量,可以通过实验测得。
偶极矩越大,分子极性越大,偶极矩μ=0,它是非极性分子。