判断极性分子(向量)
- 格式:ppt
- 大小:14.53 MB
- 文档页数:33

分子极性巧判断有关“分子的极性”的判断,大多数同学们感觉到内容较为抽象,比较难理解,在判断时也常常出现错误。
对于共价型分子如何判断分子的极性,作者提出一些方法,供参考。
1、单原子分子:单原子分子一般指由稀有气体元素原子构成的分子,都为非极性分子,如He、Ne、Ar等。
2、双原子分子;双原子分子可以从单质和化合物两个方面去考虑。
(1)单质:由于形成的化学键为非极性键,故形成的分子为非极性分子。
(2)化合物:对于化合物的极性,我们可以从四个方面去分析。
①从分子中的化学键的种类去判断如果分子中的化学键全部为非极性键,则该分子为非极性分子;若分子是以以极性键结合而形成的分子,那么既可能是极性分子,又可能是非极性分子,这时就必须看分子空间构型。
分子的空间构型均匀对称的是非极性分子,如AB2型的直线形分子CO2,AB3型的平面正三角锥形分子BF3,AB4型的正四面体结构分子CH4等;分子的空间构型不对称的多原子分子为极性分子,如V型的H2O,三角锥型的NH3,不规则四面体分子CH3Cl等。
②从分子中中心原子所形成共价键的数目去判断凡是多原子的共价分子中中心原子最外层电子全部成键,且连接相同的原子或原子团,则在中学阶段该分子一定是非极性分子。
否则为非极性分子。
③从分子中中心元素的化合价去判断若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子;若不等,则为极性分子。
如BF3、CO2等为非极性分子,NH3、H2O、SO2等为极性分子。
④从分子在某溶剂中的溶解性去判断极性分子易溶于极性分子溶剂中(如HCl易溶于水中),非极性分子易溶于非极性分子溶剂中(如碘易溶于苯中,白磷易溶于CS2中)。
【典例】下列各组物质中,都是由极性键构成的极性分子的一组是()A、CH4和Br2B、NH3和H2OC、H2S和CCl4D、CO2和HCl【解析】Br—Br为非极性键;CH4、CCl4、CO2虽然由极性键形成,但它们为对称结构,C的化合价的数值与C原子的最外层电子数相同,为非极性分子;NH3、H2O由极性键形成,H2O 空间构型为“V”型,NH3的空间构型为三角锥型,结构不对称,N、O的化合价的数值与最外层电子数不相等,故为极性键形成的极性分子,选B。

一、分子极性的判断规律分子的极性由共价键的极性及分子的空间构型两方面共同决定。
1.以极性键结合而成的异核双原子分子都是极性分子,如HCl。
2.以非极性键结合而成的同核双原子分子都是非极性分子,如Cl2。
还有某些同核多原子分子也是非极性分子,如P4。
3.以极性键结合而成的多原子分子,既有极性分子,又有非极性分子。
分子的空间构型均匀对称的是非极性分子,如:AB2型的直线型分子CO2;AB3型的平面正三角形分子BF3;AB4型的正四面体结构分子CH4等。
分子的空间构型不对称或中心原子具有孤对电子或配位原子不完全相同的多原子分子为极性分子,如V型的H2O、三角锥型的NH3、不规则四面体分子CH3Cl等。
4.判断ABn型分子极性有一经验规律:若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子;若不等,则为极性分子。
如BF3、CO2等为非极性分子,NH3、H2O、SO2等为极性分子。
二、键的极性与分子的极性键的极性与分子的极性是两个不同的概念,极性键与极性分子间既有联系又有区别。
极性分子一定含有极性键,即极性键是形成极性分子的必要条件,也可能含有非极性键。
含有极性键的分子不一定是极性分子,即极性分子内不仅含极性键,而且分子结构不对称。
若分子中的键全部是非极性的,这样的分子一般是非极性分子。
常见类型有以下几种:1.含有极性键的非极性分子,如CO2、CS2、CH4等。
2.含有非极性键的非极性分子,如H2、Cl2、N2、O2等。
3.既含极性键又含非极性键的极性分子,如H—O—O—H等。
4.既含极性键又含非极性键的非极性分子,如H—C≡C—H等。
一般从溶解性从结构可以第一次判断,有暴露的羟基,暴露的羧基,暴露的氨基的物质极性可能很大然后溶解性实验,溶剂的极性一般与物质极性一致点板,看点的扩散,如果点很凝聚,那么该物质极性可能比溶剂高,随溶剂扩散那么极性可能低一些最后用展开剂试楼主将有机化学和药物化学这两本书学好就可以啦,基本原理和理论都在厘面(1)分子母核相同的成分,分子中功能基的极性越大,或极性功能基数量越多,则整个分子的极性大,亲水性强,亲脂性弱。
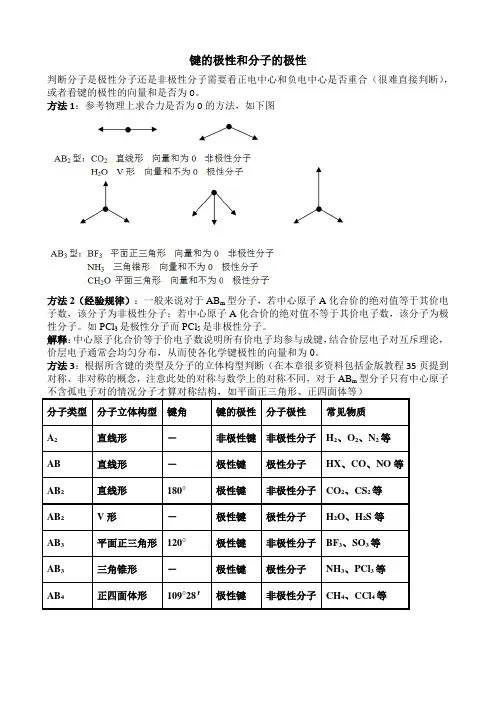
键的极性和分子的极性判断分子是极性分子还是非极性分子需要看正电中心和负电中心是否重合(很难直接判断),或者看键的极性的向量和是否为0。
方法1:参考物理上求合力是否为0的方法,如下图方法2(经验规律):一般来说对于AB m型分子,若中心原子A化合价的绝对值等于其价电子数,该分子为非极性分子;若中心原子A化合价的绝对值不等于其价电子数,该分子为极性分子。
如PCl3是极性分子而PCl5是非极性分子。
解释:中心原子化合价等于价电子数说明所有价电子均参与成键,结合价层电子对互斥理论,价层电子通常会均匀分布,从而使各化学键极性的向量和为0。
方法3:根据所含键的类型及分子的立体构型判断(在本章很多资料包括金版教程35页提到对称、非对称的概念,注意此处的对称与数学上的对称不同,对于AB m型分子只有中心原子化学键类型和物质类别的关系:1.不含有化学键的物质:稀有气体分子。
2.只含非极性键的物质:同种非金属元素构成的单质。
H2、P4、金刚石等3.只含极性键的物质:一般是不同非金属元素构成的共价化合物。
HCl、NH3等4.含非极性键和极性键的物质:H2O2、C2H2、CH3CH3、C6H6等5.只含离子键的物质:活泼金属与活泼非金属元素形成的化合物。
MgCl2、K2O等6.含离子键和非极性键的物质:Na2O2、CaC2等7.含离子键和极性键的物质:NaOH等8.含离子键、极性键和非极性键的物质:CH3COONa等9.只含金属键的物质:金属和合金(第三章内容)10.含金属键和共价键的物质:石墨(第三章内容)分子极性与键的极性的关系:1.只含非极性键的物质一定是非极性分子(除O3外的单质分子。
O3分子是V形结构,存在一个大π键,从而导致整个分子正电中心与负电中心不重合。
有时候题中会考查O3的分子构型,可根据O3与SO2互为等电子体判断)。
2. AB型的双原子分子只含一个极性键,一定是极性分子。
3.只含极性键的AB m型分子可能是极性分子(如H2O、NH3等),也可能是非极性分子(如CO2、BF3、CCl4等)。


分子极性如何判断?四步就能搞定,高一必看!化学键学习过程中我们会遇到一个概念,就是化学键的极性,如何判断化学键的极性以及分子的极性也是高种化学考察的一个重要知识点,今天就给同学们汇总一下这方面的知识,高一正在学习或者刚刚学过这部分的同学们一定要仔细看哦~不理解的可以在文末留言,会给大家详细解答~分子极性判断方法QINGMINGSTEP1、共价键的极性判断化学键有无极性,是相对于共价键而言的。
从本质上讲,共价键有无极性取决于共用电子对是否发生偏移,有电子对偏移的共价键即为极性键,无电子对偏移的共价键即为非极性键。
从形式上讲,一般来说,由同种元素的原子形成的共价键即为非极性键,由不同种元素的原子形成的共价键即为极性键。
在学习共价键的极性判断时,一定要走出这样一种误区“由同种元素的原子形成的共价键一定为非极性键”。
对于化合物来说,象H3C-CH3中的“C-C”键、CH2=CH2中的“C=C”键、Na2O2中的“O-O”键等具有结构对称的分子中同种元素原子间形成的共价键的确是非极性键。
但象CH3CH2OH、CH3COOH等结构不对称的分子中的“C-C”键却不是非极性键,而是极性键。
对于单质来说,象在H2、O2、N2、P4、C60、金刚石、石墨等共价单质中的共价键的确是非极性键。
但在O3分子中的“O-O”键却不是非极性键,而是极性键。
这是因为O3分子结构呈“V”型(或角型),键长为127.8pm(该键长正好位于氧原子单键键长148 pm与双键键长112 pm之间),与SO2结构相似,可模仿SO2把O3称作“二氧化氧”,所以O3分子中的“O-O”键是极性键,其分子是极性分子。
二、分子的极性判断分子是否存在极性,不能简单的只看分子中的共价键是否有极性,而要看整个分子中的电荷分布是否均匀、对称。
根据组成分子的原子种类和数目的多少,可将分子分为单原子分子、双原子分子和多原子分子,各类分子极性判断依据是:1、单原子分子:分子中不存在化学键,故无极性分子或非极性分子之说,如He、Ne等稀有气体分子。

精心整理分子极性及其判断规律一、分类:按照分子的极性,可把分子分为两类。
1.非极性分子:正负电荷重心重合,分子对外不显示电负性的分子。
例如:H O、、22、NH3示。
下:键的极性与分子的极性1.共价键的极性(1)共价键的种类及存在同种元素的原子形成共价键时,它们吸引电子对的能力相同,共用电子对处在正中间,不偏向任何一个原子,由于电荷在两个原子核附近均匀分布,因此成键的分子不显电性。
这样的共价键叫非极性键。
非极性键可以存在于单质之中,如H中的H—H键、P4中的P—P键;也可以存在于共2价化合物之中,如22O H 中的O —O 键;还可以存在于离子化合物之中,如22O Na 中的O —O 键。
不同种元素的原子形成共价键时,由于它们吸引电子对的能力不同,共用电子对必然偏向吸引电子能力强的原子一方,因而吸引电子能力强的原子一方相对地显负电性,吸引电子能力弱的原子一方相对地显正电性。
这样的共价键叫极性共价键,简称极性键。
极性键既可以存在于共价化合物之中,如HCl 、O H 2,也可以存在于离子化合物之中,如NaOH 中的O —H 键、42SO K 中的S —O 键。
(2)共价键极性的判断2.((BF 3H 2O 、H 2S3.(((((5)非极性分子中也可能含有极性键,如CH 4中的C —H 键。
(4)H 2S 为平面形,夹角为92°。
(5)CH CCl SiH 444()、为正四面体形,夹角为109°28'。
(6)CH Cl CH Cl CHCl 3223()、为四面体形,夹角不确定。
(7)C H为直线形,夹角为180°。
22为平面形,夹角为120°。
(8)C H24(9)C H为平面形,夹角为60°。
66(10)P为正四面体形,夹角为109°28'。
4⑦P4NH4非极性分子。
如CO CH BF、、等。
若A原子的最外层电子没有全部参与成键,这种243分子一般为极性分子。

高中化学分子的极性与非极性解析极性分子和非极性分子:(1)极性分子:正电荷中心和负电荷中心不相重合的分子(2)非极性分子:正电荷中心和负电荷中心相重合的分子(3)分子极性的判断:分子的极性由共价键的极性及分子的空间构型两个方面共同决定非极性分子和极性分子的比较:举例说明:分子极性的判断方法:An型分子(以非极性键结合形成的单质分子)一般是非极性分子(O3例外),AB型分子一定是极性分子。
对于ABn型分子是极性分子还是非极性分子,通常有以下判断方法。
1.根据分子的立体构型判断判断ABn型分子是否有极性,关键是看分子的立体构型.如果分子的立体构型为直线形、平面三角形、正四面体形、三角双锥形、正八面体形等空间对称的结构,致使正电中心与负电中心重合,这样的分子就是非极性分子。
若为V形、三角锥形、四面体形(非正四面体形)等非对称结构,则为极性分子。
比如H2O分子中虽然2个H原子轴对称,但整个分子的空间构型是不对称的:,负电中心在a点,正电中心在b 点,二者不重合,因此是极性分子。
2.根据实验现象判断将液体放入适宜的滴定管中,打开活塞让其缓慢流下,将用毛皮摩擦过的橡胶棒靠近液流,流动方向变化(发生偏移)的是极性分子.流动方向不变的是非极性分子。
3.根据中心原子最外层电子是否全部成键判断ABn型分子中的中心原子A的最外层电子若全部成键(没有孤电子对),此分子一般为非极性分子,如CO2、CCl4等;分子中的中心原子最外层电子若未全部成键(有孤电子对),此分子一般为极性分子,如H2O、PCl3等。
4.判断ABn型分子极性的经验规律若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子;若不等,则为极性分子。
如BF3、CO2、CH4、SO3等分子中,B、C、S等元素的化合价的绝对值等于其主族序数,是非极性分子;H2O、NH3、SO2、PCl3等分子中,O、N、S、P等元素的化合价的绝对值不等于其主族序数,是极性分子。

高一化学教案:分子极性及其判断规律【】鉴于大家对查字典化学网十分关注,小编在此为大家搜集整理了此文高一化学教案:分子极性及其判断规律,供大家参考!本文题目:高一化学教案:分子极性及其判断规律分子的极性及其判断是中学化学的一个难点,对于这一难点的理解,同学们可以从以下三个方面着手。
一. 分类按照分子的极性,可把分子分为两类:1. 非极性分子:电荷在分子中的分布对称。
如等。
2. 极性分子:电荷在分子中的分布不对称。
如等。
二. 掌握常见分子的极性及其空间构型常见分子的极性及其空间构型如下表所示:类型实例键的极性分子的极性空间构型X2H2、O2、N2非极性键非极性分子直线形XYHCl、NO极性键极性分子直线形XY2(X2Y)CO2、CS2极性键非极性分子直线形H2O极性键极性分子V形XY3BF3极性键非极性分子平面三角形NH3极性键极性分子三角锥形XY4CH4极性键非极性分子正四面体形三. 分子极性的判断规律1. 双原子单质分子都是非极性分子。
如等。
2. 双原子化合物分子都是极性分子。
如等。
3. 多原子分子的极性要看其空间构型是否对称,对称的是非极性分子,否则是极性分子。
如等是极性分子; 等是非极性分子。
4. 判断型分子的极性还有一个巧妙的方法:价态电子法。
首先确定中心原子A的化合价和A原子的最外层电子数,然后根据两者是否相等进行判断。
如果A的化合价等于A原子的最外层电子数,则该分子为非极性分子;如果A的化合价不等于A原子的最外层电子数,则该分子为极性分子。
另外,从表中还可以看出分子的极性或非极性与键的极性或非极性没有必然联系。
含有极性键的分子不一定是极性分子,含有非极性键的分子不一定是非极性分子。
同学们在进行有关分子极性的判断时,一定要具体情况具体分析。
【总结】2019年已经到来,新的一年查字典化学网也会为您收集更多更好的文章,希望本文高一化学教案:分子极性及其判断规律能给您带来帮助!下面请看更多频道:更多频道:高中频道高中英语学习。


关于分子有无极性问题的探讨作者:王克超来源:《中学教学参考·中旬》 2014年第2期江苏泗洪县洪翔中学(223900)王克超一直以来,关于分子有无极性的问题都是我们高中化学课堂教学的重难点内容。
很多高中生在对分子有无极性进行判断的时候无法准确把握,造成这种情况的主要原因是学生普遍缺乏抽象思维能力以及空间想象能力。
很多高中生面对该问题的时候往往采用非常笨拙的方法:对某些分子有无极性进行死记硬背。
这样就造成面对某些复杂问题的时候不能举一反三,更不能融会贯通。
本文主要分析和总结了中学化学教学中判断分子有无极性的三种方法,并分别指出这三种方法存在的优缺点以及判断分子有无极性时方法的选择。
一、“力的合成”分析法在人教版高中化学选修部分的《物质结构与性质》中对分子有无极性进行了这样的论述:当分子中的各个键的极性的向量的总和为零的时候,那么我们就可以判断这个分子是非极性分子。
反之,我们则可以判断其为极性分子。
根据这句话我们就可以引导学生用共价键的极性向量总和,即其合力是不是为零对分子有无极性进行判断。
这种判断方法比较易于操作和执行。
但是,在具体判断的时候会涉及分子的空间构型,这一点是非常关键的。
诸如高中生日常接触的分子,对于这些分子的空间构型学生很容易记住,对于这些分子是否有极性也很容易判断,比如CS2、H2S、C2H4等。
而对于平时很少接触的分子,学生对它们的空间构型就不够了解了,因此也很难判断这些分子是否有极性,比如SO3、H2O2等。
尤其当学生面对一些空间构型较为复杂的分子的时候,他们则更难判断和计算。
所以说,我们运用分子的极性键的向量和来判断该分子是否有极性,既有其优点,也存在一定的局限性。
不过这种判断方法是从学生原有的认知结构出发,有利于培养学生利用原有的知识储备来解决化学实际问题的意识。
二、“重心”分析法除了上述论述之外,在苏教版高中化学选修教材的《物质结构与性质》当中亦有相关的论述:假如分子的负电荷重心与分子的正电荷重心可以重合的话,那么我们可以判断该分子为非极性分子;假如分子的负电荷重心与分子的正电荷重心不能重合的话,我们则可以判断该分子为极性分子。

浅谈共价键的极性和分子的极性判断1. 引言1.1 共价键的定义共价键是化学键的一种,是由两个原子间共享电子形成的。
在共价键中,原子之间会通过共享电子使得每个原子在形成分子时都能够达到最稳定的电子结构。
共价键的形成通常涉及非金属原子之间的电子互相共享,这样的共价键也被称为键。
在共价键形成的过程中,原子通过共享电子来实现各自电子壳层的填充,从而降低能量,形成稳定的分子。
共价键的强度通常很大,能够使得原子在形成分子后保持在一个相对稳定的结构中。
共价键的形成有助于维持原子之间的稳定结合,同时也会影响分子的排列和性质。
共价键在化学反应中起着至关重要的作用,可以决定分子的稳定性和反应性。
共价键的定义可以简单概括为两个原子之间共享电子形成的化学键。
共价键的特点是稳定性高、强度大,能够保持原子在分子中的相对位置和结构。
1.2 极性共价键和非极性共价键的区别极性共价键是指由不同原子间电负性不同而形成的共价键。
在极性共价键中,电子密度不均匀分布在两个原子之间,导致极性共价键中的电子被吸引到电负性较大的原子周围。
这使得极性共价键产生了部分正负电荷分离的现象,使得其中的原子带有一定的电荷。
极性共价键与非极性共价键的区别在于电子密度的不均匀分布和电荷分离现象。
极性共价键在分子中会导致分子整体带有偶极矩,而非极性共价键则不会。
这两种类型的共价键在分子的性质和反应中起着重要作用,需要在分子结构和性质研究中加以区分和分析。
2. 正文2.1 极性分子的定义极性分子是指在分子内部由于原子间的电负性差异导致的电荷分布不均匀的分子。
在极性分子中,由于原子间存在极性共价键或离子键,分子整体上具有正负电荷分布不均匀的特点。
这种电荷分布不均匀导致极性分子具有一定的电偶极矩,即分子内部存在一个由正负电荷分布所形成的电偶极矩向量。
原子内部的电负性差异是导致分子极性的主要因素。
当分子中的原子具有不同的电负性时,它们之间形成的化学键会导致电子云在空间中分布不均匀,进而导致分子整体上呈现出电荷分布不均匀的性质。
判断分子极性的方法分子极性是指一种物质中分子中原子之间的电磁分布模式,是一种物质的重要性质之一。
分子极性决定了其可以参与何种反应,也决定了系统的物理和化学特性。
此外,极性也有助于人们解释科学现象,例如布鲁姆力、汞汞的力、极化现象、溶解度、折射率等等。
因此,研究分子极性的方法和技巧具有重要的意义。
判断分子极性的基本方法有三种,分别是Valence Shell Electron Pair Repulsion(VSEPR)型、Kekule形式和自基质吸收光谱 (SARP)型。
Valence Shell Electron Pair Repulsion(VSEPR)型是根据原子的电子双引子对形状进行计算分子极性的常用方法,它可以用来判断几个原子形成分子时形状的变化,以及判断分子是否是非极性的。
Kekule形式法是根据分子中的碳原子键长和碳原子结合形状来判断一种分子是否极性的方法。
而SARP模型是根据某些分子吸收特定波长的光谱特征来测量分子极性的方法。
除了以上三个基本方法之外,还有一些衍生的方法,这些方法可以用来更精确的判断分子的极性。
比如,Gaussian程序,它可以用来分析分子的电荷分布;NBO程序,可以分析分子中原子间的电子轨道;CASSCF程序,可以用来分析分子中原子间的功能性团。
以上这些方法都可以用来更精确的判断分子的极性,更有助于我们解释科学现象。
另外,我们还可以采用结构式分子的方法,即通过结构式判断分子的极性。
在结构式分子中,由四个原子组成的分子可以分为四类:平面分子、线性分子、非线性分子和其他形状的分子。
在这四类中,线性分子有可能极性;非线性分子可能是非极性;而其他形状的分子则更复杂,需要对分子中原子的位置进行分析以及对分子中原子之间的电子双引子进行分析来判断分子是否极性。
从以上我们可以看出,有多种方法可以用来判断分子的极性,它们的准确度和适用范围也各不相同。
在实际的应用中,我们根据不同的需要来采用不同的方法,以便得到更准确的分子极性结果。
关于极性分子和非极性分子的判断
1、由极性键(不同种原子形成的共价键)构成的双原子分子一定是极性分子。
如:CO、NO、HF、HBr、HI、HCl等。
2、由非极性键(同种原子之间形成的共价键)构成的双原子分子一定是非极性分子。
如:H2、O2、N2、F2、Cl2、Br2、I2等。
3、由极性键构成的多原子(三个或三个以上原子)分子可能是极性分子,也可能是非极性分子。
(1)若属于ABn或BnA型分子,关键是看中心原子(A原子)最外层上的电子是否都提供出来与B原子形成共价键。
如果A原子最外层上的电子都提供出来与B原子形成共价键,则该分子属于非极性分子;如:CO2、CH4、BF3、SO3、CS2、PCl5、CCl4等。
如果A原子最外层上的电子并没有全部提供出来与B原子形成共价键,则该分子属于极性分子;如:H2S、H2O、NH3、PCl3、SO2等。
(2)有些由极性键构成的多原子分子可以根据分子的构型判断。
如:CH3Cl、CH2Cl2、CHCl3为不对称的四面体,因此它们属于极性分子。
4、若不符合上述三种情况,则可以根据相似者相溶的原理(极性分子组成的溶质易溶于极性分子组成的溶剂中,非极性分子组成的溶质易溶于非极性分子组成的溶剂中)判断。
如:H2O2、乙醇、乙酸等易溶于水,而水是极性分子,因此它们也是极性分子;C2H4、C2H2、C6H6、汽油、白磷、稀有气体等不溶于水,因此它们是非极性分子。
高一化学教案:分子极性及其判断规律
高一化学教案:分子极性及其判断规律
【】鉴于大家对查字典化学网十分关注,小编在此为大家搜集整理了此文高一化学教案:分子极性及其判断规律,供大家参考!
本文题目:高一化学教案:分子极性及其判断规律
分子的极性及其判断是中学化学的一个难点,对于这一难点的理解,同学们可以从以下三个方面着手。
一. 分类
按照分子的极性,可把分子分为两类:
1. 非极性分子:电荷在分子中的分布对称。
如等。
2. 极性分子:电荷在分子中的分布不对称。
如等。
二. 掌握常见分子的极性及其空间构型
常见分子的极性及其空间构型如下表所示:
类型实例键的极性分子的极性空间构型
X2H2、O2、N2非极性键非极性分子直线形
XYHCl、NO极性键极性分子直线形
XY2(X2Y)CO2、CS2极性键非极性分子直线形
H2O极性键极性分子V形
XY3BF3极性键非极性分子平面三角形
NH3极性键极性分子三角锥形
XY4CH4极性键非极性分子正四面体形
三. 分子极性的判断规律。
化合物极性判断知识小汇总极性是指整个分子电荷分离的程度,分离程度越大,极性越大。
所以通常含有N、O、卤素等吸电子基团的分子极性会比较大,但需要注意,氯仿极性比二氯甲烷大,因为氯仿多一个吸电子的氯,但四氯化碳极性小于氯仿,因为这是一个对称结构,这有点类似拔河。
化合物的极性决定于分子中所含的官能团及分子结构。
对于基团对物质极性的影响应该跟物质的结构有关,不能简单的说成是上那个基团会使极性增大或减小,应综合分析,一般吸电子基团会使电子云发生偏移,产生极性,但是如果是对称的话,则物质可能为非极性的。
各类化合物的极性俺下列次序增加:—CH3,—CH2—,—CH=,—CH三,—O—R,—S—R,—NO2,—N(R)2,—OCOR,—CHO,—COR,—NH2,—OH,—COOH,—SO3H烷烃极性最小,因为其中的C和H的电负性差不多,电荷分离不明显。
烯烃有双键,极性比烷烃大。
有的书上说双键是吸电子的,所以电荷有分离,我认为这只是从最终效果解释,理论上分析,可能是由于双键与周围的C-H键形成的超共轭效应导致电子偏向双键。
常用溶剂的极性顺序:水(最大) > 甲酰胺> 乙腈> 甲醇> 乙醇> 丙醇> 丙酮> 二氧六环> 四氢呋喃> 甲乙酮> 正丁醇> 乙酸乙酯> 乙醚> 异丙醚> 二氯甲烷>氯仿>溴乙烷>苯>四氯化碳>二硫化碳>环己烷>己烷>煤油(最小)化合物名称极性粘度沸点吸收波长Water(水)10.2 1 100 268Dimethyl sulfoxide(二甲亚砜DMSO) 7.2 2.24 189 268Ethylene glycol(乙二醇) 6.9 19.9 197 210Methanol(甲醇) 6.6 0.6 65 210Dimethyl formamide(二甲基甲酰胺) 6.4 0.92 153 270Aniline(苯胺) 6.3 4.4 184 -Acetic acid(乙酸) 6.2 1.28 118 230 Acetonitrile(乙腈) 6.2 0.37 82 210 Nitromethane(硝基甲烷) 6 0.67 101 330Acetone(丙酮) 5.4 0.32 57 330Pyridine(吡啶) 5.3 0.97 115 305Dioxane( 二恶烷; 二氧六环; 二氧杂环己烷) 4.8 1.54 102 220 Methyl ethyl ketone(甲基乙基酮) 4.5 0.43 80 330 Chloroform(氯仿) 4.4 0.57 61 245Ethyl acetate(乙酸乙酯) 4.3 0.45 77 260i-propanol(异丙醇) 4.3 2.37 82 210Methyl isobutyl ketone(甲基异丁酮) 4.2 - 119 330 Tetrahydrofuran(四氢呋喃) 4.2 0.55 66 220n-butyl acetate(醋酸丁酯;乙酸丁酯) 4 - 126 254n-propanol(丙醇) 4 2.27 98 210n-butanol(正丁醇) 3.7 2.95 117 210Ethylene dichloride(二氯化乙烯) 3.5 0.78 84 228 Methylene chloride(二氯甲烷) 3.4 0.44 240 245 Benzene(苯) 3 0.65 80 280 Isobutyl alcohol(异丁醇) 3 4.7 108 220 Ethyl ether(二乙醚; 醚) 2.9 0.23 35 220 Chlorobenzene(氯苯) 2.7 0.8 132 -o-dichlorobenzene(邻二氯苯) 2.7 1.33 180 295 p-xylene(对二甲苯) 2.5 0.65 138 290 i-propyl ether(丙基醚; 丙醚) 2.4 0.37 68 220 Toluene(甲苯) 2.4 0.59 111 285 Trichlorotrifluoroethane(三氯三氟代乙烷) 1.9 0.71 48 231 Carbon tetrachloride(四氯化碳) 1.6 0.97 77 265 Butyl chloride(丁基氯; 丁酰氯) 1 0.46 78 220 Trichloroethylene(三氯乙烯; 乙炔化三氯) 1 0.57 87 273 Cyclopentane(环戊烷) 0.2 0.47 49 210 n-heptane(庚烷) 0.2 0.41 98 200 Cyclohexane(环己烷) 0.1 1 81 210 Isooctane(异辛烷) 0.1 0.53 99 210 Trifluoroacetic acid(三氟乙酸) 0.1 - 72 - Trimethylpentane(三甲基戊烷) 0.1 0.47 99 215 Hexane(己烷) 0.06 0.33 69 210 Petroleum ether(石油醚) 0.01 0.3 30~60 210 i-pentane(异戊烷) 0 - 30 -n-pentane(正戊烷) 0 0.23 36 210。
分子极性及其判断的规律高一化学教案分子的极性及其判别是中学化学的一个难点,关于这一难点的了解,同窗们可以从以下三个方面着手。
一. 分类依照分子的极性,可把分子分为两类:1. 非极性分子:电荷在分子中的散布对称。
如等。
2. 极性分子:电荷在分子中的散布不对称。
如等。
二. 掌握罕见分子的极性及其空间构型罕见分子的极性及其空间构型如下表所示:类型实例键的极性分子的极性空间构型X2H2、O2、N2非极性键非极性分子直线形XYHCl、NO极性键极性分子直线形XY2(X2Y)CO2、CS2极性键非极性分子直线形H2O极性键极性分子V形XY3BF3极性键非极性分子平面三角形NH3极性键极性分子三角锥形XY4CH4极性键非极性分子正四面体形三. 分子极性的判别规律1. 双原子单质分子都是非极性分子。
如等。
2. 双原子化合物分子都是极性分子。
如等。
3. 多原子分子的极性要看其空间构型能否对称,对称的是非极性分子,否那么是极性分子。
如等是极性分子; 等是非极性分子。
4. 判别型分子的极性还有一个巧妙的方法:价态电子法。
首先确定中心原子A的化合价和A原子的最外层电子数,然后依据两者能否相等停止判别。
假设A的化合价等于A原子的最外层电子数,那么该分子为非极性分子;假设A的化合价不等于A原子的最外层电子数,那么该分子为极性分子。
另外,从表中还可以看出分子的极性或非极性与键的极性或非极性没有肯定联络。
含有极性键的分子不一定是极性分子,含有非极性键的分子不一定是非极性分子。
同窗们在停止有关分子极性的判别时,一定要详细状况详细剖析。