广东省中考化学总复习 专题三 工艺流程练习
- 格式:doc
- 大小:697.00 KB
- 文档页数:11

工艺流程图专项训练(三)1、铝和铝合金是一类重要的金属材料、工业上用铝土矿(含有Al2O3 和SiO2,不考虑其它杂质)制取金属铝的基本流程如下:已知:①SiO2 是一种难溶于水,也不与盐酸、硫酸反应的物质.②铝盐与氨水反应,生成氢氧化铝沉淀和铵盐.请回答下列问题:(1)滤液I 的溶质有(写化学式)。
(2)该流程中涉及到的基本化学反应类型有和分解反应。
(3)写出滤液II 中溶质的一种用途。
2、硫酸钙转化为K2SO4和CaCl2·6H 2O 的工艺流程如图:(1)蒸氨过程中涉及的反应类型(填编号)。
A.复分解反应B.化合反应C.分解反应D.置换反应(2)操作Ⅲ制取CaCl2·6H 2O 晶体,包含一系列操作:蒸发浓缩、、过滤、洗涤、干燥。
(3)可循环利用的物质除了NH3 外,还有(填化学式)。
3、下图为某化工厂用废硫酸制备K2SO4 的流程如下:(1)生产上将CaCO3 研成粉末的目的是。
(2)上述流程中,可循环使用的物质是。
(填写化学式)(3)洗涤反应③所得晶体不用水而用饱和K2SO4 溶液的目的是。
4、海水是一种取之不尽、用之不竭的资源宝库.请围绕科学利用海水资源,填写空格:用海水“晒盐”的方法得到的粗盐中,除氯化钠外,还含有氯化镁、氯化钙、硫酸钠等杂质。
将此粗盐提纯的部分实验方案如下:(1)加入过量氢氧化钠溶液的目的是。
(2)过滤后得到的沉淀成分有:氢氧化镁、碳酸钙、。
(3)请设计实验,能通过清晰可见的现象,准确控制在少量滤液样品中加入稀盐酸,至恰好完全反应:。
5、高纯碳酸钙广泛应用医药、生活生产中。
如图是由工业副产品氯化钙(含有氯化亚铁和氯化镁)制取高纯碳酸钙的工艺流程图。
有关资料:①氯化铵受热会分解;②在室温下,氯化铵的溶解度随氯化钙的质量分数的变化关系如图如示;回答下列问题:(1)工艺流程中操作1 的名称是;(2)向工业氯化钙溶液中加入氧化钙,氧化钙与水发生反应的基本反应类型是,所需氧化钙为粉末状,其目的是。


班级:____________ 姓名:____________专题三 工艺流程类型1 物质制备1.氧化锌软膏可用于急性或亚急性皮炎、湿疹、痱子及轻度、小面积的皮肤溃疡,其有效成分氧化锌(ZnO)是一种白色固体。
一种工业生产药用高纯氧化锌的流程如图:(1)“酸溶”的目的是将锌块转化为可溶于水的__________(填名称)。
(2)由草酸铵推测草酸的化学式为____________。
“沉淀”过程中发生反应的化学方程式为______________________________________________________。
(3)溶液X 结晶所得化肥是该工艺中有价值的副产品,证明它是铵态氮肥的方法是:取少量样品,先放入________(填仪器名称)中,然后再与________(填化学式)混合、研磨,能闻到氨味。
(4)“操作B ”是高温灼烧,该过程除生成氧化锌外,还会生成两种常见的气体氧化物,则草酸锌分解的化学方程式为________________________________________。
2.(2019烟台)我国煤炭资源丰富。
某实验室设计的利用水煤浆(由煤和水混合而成)制备氢气的生产工艺如流程一所示。
【流程一】制备氢气。
(1)气化器中发生的主要反应有:Ⅰ.H 2O +C=====高温 CO +H 2;Ⅱ.CO +H 2O=====高温CO 2+H 2,其中属于置换反应的是______(填“Ⅰ”或“Ⅱ”)。
(2)重整器的作用是________________________________。
重整器中发生反应的化学方程式是__________________________。
(3)该流程中可以循环使用的物质是________________。
【流程二】为充分利用流程一产生的高纯度CO 2,该实验室又设计了如流程二所示的两种工艺分别制备尿素和乙二醇。
(4)在高温、高压下,CO 2和NH 3可以合成尿素[CO(NH 2)2],同时生成水,该反应的化学方程式为____________________________________________________。

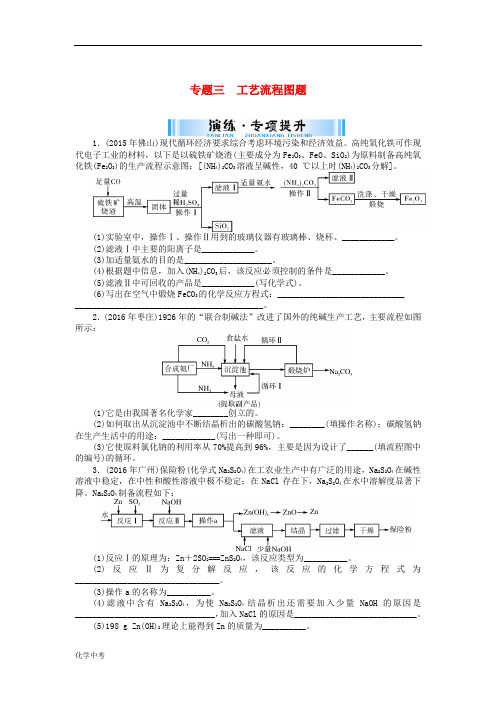
专题三工艺流程图题1.(2015年佛山)现代循环经济要求综合考虑环境污染和经济效益。
高纯氧化铁可作现代电子工业的材料,以下是以硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制备高纯氧化铁(Fe2O3)的生产流程示意图:[(NH4)2CO3溶液呈碱性,40 ℃以上时(NH4)2CO3分解]。
(1)实验室中,操作Ⅰ、操作Ⅱ用到的玻璃仪器有玻璃棒、烧杯、____________。
(2)滤液Ⅰ中主要的阳离子是____________。
(3)加适量氨水的目的是____________________。
(4)根据题中信息,加入(NH4)2CO3后,该反应必须控制的条件是____________。
(5)滤液Ⅱ中可回收的产品是____________(写化学式)。
(6)写出在空气中煅烧FeCO3的化学反应方程式:________________________________________________________________________。
2.(2016年枣庄)1926年的“联合制碱法”改进了国外的纯碱生产工艺,主要流程如图所示:(1)它是由我国著名化学家________创立的。
(2)如何取出从沉淀池中不断结晶析出的碳酸氢钠:________(填操作名称);碳酸氢钠在生产生活中的用途:____________(写出一种即可)。
(3)它使原料氯化钠的利用率从70%提高到96%,主要是因为设计了______(填流程图中的编号)的循环。
3.(2016年广州)保险粉(化学式Na2S2O4)在工农业生产中有广泛的用途,Na2S2O4在碱性溶液中稳定,在中性和酸性溶液中极不稳定;在NaCl存在下,Na2S2O4在水中溶解度显著下降。
Na2S2O4制备流程如下:(1)反应Ⅰ的原理为:Zn+2SO2===ZnS2O4,该反应类型为__________。
(2)反应Ⅱ为复分解反应,该反应的化学方程式为_________________________________。

专题三工艺流程类型1 物质制备1.(南宁)碳酸钡是一种重要的化工产品,某厂用含二氧化硅杂质的碳酸钡原料生产碳酸钡产品,采用了以下的工艺流程:(1)为节约成本,过程中的生成物可直接应用于流程的是________________,加入过量的盐酸的目的是____________________________________。
(2)向氯化钡溶液中加入过量的氢氧化钾并通入二氧化碳,其中一种产物是碳酸钡,写出该反应的化学方程式:____________________________________________。
(3)溶液A中溶质的成分,可能的组合有________________________________。
(4)操作3包括的两个操作是____________________。
2.(南通)实验室以MnO2为原料制备少量高纯MnCO3的流程如下:已知:①反应Ⅰ的化学方程式:MnO2+SO2=== MnSO4;②MnCO3、Mn(OH)2均难溶于水,MnCO3在100 ℃时开始分解。
(1)反应Ⅰ属于基本反应类型中的____________反应。
(2)流程中“操作”的名称为____________,所需要的主要玻璃仪器有_______________________________________________________________________。
(3)反应Ⅱ的化学方程式为_____________________________________________,该反应需控制溶液的酸碱性,若碱性过强,MnCO3粗产品中将混有______________(填化学式)。
(4)验证MnCO3粗产品表面附着有Na2SO4杂质:取样品少许,向其中加入水,搅拌、过滤,向滤液中加入适量的______________(填化学式)溶液,有白色沉淀产生。
(5)为获得高纯MnCO3,需选择“低温”干燥的原因是_______________________________________________________________。
广东省中考化学总复习专题三工艺流程练习工艺流程题一般以“生产工艺”或“实验操作流程”为情境,将化工生产过程中的主要生产阶段以生产流程呈现出来,并根据生产流程中有关的化学知识步步设问,形成与化工生产紧密联系的化工工艺试题。
中考中的工艺流程题主要是物质的制备和除杂。
工艺流程题常考的知识点有:物质成分的分析(推断某物质),化学反应原理(物质的除杂、化学方程式的书写等),操作步骤的名称及操作所需要的仪器等,绿色化学(物质的循环利用、废物处理、能量的充分利用等),工艺流程的评价等。
因此解答化学工艺流程题,除了必须要掌握物质的性质和物质之间相互作用的基本知识及分离、提纯物质的基本技能外,还要学会从题干中获取有用信息,了解生产的产品。
关注流程图中的出线、进线(均表示物料流向或操作流程)、可逆线(表示物质循环使用)和核心化学反应(如下所示)。
1.物质成分的分析(推断流程图中的某种物质等)(1)分析流程中的每一步骤,从几个方面解流程:①反应物是什么;②发生了什么反应;③图中有没有物质没有写上去或是省略了;④该反应造成了什么后果,对制造产品有什么作用。
(2)要判断所加的试剂,可以从加入试剂的目的、反应的产物入手进行分析。
(3)推断流程图中某一步中的物质,从上一步操作中反应物可能发生的反应入手进行分析,同时需注意所加试剂是否有剩余。
2.化学方程式的书写(1)根据流程图书写某步中发生反应的化学方程式:根据所学知识判断其可能发生的反应,然后写出反应物、产物,并进行配平。
(2)陌生化学方程式的书写:根据箭头方向,箭头进入的是投料(即反应物),出去的是生成物(包括主产物和副产物);若从已知信息中找出的反应物和生成物不满足质量守恒定律,可以在反应物或生成物中加上水,然后进行配平,还应注意反应条件的有关信息;若在空气中煅烧或通入空气则还需考虑空气中的氧气是否参与反应。
3.混合物分离、提纯的操作及所需仪器的判断(1)固体和液体混合物的分离:过滤。
其所需的仪器有铁架台、漏斗、烧杯、玻璃棒、滤纸。
(2)从物质的溶液中得到该物质的晶体常用的方法:①蒸发结晶(具体操作见粗盐的提纯)。
②降温结晶,操作过程为蒸发浓缩→冷却结晶→过滤→洗涤→干燥。
4.判断能够回收利用或可循环使用的物质(1)回收利用的物质:若流程图中的原料在生产中以副产物的形式产生,则可将其进行回收利用。
(2)循环使用的物质:步骤中一步的产物是另一步的原料,根据上图中箭头方向(可逆线)即可判断出可循环使用的物质。
5.工艺流程的评价(1)设计方案的科学性:能否达到实验目的,杂质是否完全除去、是否引入新的杂质等。
(2)安全性和简便性:尽量选用较温和的反应条件,避免高温、高压条件。
(3)对环境的影响:是否符合绿色化学理念。
(4)节约性:原料利用率要尽量高。
注:绿色化学又称环境友好化学,它的主要特点是:①充分利用资源和能源,采用无毒、无害的原料;②在无毒、无害的条件下进行反应,以减少废物向环境排放;③提高原子的利用率,力图使所有作为原料的原子都被产品所消纳,实现“零排放”;④生产出有利于环境保护、社区安全和人体健康的环境友好的产品。
类型一物质制备(实验室模拟、工业生产等) (xx、xx、xx、xx考)例1 (xx南通)实验室以MnO2为原料制备少量高纯MnCO3的流程如下:已知:①反应Ⅰ的化学方程式:MnO2+SO2=== MnSO4;②MnCO3、Mn(OH)2均难溶于水,MnCO3在100 ℃时开始分解。
(1)反应Ⅰ属于基本反应类型中的__________反应。
(2)流程中“操作”的名称为__________,所需要的主要玻璃仪器有______________。
(3)反应Ⅱ的化学方程式为_________________________。
反应Ⅱ需控制溶液的酸碱性,若碱性过强,MnCO3粗产品中将混有____________________(填化学式)。
(4)验证MnCO3粗产品表面附着有Na2SO4杂质:取样品少许,向其中加入水,搅拌、过滤,向滤液中加入适量的____________________(填化学式)溶液,有白色沉淀产生。
(5)为获得高纯MnCO3,需选择“低温”干燥的原因是___________________________。
例2 (xx广州)氯化亚铜(CuCl)广泛应用于冶金、电镀、医药等行业。
已知CuCl难溶于水和乙醇,在潮湿空气中易变质。
CuCl的制备流程如下:(1)“滤液1”中除了Na+、SO2-4外,还存在较多的离子是__________(写离子符号)。
(2)“反应”中发生的化学变化是2CuCl2+Na2SO3=== 2CuCl↓+2NaCl+SO3,产生的SO3迅速与水化合生成一种酸,该反应的化学方程式为__________________________。
(3)“操作a”的名称是__________,流程中可以循环利用的物质(水除外)是__________(写化学式)。
(4)可用“水洗”的原因是______________________________,“醇洗”的目的是_________________________________。
(5)160 g CuSO4与足量NaCl经上述制备流程,可生成的CuCl最多是______________________________。
例3 (xx陕西改编)我国每年报废的手机超过1亿部。
废旧手机的电路板中含有铝、铁、铜、银、金等多种金属,化学兴趣小组为回收其中的铜,设计并进行了如下实验:已知:Cu+H2O2+H2SO4=== CuSO4+2H2O;不考虑金、银发生类似反应。
(1)将电路板粉碎成粉末的目的是__________________________。
(2)步骤①所得滤液中的溶质除硫酸外,还有____________________________。
(3)步骤②中的实验现象:固体部分溶解,__________________。
(4)步骤④中反应的化学方程式是_____________________________。
(5)对废旧手机中的金属加以回收的意义是___________________(写一条)。
例4 (xx广东)现有工厂丢弃的废铜屑(铜屑表面呈绿色,其中混有少量生锈铁屑)。
课外活动小组同学欲利用其制取胆矾,他们设计了下面的两种制取流程。
已知:Cu+Fe2(SO4)3=== 2FeSO4+CuSO4。
请回答:(1)铜屑表面呈绿色的物质的化学式是Cu2(OH)2CO3,俗称________;操作①所用到的玻璃仪器有:烧杯、玻璃棒和________。
(2)溶液A的溶质有____________(只写一种);铁锈与稀硫酸反应的化学方程式为_______________________________________。
(3)两种方法比较,符合绿色化学要求的是方法__________;方法Ⅱ的化学反应方程式为:2Cu+2H2SO4+________=== 2CuSO4+________;操作②的实验步骤为:________、降温结晶。
类型二分离提纯 (xx、xx、xx考)例5 (xx德州改编)CO2是造成温室效应的主要气体,而工业上却可用CO2来制备甲醛等物质,“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来并加以利用——如可利用NaOH溶液来“捕捉”CO2,其过程如图所示(部分条件及物质未标出)。
请根据有关信息回答问题:(1)用NaOH溶液“捕捉”CO2的化学方程式是________________________________。
(2)“反应分离”环节中,分离物质所采用的基本操作是__________。
(3)此化学工艺流程中没有涉及到的基本反应类型是________________。
(4)整个过程中,可以循环利用的物质是__________和__________。
例6 (xx兰州改编)粗盐中MgCl2、CaCl2等杂质,提纯粗盐的工艺流程如图所示:回答下列问题:(1)氢氧化钠有强烈的腐蚀性,如果不慎沾到皮肤上,要用大量的水冲洗,再涂上__________。
(2)步骤①中发生反应的化学方程式为________________________________,步骤②加入过量的碳酸钠溶液的作用是________________________。
(3)操作a的名称是__________。
(4)步骤④中,要用玻璃棒不断搅拌,其目的是________________________________。
类型三环保相关 (xx、xx、xx考)例7 (xx广东)某垃圾处理厂对生活垃圾进行处理与综合利用的部分流程如下图:资料1: 垃级焚烧产生的烟气中含有SO2等有害气体。
资料2:FeSO4容易被空气中的O2氧化。
回答下列问题:(1)石灰浆吸收SO2(性质与CO2相似)的化学反应方程式为_______________________。
(2)溶解步骤中同时发生的三个化学反应方程式为:Fe+Fe2(SO4)3=== 3FeSO4、_________________________、__________________________。
(3)将所得FeSO4溶液在氮气环境中蒸发浓缩、__________、过滤,得到FeSO4晶体,其中氮气的作用是___________________________________。
(4)政府倡导垃圾分类,其好处是__________________________(写一点)。
注:领跑化学xx版课时作业P50第10题与该题基本一样。
例8 某烟气脱硫的工艺不仅能消除SO2,还能将其转化为石膏(CaSO4·2H2O)等产品,实现“变废为宝”。
主要物质转化关系如图1所示:图1图2(1)设备1中,通过喷淋水脱去烟气中的SO2,该反应的化学方程式为__________________________,若将烟气直接排放到空气中,可能会导致的环境问题是__________。
(2)设备2中,加入CaCO3的目的是_______________________________。
(3)设备3中反应的化学方程式是_______________________________。
(4)有一工厂为防治SO2的污染,另外设计了一种治污方法,不仅吸收了二氧化硫,同时也得到了硫酸等工业产品,该工艺流程如图2所示。
①Fe2(SO4)3吸收SO2的化学方程式是:Fe2(SO4)3+2__________+SO2=== 2FeSO4+2H2SO4。
②该流程中可循环利用的物质是__________________。
专题三工艺流程例1 (1)化合(2)过滤漏斗、玻璃棒、烧杯(3)MnSO4+2NaHCO3=== Na2SO4+MnCO3↓+CO2↑+H2O Mn(OH)2(4)BaCl2(5)MnCO3的分解温度为100 ℃,为防止MnCO3高温分解,影响高纯MnCO3的纯度例2 (1)Cu2+、Cl-(2)SO3+H2O=== H2SO4(3)过滤NaCl (4)能够除去可溶性杂质可以除去水,防止在后续步骤中CuCl变质(5)99.5【解析】(5)160 g CuSO4中铜元素质量为160 g×64160×100%=64 g,反应过程中硫酸铜的铜元素完全转化到了氯化亚铜中,因此足量NaCl经上述制备流程,可生成的CuCl最多为64 g÷(64×100%)=99.5 g。