优化蛋白相互作用实验(一)
- 格式:pdf
- 大小:349.38 KB
- 文档页数:1

检测蛋白相互作用的方法
检测蛋白相互作用的方法主要有酵母双杂交技术、免疫共沉淀和GST pull-down实验。
1. 酵母双杂交技术:主要用来进行互作蛋白的筛选,缺点就是假阳性较高,所以需要进行结果验证,一般可采用免疫共沉淀或GST-pull down实验进行验证。
2. 免疫共沉淀:是以抗体和抗原之间的专一性作用为基础的用于研究蛋白质相互作用的经典方法。
当细胞在非变性条件下被裂解时,完整细胞内存在的许多蛋白质-蛋白质间的相互作用被保留了下来。
当用预先固化在argarose beads上的蛋白质A的抗体免疫沉淀A蛋白,那么与A蛋白在体内结合的蛋白质B也能一起沉淀下来。
再通过蛋白变性分离,对B蛋白进行Western blot检测,进而证明两者间的相互作用。
3. GST pull-down实验:是一个行之有效的验证酵母双杂交系统的体外试验技术。
其基本原理是先构建靶蛋白-GST融合蛋白载体,然后进行体外表达及纯化。
将得到的靶蛋白-GST(Glutathione-S-transferase谷胱苷肽巯基转移酶)融合蛋白亲和固化在谷胱甘肽亲和树脂上,充当一种“诱饵蛋白”,然后将目的蛋白溶液过柱,可从中捕获与之相互作用的蛋白,将目的蛋白洗脱下来,通过SDS-PAGE电泳及Western blot分析证实两种蛋白间的相互作用。
以上内容仅供参考,建议查阅相关文献获取更专业的信息。

研究蛋白质相互作用的九种方法,写标书用得上寒风凛冽,又到了一年一度写标书的季节,你开始准备了么?在分子机制的研究中,蛋白和蛋白之间的互作研究可以说是非常经典了,研究蛋白互作的方法有很多,今天我们来介绍九种。
1、免疫共沉淀(Co-Immunoprecipitation,CoIP)CoIP其实就是两个蛋白相互的IP(免疫沉淀反应)实验,在已知蛋白B和C之间有相互作用的前提下,这种前提一般需要有一个酵母双杂实验或者Pulldown实验来作为支持。
IP就是用来验证蛋白C和蛋白B之间相互作用的。
如果在Agarose珠上的Protean A/G所结合的抗体,可以结合并拉下蛋白B,那用Western Blot即可检测出蛋白C的表达,反之亦然,通过这种相互间免疫共沉淀的实验,就可以明确地验证出,B与C之间的相互作用了。
比如这份标书:PYK2促进肝癌细胞迁移的一个新的分子机制研究:结合并磷酸化E-cadherin?(百度检索题目可查到全文)2、Pull-down实验这个实验跟免疫共沉淀实验很像,不同的是免疫共沉淀是在细胞里进行的,在众多的蛋白里,拉住A蛋白的同时,把B蛋白也给拉出来了,这还不能证明是直接的结合,很有可能是A 拉住了C,而C拉住了B,这样拉住A蛋白的同时也能把B蛋白也给拉出来。
要证明直接的结合就是Pull-down实验。
提纯所要研究的两个蛋白(一般是在BL21等菌种表达提纯),这两个蛋白带上不同的标签(提纯蛋白一般带GST或者HIIS标签),然后将他们放在同一个体系里,使用GST-beads或者NI-beads,把其中一个蛋白拉下来,用WB检测另一个蛋白的存在。
比如这份标书:恶性肿瘤的发生、发展的细胞表观遗传学机制。
(同样可以百度检索到全文)3、免疫荧光(Immunofluorescence,IF)——共定位将免疫学方法(抗原抗体特异结合)与荧光标记技术结合起来研究特异蛋白抗原在细胞内分布的方法。
由于荧光素所发的荧光可在荧光显微镜下检出,从而可对抗原进行细胞定位。

通过荧光共振能量转移技术研究蛋白质相互作用的实验方案引言:蛋白质是细胞中最重要的生物大分子之一,其相互作用是细胞内各种生物过程的基础。
荧光共振能量转移技术(FRET)是一种重要的生物物理方法,可以用于研究蛋白质相互作用。
本文将介绍一种基于FRET技术的实验方案,用于研究蛋白质相互作用的机制。
一、实验原理荧光共振能量转移技术基于两个荧光染料之间的能量传递过程。
当两个荧光染料距离足够近并且能量传递的条件满足时,能量将从一个荧光染料转移到另一个荧光染料上,从而引起荧光信号的变化。
在蛋白质相互作用研究中,通常将感兴趣的蛋白质标记上两个荧光染料,一个作为受体,一个作为给体。
当两个蛋白质相互作用时,两个荧光染料之间的距离发生改变,从而引起FRET信号的变化。
二、实验步骤1. 蛋白质标记首先,选择适合的荧光染料,并将其共价地标记到感兴趣的蛋白质上。
这可以通过化学反应或基因工程技术实现。
确保标记的荧光染料在蛋白质结构中不会引起明显的结构改变,以保证实验结果的准确性。
2. 荧光光谱分析使用荧光光谱仪对标记的蛋白质进行荧光光谱分析。
通过测量给体荧光和受体荧光的光谱特性,确定荧光染料的最大激发波长和最大发射波长。
这些参数将在后续实验中用于选择适当的激发光和检测光。
3. FRET效率测定使用FRET效率测定实验,确定两个荧光染料之间的能量传递效率。
这可以通过测量给体荧光的减弱和受体荧光的增强来实现。
根据FRET效率的计算公式,可以得到两个荧光染料之间的距离。
4. 蛋白质相互作用实验将标记的蛋白质样品加入到含有适当缓冲液的反应体系中,使蛋白质相互作用。
然后使用荧光光谱仪或荧光显微镜等设备,测量FRET信号的变化。
根据FRET效率的变化,可以推断蛋白质相互作用的强度和机制。
三、实验注意事项1. 荧光染料的选择应考虑其激发和发射波长的重叠程度,以及在生物体系中的稳定性和光学性质。
2. 蛋白质标记的方法应选择对蛋白质结构影响较小的方法,避免影响实验结果的准确性。
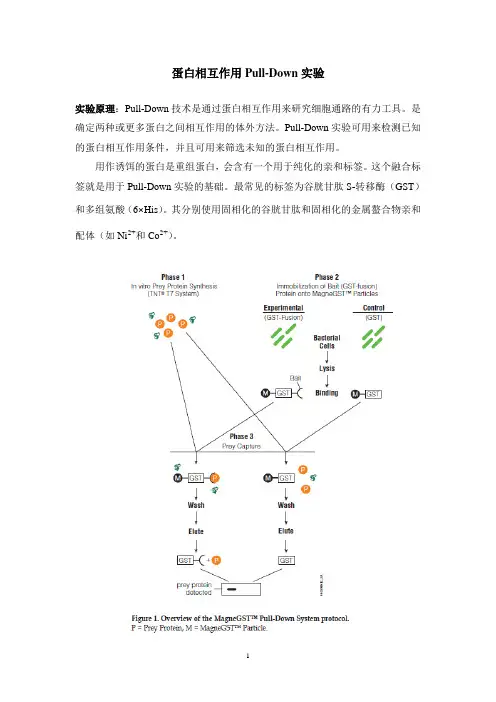
蛋白相互作用Pull-Down实验实验原理:Pull-Down技术是通过蛋白相互作用来研究细胞通路的有力工具。
是确定两种或更多蛋白之间相互作用的体外方法。
Pull-Down实验可用来检测已知的蛋白相互作用条件,并且可用来筛选未知的蛋白相互作用。
用作诱饵的蛋白是重组蛋白,会含有一个用于纯化的亲和标签。
这个融合标签就是用于Pull-Down实验的基础。
最常见的标签为谷胱甘肽S-转移酶(GST)和多组氨酸(6×His)。
其分别使用固相化的谷胱甘肽和固相化的金属螯合物亲和配体(如Ni2+和Co2+)。
实验准备:实验仪器:谷胱甘肽琼脂糖凝胶(镍离子琼脂糖凝胶)、离心机、实验材料:表达的含标签的纯化蛋白、细胞裂解液实验试剂:Binding Buffer/Washing Buffer: 4.2mM Na2HPO4、2mM KH2PO4、140mM NaCl、10mM KClSDS loading Buffer: 50mM Tris-Cl(pH6.8)、2%SDS、0.1%溴酚蓝、10%甘油、10mM DTT裂解缓冲液:20mM Tris-Cl(pH8.0)、200mM NaCl、1mM EDTA(pH8.0)、0.5% Nonidet P-40 使用前加入加入蛋白酶抑制剂。
(蛋白酶抑制剂:2ug/ul抑肽酶(aprotinin)、1ug/ul白胃素(leupeptin)、0.7ug/ml胃酶抑素(pepstatin)、25ug/ml苯甲磺酰氟(PMSF))实验方法:方法一:1、预清除细胞裂解液:将细胞裂解液与50ul的50%谷胱甘肽琼脂糖球珠悬液和25ug GST在4℃混合孵育2h。
离心机12,000g在4℃离心2min。
将上清转移至新的离心管中。
2、探测细胞裂解液两个含等量预清除细胞裂解液及50ul谷胱甘肽琼脂糖球珠的微量离心管。
在一管中加约10ug的GST蛋白,另一管中加约10ug的GST融合探针蛋白。

检测蛋白质与蛋白质之间相互作用的实验技术蛋白质之间的相互作用对于生物体的正常功能和生理进程至关重要。
因此,了解和研究蛋白质与蛋白质之间的相互作用对于疾病研究和新药发现具有重要意义。
本文将介绍常见的用于检测蛋白质与蛋白质之间相互作用的实验技术。
1. 免疫沉淀(Immunoprecipitation,IP)免疫沉淀是一种常用的方法,用于鉴定和分离与特定抗原相互作用的蛋白质。
该方法利用特异性抗体结合特定蛋白质并沉淀出来,然后通过电泳、质谱或免疫印迹等分析方法进行检测。
这种方法不仅可以用于识别特定的蛋白质-蛋白质相互作用,还可以捕获整个蛋白质复合物。
2. 酵母双杂交(Yeast Two-Hybrid,Y2H)酵母双杂交是一种广泛应用于蛋白质-蛋白质相互作用的实验技术。
该方法利用了转录因子的两个功能域的相互作用来检测蛋白质-蛋白质相互作用。
这种方法包括构建两个融合蛋白质:一个与DNA结合域融合的结构域和一个与激活域融合的结构域。
当两个融合蛋白质相互结合时,它们能够重新组装转录因子并激活报告基因的表达。
3. 质谱(Mass Spectrometry,MS)质谱是一种常用于分析蛋白质-蛋白质相互作用的技术。
图谱可以通过分析蛋白质混合物的质量和荷质比来确定蛋白质相互作用的可能性。
质谱技术包括多肽和蛋白质质量指纹图谱(Peptide and protein mass fingerprinting),包括基于基质辅助激光脱附电离(Matrix-assisted laser desorption/ionization,MALDI)和电喷雾(Electrospray Ionization,ESI)的方法。
4. X射线晶体学(X-ray crystallography)X射线晶体学是一种用于解析蛋白质-蛋白质相互作用的高分辨率结构的技术。
该方法涉及到将蛋白质复合物结晶成晶体,然后通过测量和分析这些晶体所产生的X射线散射模式来确定蛋白质的结构及相互作用。

研究蛋白质与蛋白质相互作用方法总结实验步骤蛋白质与蛋白质相互作用是生物学领域中的一个重要研究方向,可以揭示生命活动的基本机理以及药物设计和治疗疾病的潜在靶点。
本文将总结蛋白质与蛋白质相互作用的研究方法以及实验步骤。
一、蛋白质与蛋白质相互作用研究方法总结:1.蛋白质-蛋白质亲和层析法:该方法通过利用蛋白质与目标蛋白质之间的亲和力,将目标蛋白质与其他非特异结合的蛋白质分离,可用于筛选靶向蛋白质的抑制剂或开发特定结合位点。
2.酵母双杂交方法:该方法是通过融合目标蛋白质与一组已知蛋白质相互作用的底物,通过检测底物报告基因(比如启动子)的表达来确定两个蛋白质相互作用的情况。
3.免疫共沉淀法:该方法通过利用抗体的特异性,将目标蛋白质和与其相互作用的蛋白质一同从细胞裂解液中沉淀下来,以证明它们之间存在相互作用关系。
4.光学双光子显微镜或荧光共振能量转移法:这些方法可以利用荧光染料标记的蛋白质,通过观察它们之间的相互作用情况来研究蛋白质与蛋白质之间的相互作用。
5.表面等离子体共振(SPR):该方法通过在金属表面固定一个蛋白质,然后观察黄金膜表面等离子体共振信号的变化来研究蛋白质与蛋白质之间的相互作用过程。
6.核磁共振(NMR):该方法利用蛋白质中的^1H、^13C和^15N原子的自旋,通过一系列的波形解析来确定蛋白质与蛋白质之间的相互作用,可以提供高分辨率的结构和动力学信息。
7.体外重组蛋白质表达和结合实验:利用大肠杆菌或霞赤红热单核细胞感染表达载体后表达目标蛋白质,以及通过重组技术制备的其他蛋白质,通过混合这些重组蛋白质来研究它们之间的相互作用。
二、蛋白质与蛋白质相互作用实验步骤:1.实验前准备:根据研究目的选择适当的实验方法和方法,准备相应的试剂和材料。
2.原料处理:获得目标蛋白质样品后,进行必要的纯化或浓缩处理,以去除其他污染物,并保持蛋白质的活性。
3.实验设计:根据研究目的设计实验方案,比如确定实验条件、控制实验和重复实验。

研究蛋白质之间相互作用的实验方法一、酵母双杂交系统酵母双杂交系统是当前广泛用于蛋白质相互作用组学研究的一种重要方法。
其原理是当靶蛋白和诱饵蛋白特异结合后,诱饵蛋白结合于报道基因的启动子,启动报道基因在酵母细胞内的表达,如果检测到报道基因的表达产物,则说明两者之间有相互作用,反之则两者之间没有相互作用。
将这种技术微量化、阵列化后则可用于大规模蛋白质之间相互作用的研究。
在实际工作中,人们根据需要发展了单杂交系统、三杂交系统和反向杂交系统等。
Angermayr等设计了一个SOS蛋白介导的双杂交系统。
可以研究膜蛋白的功能,丰富了酵母双杂交系统的功能。
此外,酵母双杂交系统的作用也已扩展至对蛋白质的鉴定。
二、噬茵体展示技术在编码噬菌体外壳蛋白基因上连接一单克隆抗体的DNA序列,当噬菌体生长时,表面就表达出相应的单抗,再将噬菌体过柱,柱上若含目的蛋白,就会与相应抗体特异性结合,这被称为噬菌体展示技术。
此技术也主要用于研究蛋白质之间的相互作用,不仅有高通量及简便的特点,还具有直接得到基因、高选择性的筛选复杂混合物、在筛选过程中通过适当改变条件可以直接评价相互结合的特异性等优点。
目前,用优化的噬菌体展示技术,已经展示了人和鼠的两种特殊细胞系的cDNA文库,并分离出了人上皮生长因子信号传导途径中的信号分子。
三、等离子共振技术表面等离子共振技术(Surface Plasmon Resonance,SPR)已成为蛋白质相互作用研究中的新手段。
它的原理是利用一种纳米级的薄膜吸附上“诱饵蛋白”,当待测蛋白与诱饵蛋白结合后,薄膜的共振性质会发生改变,通过检测便可知这两种蛋白的结合情况。
SPR技术的优点是不需标记物或染料,反应过程可实时监控。
测定快速且安全,还可用于检测蛋白一核酸及其它生物大分子之间的相互作用。
四、荧光能量转移技术荧光共振能量转移(FRET )广泛用于研究分子间的距离及其相互作用; 与荧光显微镜结合,可定量获取有关生物活体内蛋白质、脂类、DNA 和RNA 的时空信息。
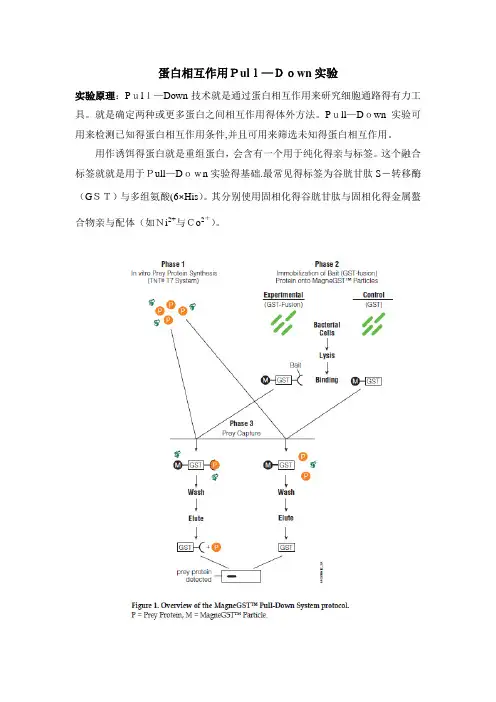
蛋白相互作用Pull—Down实验实验原理:Pull—Down技术就是通过蛋白相互作用来研究细胞通路得有力工具。
就是确定两种或更多蛋白之间相互作用得体外方法。
Pull—Down实验可用来检测已知得蛋白相互作用条件,并且可用来筛选未知得蛋白相互作用。
用作诱饵得蛋白就是重组蛋白,会含有一个用于纯化得亲与标签。
这个融合标签就就是用于Pull—Down实验得基础.最常见得标签为谷胱甘肽S-转移酶(GST)与多组氨酸(6×His)。
其分别使用固相化得谷胱甘肽与固相化得金属螯合物亲与配体(如Ni2+与Co2+)。
实验准备:实验仪器:谷胱甘肽琼脂糖凝胶(镍离子琼脂糖凝胶)、离心机、实验材料:表达得含标签得纯化蛋白、细胞裂解液实验试剂:BindingBuffer/Washing Buffer:4、2mM Na2HPO4、2mM KH2PO4、140mM NaCl、10mM KClSDSloading Buffer:50mMTris—Cl(pH6、8)、2%SDS、0、1%溴酚蓝、10%甘油、10mM DTT裂解缓冲液:20mM Tris-Cl(pH8、0)、200mM NaCl、1mM EDTA(pH8、0)、0、5%Nonidet P-40 使用前加入加入蛋白酶抑制剂.(蛋白酶抑制剂:2ug/ul抑肽酶(aprotinin)、1ug/ul白胃素(leupeptin)、0、7ug/ml胃酶抑素(pepstatin)、25ug/ml苯甲磺酰氟(PMSF))实验方法:方法一:1、预清除细胞裂解液:将细胞裂解液与50ul得50%谷胱甘肽琼脂糖球珠悬液与25ug GST在4℃混合孵育2h。
离心机12,000g在4℃离心2min.将上清转移至新得离心管中.2、探测细胞裂解液两个含等量预清除细胞裂解液及50ul谷胱甘肽琼脂糖球珠得微量离心管.在一管中加约10ug得GST蛋白,另一管中加约10ug得GST融合探针蛋白.两个反应中加入得探针与对照蛋白质得量应该就是等摩尔得.将离心管在4℃翻转混合孵育2h。

蛋白质相互作用实验报告摘要:蛋白质相互作用是生物学研究中至关重要的一环。
该实验旨在通过不同的实验方法和技术手段,探究蛋白质相互作用的性质和机制。
通过实验发现,蛋白质相互作用在细胞内发挥着调控、传递信号以及发展和维持生物体各种结构和功能的重要作用。
本实验以蛋白质A和蛋白质B作为研究对象,采用凝胶过滤实验和表面等离子共振技术,对蛋白质相互作用进行了定性和定量分析。
实验结果表明蛋白质A和蛋白质B之间存在特定的结合关系。
实验结果对于深入理解蛋白质相互作用以及开发相关药物和治疗方法具有重要意义。
引言:蛋白质是生物体内最为基本的分子之一,能够通过相互作用来调控和协调许多生物过程。
蛋白质相互作用是指两个或多个蛋白质相互结合形成复合物的过程。
这些相互作用不仅能够调节细胞的代谢和信号传导,还能够影响生物体内的结构和功能。
因此,对蛋白质相互作用的研究具有重要的生物学意义。
材料与方法:1. 实验材料:a. 蛋白质A溶液b. 蛋白质B溶液c. 缓冲液d. 色谱柱2. 凝胶过滤实验:a. 将蛋白质A和蛋白质B分别加入到不同的实验管中。
b. 将实验管放入冷冻离心机中,离心20分钟,分离上清液和沉淀。
c. 使用色谱柱进行样品纯化。
d. 通过凝胶过滤法对蛋白质相互作用进行定性分析。
3. 表面等离子共振技术:a. 将蛋白质A和蛋白质B溶液分别注入到流动相中。
b. 利用表面等离子共振技术测量蛋白质相互作用过程中的吸附和解离。
结果与分析:通过凝胶过滤实验,观察到蛋白质A与蛋白质B在凝胶上形成带状阴影,表明两者之间存在相互作用。
此外,通过表面等离子共振技术测量,发现蛋白质A和蛋白质B的结合强度随着浓度的增加而增加,这进一步证实了它们之间的相互作用。
实验结果表明蛋白质A和蛋白质B之间存在特定的结合关系。
讨论:蛋白质相互作用在细胞内起着调控、传递信号以及发展和维持生物体各种结构和功能的重要作用。
通过对蛋白质A和蛋白质B的相互作用的研究,我们可以更深入地了解蛋白质相互作用的性质和机制。

peg修饰蛋白实验步骤引言:PEG(聚乙二醇)修饰蛋白是一种常用的实验方法,通过将PEG与蛋白相互作用,可以改变蛋白的性质和功能。
本文将介绍PEG修饰蛋白的实验步骤,以帮助读者了解该方法的基本原理和操作过程。
一、蛋白的纯化与浓缩1. 选择目标蛋白:确定需要修饰的蛋白,可以是已知的重要蛋白,也可以是研究中的新蛋白。
2. 表达与纯化:根据蛋白的特性选择合适的表达系统,并进行蛋白的纯化。
常见的方法包括亲和层析、离子交换层析和凝胶过滤层析等。
3. 浓缩蛋白:使用浓缩方法(如超滤或醋酸铵沉淀)将纯化得到的蛋白浓缩至适当的浓度,以便进行后续的PEG修饰实验。
二、PEG修饰蛋白的实验步骤1. 选择PEG修饰试剂:根据需要修饰的蛋白特性和实验设计,选择合适的PEG修饰试剂。
常见的PEG修饰试剂包括NHS-PEG、Maleimide-PEG和Aldehyde-PEG等。
2. 准备修饰反应体系:将纯化得到的蛋白溶解至适当浓度,并在合适的缓冲液中加入PEG修饰试剂。
根据实验需要,可以加入其他辅助试剂,如还原剂或催化剂。
3. 进行修饰反应:将修饰反应体系在适当温度和时间下进行反应。
反应条件的选择应根据具体实验目的和蛋白特性进行优化。
4. 反应终止与蛋白的后续处理:将反应终止剂加入修饰反应体系,停止修饰反应。
根据实验需要,可以对修饰后的蛋白进行一系列的后续处理,如洗涤、浓缩或纯化等。
5. 验证修饰效果:通过一系列的实验方法,如SDS-PAGE、质谱分析等,验证修饰效果和修饰位点。
根据实验结果进行数据分析和解释。
6. 功能分析与应用研究:进一步研究修饰后蛋白的性质和功能变化,如抗原性的改变、稳定性的提高等。
根据实验目的,可以进行细胞实验、动物实验或体外试验等。
三、实验注意事项1. 实验条件的优化:根据蛋白的特性和实验目的,对实验条件进行优化,如修饰试剂的浓度、反应时间和温度等。
2. 蛋白的稳定性:在修饰过程中,一些蛋白可能会因为修饰试剂的加入而失去稳定性。

蛋白质相互作用实验报告一、实验背景蛋白质是生命活动的主要承担者,它们在细胞内通过相互作用形成复杂的网络,共同执行各种生物学功能。
研究蛋白质相互作用对于理解生命过程、疾病发生机制以及药物研发具有重要意义。
本实验旨在探究两种特定蛋白质之间的相互作用关系。
二、实验目的1、确定目标蛋白质 A 和蛋白质 B 是否存在相互作用。
2、分析蛋白质相互作用的强度和特性。
三、实验材料与方法(一)实验材料1、蛋白质 A 和蛋白质 B 的纯品。
2、相关试剂,如缓冲液、抗体等。
3、实验仪器,包括离心机、移液器、电泳设备、荧光显微镜等。
(二)实验方法1、免疫共沉淀(CoImmunoprecipitation,CoIP)将蛋白质 A 和蛋白质 B 共同孵育,加入特异性抗体与其中一种蛋白质结合。
通过免疫沉淀将结合有抗体的复合物沉淀下来。
对沉淀下来的复合物进行 Western blot 检测,查看是否存在另一种蛋白质。
2、酵母双杂交系统(Yeast TwoHybrid System)构建分别含有蛋白质 A 和蛋白质 B 编码序列的载体。
将载体分别转化到酵母细胞中。
观察酵母细胞的生长情况和报告基因的表达,判断蛋白质相互作用。
3、荧光共振能量转移(Fluorescence Resonance Energy Transfer,FRET)对蛋白质 A 和蛋白质 B 分别进行荧光标记。
使标记后的蛋白质相互作用。
通过检测荧光信号的变化来判断是否发生能量转移,从而确定相互作用。
四、实验结果1、免疫共沉淀实验结果显示,在沉淀复合物中同时检测到了蛋白质 A 和蛋白质 B,表明它们之间存在直接的相互作用。
2、酵母双杂交系统中,酵母细胞在特定条件下生长良好,并且报告基因得以表达,进一步证实了蛋白质 A 和蛋白质 B 的相互作用。
3、荧光共振能量转移实验中,观察到了明显的荧光信号变化,支持了蛋白质 A 和蛋白质 B 相互作用的结论。
五、结果分析与讨论1、综合三种实验方法的结果,均有力地证明了蛋白质 A 和蛋白质B 之间存在相互作用。
蛋白质与蛋白质相互作用(Protein-Protein Interaction, PPI)研究方法概述目前检验蛋白质之间相互作用的实验方法主要有:酵母双杂交系统(Yeast two-hybrid system)、噬菌体展示技术(Phage display)、串联亲和纯化-质谱(Tandem affinity purification-mass spectrometry, TAP-MS)以及GST pull-down。
其原理与适用范围如下:(1)酵母双杂交系统(Yeast two-hybrid system)实验原理:双杂交系统的建立基于对真核生物调控转录起始过程的认识。
细胞起始基因转录需要有转录激活因子的参与,转录激活因子在结构上是组件式的,即这些因子往往由两个或两个以上相互独立的结构域构成,其中有DNA结合结构域(binding domain,简称为BD)和转录激活结构域(activation domain,简称为AD),它们是转录激活因子发挥功能所必需的。
在酵母双杂交系统中,“诱饵”蛋白X(也就是已知的蛋白)克隆至DNA-BD载体中,表达DNA-BD/X融合蛋白;待测试蛋白Y克隆至AD载体中,表达AD/Y融合蛋白。
一旦X与Y蛋白间有相互作用,则DNA-BD和AD也随之被牵拉靠近,恢复行使功能,激活报告重组体中基因的表达。
图解:说明:其中,UAS即upstream activating sequence,上游激活序列。
适用范围:已知一种蛋白X,在体内(in vivo)筛选与其相互作用的蛋白,但前体是需预备一批可能与已知蛋白X相互作用的蛋白Y。
(2)噬菌体展示技术(Phage display)实验原理:将编码多肽的外源DNA片段与噬菌体表面蛋白的编码基因融合后,以融合蛋白的形式呈现在噬菌体的表面,被展示的多肽或蛋白可保持相对的空间结构和生物活性,导入了各种各样外源基因的一群噬菌体,就构成一个展示各种各样外源肽的噬菌体展示库。
蛋白质相互作用的研究方法蛋白质相互作用(protein-protein interaction, PPI)研究方法可以分为生化方法、细胞生物学方法、生物物理化学方法和计算方法等多个方面。
以下将详细介绍几种常用的研究方法。
1. 酵母双杂交法(Yeast Two-Hybrid, Y2H)酵母双杂交法是一种广泛应用的PPI研究方法。
该方法利用酵母细胞中两个蛋白质结合后的活性报告基因表达,从而实现对蛋白质相互作用的筛选和鉴定。
该方法的优点是操作简单、高通量性能强,但也存在一些局限性,如可能存在假阳性结果和只能检测胞内相互作用。
2. 免疫共沉淀法(Immunoprecipitation, IP)免疫共沉淀法是一种常用的生化方法,用于鉴定蛋白质相互作用。
该方法基于抗体的特异性,将靶蛋白及其结合蛋白共同沉淀下来,通过蛋白质分析技术(如质谱分析)鉴定共沉淀的蛋白质。
该方法适用于研究细胞内和细胞间的蛋白质相互作用,但需要针对每个靶蛋白制备特异性抗体。
3. 原位近距离显微镜法(Fluorescence Resonance Energy Transfer, FRET)FRET是一种用于研究蛋白质相互作用的生物物理化学方法。
该方法通过将两个蛋白质分别与一对荧光染料标记,根据能量转移来检测蛋白质间的相互作用。
FRET可以在活细胞和组织中进行,具有高时空分辨率,但需要合适的显微镜设备和特定的染色体系。
4. 表面等离子体共振传感器法(Surface Plasmon Resonance, SPR)SPR是一种用于检测蛋白质相互作用的生物物理化学方法。
该方法通过检测表面等离子体共振信号的变化来定量分析蛋白质间的结合动力学和亲和性。
SPR具有高灵敏度和实时监测能力,可用于定量研究蛋白质相互作用,但需要具备专业的设备和表面修饰技术。
5. 结构生物学方法结构生物学方法包括X射线晶体学、核磁共振(Nuclear Magnetic Resonance, NMR)和电子显微镜(Electron Microscopy, EM)等。
药物与蛋白实验报告药物与蛋白是药物研发领域的重要研究方向,通过研究药物与蛋白的相互作用,可以揭示药物的药理作用和作用机制,为药物的设计和开发提供理论依据。
以下是一份关于药物与蛋白实验的报告,内容包括实验目的、实验方法、实验结果与讨论。
实验目的:本实验旨在研究药物与目标蛋白相互作用,评价药物的亲和力和抑制效果,并探讨药物与蛋白的结合方式和作用机制。
实验方法:1. 实验所用的目标蛋白是经纯化和修饰后的重要药物靶点蛋白。
将该蛋白溶解于缓冲液中,并进行浓度调整。
2. 根据需求,选择一种或多种药物进行实验。
将药物溶解于适当的溶剂中,以得到一定浓度的药物溶液。
3. 在试管中,将一定量的目标蛋白溶液与一定浓度的药物溶液混合,形成药物与蛋白的复合物。
在控制组中,将药物溶液替换为纯溶剂。
4. 在一定温度下,孵育一定时间后,采用适当的技术手段(如ELISA、Western blot、共沉淀)进行检测和观察目标蛋白与药物复合物的形成情况。
5. 分析实验数据,计算药物与目标蛋白的结合常数和抑制常数,并评价其亲和力和抑制效果。
6. 根据实验结果,进一步分析药物与蛋白之间的结合模式和作用机制。
实验结果与讨论:通过实验测得药物与目标蛋白的结合常数和抑制常数,评价了药物的亲和力和抑制效果。
结果显示,药物A与目标蛋白的结合常数较大,表明药物A具有较高的亲和力;而药物B的抑制常数较小,表明药物B具有良好的抑制效果。
进一步分析药物与蛋白之间的结合模式和作用机制,发现药物A主要通过竞争性结合与蛋白相互作用,从而发挥其药理作用;而药物B通过非竞争性结合与蛋白相互作用,改变蛋白的构象和功能,从而发挥其药理作用。
另外,实验发现药物与目标蛋白的结合方式与药物的化学结构特点密切相关。
药物A具有较大的极性基团,与目标蛋白的极性位点发生作用;而药物B具有较大的非极性基团,与目标蛋白的非极性位点发生作用。
这表明,药物设计和优化时,应该考虑药物与蛋白的相互作用模式和结合位点的特点。
蛋白质与蛋白质相互作用实验方法我折腾了好久蛋白质与蛋白质相互作用实验方法,总算找到点门道。
说实话,一开始我在这事儿上也是瞎摸索。
我先试了酵母双杂交这个方法。
这就好比是给蛋白质牵红线,把可能相互作用的蛋白一个放到BD结构域那边,一个放到AD结构域那边,如果这俩蛋白质相互作用了,就像两个人看对眼了,那么报告基因就能被激活,我们就能测出来。
刚做的时候呀,我那叫一个手忙脚乱。
克隆构建这一步就把我难住好久,就像在一堆乱麻里找线头,一点一点地理顺。
有一回我没把基因连接好就急着转酵母了,结果啥都没做出来,白忙乎一场。
后来我就知道了,这个克隆构建得特别细心,每一步都要核对好了才行。
还有酵母培养的条件也很重要,温度呀,营养呀都得合适。
就像人得有一个舒适的居住环境一样,酵母在合适的条件下才能好好干活,帮我们检测蛋白质的相互作用。
我还试过免疫共沉淀实验。
这就像是钓鱼,用一种蛋白质做诱饵,去把和它相互作用的蛋白质钓上来。
我在做这个实验的时候呢,抗体的选择是关键。
我刚开始选错了抗体,那结果简直一塌糊涂。
我以为只要是能识别那个蛋白的抗体就可以,后来才知道还得考虑特异性和亲和力这些因素。
就好比你去钓鱼,你得选好合适的鱼饵,太普通的鱼饵,鱼根本不咬钩。
还有细胞裂解那块,要控制好条件,如果裂解太猛了,可能把一些本来没有相互作用的蛋白也混在一起了,这就像你钓鱼的时候用力过猛,把河底的烂泥巴都搅上来了。
还有一种方法是GST pull - down。
这个方法有点像把一件件东西分别标记一下,然后放到一起看看谁能和谁挨着。
我做的时候呢,GST标记的蛋白纯化总是不太理想,纯度不够的话就很难准确判断它们的相互作用。
我尝试了不同的纯化柱,调整了各种洗脱的条件,后来才慢慢找到了比较合适的方法。
总之呢,做蛋白质与蛋白质相互作用实验就是得特别细心,多尝试,不怕犯错,从失败里总结经验就好了。
也许还有别的好方法,我还在继续摸索当中呢。
另外像荧光共振能量转移法FRET,这个方法理论上感觉挺奇妙的。
pulldown 实验方法一、啥是pulldown实验呀。
pulldown实验呢,简单来说,就是一种用来研究蛋白质与蛋白质之间相互作用的实验方法哟。
它就像是一个“蛋白质相亲大会”,帮我们看看哪些蛋白质之间能相互吸引、相互结合啦,是不是很有趣呢?这种实验在生物学研究领域那可是相当重要的,能让我们更好地了解细胞内各种复杂的生命活动过程呢。
二、实验前的准备工作。
咱得先把实验要用的东西都准备齐全咯。
首先是各种试剂,像亲和标签融合蛋白(这个可是关键角色哦,就像是带着特殊标记的“诱饵蛋白”)、缓冲液(它就像一个温柔的小环境,让蛋白质们能舒服地待着)、蛋白酶抑制剂(这是个小卫士,防止蛋白质被不小心破坏掉)等等。
然后就是实验器材啦,比如离心管、移液器、摇床、离心机这些常见的“实验小伙伴”都不能少哦。
还有哦,别忘了把要研究的目标蛋白质和可能与之相互作用的蛋白质都准备好,这就像是安排好“相亲对象”一样重要呢。
三、实验具体步骤。
这里面可有不少小细节要注意哟。
1. 亲和标签融合蛋白的准备。
把带有亲和标签的融合蛋白表达出来,然后进行纯化。
这一步就像是给“诱饵蛋白”打扮得漂漂亮亮的,让它能更好地吸引目标蛋白质。
纯化的过程要小心仔细,不然“诱饵蛋白”可能就不那么有魅力啦。
2. 亲和标签融合蛋白与琼脂糖珠的结合。
把纯化好的亲和标签融合蛋白和琼脂糖珠混合在一起,让它们充分结合。
想象一下,这就像是把“诱饵蛋白”挂在一个小珠子上,方便后面去“钓”目标蛋白质哦。
结合的过程中要注意控制好温度和时间,就像谈恋爱一样,得给它们足够的时间和合适的环境去相互了解嘛。
3. 蛋白样品的准备。
把含有目标蛋白质的样品处理一下,加入蛋白酶抑制剂,防止蛋白质被破坏。
这一步就像是给目标蛋白质穿上一层保护衣,让它能健健康康地去参加“相亲”。
4. 结合反应。
把处理好的蛋白样品和结合了亲和标签融合蛋白的琼脂糖珠混合在一起,在摇床上轻轻摇晃,让它们充分接触。
这时候就像是在举办“相亲派对”啦,让蛋白质们有机会相互认识、相互结合。
Sigma-Aldrich公司近日推出Imprint Methylated DNA Quantification Kit (MDQ1),用于表观遗传学研究。
Imprint Methylated DNA Quantification Kit利用类似ELISA的步骤,无需放射性同位素或层析,能在不到四小时内检测整体的甲基化情况。
这个试剂盒只需要5ng的甲基化DNA,分析形式为灵活的8孔分析胶条,能够对培养的细胞、组织、血浆和其他体液样品的DNA进行高通量或手工分析。
Imprint MDQ技术让科学家迅速确定生物样品中的整体甲基化状态,为改变甲基化状态的条件以及更深入的疾病研究打下基础。
目前的甲基化定量研究主要采取反向HPLC、MALDI-TOF-MS 、甲基化敏感内切酶指纹法、DNA甲基化酶分析、免疫组化染色和点杂交等方法。
MDQ1试剂盒为研究人员提供了一种新的选择。
MDQ1试剂盒中包含了所有必需的试剂,能让实验室自行筛选样品,而无需将样品送出去分析。
Sigma-Aldrich的销售经理Tim Fleming表示:“我们的Imprint Methylated DNA Quantification Kit为整体DNA甲基化定量提供了快速而完整的解决方案。
这项激动人心的技术添加到我们的表观遗传学研究产品中,反映出Sigma- Aldrich开发可靠的平台来支持表观遗传学研究的承诺。
”
Sigma- Aldrich是从Epigentek集团获得MDQ技术的许可。
Imprint Methylated DNA Quantification Kit 是Sigma在生命科学领域的表观遗传学研究产品线的补充,它还包括Imprint DNA Modification Kit和Imprint ChIP Kit,以及DNA纯化、qPCR、测序和反应后纯化等产品。
Epigentek的首席科技官Adam Li表示:“我们非常高兴Sigma-Aldrich选择与Epigentek在表观遗传学领域合作。
这次协议强调了Epigentek在表观遗传学方面的地位,巩固了我们的策略和产品,两家公司有望合作开发新的表观遗传学技术和产品。
”
关于Imprint Methylated DNA Quantification Kit以及Sigma-Aldrich表观遗传学研究产品组合的更多信息,请访问/epigenetics。
关于Sigma-Aldrich
Sigma-Aldrich是一个领先的生命科学和高科技公司。
它的生化和有机化学产品和试剂盒广泛应用于基因组学研究、生物技术、药物研发和疾病诊断,并成为药物及其他高科技生产的关键组分。
该公司的客户遍布生命科学公司、大学和政府研究院、医院和工业。
超过百万科学家和技术人员使用其产品。
Sigma-Aldrich致力于通过在生命科学的领导地位、高科技和服务来加速客户的成功。
如需Sigma-Aldrich的更详细信息,请访问其屡获大奖的网站。
(生物通余亮)
2008年11月6日第四十六期第 10 页,共 21 页下一页 返回。