自噬双标腺病毒(mRFP-GFP-LC3)使用指南
- 格式:doc
- 大小:590.00 KB
- 文档页数:10

mcherry-gfp-lc3原理
Mcherry-GFP-LC3是一种荧光标记蛋白,用于研究细胞自噬。
原理如下:
1. Mcherry是一种红色荧光蛋白,GFP是一种绿色荧光蛋白,它们都可以通过荧光显微镜观察。
2. LC3是一种微管相关蛋白3(Microtubule-associated protein 1A/1B-light chain 3),参与调控和介导细胞自噬过程。
LC3有LC3-I和LC3-II两种形式,LC3-I是胞浆中的非结合形式,LC3-II是结合在自噬小体(autophagosome)膜上的形式。
3. Mcherry-GFP-LC3是将Mcherry和GFP两种荧光蛋白与
LC3一起融合而成。
在正常条件下,细胞中的自噬活性较低,Mcherry-GFP-LC3主要存在于胞浆中。
4. 当细胞启动自噬过程时,LC3-I会转化为LC3-II,并结合在自噬小体膜上。
由于GFP对酸性条件敏感,在自噬小体酸性环境中会逐渐失去荧光,而Mcherry对酸性环境不敏感,能够保持红色荧光。
5. 通过观察Mcherry-GFP-LC3的荧光表达,可以判断细胞是否在进行自噬。
当细胞开始自噬时,会出现红色和黄色(红色与绿色复合)荧光,而在胞浆中继续存在的Mcherry-GFP-LC3会呈现黄色荧光,表明自噬的早期过程。
当自噬小体与溶酶体融合后,酸性环境导致GFP的荧光丧失,只保留红色荧光,表明自噬已经发生。
综上所述,通过观察Mcherry-GFP-LC3的荧光表达变化,可以定量分析细胞中自噬的活性和过程。
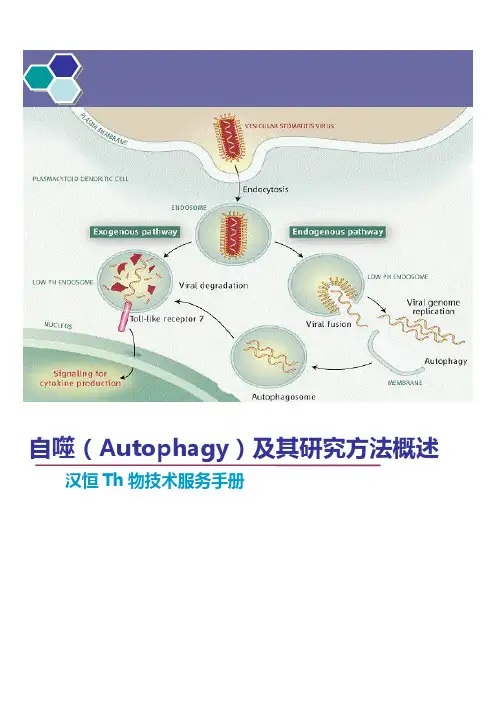
自噬(Autophagy)及其研究方法概述汉恒Th物技术服务手册目录1概念2自噬的过程3自噬的特性4自噬过程的调控5自噬与肿瘤的关系6自噬的研究方法概述7汉恒自噬研究特色服务自噬研究相关产品及服务1.病毒工具(独家推出)mRFP-GFP-LC3腺病毒系统,可高效感染目的细胞,表达mRFP-GFP-LC3,感染后细胞可在荧光显微镜下实时观察自噬发Th过程(具体内容后面有介绍);2.自噬相关服务汉恒Th物可提供自噬研究整体科研服务,若您的时间紧张或是对实验有所顾忌,我们可以为您代劳部分实验内容;3.自噬研究相关试剂汉恒Th物可以根据您的实验需求为您提供最实用的试剂产品,让你用的放心,省心!产品厂商规格A14292,Premo自噬TB/GFP TR-FRETinvitrogen6000Tests LC3B抗体试剂盒pllabs0.1mgAnti-MAP1A/LC3A/B自噬微管相关蛋白轻链3抗体pllabs0.1mgAnti-MAP1LC3A(microtubule-associated protein1light chain3)自噬微管相关蛋白轻链3抗体Invitrogen1mg/1ml兔抗人、大、小APG4B细胞自噬相关抗体\Anti-APG4B/AUTL1BD1mg/1ml自噬微管相关蛋白轻链3抗体\Anti-MAP1LC3AAnti-SQSTM1/p62antibody abcamSigma1g溶酶体抑制剂Hydroxychloroquine(羟氯喹)mTOR抑制剂rapamycin Sigma20mM自噬抑制剂3-Methyladenine(3-MA)Sigma100mg1概念目前根据发Th过程分为三类:Macroautophagy,Microautophagy和Chaperone-mediated autophagy(CM A)大自噬(Macroautophagy)即我们说的自噬(autophagy);微自噬(Microautophagy):是指溶酶体主动、直接吞噬胞浆成分的一种方式;分子伴侣介导的自噬(Chaperone-mediated autophagy,CMA):一些分子伴侣,如hsp70,能帮助未折叠蛋白转位入溶酶体。

mrfp-gfp-lc3自噬评判标准摘要:1.自噬概述2.mrfp-gfp-lc3 自噬评判标准的含义3.自噬在生物体中的功能4.mrfp-gfp-lc3 自噬评判标准的应用领域5.我国在mrfp-gfp-lc3 自噬评判标准研究方面的进展6.未来发展趋势与挑战正文:1.自噬概述自噬是细胞内一种重要的降解机制,通过吞噬并降解细胞内有害蛋白质、细胞器以及其他有害物质,维持细胞内稳态。
自噬过程分为四个阶段:招募、吞噬、融合和降解。
近年来,自噬在生物学和医学研究中受到广泛关注,与许多疾病的发生和发展密切相关。
2.mrfp-gfp-lc3 自噬评判标准的含义mrfp-gfp-lc3 是一种用于检测自噬过程的荧光报告系统,由mRFP-GFP 融合蛋白和LC3 蛋白组成。
mRFP-GFP 融合蛋白能够反映自噬泡的融合过程,LC3 蛋白则可以作为自噬体的标志物。
mrfp-gfp-lc3 自噬评判标准是基于这一荧光报告系统,通过对细胞内mRFP 和GFP 信号的动态变化以及LC3 puncta 的形成来评估自噬的活性和效率。
3.自噬在生物体中的功能自噬在生物体中具有多种功能,包括维持细胞内稳态、降解有害蛋白质、细胞器的更新与维护、抵抗外部压力以及调控细胞生长和死亡等。
自噬异常与许多疾病的发生和发展密切相关,如神经退行性疾病、肿瘤、免疫疾病等。
4.mrfp-gfp-lc3 自噬评判标准的应用领域mrfp-gfp-lc3 自噬评判标准广泛应用于生物学和医学研究中,包括自噬调控机制的研究、药物筛选、疾病模型的建立以及治疗策略的开发等。
通过这一评判标准,研究人员可以快速、准确地评估自噬活性和效率,为进一步研究自噬在生物体中的作用提供便利。
5.我国在mrfp-gfp-lc3 自噬评判标准研究方面的进展近年来,我国在mrfp-gfp-lc3 自噬评判标准研究方面取得了显著进展,不仅在实验技术上不断优化,而且在自噬调控机制、疾病模型以及治疗策略等方面取得了突破。

lc3双荧光自噬流原理LC3双荧光自噬流原理是指通过标记LC3蛋白的N端和C端分别与绿色荧光蛋白(GFP)和红色荧光蛋白(RFP)结合,来研究细胞中的自噬过程。
自噬是一种细胞内垃圾清除机制,可以通过分解细胞内受损或老化的蛋白质、细胞器和长链脂肪酸等细胞成分,提供新的营养物质和能量。
理解自噬的调控机制和功能对于许多疾病的研究具有重要意义。
LC3(Microtubule-associated protein light chain 3)蛋白是自噬过程中的一个关键分子,它可以作为自噬小体的特异性标记物。
在自噬过程中,LC3蛋白从非修饰形式(LC3-I)转化为修饰形式(LC3-II),并参与自噬小体的形成和界定。
LC3双荧光自噬流技术就是通过标记LC3蛋白的N端和C端分别与GFP和RFP结合来追踪自噬小体的形成和变化。
LC3蛋白有两个酶解位点,分别是Glycine120和Glycine121。
在绝大多数正常生理条件下,LC3蛋白主要以非修饰形式存在于细胞质中,称为LC3-I。
LC3-I分子上的Glycine120位点和Glycine121位点上含有一个负电荷的C-末端甘氨酸。
当自噬通路被激活时,LC3-I分子的C-末端甘氨酸被肌酸激酶ATG4剪切,形成一个临时的中间体LC3-I-PE (LC3-半胱氨酸乙酰乙酸胺酰酶)。
LC3-I-PE分子会进一步和自噬小体膜结合,形成LC3-II分子。
LC3-II通过与自噬小体膜相互作用,将自噬小体界定在特定的细胞区域,并参与自噬小体的形成和降解进程。
LC3-II分子富集在自噬小体内,是自噬小体的特异性标记。
因此,观察LC3-II的表达水平和荧光变化,可以反映自噬小体的形成和变化。
LC3双荧光自噬流技术就是通过将LC3-GFP和LC3-RFP融合蛋白导入细胞中,使它们定位在细胞质,并随后转变为LC3-II形式进入自噬小体。
在正常情况下,LC3-GFP和LC3-RFP会同时发放绿色和红色荧光。

细胞自噬检测引言细胞自噬(Autophagy)是一种维持细胞内稳态的重要细胞生理过程。
它通过将细胞内的有害垃圾物质、受损蛋白质和细胞器通过包裹成双层膜体而将其降解和回收。
细胞自噬不仅对于维持细胞内环境的平衡,也在细胞营养不足、应激等情况下发挥至关重要的作用。
为了研究细胞自噬的机制、功能以及其在疾病中的作用,科研人员常常需要进行细胞自噬的检测。
本文将介绍一些常用的细胞自噬检测方法,旨在帮助科研人员更好地开展相关研究。
方法一:免疫组化检测免疫组化检测是常用的细胞自噬检测方法之一,它利用特异性抗体识别和定位自噬相关的蛋白质标记。
以下是免疫组化检测的步骤:1.固定和透化:将细胞样品固定在载玻片上,并通过透化剂处理,以便抗体能够穿透细胞膜进入细胞内。
2.抗体反应:加入特异性的抗体,使其与目标自噬蛋白结合。
3.洗涤:进行多次洗涤,以除去未结合的抗体。
4.二抗结合:加入与第一抗体来源不同种类的第二抗体,它能连接到第一抗体上,使得目标蛋白能够被可见光或荧光染料标记。
5.洗涤:进行多次洗涤,以除去未结合的第二抗体。
6.显色或荧光检测:加入适当的显色剂或荧光标记物,观察细胞自噬标记的结果。
免疫组化检测方法适用于观察细胞内特定蛋白质的表达和定位情况,从而间接地了解细胞自噬的活性。
方法二:转染自噬标记基因为了直接观察细胞内自噬相关的蛋白质的表达情况,科研人员可以利用转染自噬标记基因的方法。
以下是一种常用的自噬标记基因:mRFP-GFP-LC3。
mRFP-GFP-LC3是一种融合蛋白,其中GFP(绿色荧光蛋白)和mRFP(红色荧光蛋白)与自噬相关的蛋白LC3融合在一起。
GFP能够在细胞自噬过程中被降解,而mRFP则能够在自噬过程中保持稳定。
转染mRFP-GFP-LC3基因后,科研人员可以通过观察细胞中的荧光信号来确定细胞的自噬活性。
当细胞自噬活性较低时,绿色和红色荧光都很强;而当细胞自噬活性增加时,绿色荧光减弱而红色荧光增强。

自噬研究方法及研究步骤自噬简介细胞自噬(autophagy or autophagocytosis):又称为Ⅱ型细胞死亡,是细胞在自噬相关基因(autophagy related gene,Atg)的调控下利用溶酶体降解自身受损的细胞器和大分子物质的过程。
比利时科学家Christian de Duve在上世纪50年代经过电镜察看到自噬体(autophagosome)构造,并且在 1963 年溶酶体国际会议上首先提出了“自噬”这种说法。
因而Christian de Duve被公以为自噬研讨的鼻祖。
Christian de Duve 也因发现溶酶体,于1974年取得诺贝尔奖。
目前根据发生过程分为三类:Macroautophagy,Microautophagy和Chaperone-mediated autophagy CMA)。
●大自噬(Macroautophagy):即我们说的自噬(autophagy);●微自噬(Microautophagy):是指溶酶体主动、直接吞噬胞浆成分的一种方式;●分子伴侣介导的自噬 (Chaperone-mediated autophagy,CMA):一些分子伴侣,如hsp70,能帮助未折叠蛋白转位入溶酶体。
通常说的自噬泛指Macroautophagy.自噬的过程1):细胞接受自噬诱导信号后,在胞浆的某处形成一个小的类似“脂质体”样的膜结构,然后不断扩张,被称为Phagophore。
2):Phagophore不断延伸,将胞浆中的任何成分,全部揽入,然后“收口”,成为密闭的球状的autophagosome,即“自噬体”。
3):自噬体形成后,可与细胞内吞的吞噬泡、吞饮泡和内体融合(这种情况不是必然要发生的)。
4):自噬体与溶酶体融合形成autolysosome,期间自噬体的内膜被溶酶体酶降解,2者的内容物合为一体,自噬体中的“货物”也被降解,产物(氨基酸、脂肪酸等)被输送到胞浆中供细胞重新利用,而残渣或被排出细胞外或滞留在胞浆中。


自噬双标腺病毒( mRFP-GFP-LC3 )使用指南背景:自噬是细胞内的一种“自食(Self-eating )”的现象,凋亡是“自杀( Self-killing )”的现象,二者共用相同的刺激因素和调节蛋白,但是诱发阈值和门槛不同,如何转换和协调目前还不清楚. 自噬是指膜(目前来源还有争议,大部分表现为双层膜,有时多层或单层)包裹部分胞质和细胞内需降解的细胞器、蛋白质等形成自噬体,最后与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物,以实现细胞稳态和细胞器的更新。
目前文献对自噬过程进行观察和检测常用的策略和手段有:通过western blot检测LC3勺剪切;通过电镜观测自噬体的形成;在荧光显微镜下采用GFP(-RFP) -LC3等融合蛋白来示踪自噬体形成以及降解。
近几年对自噬流的研究日趋增多,针对于此我们汉恒生物科技(上海)有限公司自主研发了用于实时监测自噬( 流)的mRFP-GFP-LC腺病毒,mRFP用于标记及追踪LC3, GF啲减弱可指示溶酶体与自噬小体的融合形成自噬溶酶体,即由于GF荧光蛋白对酸性敏感,当自噬体与溶酶体融合后GFP 荧光发生淬灭, 此时只能检测到红色荧光。
这种串联的荧光蛋白表达载体系统直观清晰的指示了细胞自噬流的水平,是我们自噬研究尤其是自噬流研究不可或缺的利器。
mRFP-GFP-LC3 腺病毒的操作收到病毒后的处理(一)、腺病毒的储存1、腺病毒采用冰袋运输。
(1)、收到病毒液后如未融化请置于-80 C冰箱,下次使用时再进行分装;(2)、如客户收到时腺病毒已融化,请直接分装后置于-80 C冰箱保存;若短期内用于实验,可分装部分于4C保存(尽量一周内用完)。
2、尽量避免反复冻融,否则会降低病毒滴度(每次冻融会降低病毒滴度10%)。
建议不要在-20 C下长期保存。
如果病毒储存时间超过6个月,应该重新测定病毒滴度。
3、建议收到病毒产品后根据实验需求自行分装或购买经过分装的小包装病毒产品(购买时请提出)。

mRFP-EGFP-LC3稳转细胞株构建服务质粒来源:Addgene # 21074 ( 载体pEGFP-C1+mRFP;插入基因Rat LC3B,GenBank ID: U05784 )背景:自噬为机体在亚细胞水平的“自我吞噬”,可以帮助细胞维持自身稳态及适应应激环境。
近年来,自噬已成为生物学领域中的一个研究热点。
迄今研究发现,自噬可以参与多种疾病的发生发展,例如肿瘤,心血管疾病,神经退行性疾病等。
因而,自噬在各类相关疾病研究中作为药物筛选靶点越来越受关注和讨论。
自噬研究的基础是有效地观察,定量细胞中自噬的发生。
而目前应用较为广泛的自噬检测方法为观察GFP-LC3荧光斑,细胞正常生理环境LC3呈弥散状分布,自噬激活时LC3会转移至自噬囊泡上,因此,GFP荧光的弥散或斑点状聚集可以比较准确的反应细胞状态。
由于分子生物学的发展,现在已经诞生了mRFP-GFP-LC3 双荧光自噬指示体系,用于标记及追踪LC3以及自噬流的变化。
其中GFP是酸敏感型GFP蛋白,而mRFP是稳定的荧光表达基团,不受外界影响。
由于自噬小体进入第二阶段后,与溶酶体进行融合,形成自噬溶酶体。
自噬溶酶体由于溶酶体内部的酸性环境,可以导致PH下降,GFP淬灭,因此,GFP的减弱可指示自噬溶酶体形成的顺利程度,GFP越少,则从自噬小体到自噬溶酶体阶段流通得越顺畅。
反之,自噬小体和溶酶体融合被抑制,自噬溶酶体进程受阻。
mRFP是一直稳定表达的,因而可以通过GFP与mRFP的亮点比例来评价自噬流进程。
优点:mRFP-EGFP-LC3稳转细胞株可以稳定持续的表达mRFP-EGFP-LC3,能够有效地解决瞬转实验的效率低、周期长、操作繁琐、不稳定等问题,有利于保证实验结果稳定性与可重复性。
mRFP-GFP-LC3 双荧光自噬指示体系的出现,把自噬研究带入了一个新的阶段,自噬不再只是指标,而是一种机制,自噬流的顺畅与否,对于细胞生理功能的稳定非常关键。

mrfp-gfp-lc3自噬评判标准
MRFp-GFP-LC3是一种用于评判细胞自噬活性的标识物。
LC3(Microtubule-associated protein 1A/1B-light chain 3)是自噬过程中的一个关键蛋白,其选择性地在自噬过程中结合于自噬囊泡膜上。
MRFp-GFP-LC3是一种融合蛋白,将MRFp和GFP 与LC3融合在一起,可以通过观察细胞内自噬囊泡膜上的MRFp-GFP-LC3信号来定量细胞的自噬活性。
评判标准:
1. 自噬囊泡膜的形成:正常情况下,细胞内的MRFp-GFP-LC3表达时呈现为一个均匀分布的绿色荧光信号。
当自噬过程发生时,MRFp-GFP-LC3会在囊泡膜上形成点状或环状的荧光信号。
观察细胞中是否出现这些点状或环状的信号,可以评判自噬囊泡膜的形成。
2. 自噬囊泡膜的积累:正常情况下,自噬囊泡会在细胞内迅速融合并降解其内的物质。
当自噬的降解过程受到抑制时,自噬囊泡膜会在细胞内积累。
通过观察细胞内的MRFp-GFP-LC3信号,如果发现大量的点状或环状信号积累在细胞内,可以判断自噬囊泡膜的积累。
3. 自噬囊泡膜的降解:除了观察自噬囊泡的形成和积累,还可以评判自噬囊泡膜的降解。
在自噬降解过程中,MRFp-GFP-LC3会被酸性的自噬溶酶体降解,荧光信号会减弱甚至消失。
通过观察细胞内的MRFp-GFP-LC3信号的强度变化,可以评判自噬囊泡膜的降解情况。
综合以上几个方面的观察和判断,可以评判细胞的自噬活性。
需要注意的是,不同细胞类型和研究对象的自噬特征可能有所差异,因此在进行自噬评判时,还需结合其他相关实验和标记物的结果进行综合分析。
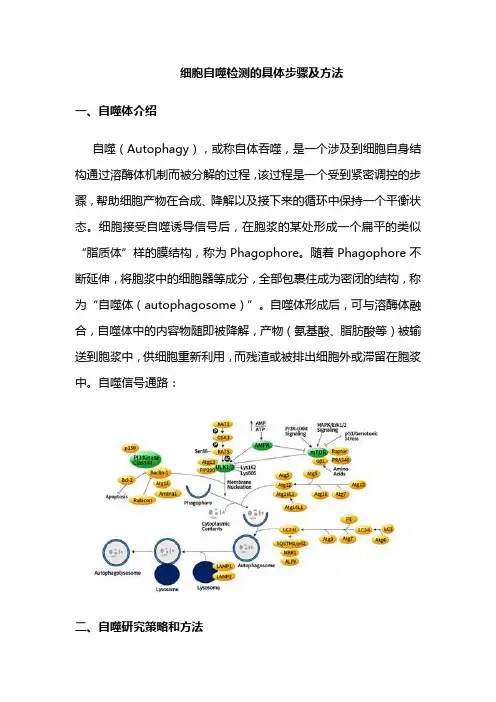
细胞自噬检测的具体步骤及方法一、自噬体介绍自噬(Autophagy),或称自体吞噬,是一个涉及到细胞自身结构通过溶酶体机制而被分解的过程,该过程是一个受到紧密调控的步骤,帮助细胞产物在合成、降解以及接下来的循环中保持一个平衡状态。
细胞接受自噬诱导信号后,在胞浆的某处形成一个扁平的类似“脂质体”样的膜结构,称为Phagophore。
随着Phagophore不断延伸,将胞浆中的细胞器等成分,全部包裹住成为密闭的结构,称为“自噬体(autophagosome)”。
自噬体形成后,可与溶酶体融合,自噬体中的内容物随即被降解,产物(氨基酸、脂肪酸等)被输送到胞浆中,供细胞重新利用,而残渣或被排出细胞外或滞留在胞浆中。
自噬信号通路:二、自噬研究策略和方法正常细胞基础水平自噬活性比较低,对自噬研究通常需要进行人工调节和干预,常用药物有:1、自噬诱导剂a) Bredeldin A / Thapsigargin / Tunicamycin :模拟内质网应激;b) Carbamazepine/ L-690,330/ Lithium Chloride(氯化锂):IMPase 抑制剂(即Inositol monophosphatase,肌醇单磷酸酶);c) Earle's平衡盐溶液:制造饥饿;d) N-Acetyl-D-sphingosine(C2-ceramide):Class I PI3K Pathway抑制剂;e) Rapamycin:mTOR抑制剂;f) Xestospongin B/C:IP3R阻滞剂。
2、自噬抑制剂a) 自噬抑制剂3-Methyladenine(3-MA):(Class III PI3K) hVps34 抑制剂;b) Bafilomycin A1:质子泵抑制剂;c) 溶酶体抑制剂Hydroxychloroquine(羟氯喹)。
3、自噬检测1) 透射电镜;电镜作为自噬检测的金指标。
由于自噬体属于亚细胞结构,普通光镜下观察不到自噬体的形成,因此,直接观察自噬体需在透射电镜下。
lc3双荧光自噬流原理自噬是一种细胞内的重要降解机制,可以降解并回收细胞内的蛋白质、有损的细胞器和细胞内的垃圾。
自噬流原理指的是自噬在细胞内的连续过程,其中LC3蛋白家族扮演着关键角色。
本文将介绍LC3双荧光自噬流原理以及其在细胞生物学研究中的应用。
一、自噬的基本原理自噬是维持细胞内环境稳定的重要机制。
在细胞发生饥饿、感染、细胞应激等情况下,自噬通过形成自噬器官瓶颈体,将细胞内的有害分子进行包裹并送入溶酶体进行降解。
这一过程可以提供细胞能量并维持细胞功能。
自噬的启动主要通过一系列信号通路和蛋白质相互作用来实现。
二、LC3蛋白家族的功能和结构LC3蛋白家族是自噬过程中关键的蛋白质家族。
它们的命名来源于"microtubule-associated protein light chain 3"。
在自噬过程中,LC3负责新生自噬泡的形成、膜的扩张以及涉及自噬的其他关键步骤。
LC3蛋白家族包括LC3A、LC3B和LC3C等。
它们具有高度保守的结构和功能。
LC3蛋白家族存在两种形式,即LC3-I和LC3-II。
LC3-I主要存在于胞质中,是被涂抹在自噬泡内部膜的蛋白质。
在自噬启动后,LC3-I 转化为LC3-II,并在自噬泡膜上延伸形成LC3膜扩张体。
因此,LC3-II是自噬流程中的重要标志。
LC3-II还与自噬相关蛋白如Atg5、Atg7等蛋白质的相互作用协同推动自噬的进行。
三、LC3双荧光自噬流原理为了研究自噬的动态过程,科学家发展出了LC3双荧光自噬流技术。
这一技术基于LC3蛋白家族在自噬过程中的表达和转变特点,通过转染细胞并观察LC3蛋白家族的荧光标记来实现。
LC3双荧光自噬流技术包括LC3-GFP(Green Fluorescent Protein)和LC3-mCherry(Red Fluorescent Protein)的表达。
通过显微镜观察细胞中的荧光分布情况,可以判断自噬过程的不同阶段。
自噬双标腺病毒(mRFP-GFP-LC3)使用指南背景:自噬是细胞内的一种“自食(Self-eating)”的现象,凋亡是“自杀(Self-killing)”的现象,二者共用相同的刺激因素和调节蛋白,但是诱发阈值和门槛不同,如何转换和协调目前还不清楚. 自噬是指膜(目前来源还有争议,大部分表现为双层膜,有时多层或单层)包裹部分胞质和细胞内需降解的细胞器、蛋白质等形成自噬体,最后与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物,以实现细胞稳态和细胞器的更新。
目前文献对自噬过程进行观察和检测常用的策略和手段有:通过western blot检测LC3的剪切;通过电镜观测自噬体的形成;在荧光显微镜下采用GFP(-RFP)-LC3等融合蛋白来示踪自噬体形成以及降解。
近几年对自噬流的研究日趋增多,针对于此我们汉恒生物科技(上海)有限公司自主研发了用于实时监测自噬(流)的mRFP-GFP-LC3腺病毒,mRFP 用于标记及追踪LC3,GFP的减弱可指示溶酶体与自噬小体的融合形成自噬溶酶体,即由于GFP荧光蛋白对酸性敏感,当自噬体与溶酶体融合后GFP 荧光发生淬灭,此时只能检测到红色荧光。
这种串联的荧光蛋白表达载体系统直观清晰的指示了细胞自噬流的水平,是我们自噬研究尤其是自噬流研究不可或缺的利器。
mRFP-GFP-LC3腺病毒的操作收到病毒后的处理(一)、腺病毒的储存1、腺病毒采用冰袋运输。
(1)、收到病毒液后如未融化请置于-80℃冰箱,下次使用时再进行分装;(2)、如客户收到时腺病毒已融化,请直接分装后置于-80℃冰箱保存;若短期内用于实验,可分装部分于4℃保存(尽量一周内用完)。
2、尽量避免反复冻融,否则会降低病毒滴度(每次冻融会降低病毒滴度10%)。
建议不要在-20℃下长期保存。
如果病毒储存时间超过6个月,应该重新测定病毒滴度。
3、建议收到病毒产品后根据实验需求自行分装或购买经过分装的小包装病毒产品(购买时请提出)。
自噬是一个吞噬自身细胞质蛋白或细胞器并使其包被进入囊泡,并与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物的过程,藉此实现细胞本身的代谢需要和某些细胞器的更新。
自噬(autophagy)是由Ashford 和Porter 在1962 年发现细胞内有"自己吃自己"的现象后提出的,是指从粗面内质网的无核糖体附着区脱落的双层膜包裹部分胞质和细胞内需降解的细胞器、蛋白质等成分形成自噬体(autophagosome),并与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物,以实现细胞本身的代谢需要和某些细胞器的更新。
自噬在机体的生理和病理过程中都能见到,其所起的作用是正面还是负面的尚未完全阐明,对肿瘤的研究尤其如此,值得关注。
自噬的功能:(1)饥饿应答时的作用,在不同的器官如肝脏或在培养细胞中,氨基酸的匮乏会诱导细胞产生自体吞噬,由自体吞噬分解大分子,产生在分解代谢和合成代谢过程中所必须的中间代谢物(2)在细胞正常活动中的作用,如在动物的变态发育、老化和分化过程中,自体吞噬负责降解正常的蛋白以重新组建细胞。
尽管通常人们认为自体吞噬不具有选择性,但是在某些病理和压力条件下,通过自体吞噬能选择性地隔离某些细胞器,如线粒体、过氧化物酶体等。
(3)在某些组织中的特定功能,如黑人的塞梅林神经节中,多巴胺能神经元中的神经黑色素的合成就需要把细胞质中的多巴胺醌用A V包被隔离起来。
自噬发生过程:在此过程中,自噬体的形成是关键,其直径一般为300 ~ 900 nm,平均500 nm,囊泡内常见的包含物有胞质成分和某些细胞器如线粒体、内吞体、过氧化物酶体等。
与其他细胞器相比,自噬体的半衰期很短,只有8 min 左右,说明自噬是细胞对于环境变化的有效反应。
由于自体吞噬较少受到关注,而且很难在体外实验条件下实现,因此到目前为止,对自体吞噬的机制还不是很了解。
研究主要集中在酵母及其它重要的单细胞真核生物,而对植物和哺乳动物细胞中的自体吞噬过程的了解则更少。
自噬研究:快到碗里来!作者:右哉最近自噬的研究都很火,耐药不耐药,凋亡不凋亡的都开始往上扯了。
这篇文章的题目是:'Ulinastatin Reduces the Resistance of Liver Cancer Cells to Epirubicin by Inhibiting Autophagy',基本上可以作为入门级自噬研究的参考模板了。
文章思路是这样的:首先文章证明了EPI能诱导肝癌细胞自噬,而UTI能抑制这样的自噬;然后UTI能促进EPI诱导的细胞凋亡;接着证明UTI是抑制自噬从而促进了EPI诱导的凋亡;然后证明了UTI是通过NF-kB信号通路起到了这样的作用;最后做了一下成瘤实验。
我们就看第一个Fig,就基本能了解自噬他们究竟做了点啥。
自噬研究基本可以分这样几个层次:1.证明自噬参与了你的研究表型:western检测LC3,p62;LC3双荧光测细胞自噬流;电镜观测自噬;自噬形成时胞浆型LC3(即LC3-I)会酶解掉一小段多肽,转变为(自噬体)膜型(即LC3-II),LC3-II/I比值的大小可估计自噬水平的高低。
但LC3的抗体会对LC3-II有更高的亲和力,所以往往会造成假阳性。
所以通常会使用LC3的亚细胞结构定位来辅助实验。
比如这篇文章所采用的就是HanBio Inc.(汉恒生物)的mRFP-GFP-LC3的腺病毒进行分析的。
2.证明自噬在你的表型中起了关键作用:加自噬抑制剂3-MA,激动剂rapamycin等,然后检测表型(功能);这里就用到了两种自噬抑制剂:3-MA和CQ(Chloroquine)。
3.找到表型与自噬衔接的分子:检测自噬通路如pI3K 通路,Beclin-1,ATG家族各成员,看看哪个与表型呈现正相关变化;4.基因操作3中的分子,检测自噬和表型:说明该分子在衔接自噬和表型中的作用机制;这一点需要运用到的也就是柯霍氏法则和回复实验。
…华丽丽的分割线…李莫愁博士:而普通的自噬研究,也就是这样一个模式:(感谢汉恒生物的蔡博士为我们整理)自噬表型研究中,较为常用的就是采用汉恒的mRFP-GFP-LC3融合蛋白的腺病毒,对细胞进行了感染。
自噬标志物—lc3检测要点自噬是一种细胞自我降解的过程,它在维持细胞内环境稳定、清除垃圾蛋白质和对抗压力等方面起着重要作用。
要检测自噬的活性,常常使用LC3 (Microtubule-associated protein 1 light chain 3)作为标志物。
下面将介绍LC3检测的要点。
1. LC3 I和LC3 II:LC3是一种在自噬过程中参与的蛋白质。
它存在两种形式:LC3 I和LC3 II。
LC3 I是未修饰的形式,而LC3 II是经过磷酸化和脂化修饰的形式。
LC3 II在自噬过程中会转移到自噬体膜上,因此LC3 II的水平可以反映自噬的活性。
2. 免疫印迹法:常用的检测LC3的方法是免疫印迹法。
首先,需要制备细胞提取物,并使用蛋白质浓度检测方法确定提取物的蛋白质浓度。
然后,将相同量的蛋白质加载到SDS-PAGE凝胶中,进行电泳分离。
接下来,将蛋白质转移到聚丙烯酰胺膜上,并使用抗LC3的抗体进行免疫检测。
最后,使用化学发光法或显色法观察和定量LC3的水平。
3. LC3转化:在自噬过程中,LC3 I会被ATG4蛋白酶切割,形成LC3 II。
因此,LC3 II的水平可以反映自噬的活性。
LC3转化可以通过观察LC3 I和LC3 II的比例来评估。
当自噬活性增加时,LC3 II的水平会增加,而LC3 I的水平会减少。
4. 自噬诱导剂和抑制剂:为了评估细胞自噬的活性,可以使用自噬诱导剂或抑制剂。
自噬诱导剂如雷帕霉素(rapamycin)可以增加自噬的活性,而自噬抑制剂如氯喹(chloroquine)可以抑制自噬的活性。
通过与这些药物的处理,可以进一步验证LC3的水平是否与自噬活性相关。
LC3是检测自噬活性的重要标志物。
通过免疫印迹法检测LC3 I和LC3 II的水平,可以评估细胞自噬的活性。
此外,自噬诱导剂和抑制剂的使用也可以帮助验证LC3水平与自噬活性的相关性。
通过这些要点的了解和应用,我们可以更好地研究和理解细胞自噬的机制和功能。
WB常见指标——⾃噬标志物LC3摘要LC3特点实验要点LC3A/B/C有细胞/组织类型分布特点查询细胞/组织中各亚型的表达谱,选择合适靶标的抗体LC3-I可转变为LC3-II检测LC3-I和LC3-II使⽤LC3A,LC3B或者LC3A/B的抗体均可。
脂化、膜相关蛋⽩超声确保充分裂解⼩分⼦量蛋⽩~15%分离胶,0.22um印记膜转膜LC3-II可被溶酶体降解加⼊⼯具药(如氯喹等),阻断降解LC3-I/II的形成和降解是⼀个动态过程瞬时LC3-II表达不能反映⾃噬程度,需配合使⽤⼯具药(如氯喹)分析⾃噬变化正⽂在进⾏⾃噬研究时,WB检测LC3-I和LC3-II⼏乎是必做的实验,那么,进⾏LC3检测时,需要注意哪些要点呢?请看下⽂LC3: 从何处来?往何处去?LC3/Atg8 被具有蛋⽩内切酶活性的Atg4在羧基端剪切,⽣成胞质 LC3-I。
LC3-I通过Atg7 和Atg3(分别对应 E1 和 E2 样酶)参与的泛素样反应,使磷脂酰⼄醇胺 (PtdEth,PE) 偶联,⽣成脂质化形式的 LC3,也称作 LC3-II,它可以附着到⾃噬体(autophagosome)的膜上,是⾃噬体的结构蛋⽩。
在降解过程中,位于⾃噬溶酶体外膜的LC3-II被半胱氨酸蛋⽩酶Atg4B移除后回收,位于内膜的LC3-II则与包裹的内容物⼀起,被溶酶体降解。
图1:⾃噬信号通路的调控,点击下载源⽂件LC3A/B/C有种属细胞/组织分布特点LC3/Atg8 被具有蛋⽩内切酶活性的Atg4在羧基端剪切,⽣成胞质 LC3-I。
LC3-I通过Atg7 和Atg3(分别对应 E1 和 E2 样酶)参与的泛素样反应,使磷脂酰⼄醇胺 (PtdEth,PE) 偶联,⽣成脂质化形式的 LC3,也称作 LC3-II,它可以附着到⾃噬体(autophagosome)的膜上,是⾃噬体的结构蛋⽩。
在降解过程中,位于⾃噬溶酶体外膜的LC3-II被半胱氨酸蛋⽩酶Atg4B移除后回收,位于内膜的LC3-II则与包裹的内容物⼀起,被溶酶体降解。
自噬双标腺病毒(mRFP-GFP-LC3)使用指南背景:自噬是细胞内的一种“自食(Self-eating)”的现象,凋亡是“自杀(Self-killing)”的现象,二者共用相同的刺激因素和调节蛋白,但是诱发阈值和门槛不同,如何转换和协调目前还不清楚. 自噬是指膜(目前来源还有争议,大部分表现为双层膜,有时多层或单层)包裹部分胞质和细胞内需降解的细胞器、蛋白质等形成自噬体,最后与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物,以实现细胞稳态和细胞器的更新。
目前文献对自噬过程进行观察和检测常用的策略和手段有:通过western blot检测LC3的剪切;通过电镜观测自噬体的形成;在荧光显微镜下采用GFP(-RFP)-LC3等融合蛋白来示踪自噬体形成以及降解。
近几年对自噬流的研究日趋增多,针对于此我们汉恒生物科技(上海)有限公司自主研发了用于实时监测自噬(流)的mRFP-GFP-LC3腺病毒,mRFP 用于标记及追踪LC3,GFP的减弱可指示溶酶体与自噬小体的融合形成自噬溶酶体,即由于GFP荧光蛋白对酸性敏感,当自噬体与溶酶体融合后GFP 荧光发生淬灭,此时只能检测到红色荧光。
这种串联的荧光蛋白表达载体系统直观清晰的指示了细胞自噬流的水平,是我们自噬研究尤其是自噬流研究不可或缺的利器。
mRFP-GFP-LC3腺病毒的操作收到病毒后的处理(一)、腺病毒的储存1、腺病毒采用冰袋运输。
(1)、收到病毒液后如未融化请置于-80℃冰箱,下次使用时再进行分装;(2)、如客户收到时腺病毒已融化,请直接分装后置于-80℃冰箱保存;若短期内用于实验,可分装部分于4℃保存(尽量一周内用完)。
2、尽量避免反复冻融,否则会降低病毒滴度(每次冻融会降低病毒滴度10%)。
建议不要在-20℃下长期保存。
如果病毒储存时间超过6个月,应该重新测定病毒滴度。
3、建议收到病毒产品后根据实验需求自行分装或购买经过分装的小包装病毒产品(购买时请提出)。
(二)、腺病毒的稀释需要稀释病毒时,将病毒取出后置于冰上融解,使用培养目的细胞用PBS或培养基稀释到所需浓度后混匀分装后4℃保存,并尽快用于实验(尽量一周内用完),动物实验建议使用注射用平衡液来稀释,并尽快用完。
感染目的细胞由于腺病毒是自主复制性基因载体,不能插入基因组稳定遗传,因此实验中细胞感染腺病毒的实验需要具体情况具体对待。
一般根据外界刺激处理的时间来选择感染腺病毒的时间,短时程处理(一周之内)建议先感染腺病毒之后再进行处理,长时程刺激的建议在刺激结束前2~3天进行腺病毒感染。
另外不同细胞的MOI不同,所以在将病毒感染正式感染目的细胞前,需要做一个预实验以确定目的细胞中加入的病毒数。
(一)细胞准备将状态良好的目的细胞接种到24孔板,使细胞浓度为1×105/ml 细胞,接种细胞数量因细胞的生长速度而略有不同,一般是保证第二天进行病毒感染的时候细胞汇合率介于50%至70%直接。
(二)病毒感染I、贴壁细胞由于该病毒感染后续拍照需要进行自噬小点的计算,因此需要在高倍镜下拍照,条件允许最好使用共聚焦显微镜拍照,此时需要把细胞铺被在玻片上面(部分细胞铁壁能力不是很强,此时需要预先在玻片上包被galetin甚至laminin)。
感染实验在1/2体积培养液感染(详见下表格)。
加入的病毒量范围在MOI=20~50内(具体感染的操作量参见附录表格),每个MOI值加两个孔 2小时后换液。
II、悬浮细胞上面介绍的是针对贴壁细胞的感染方法,若是悬浮或半悬浮细胞,则需要通过平角离心转染法,即将适量的病毒液加入细胞培养皿后,封好口,放入平角离心机后,低速离心1h,然后放入培养箱中正常培养即可。
若由于实验条件有限,没有平角离心机,可用离心管代替,将细胞吹打吸入离心管中,进行低速离心,去掉大部分上清,然后加入适量的病毒液,室温放置10min(不能超过半小时),然后将细胞和病毒液同时吸出转入培养皿中继续病毒感染至2小时后换液即可。
(三)观察感染情况感染24小时后,可以开始观察到GFP以及RFP表达,36-48小时可以进行细胞固定、封片(需要使用防淬灭的固定剂)、拍照分析。
(四)结果分析mRFP-GFP-LC3串联荧光蛋白腺病毒中表达的GFP和mRFP用于标记及追踪LC3,GFP 的减弱可指示溶酶体与自噬小体的融合形成自噬溶酶体(由GFP荧光蛋白对酸性敏感,当自噬体与溶酶体融合后GFP荧光发生淬灭,此时只能检测到红色荧光,原理如下图所示)。
统计方法我们在显微镜成像后红绿荧光merge后通过merge后出现的黄色斑点即只是自噬体.红色的斑点指示自噬溶酶体,通过不同颜色斑点的计数可以清晰的看出自噬流的强弱:一般统计采用人为计数的方法,也就是统计叠加(overlay)之后黄色斑点和红色斑点的数目,然后做出bar图。
如下图:细胞转染mRFP-GFP-LC3病毒后给予氨基酸剥夺处理2 小时后出现明显增强的自噬以及自噬流(通过merge后的红色小点明显增多可以判定自噬流水平升高)。
Antioxid Redox Signal 14(11): 2179-2190.实验操作注意事项1、操作病毒时请尽量使用生物安全柜;2、操作时需戴上帽子,佩戴双层手套,双层口罩;3、病毒操作中绝对禁止在安全柜内有任何皮肤直接暴露的情况;4、剩余的病毒和接种用的注射器等耗材需高压灭菌后才能扔弃;5、操作完毕要及时用肥皂和水洗手消毒;6、未尽事宜请咨询汉恒生物技术人员了解详情,汉恒生物全国免费热线400-092-0065;7、您可登录汉恒生物官网观看腺病毒实验操作视频,并与我们的客服人员互动交流。
参考文献:Hariharan, N., et al. (2011). "Oxidative stress stimulates autophagic flux during ischemia/reperfusion." Antioxid Redox Signal 14(11): 2179-2190.Ma, X., et al. (2012). "Impaired autophagosome clearance contributes to cardiomyocyte death in ischemia/reperfusion injury." Circulation 125(25): 3170-3181.Choi, A. M., S. W. Ryter and B. Levine (2013). "Autophagy in human health and disease." N Engl J Med 368(7): 651-662. Gannage, M., D. Dormann, R. Albrecht, J. Dengjel, T. Torossi, P. C. Ramer, M. Lee, T. Strowig, F. Arrey, G. Conenello, M. Pypaert, J. Andersen, A. Garcia-Sastre and C. Munz (2009). "Matrix protein 2 of influenza A virus blocks autophagosome fusion with lysosomes." Cell Host Microbe 6(4): 367-380. Hariharan, N., Y. Maejima, J. Nakae, J. Paik, R. A. Depinho and J. Sadoshima (2010). "Deacetylation of FoxO by Sirt1 Plays an Essential Role in Mediating Starvation-Induced Autophagy in Cardiac Myocytes." Circ Res 107(12): 1470-1482.Levine, B. and G. Kroemer (2008). "Autophagy in the pathogenesis of disease." Cell 132(1): 27-42.Mizushima, N., T. Yoshimori and B. Levine (2010). "Methods in mammalian autophagy research." Cell 140(3): 313-326. Ravikumar, B., K. Moreau, L. Jahreiss, C. Puri and D. C. Rubinsztein (2010). "Plasma membrane contributes to the formation of pre-autophagosomal structures." Nat Cell Biol 12(8): 747-757.Ravikumar, B., S. Sarkar, J. E. Davies, M. Futter, M. Garcia-Arencibia, Z. W. Green-Thompson, M. Jimenez-Sanchez, V.I. Korolchuk, M. Lichtenberg, S. Luo, D. C. Massey, F. M. Menzies, K. Moreau, U. Narayanan, M. Renna, F. H. Siddiqi, B. R. Underwood, A. R. Winslow and D. C. Rubinsztein (2010). "Regulation of mammalian autophagy in physiology and pathophysiology." Physiol Rev 90(4): 1383-1435.Wei, Y., Z. Zou, N. Becker, M. Anderson, R. Sumpter, G. Xiao, L. Kinch, P. Koduru, C. S. Christudass, R. W. Veltri, N. V. Grishin, M. Peyton, J. Minna, G. Bhagat and B. Levine (2013). "EGFR-Mediated Beclin 1 Phosphorylation in Autophagy Suppression, Tumor Progression, and Tumor Chemoresistance." Cell 154(6): 1269-1284.附录注:1)24板长满了细胞大约有3×105个细胞。