常见弱酸弱碱的电离平衡常数
- 格式:doc
- 大小:146.50 KB
- 文档页数:2

电离平衡常数和水解平衡常数关系
若是一元弱碱强酸盐,如氯化铵:可得Kh=Kw/ Kb。
若是弱酸弱碱盐,如醋酸铵:可得Kh= Kw/(Ka×Kb)。
1、Ka、Kb分别表示一元弱酸、一元弱碱的电离常数,弱酸、弱碱均属于弱电解质。
在一定条件下,弱电解质电离达到平衡时,溶液中电离出来的各种离子浓度乘积与溶液中未电离的电解质分子浓度的比值是一个常数,叫做该弱电解质的电离平衡常数。
弱电解质的电离平衡常数只与温度有关,而与该弱电解质的浓度无关。
一般Ka (或Kb)值越大,表示酸(或碱)的电离程度就越大,相应酸(或碱)的酸性(或碱性)就越强。
可利用Ka、Kb的值计算酸(或碱)溶液中各微粒浓度。
2、Kh是盐的水解平衡常数,水解反应也是一种离子平衡。
在一定温度下,能水解的盐(强碱弱酸盐、强酸弱碱盐或弱酸弱碱盐)在水溶液中达到水解平衡时。
生成的弱酸(或弱碱)浓度与氢氧根离子(或氢离子)浓度之积与溶液中未水解的弱酸根阴离子(或弱碱的阳离子)浓度之比是一个常数,该常数就叫水解平衡常数。
同其它平衡常数一样,Kh只与水解盐的性质、温度有关。
Kh也可以衡量反应进行程度的。
Kh越大,表示水解程度越大。
可利用Kh的值计算溶液中各微粒浓度。
3、Kw是水的离子积,是指在一定温度下水中c(H+)和c(OH-)的乘积。

第4节 弱酸弱碱的电离平衡
4.4.1 一元弱酸、弱碱的电离
一元酸: 每个分子只能电离出一个H + 的酸;
一元碱: 每个分子只能电离出一个OH -
的碱。
弱酸(碱): 在水溶液中只有部分分子发生电离的酸(碱)。
以HAc 和NH 3·H 2O 为例来讨论一元弱酸弱碱的电离。
1.电离常数
醋酸在溶液中的电离过程如下:
HAc + H 2O
H 3O + + Ac - 简写为 HAc H + + Ac - ]HAc []][Ac [H -+=a K (4-7)
K a 为弱酸的电离平衡常数,简称酸常数。
[H +]、[Ac -]、[HAc]表示平衡浓度。
同样,一元弱碱氨水的电离过程是:
NH 3·H 2O
NH 4+ + OH - ]O H NH []
OH ][NH [234b ⋅=-+K (4-8) K b 为弱碱的电离平衡常数,简称碱常数。
K a 、K b 均属于化学平衡常数。
K a (或K b ) 的数值越大(小),其酸(或碱)性越强(弱), 通常把K a <10-2的酸称为弱酸。

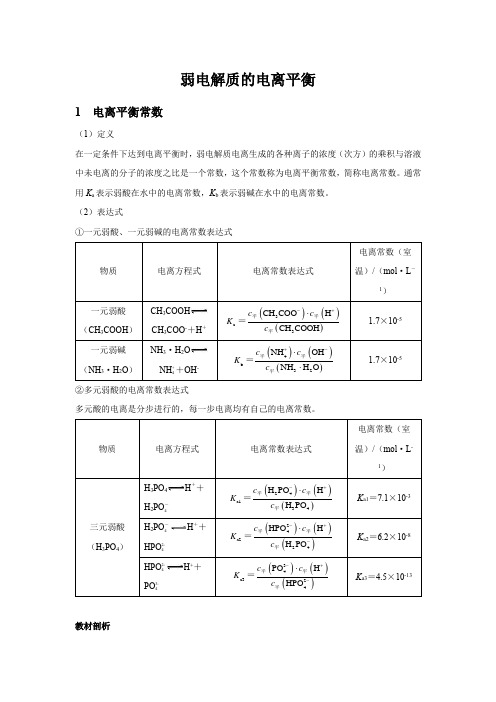
弱电解质的电离平衡1 电离平衡常数(1)定义在一定条件下达到电离平衡时,弱电解质电离生成的各种离子的浓度(次方)的乘积与溶液中未电离的分子的浓度之比是一个常数,这个常数称为电离平衡常数,简称电离常数。
通常用K a表示弱酸在水中的电离常数,K b表示弱碱在水中的电离常数。
(2)表达式①一元弱酸、一元弱碱的电离常数表达式CH3COOHCH3COO-+H+NH3·H2ONH ++OH-4②多元弱酸的电离常数表达式多元酸的电离是分步进行的,每一步电离均有自己的电离常数。
H3PO4H++H2PO-4H2PO-H++4HPO2-4H++HPO2-4PO3-4教材剖析【教材P98】 “多元弱酸的各级电离常数逐级减小。
对于各级电离常数相差很大的多元弱酸,其水溶液中的H +主要是由第一步电离产生的。
”【教材剖析】 多元弱酸第一步电离出H +后,剩余的酸根离子带负电荷,对H +的吸引力增强,使其电离出H +更困难,故一般K a1>>K a2>>K a3……。
因此计算多元弱酸溶液中的c (H+)或比较弱酸酸性的相对强弱时,通常只考虑第一步电离。
(3)意义电离常数表征了弱电解质的电离能力,根据相同温度下电离常数的大小可以判断弱电解质电离能力的相对强弱。
弱酸的电离常数越大,弱酸电离出H +的能力就越强,酸性也就越强;反之,酸性越弱。
如:名师提醒(1)电离常数服从化学平衡常数的一般规律,只受温度的影响。
(2)电离常数相对较大、电离能力较强的弱电解质,其溶液的导电能力不一定强。
这是因为溶液的导电能力与溶液中的离子浓度和离子所带电荷数有关。
(3)相同温度下,等浓度的多种一元弱酸溶液,弱酸的电离常数越大,溶液中c (H +)越大,溶液的导电能力也就越强。
2 电离度(1)定义弱电解质在水中的电离达到平衡状态时,已电离的溶质的分子数占原有溶质分子总数(包括已电离的和未电离的)的百分率称为电离度,通常用α表示。




专题43电离平衡常数及相关计算1.表达式(1)对于一元弱酸HA :HAH ++A −,电离常数K =。
H A HA c c c +-⋅()()()(2)对于一元弱碱BOH :BOHB ++OH −,电离常数K =。
B OH BOH c c c +-⋅()()()(3)对于二元弱酸,如H 2CO 3:H 2CO 3H ++,K 1=;H ++3HCO -323H HCO H CO c c c +-⋅()()()3HCO -,K 2=;且K 1>K 2。
23CO -233H CO HCO c c c +--⋅()()()2.意义:相同条件下,K 越大→越易电离→酸(或碱)性越强3.特点:多元弱酸是分步电离的,各级电离常数的大小关系是K 1≫K 2……,所以其酸性主要决定于第一步电离。
4.影响因素5.电离常数的三大应用(1)判断弱酸(或弱碱)的相对强弱,电离常数越大,酸性(或碱性)越强。
(2)判断盐溶液的酸性(或碱性)强弱,电离常数越大,对应的盐水解程度越小,碱性(或酸性)越弱。
(3)判断复分解反应能否发生,一般符合“强酸制弱酸”规律。
6.电离平衡常数相关计算(以弱酸HX 为例)(1)已知c (HX)和c (H +),求电离常数 HX H + + X −起始(mol·L −1):c (HX) 0 0平衡(mol·L −1):c (HX)−c (H +) c (H +) c (H +)则:K ==。
H X HX c c c +-⋅()()()2H HX H c c c ++()()-()由于弱酸只有极少一部分电离,c (H +)的数值很小,可做近似处理:c (HX)−c (H +)≈c (HX),则K =,2H HX c c +()()代入数值求解即可。
(2)已知c (HX)和电离常数,求c (H +)HX H + + X −起始:c (HX) 0 0平衡:c (HX)−c (H +) c (H +) c (H +)则:K ==。



电离平衡常数【知识梳理】 一、电离常数1.概念:在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种离子浓度的乘积与溶液中未电离的分子浓度的比值是一个常数,这个常数叫做电离平衡常数。
用K (弱酸的用K a ,弱碱的用K b )表示。
2.表达式(1)对于一元弱酸HA :HA H ++A -电离常数K a =c (H +)·c (A -)c (HA )(2)对于一元弱碱BOH :BOHB ++OH -电离常数K b =c (B +)·c (OH -)c (BOH )(3)对于多元弱酸,以H 2CO 3为例: H 2CO 3H ++HCO -3 K a1=c (H +)·c (HCO -3)c (H 2CO 3)HCO -3H++CO 2-3K a2=c (H +)·c (CO 2-3)c (HCO -3)3.意义相同条件下,K 值越大,表示该弱电解质越易电离,所对应的酸性或碱性相对越强。
4.特点电离常数只与温度有关,与电解质的浓度、酸碱性无关,由于电离过程是吸热的,故温度升高,K 增大。
多元弱酸是分步电离的,各级电离常数的大小关系是K 1≫K 2……,所以其酸性主要决定于第一步电离。
二、电离常数的4个应用1.判断弱酸(或弱碱)的相对强弱:电离常数越大,酸性(或碱性)越强。
如:常温下,CH 3COOH 的K a =1.8×10-5,H 2CO 3的K a1=4.3×10-7、K a2=5.6×10-11。
则酸性:CH 3COOH>H 2CO 3>HCO -32.判断复分解反应能否发生:一般符合“强酸制弱酸”规律。
如:利用上面中电离常数的数值可知,向Na 2CO 3溶液中加入足量CH 3COOH 的离子方程式为CO 2-3+2CH3COOH===2CH3COO-+H2O+CO2↑【例1】已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是三种酸的电离平衡常数,若已知这些酸可发生如下反应:①NaCN+HNO2HCN+NaNO2 ②NaCN+HF HCN+NaF ③NaNO2+HF HNO2+NaF由此可判断下列叙述不正确的是( )A. HF的电离平衡常数为7.2×10-4B. HNO2的电离平衡常数为4.9×10-10C. 根据反应①③即可知三种酸的相对强弱D. HNO2的电离平衡常数比HCN大,比HF小【对点练习1】H2CO3和H2S在25 ℃时的电离常数如下:则下列反应可能发生的是( )A. NaHCO3+NaHS Na2CO3+H2SB. H2S+Na2CO3NaHS+NaHCO3C. Na2S+H2O+CO2H2S+Na2CO3D. H2S+NaHCO3NaHS+H2CO33.判断微粒浓度比值的变化:弱电解质加水稀释时,能促进弱电解质的电离,溶液中离子和分子的浓度会发生相应的变化,但电离常数不变,题目中经常利用电离常数来判断溶液中微粒浓度比值的变化情况。

一、电离平衡常数的概念与表达式 1.概念在一定条件下,当弱电解质的电离达到平衡时,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之比是一个常数,这个常数叫做电离平衡常数,简称电离常数,用K 表示(通常用K a 、K b 分别表示弱酸、弱碱的电离平衡常数)。
2.表示方法 (1)一元弱酸、弱碱电离方程式电离常数表达式 CH 3COOH CH 3COOH ⇌CH 3COO -+ H +K a =c(H +)·c(CH 3COO -)c(CH 3COOH)NH 3·H 2O NH 3·H 2O ⇌NH 4++ OH -K b =c(NH 4+)·c(OH -)c(NH 3·H 2O)(2)多元弱酸、弱碱电离方程式 电离常数表达式 H 2CO 3H 2CO 3⇌H + +HCO 3-HCO 3-⇌ H + +CO 32-K 1=c(H +)·c(HCO 3-)c(H 2CO 3)知识精讲知识导航《电离平衡常数》教案二、电离平衡常数的意义1. 意义电离平衡常数表示弱电解质的电离能力。
一定温度下,K值越大,弱电解质的电离程度越大,酸性(或碱性)越强。
2. 实例下表是几种弱酸常温下的电离平衡常数,则酸性强弱顺序为:CH3COOH>H2CO3>H2S>HCO->HS-三、电离平衡常数的影响因素1. 内因:弱电解质本身的性质。
2. 外因:电离平衡常数只跟温度有关,温度升高,电离平衡常数增大。
四、电离度1. 概念:弱电解质达电离平衡时,已电离的电解质分子数占原来总分子数(包括已电离的和未电离的)的百分数。
2. 影响因素①内因:弱电解质本身的性质②外因:温度及浓度3. 意义:表示不同弱电解质在水溶液中的电离程度,在相等条件下可用电离度比较弱电解质的相对强弱。
五、电离常数的计算1. 列出“三段式”2. 由于弱电解质的电离程度比较小,最终计算时,一般弱电解质的平衡浓度≈起始浓度(即忽略弱电解质电离的部分)。


考点43 电离平衡常数及相关计算1.表达式(1)对于一元弱酸HA :HAH ++A −,电离常数K =H A HA c c c +-⋅()()()。
(2)对于一元弱碱BOH :BOHB ++OH −,电离常数K =B OH BOH c c c +-⋅()()()。
(3)对于二元弱酸,如H 2CO 3:H 2CO 3H ++3HCO -,K 1=323H HCO H CO c c c +-⋅()()();3HCO-H ++23CO -,K 2=233H CO HCO c c c +--⋅()()();且K 1>K 2。
2.意义:相同条件下,K 越大→越易电离→酸(或碱)性越强3.特点:多元弱酸是分步电离的,各级电离常数的大小关系是K 1≫K 2……,所以其酸性主要决定于第一步电离。
4.影响因素5.电离常数的三大应用(1)判断弱酸(或弱碱)的相对强弱,电离常数越大,酸性(或碱性)越强。
(2)判断盐溶液的酸性(或碱性)强弱,电离常数越大,对应的盐水解程度越小,碱性(或酸性)越弱。
(3)判断复分解反应能否发生,一般符合“强酸制弱酸”规律。
6.电离平衡常数相关计算(以弱酸HX 为例)(1)已知c (HX)和c (H +),求电离常数 HXH + + X −起始(mol·L −1):c (HX) 0 0 平衡(mol·L −1):c (HX)−c (H +) c (H +) c (H +)则:K=H XHXc cc+-⋅()()()=2HHX Hcc c++()()-()。
由于弱酸只有极少一部分电离,c(H+)的数值很小,可做近似处理:c(HX)−c(H+)≈c(HX),则K=2HHXcc+()(),代入数值求解即可。
(2)已知c(HX)和电离常数,求c(H+)HX H++X−起始:c(HX)00平衡:c(HX)−c(H+)c(H+) c(H+)则:K=H XHXc cc+-⋅()()()=2HHX Hcc c++()()-()。