羧酸和取代羧酸亲核加成消除反应
- 格式:ppt
- 大小:934.50 KB
- 文档页数:55

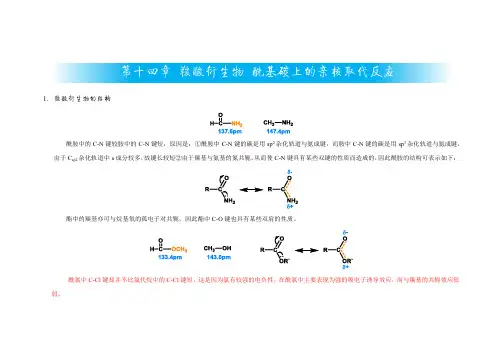
第十四章羧酸衍生物酰基碳上的亲核取代反应1.羧酸衍生物的结构酰胺中的C-N键较胺中的C-N键短,原因是:①酰胺中C-N键的碳是用sp2杂化轨道与氮成键,而胺中C-N键的碳是用sp3杂化轨道与氮成键,由于C sp2杂化轨道中s成分较多,故键长较短②由于羰基与氨基的氮共轭,从而使C-N键具有某些双键的性质而造成的,因此酰胺的结构可表示如下:酯中的羰基亦可与烷基氧的孤电子对共轭,因此酯中C-O键也具有某些双肩的性质。
酰氯中C-Cl键却并不比氯代烷中的C-Cl键短,这是因为氯有较强的电负性,在酰氯中主要表现为强的吸电子诱导效应,而与羰基的共轭效应很弱。
酰胺、酯、酰氯的共振式如下:在酰胺中具有相反电荷的偶系结构是主要的,酯中次之,而在酰氯中这种偶极结构很少。
2.羧酸衍生物的物理性质低级酰氯与酸酐是有刺激气味的液体。
高级的为固体。
低级酯具有芳香的气味,存在于水果中,可用作香料。
十四碳以下的甲酯/乙酯均为液体。
酰胺除甲酰胺外,均是固体,只是因为分子中形成氢键,如果氮上的氢逐个被取代,则氢键缔合减少,因此脂肪族的N-取代酰胺常为液体。
酰氯和酯的沸点因分子中没有缔合,比相应的羧酸低,酸酐与酰胺的沸点,比相应的羧酸高。
(乙酰氯bp:51℃乙酸酐bp:140℃乙酸乙酯bp:77℃乙酰胺bp:222℃)酰氯和酸酐不溶于水,低级的遇水分解;酯在水中的溶解度很小;低级的酰胺可溶于水,N,N-二甲基甲酰胺和N,N-二甲基乙酰胺是很好的非质子性溶剂,可与水以任何比例混合。
乙酸乙酯是很好的有机溶剂,大量用于油漆工业。
3.羧酸衍生物的反应1)酰基碳上的亲核取代反应①酰基碳上的亲核取代反应概述基团离去能力的次序是:I- > Br- > Cl- > -OCOOR > -OR > -OH > -NH2(氨基的碱性比氢氧根强)不管是酸催化还是碱催化的机理,羧酸衍生物亲核取代反应性顺序都是:卤酐醛酮(活泼)酯酸胺腈(较稳定)②羧酸衍生物的水解——形成羧酸a)酰卤的水解在羧酸衍生物中,酰卤的水解速率很快,低分子酰卤水解很猛烈,如乙酰氯在湿空气中会发烟,这是因为乙酰氯水解产生盐酸。

有机化学中的取代反应和消除反应有机化学是研究碳元素及其化合物的化学性质和变化规律的学科。
在有机化学中,取代反应和消除反应是两种常见的反应类型。
它们在有机合成和药物研发等领域中有着重要的应用。
本文将对取代反应和消除反应进行介绍和讨论。
一、取代反应1.1 取代反应的概念取代反应是指一个原子、离子或官能团被另一个原子、离子或官能团所取代的化学反应。
在有机化学中,常见的取代反应包括亲核取代反应和电子亲攻取代反应。
1.2 亲核取代反应亲核取代反应是指亲核试剂与有机分子中电子不足的部位发生反应,亲核试剂中的亲核试剂取代了有机分子中的某功能团或原子。
典型的亲核取代反应包括酯水解、醇醚化反应和酰基取代反应等。
1.3 电子亲攻取代反应电子亲攻取代反应是指亲电试剂与有机分子中的一个亲电中心发生反应,亲电试剂取代了有机分子中的某个官能团或原子。
典型的电子亲攻取代反应包括芳香取代反应和炔烃加成反应等。
二、消除反应2.1 消除反应的概念消除反应是指有机分子中两个官能团之间的化学键发生断裂,生成一个双键或三键的化学反应。
消除反应可以是单分子反应,也可以是双分子反应。
2.2 β-消除反应β-消除反应是指在有机分子中,发生在邻位(β位)碳上的消除反应。
典型的β-消除反应包括醇酸消除反应和芳香羧酸消除反应等。
2.3 δ-消除反应δ-消除反应是指在有机分子中,发生在δ位碳上的消除反应。
典型的δ-消除反应包括酮醇消除反应和烯烃酮消除反应等。
三、应用和进展3.1 应用领域取代反应和消除反应在有机合成中有广泛的应用。
它们可以用于构建复杂分子的骨架,引入特定官能团,改变分子的立体结构等。
这些反应在药物研发、材料科学和农药合成等领域中扮演着重要的角色。
3.2 进展和研究方向随着有机化学的发展,新的取代反应和消除反应不断被发现和探索。
研究人员不断提出新的催化剂、反应条件和底物设计,以改善反应效率、选择性和绿色性。
此外,有机合成中的计算化学方法和机器学习算法也得到了广泛的应用,为反应的理解和优化提供了新的思路和工具。



亲电取代和亲核取代例子亲电取代和亲核取代是有机化学中常见的反应类型,它们分别是指一个原子或基团被一个亲电试剂取代或被一个亲核试剂取代。
下面将分别列举十个例子来说明这两个反应类型。
亲电取代:1. 醇的酸催化醚化反应:醇与酸催化剂反应生成醚。
例如,乙醇与浓硫酸反应生成乙醚。
2. 卤代烷的亲电取代反应:卤代烷与亲电试剂反应生成取代产物。
例如,溴乙烷与氢氧化钠反应生成乙醇。
3. 酮的氧化反应:酮与亲电氧化剂反应生成酮酸。
例如,丙酮与高锰酸钾反应生成丙酮酸。
4. 脂肪酸的酯化反应:脂肪酸与醇反应生成酯。
例如,乙酸与乙醇反应生成乙酸乙酯。
5. 酸催化的烯烃加成反应:烯烃与亲电试剂反应生成加成产物。
例如,丙烯与溴反应生成1,2-二溴丙烷。
6. 羰基化合物的亲电取代反应:羰基化合物与亲电试剂反应生成取代产物。
例如,醛与氨反应生成胺。
7. 羧酸的酯化反应:羧酸与醇反应生成酯。
例如,乙酸与乙醇反应生成乙酸乙酯。
8. 酰卤的亲电取代反应:酰卤与亲电试剂反应生成取代产物。
例如,酰氯与氨反应生成酰胺。
9. 羟醛的亲电取代反应:羟醛与亲电试剂反应生成取代产物。
例如,甲醛与氨反应生成甲酰胺。
10. 羧酸的酯化反应:羧酸与醇反应生成酯。
例如,乙酸与乙醇反应生成乙酸乙酯。
亲核取代:1. 卤代烷的亲核取代反应:卤代烷与亲核试剂反应生成取代产物。
例如,溴乙烷与氢氧化钠反应生成乙醇。
2. 酮的亲核取代反应:酮与亲核试剂反应生成取代产物。
例如,丙酮与甲胺反应生成N-甲基丙酮胺。
3. 羰基化合物的亲核取代反应:羰基化合物与亲核试剂反应生成取代产物。
例如,醛与氨反应生成胺。
4. 酸催化的醇的酯化反应:醇与酸催化剂反应生成酯。
例如,乙醇与乙酸反应生成乙酸乙酯。
5. 羧酸的亲核取代反应:羧酸与亲核试剂反应生成取代产物。
例如,乙酸与氨反应生成乙酰胺。
6. 羧酸的酯化反应:羧酸与醇反应生成酯。
例如,乙酸与乙醇反应生成乙酸乙酯。
7. 羟醛的亲核取代反应:羟醛与亲核试剂反应生成取代产物。


羧酸衍生物答案1、下列羧酸中,酸性最强的是:A、2-氟丙酸B、2-氯丙酸C、2-溴丙酸D、丙酸答案:2-氟丙酸--------------------------------2、由于p-π共轭的影响,使羧基中的C=O键长较醛、酮羰基键长略有所增长,而其C—O键长较醇中的C—O键长短。
答案:对--------------------------------3、将丙酸转化为2-甲基丙二酸,判断下列合成路线是否合理?答案:-------------------------------- 1、下列化合物俗名为:A、乳酸B、苹果酸C、柠檬酸D、酒石酸答案:柠檬酸-------------------------------- 2、下列化合物,经过Tollens试剂作用,然后在酸性条件下加热,得到产物是。
答案:环戊酮-------------------------------- 1、羧酸衍生物水解反应的活性次序是:酰卤脂肪胺> NH3 >芳香胺答案:对-------------------------------- 3、判断下列反应是否正确:答案:错-------------------------------- 1、吡咯、呋喃、噻吩中的杂原子和碳原子均采用sp2杂化轨道成键,每个环中的杂原子提供两个p电子,每个碳原子提供一个p电子,形成6π电子的芳香体系。
答案:对-------------------------------- 2、判断下列反应是否正确:答案:错-------------------------------- 1、发生亲电取代反应活性最高的是:A.a>b>c>d B.b>a>c>d C.d>c>b>a D.c>b>d>a答案:D-------------------------------- 2、下列化合物命名正确的是:A、4-甲基噻唑B、3-甲基噻唑C、2-甲基噻唑D、5-甲基噻唑答案:4-甲基噻唑--------------------------------3、下列化合物碱性由大到小顺序是:④>③>②>①①>②>③>④④>③>①>②②>③>④>①答案:④>③>①>②--------------------------------1、下列羧酸中,酸性最强的是:A、2-氟丙酸B、2-氯丙酸C、2-溴丙酸D、丙酸答案:2-氟丙酸--------------------------------2、由于p-π共轭的影响,使羧基中的C=O键长较醛、酮羰基键长略有所增长,而其C—O键长较醇中的C—O键长短。


第六章羧酸及羧酸衍生物得性质及重要反应机理一、羧酸得化学性质1、酸性羧酸具有酸性,诱导、共轭、场效应等对酸性强弱有影响。
利用羧酸得酸性可以制备羧酸酯与羧酸盐。
2、亲核取代反应这就是羧酸在一定条件下转变成羧酸生物得反应。
大多数亲核取代反应就是通过加成-消除历程完成得。
3、还原反应羧酸能被LiAlH4与B2H6还原成相应得伯醇。
4、α-H得卤化(Hell-Volhard-Zelinsky反应)通过控制卤素得用量可以制备一元或多元得卤代羧酸,并进一步制备羟基酸与氨基酸。
5、脱羧反应羧酸在适当得条件下,一般都能发生脱羧反应,这就是缩短碳链得反应。
通常得脱羧反应表示如下:A为-COOH、-CN、-(C=O)R、-NO2、-CX3、-C=O、C6H5-等吸电子基团时,脱羧反应相当容易进行。
此外还有一些特殊得脱羧方法。
二元羧酸得脱羧规律就是:乙二酸、丙二酸、加热失羧,丁二酸、戊二酸加热就是水生成分子内酸酐,己二酸、庚二酸加热就是水、失羧生成环酮。
根据以上反应可以得出一个结论,在有机反应中有成环可能时,一般易形成五元环或六元环。
这称为布朗克(Blanc)规则。
二、羧酸衍生物得化学性质1、亲核取代反应这就是羧酸衍生物得转换反应。
转换得活性顺序为:RCOX>CRCOOOCR>RCOOR′>RCONR2酸与碱都能催化反应。
2、与有机金属化合物得反应选用空阻大得酰卤,反应能控制在酮得阶段。
选用甲酸酯,可以制备对称二级醇。
选用碳酸酯,可制备三个烃基相同得三级醇。
二元酸得环状酸酐可用来制备酮酸。
酰胺氮上有活泼氢,一般不宜使用。
3、还原反应反应物还原剂NaBH4LiAlH4催化氢化B2H6RCOCl Rosenmund法RCHO+ + RCH2OH RCOOOCR + + + + 2RCH2OHRCOOR′+ +特殊催化剂+ RCH2OHR′OHRCONH2+ +特殊催化剂+ RCH2NH2RCN + + RCH2NH2反应、Bouveault-Blanc反应、酮醇反应、酯得热裂等见重要反应机理。