卤代烃亲核取代反应
- 格式:ppt
- 大小:820.00 KB
- 文档页数:23


卤代烃的化学反应卤代烃的化学反应2010-04-2708:54卤代烃由烃基和卤素两部分组成,C-X键是卤代烃的官能团,也是化学反应容易发生的地方,当然,烃基也可以发生前面各章所讲的烃类的反应。
本节只讨论发生在C-X键上的反应以及由于C-X键的存在而发生的一些烃基上的反应。
5.3.1脂肪族卤代烃亲核取代反应脂肪族卤代烃亲核取代反应的基本形式为:亲核取代反应是卤代烃的一个特征反应。
在这个反应中,反应物中的离去基团离开,亲核试剂代替离去基团,形成产物。
表5.5列出了卤代烃的一些常见亲核取代反应。
表5.5一些常见的卤代烃亲核取代反应R-X亲核试剂反应产物OH-ROH+X-H2OROH+HXR'O-R'-O-R+X-R'C≡C-RC≡CR'+X-R'2CuLiR-R'I-R-I+X-CN-R-CN+X-R'COO-R'COOR+X-NH3R-NH2+X-NH2R'RNHR'+X-NHR'2RNR'2+X-PPh3[RPPh3]+X-SH-RSH+X-SR'RSR'+X-ArH,AlCl3Ar-R+X-[CH(COOR')2]-RCH(COOR')2+X-[CH3COCHCOOR']-CH3COCHRCOOR'+X-AgNO3RONO2+AgX5.3.1.1被羟基取代卤代烷与NaOH水溶液共热,卤原子则被羟基-OH取代,产物是醇:这个反应也叫做卤代烃的水解反应。
一般卤代烷都可由相应的醇制得,故对于较简单的卤代烷,这个反应的合成价值不高。
而对于一些比较复杂的分子,引入一个羟基常比引入一个卤素原子困难。
故在合成上往往先引入卤素原子,然后水解再引入羟基。
例如工业上将一氯戊烷的各种异构体混合物通过水解反应制得戊醇各种异构体的混合物,用作工业溶剂。
卤代烷水解反应速度与卤代烷的结构、反应溶剂及反应条件等有关。





六, 卤代烃的亲核取代反应、消除反应及和金属的反应卤代烃的亲和取代和消除是有机化学中的难点,希望同学们能比较仔细地阅读本部分内容。
这里有一些内容和一般的教科书中介绍的有所不同。
6-1 卤代烃的亲核取代反应,S N1和S N2在有机化学反应中,常常把反应物分为底物和试剂。
在讨论卤代烃的反应中,卤代烃就是底物。
本节主要讨论卤代烷作为底物的取代反应。
卤代烷就是烷烃中的一个氢为卤素取代的“结构为RX(R=烷基,X=卤素)的化合物,又称为烷基卤[化物],P5。
”取代反应就是“分子中某一原子或基团被另一原子或基团替换的基元或分步反应,P86。
”卤代烷的亲核取代反应就是富电子的或带负电荷的试剂把卤代烃中卤素取代下来的反应。
这个反应在合成中非常有用。
例如:RX + Na+ -OH −→ROH + Na+X-RX + Na+ -OR’−→ROR’ + Na+X-制醚的重要方法,称为Williamson醚合成法RX + Na+ -CN −→RCN + Na+X-制腈的重要方法RX + Na+ -C≡CH −→RC≡CH + Na+X-把炔键引入分子从上面的几个反应来看,钠离子没有在反应中起作用,起作用的是-OH、-OR、-CN、-C≡CH等负离子。
是这些负离子把卤素负离子取代了下来。
在这个反应中卤代烷中的卤素是带着一对电子成为卤素负离子离去的,叫做离去基团。
如果把带负电荷的亲核试剂写成Nu-而把离去基团写成-L。
那么卤代烷的亲核取代反应就可以拓展为:R-L + Nu-−→RNu + L-这实际上可看成是一个广义的酸碱反应。
只要是带负电荷的亲核试剂Nu-的碱性比取代下来的离去基团L-的碱性强,这种反应就能发生。
亲核试剂可以是:HO-、RO-、CN-、HC≡C-、RCOO-、CH3COC-HCOOC2H5(以后会知道这就是乙酰乙酸乙酯的合成法)、C2H5OOCC-HCOOC2H5(丙二酸二乙酯合成法)……如果把上面的氧原子换成硫原子,又是一批亲核试剂。
亲核取代反应历程卤代烃的亲核取代反应是一类重要反应,由于这类反应可用于各种官能团的转变,在有机合成中具有广泛的用途,因此,对其反应历程的研究也就比较重要。
在亲核取代反应中,研究最多的是卤代烃的水解,在反应的动力学、立体化学,以及卤代物的结构,溶剂等对反应速率的影响等都有不少的资料。
根据化学动力学的研究及许多实验表明,卤代烃的亲核取代反应是按两种历程进行的,即双分子亲核取代反应(S N 2反应)和单分子亲核取代反应(S N 1反应)。
一、双分子亲核取代反应(S N 2反应)实验证明:伯卤代烃的水解反应为S N 2历程。
RCH 2Br+OH -→RCH 2OH+Br -,v =k [RCH 2Br]·[OH -],v 为水解速率,k 为水解常数。
因为RCH 2Br 的水解速率与RCH 2Br 和OH -的浓度有关,所以叫做 双分子亲核取代反应(S N 2反应)。
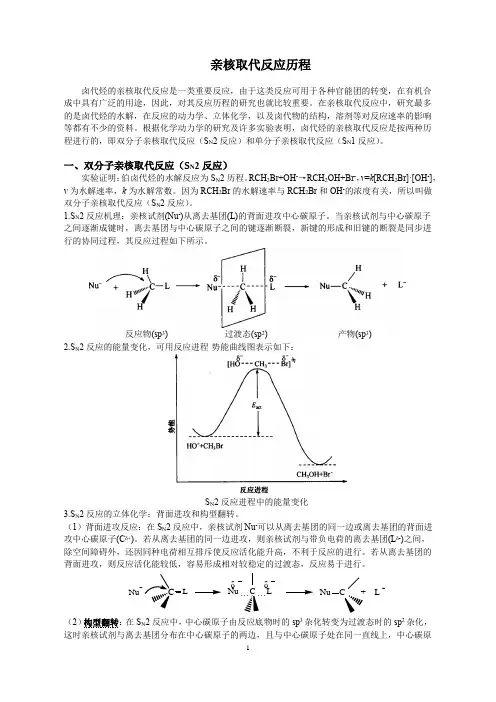
1.S N 2反应机理:亲核试剂(Nu -)从离去基团(L)的背面进攻中心碳原子。
当亲核试剂与中心碳原子之间逐渐成键时,离去基团与中心碳原子之间的键逐渐断裂,新键的形成和旧键的断裂是同步进行的协同过程,其反应过程如下所示。
反应物(sp 3) 过渡态(sp 2)产物(sp 3) 2.S N 2反应的能量变化,可用反应进程-势能曲线图表示如下:S N 2反应进程中的能量变化3.S N 2反应的立体化学:背面进攻和构型翻转。
(1)背面进攻反应:在S N 2反应中,亲核试剂Nu -可以从离去基团的同一边或离去基团的背面进攻中心碳原子(C δ+)。
若从离去基团的同一边进攻,则亲核试剂与带负电荷的离去基团(L δ-)之间,除空间障碍外,还因同种电荷相互排斥使反应活化能升高,不利于反应的进行。
若从离去基团的背面进攻,则反应活化能较低,容易形成相对较稳定的过渡态,反应易于进行。
(2)构型翻转:在S N 2反应中,中心碳原子由反应底物时的sp 3杂化转变为过渡态时的sp 2杂化,这时亲核试剂与离去基团分布在中心碳原子的两边,且与中心碳原子处在同一直线上,中心碳原CδδNu C + L -δδNu C + L δδNu C + L -Nu子与它上面的其他三个基团处于同一平面内。


卤代烃亲核取代反应
卤代烃亲核取代反应是有机化学中常见的一个类型的反应。
它是指一个亲核试剂(通常是一个亲电性离子或分子)与一个卤代烃反应,取代掉烃分子中的卤素原子。
在反应中,亲核试剂与卤代烃发生反应,亲核试剂中的亲核原子(通常是负电荷的氧、硫、氮等)攻击卤代烃中的卤素原子,形成一个新的化合物。
反应机制通常涉及一个亲核试剂的核攻击、卤素原子的离去以及负电荷的平衡。
常见的卤代烃亲核取代反应包括:醇的亲核取代反应(例如SN1和SN2反应)、硫醇的亲核取代反应、醛和酮的亲核加成反应、羧酸和酰氯的亲核取代反应等。
卤代烃亲核取代反应在有机合成中非常重要,它可以用于合成新的有机化合物、引入功能团或产生新的化学键。
《亲核取代反应历程》【学习要求】1、了解卤代烃亲核取代反应的两种历程: S N 1和S N 2历程及其特点2、了解S N 1历程中的反应活性中间体——碳正离子和S N 2历程中过渡态的概念3、会判断复杂反应中决定反应速度的步骤4、掌握卤代烃分子中烃基结构对亲核取代反应历程的影响一、亲核取代反应反应历程在亲核取代反应中,研究得最多的是卤代烷的水解,在反应的动力学、立体 化学,以及卤代物的结构,溶剂等对反应速度的影响等都有不少的资料。
根据化学动力学的研究及许多实验表明,卤代烷的亲核取代反应是按两种历程进行的。
即双分子亲核取代反应(S N 2反应)和单分子亲核取代反应(S N 1反应)。
(一)双分子亲核取代反应(S N 2反应) 实验证明:伯卤代烷的水解反应为S N 2历程。
因为RCH 2Br 的水解速率与RCH 2Br 和OH -的浓度有关,所以叫做双分子亲核取代反应(S N 2反应)。
1、反应机理一步完成(新键的形成和旧键的断裂同步进行),无中间体生成,经过一个不稳定的“过渡态”。
其反应过程中的轨道重叠变化如下图所示:RCH 2Br + OH -RCH 2OH + Br-V = K[ RCH 2Br ] [ OH -]V =K =水解速度水解常数HHOC HHO +δδ+ Br过渡态+反应成键过程中轨道转变示意图S N 22、S N 2反应的能量变化S N 2反应机理的能量变化可用反应进程 — 位能曲线图表示如下:3、S N 2反应的立体化学1)异面进攻反应(Nu -从离去基团L 的背面进攻反应中心)。
2) 构型翻转(产物的构型与底物的构型相反——瓦尔登Walden 转化)。
例如:实例说明,通过水解反应,手性中心碳原子的构型发生了翻转。
根据大量立体化学和动力学研究材料,可以得出下面的结论:按双分子历程进行亲核取代反应,总是伴随着构型的翻转。
也就是说,完全的构型转化往往可作为双分子亲核取代反应的标志。