卤代烃的亲核取代反应机制
- 格式:ppt
- 大小:198.00 KB
- 文档页数:12



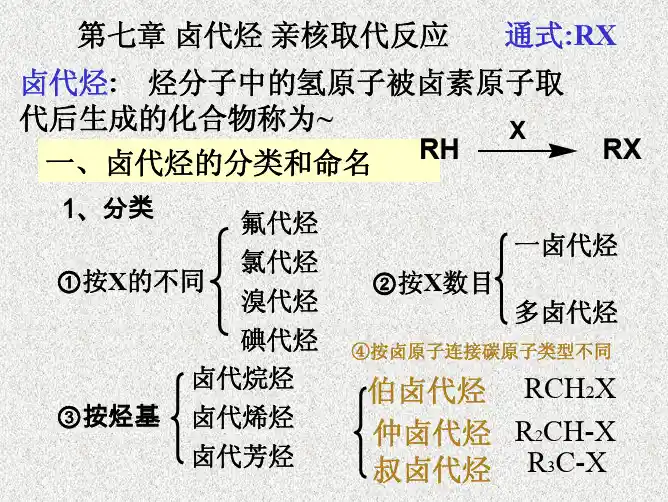
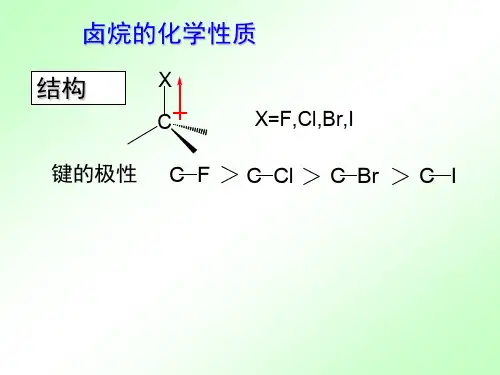


有机化学基础知识点整理卤代烃的消除反应和亲核取代反应有机化学基础知识点整理:卤代烃的消除反应和亲核取代反应有机化学中,卤代烃是一类重要的化合物。
它们包含有一个或多个卤素原子,如氯、溴、或碘,与碳原子相连。
在有机合成和反应中,卤代烃经常被用作起始物质或中间体。
在本文中,我们将重点介绍卤代烃的消除反应和亲核取代反应两个重要的基础知识点。
一、卤代烃的消除反应卤代烃的消除反应是指在适当的条件下,卤素原子与相邻碳原子之间的化学键断裂,从而形成一个双键或三键,并且卤素原子被去除。
常见的消除反应有β-消除反应和氢化物消除反应。
1. β-消除反应β-消除反应是指当卤代烃的邻碳上有一个或多个氢原子时,卤素和一个氢原子同时被去除,形成一个双键。
常见的β-消除反应有氢氧化钠和氨水处理。
例如,当2-溴丙烷与氢氧化钠反应时,产物为丙烯和溴化钠:CH3CHBrCH3 + NaOH → CH2=CHCH3 + NaBr + H2O2. 氢化物消除反应氢化物消除反应是指当卤代烃中没有邻碳上的氢原子时,卤素与一个氢化物离子(如乙醇钠)同时被去除,形成烯烃。
例如,当1,2-二溴乙烷与乙醇钠反应时,产物为乙烯和溴化钠:CH2Br-CH2Br + 2 NaOEt → CH2=CH2 + 2 NaBr + EtOH二、卤代烃的亲核取代反应卤代烃的亲核取代反应是指一个亲核试剂与卤代烃发生反应,亲核试剂的亲电子进攻和取代卤素原子,形成一个新的化合物。
亲核取代反应是有机合成中最常见的反应之一。
1. SN1 亲核取代反应SN1 亲核取代反应是指在两步反应中,第一步生成一个稳定的卤代烷离子,然后在第二步中,亲核试剂攻击离子,取代卤素原子。
SN1亲核取代反应通常发生在三级卤代烷上,存在亲核试剂的浓度低的情况下。
例如,当溴代异丙基反应生成异丙基碳离子,然后氢氧化钠攻击碳离子,形成异丙醇:(CH3)3C-Br + NaOH → (CH3)3C-OH + NaBr2. SN2 亲核取代反应SN2 亲核取代反应是指在一步反应中,亲核试剂直接攻击卤素原子,并取代它。

卤代烃亲核取代和消除反应机理亲核取代反应历程卤代烃的亲核取代反应是⼀类重要反应,由于这类反应可⽤于各种官能团的转变,在有机合成中具有⼴泛的⽤途,因此,对其反应历程的研究也就⽐较重要。
在亲核取代反应中,研究最多的是卤代烃的⽔解,在反应的动⼒学、⽴体化学,以及卤代物的结构,溶剂等对反应速率的影响等都有不少的资料。
根据化学动⼒学的研究及许多实验表明,卤代烃的亲核取代反应是按两种历程进⾏的,即双分⼦亲核取代反应(S N 2反应)和单分⼦亲核取代反应(S N 1反应)。
⼀、双分⼦亲核取代反应(S N 2反应)实验证明:伯卤代烃的⽔解反应为S N 2历程。
RCH 2Br+OH -→RCH 2OH+Br -,v =k [RCH 2Br]·[OH -],v 为⽔解速率,k 为⽔解常数。
因为RCH 2Br 的⽔解速率与RCH 2Br 和OH -的浓度有关,所以叫做双分⼦亲核取代反应(S N 2反应)。
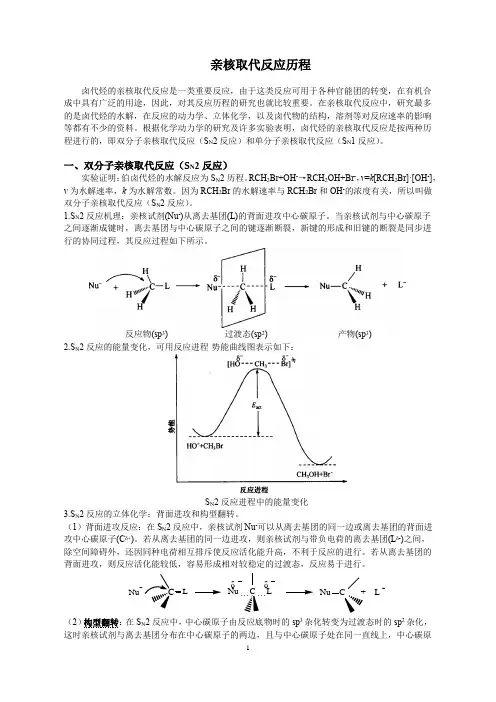
1.S N 2反应机理:亲核试剂(Nu -)从离去基团(L)的背⾯进攻中⼼碳原⼦。
当亲核试剂与中⼼碳原⼦之间逐渐成键时,离去基团与中⼼碳原⼦之间的键逐渐断裂,新键的形成和旧键的断裂是同步进⾏的协同过程,其反应过程如下所⽰。
反应物(sp 3) 过渡态(sp 2)产物(sp 3) 2.S N 2反应的能量变化,可⽤反应进程-势能曲线图表⽰如下:S N 2反应进程中的能量变化3.S N 2反应的⽴体化学:背⾯进攻和构型翻转。
(1)背⾯进攻反应:在S N 2反应中,亲核试剂Nu -可以从离去基团的同⼀边或离去基团的背⾯进攻中⼼碳原⼦(C δ+)。
若从离去基团的同⼀边进攻,则亲核试剂与带负电荷的离去基团(L δ-)之间,除空间障碍外,还因同种电荷相互排斥使反应活化能升⾼,不利于反应的进⾏。
若从离去基团的背⾯进攻,则反应活化能较低,容易形成相对较稳定的过渡态,反应易于进⾏。
(2)构型翻转:在S N 2反应中,中⼼碳原⼦由反应底物时的sp 3杂化转变为过渡态时的sp 2杂化,这时亲核试剂与离去基团分布在中⼼碳原⼦的两边,且与中⼼碳原⼦处在同⼀直线上,中⼼碳原CδδNu C + L -δδNu C + L δδNu C + L -Nu⼦与它上⾯的其他三个基团处于同⼀平⾯内。


亲核取代反应历程卤代烃的亲核取代反应是一类重要反应,由于这类反应可用于各种官能团的转变,在有机合成中具有广泛的用途,因此,对其反应历程的研究也就比较重要。
在亲核取代反应中,研究最多的是卤代烃的水解,在反应的动力学、立体化学,以及卤代物的结构,溶剂等对反应速率的影响等都有不少的资料。
根据化学动力学的研究及许多实验表明,卤代烃的亲核取代反应是按两种历程进行的,即双分子亲核取代反应(S N 2反应)和单分子亲核取代反应(S N 1反应)。
一、双分子亲核取代反应(S N 2反应)实验证明:伯卤代烃的水解反应为S N 2历程。
RCH 2Br+OH -→RCH 2OH+Br -,v =k [RCH 2Br]·[OH -],v 为水解速率,k 为水解常数。
因为RCH 2Br 的水解速率与RCH 2Br 和OH -的浓度有关,所以叫做 双分子亲核取代反应(S N 2反应)。
1.S N 2反应机理:亲核试剂(Nu -)从离去基团(L)的背面进攻中心碳原子。
当亲核试剂与中心碳原子之间逐渐成键时,离去基团与中心碳原子之间的键逐渐断裂,新键的形成和旧键的断裂是同步进行的协同过程,其反应过程如下所示。
反应物(sp 3) 过渡态(sp 2)产物(sp 3) 2.S N 2反应的能量变化,可用反应进程-势能曲线图表示如下:S N 2反应进程中的能量变化3.S N 2反应的立体化学:背面进攻和构型翻转。
(1)背面进攻反应:在S N 2反应中,亲核试剂Nu -可以从离去基团的同一边或离去基团的背面进攻中心碳原子(C δ+)。
若从离去基团的同一边进攻,则亲核试剂与带负电荷的离去基团(L δ-)之间,除空间障碍外,还因同种电荷相互排斥使反应活化能升高,不利于反应的进行。
若从离去基团的背面进攻,则反应活化能较低,容易形成相对较稳定的过渡态,反应易于进行。
(2)构型翻转:在S N 2反应中,中心碳原子由反应底物时的sp 3杂化转变为过渡态时的sp 2杂化,这时亲核试剂与离去基团分布在中心碳原子的两边,且与中心碳原子处在同一直线上,中心碳原CδδNu C + L -δδNu C + L δδNu C + L -Nu子与它上面的其他三个基团处于同一平面内。
n-杂环卡宾参与的芳香醛与卤代烃的亲核取代反应及其机
理研究
N杂环卡宾(NHCs)是极性反转的有机催化反应中最常用的有机小分子催化剂之一。
NHCs参与的各类反应中,以Stetter反应通常在不对称催化和天然产物、药物中间体合成中起到关键作用而倍受关注,但亲电试剂局限于以不饱和羰基化合物为代表的Michael受体。
NHCs参与的亲核取代反应是NHCs在极性反转的应用中较新型的一类,目前有关的亲核取代反应的报道中底物往往缺乏多样性,或者反应仅限于分子内的亲核取代,或者反应实质上还是属于经典Stetter反应。
在我们研究的NHC参与的亲核取代反应中以卤代烃Michael受体作为亲电试剂,在NHC参与下与芳香醛进行反应,不但拓宽了类反应的底物范围和反应类型而且建立了方便合成各种含乙酮基结构单元的,包括α-芳基酮在内的各种酮类化合物的新方法,该类化合物是重要的医药、香精香料中间体或生物活性分子。
卤代烃亲核取代反应机理演示一、卤代烃亲核取代反应简介卤代烃亲核取代反应是一类重要的有机化学反应,其机理主要是由亲核试剂攻击卤代烃而产生的。
在该反应中,卤素原子可以被氢、羟基、氨基等亲核试剂所取代,从而形成新的化合物。
这种反应通常需要在有机溶剂中进行,并需要适当的温度和时间。
二、卤代烃亲核取代反应机理1. 亲核试剂的攻击在卤代烃亲核取代反应中,首先需要有一个具有强亲核性质的试剂来攻击卤素原子。
这个试剂通常是一个带有负电荷或富电子密度的分子,例如羟基离子、氨基离子等。
当这些试剂接近到卤素原子附近时,它们会攻击卤素原子上的δ+电荷,从而形成一个共价键。
2. 形成中间体在经过第一步后,形成了一个新的分子,其中一个原子与卤素原子共享了一个电对。
这个中间体通常不稳定,并且容易发生进一步反应。
在某些情况下,这个中间体可以通过脱离卤素原子上的卤素离子来稳定下来。
在其他情况下,这个中间体可以被其他试剂攻击,从而形成更加复杂的化合物。
3. 形成新化合物在经过第二步后,形成了一个新的化合物。
这个新化合物通常是一个取代了卤素原子的分子。
在某些情况下,这个新分子可能会继续发生反应,并形成其他类型的分子。
三、卤代烃亲核取代反应实例1. 羟基离子与卤代烃反应羟基离子是一种强亲核试剂,在有机化学中广泛应用。
当羟基离子接近到卤素原子附近时,它会攻击卤素原子上的δ+电荷,并形成一个共价键。
随后,羟基离子会从卤素原子上脱离出来,并形成一个新的醇分子。
2. 氨基离子与卤代烃反应氨基离子也是一种常见的亲核试剂,在有机化学中广泛应用。
当氨基离子接近到卤素原子附近时,它会攻击卤素原子上的δ+电荷,并形成一个共价键。
随后,氨基离子会从卤素原子上脱离出来,并形成一个新的胺分子。
四、总结卤代烃亲核取代反应是一种重要的有机化学反应,其机理主要是由亲核试剂攻击卤素原子而产生的。
在该反应中,卤素原子可以被氢、羟基、氨基等亲核试剂所取代,从而形成新的化合物。