专题-粗盐中可溶性杂质的去除
- 格式:ppt
- 大小:332.15 KB
- 文档页数:9




专题08 粗盐中可溶性杂质的去除学校:___________姓名:___________班级:___________考号:___________一、填空题1.(2021·河南模拟)实验室除去粗实验中难溶性杂质的主要实验步骤有:溶解、______、蒸发;除去粗实验水中的杂质CaC12、MgC12、Na 2SO 4,可依次加入过量的NaOH 、______、Na 2CO 3溶液,分离出沉淀后,再加入适量盐酸,其作用是______。
2.(2021·开封二模)为了除去粗盐中的 2CaCl 、MgSO 4等可溶性杂质,需进行如下操作:①溶解;②依次加过量的 2Ba OH ()、23Na CO 溶液;③过滤;④加适量稀盐酸;⑤蒸发结晶。
(1)写出加入过量氢氧化钡发生反应的化学方程式______。
(2)若操作③和操作④顺序颠倒,导致所制得的精盐中有哪些杂质?______。
(3)请设计实验证明过滤后的溶液中所含有的杂质。
______(简要写出实验步骤、现象和结论) 3.(2021·平顶山二模)除去NaCl 溶液中CaCl 2、MgSO 4杂质得到NaCl 晶体的操作有:①加过量Ba(OH)2溶液;②加过量Na 2CO 3溶液;③过滤;④加适量稀盐酸;⑤蒸发结晶。
(1)操作③中用到的玻璃仪器有烧杯、漏斗和_______。
(2)写出加入Ba(OH)2溶液发生反应的化学方程式______。
(3)加适量稀盐酸的目的是什么?______4.(2021·许昌一模)为除去粗盐中CaCl 2、MgCl 2、Na 2SO 4等可溶性杂质,需进行如下操作:①溶解;②依次加过量的BaCl 2、NaOH 、Na 2CO 3溶液;③过滤;④加适量盐酸;⑤蒸发、结晶。
(1)整个实验过程发生的化学变化中,生成氯化钠的复分解反应有______个?(不考虑氯化钙与氢氧化钠的反应)(2)若将BaCl 2、NaOH 溶液换成2Ba(OH)溶液,此时Na 2CO 3的作用是______?5.(2021·平顶山一模)已知某粗盐样品混有硫酸钠(Na 2SO 4),为了除去杂质并制得纯净的氯化钠固体,某学生设计方案如图所示(步骤②③中加入试剂均过量),请回答下列问题:(提示:悬浊液为不溶性固体小颗粒悬浮在液体中形成的混合物)(1)写出此方案中除去Na2SO4反应的化学方程式______。





粗盐中可溶性杂质的去除专题练习1.下图是去除粗盐中难溶性杂质的实验操作,其中正确的是A.取粗盐B.溶解C.过滤D.蒸发【答案】B【解析】A、取用药品瓶塞倒放,以免沾染杂质污染试剂,故图示操作错误;B、溶解使用玻璃棒搅拌,故图示操作正确;C、过滤液体时,要注意“一贴、二低、三靠”的原则,图中缺少玻璃棒引流,故图示操作错误;D、正在加热的蒸发皿温度较高,为防止烫伤手,不能用手直接拿热的蒸发皿,应用坩埚钳夹取,故图示操作错误。
故选B。
2.为除去粗盐水中的MgCl2杂质,某同学设计的实验方案如下:在该粗盐水中加入过量的氢氧化钠溶液;充分反应后过滤,向滤液中加入适量盐酸。
(1)过滤操作中使用的玻璃仪器有烧杯、玻璃棒和______。
(2)写出加入NaOH溶液后所发生反应的化学方程式______。
(3)若将滤液在空气中敞口放置一段时间,则所得滤液中一定含有的溶质是______。
【答案】(1)漏斗(2)MgCl2+2NaOH=Mg(OH)2↓+2NaCl(3)NaCl、Na2CO3【解析】(1)过滤操作中使用的玻璃仪器有烧杯、玻璃棒和漏斗;(2)NaOH溶液与氯化镁反应生成氢氧化镁沉淀和氯化钠,所以加入NaOH溶液后所发生反应的化学方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;(3)因为在该粗盐水中加入过量的氢氧化钠溶液,所以滤液中含有NaOH,NaOH能与空气中的二氧化碳反应生成碳酸钠、水,故所得滤液中一定含有的溶质是Na2CO3及生成的NaCl。
3.除去NaCl溶液中CaCl2、MgSO4杂质,得到NaCl晶体的操作有①加过量Ba(OH)2溶液:②加过量Na2CO3溶液:③过滤:④加适量稀盐酸:⑤蒸发结晶。
(1)操作③中用到的玻璃仪器有烧杯、漏斗和_______。
(2)写出加入Na2CO3溶液发生反应的化学方程式________。
(写一个化学方程式即可)试卷第2页,共14页(3)加适量稀盐酸的目的是________。
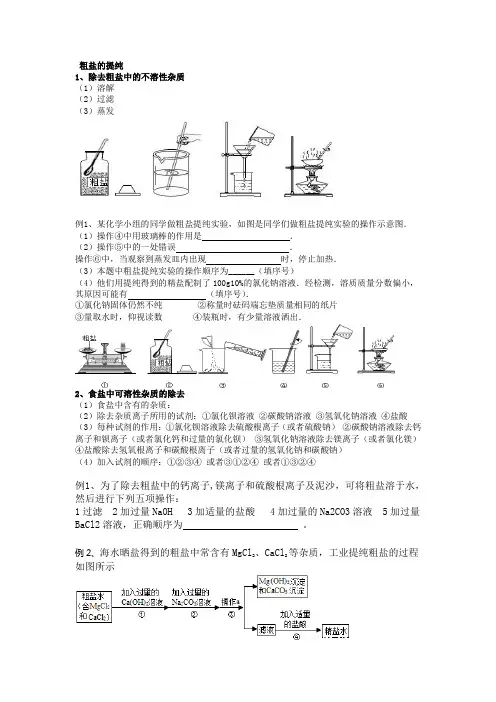
粗盐的提纯1、除去粗盐中的不溶性杂质(1)溶解(2)过滤(3)蒸发例1、某化学小组的同学做粗盐提纯实验,如图是同学们做粗盐提纯实验的操作示意图.(1)操作④中用玻璃棒的作用是.(2)操作⑤中的一处错误.操作⑥中,当观察到蒸发皿内出现时,停止加热.(3)本题中粗盐提纯实验的操作顺序为______(填序号)(4)他们用提纯得到的精盐配制了100g10%的氯化钠溶液.经检测,溶质质量分数偏小,其原因可能有(填序号).①氯化钠固体仍然不纯②称量时砝码端忘垫质量相同的纸片③量取水时,仰视读数④装瓶时,有少量溶液洒出.2、食盐中可溶性杂质的除去(1)食盐中含有的杂质:(2)除去杂质离子所用的试剂:①氯化钡溶液②碳酸钠溶液③氢氧化钠溶液④盐酸(3)每种试剂的作用:①氯化钡溶液除去硫酸根离子(或者硫酸钠)②碳酸钠溶液除去钙离子和钡离子(或者氯化钙和过量的氯化钡)③氢氧化钠溶液除去镁离子(或者氯化镁)④盐酸除去氢氧根离子和碳酸根离子(或者过量的氢氧化钠和碳酸钠)(4)加入试剂的顺序:①②③④或者③①②④或者①③②④例1、为了除去粗盐中的钙离子,镁离子和硫酸根离子及泥沙,可将粗盐溶于水,然后进行下列五项操作:1过滤 2加过量NaOH 3加适量的盐酸 4加过量的Na2CO3溶液 5加过量BaCl2溶液,正确顺序为。
例2、海水晒盐得到的粗盐中常含有MgCl2、CaCl2等杂质,工业提纯粗盐的过程如图所示(1)步骤①反应的化学方程式为.(2)步骤③中操作a的名称是;步骤④加入适量盐酸的目的是除去滤液中的Na2CO3和.(3)蒸发精盐水到即停止加热,然后继续搅拌得到精盐.(4)若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有例3、盐城濒临黄海,海盐文化全国知名.某兴趣小组同学去盐场参观,带回了部分粗盐样品,并对其进行了如下探究(1)操作①中必须用到的一种仪器是(填序号)A.研钵 B.量筒 C.烧杯 D.试管(2)操作③的名称是,操作④中用到玻璃棒,作用为.(3)用提纯得到的“精盐”配制100g 7.5%的氯化钠溶液.经检测,溶质质量分数偏小,其原因可能有(填序号)①氯化钠固体不纯②称量时精盐与砝码放反了③量取水时俯视读数④装瓶时,有少量溶液洒出(4)查阅资料得知:粗盐中除含少量泥沙等不溶性杂质外,还含有少量的可溶性杂质(假定可溶性杂质只有MgCl2一种),为了得到较纯净的氯化钠,小组同学将所得的“精盐”又作了如下处理:①白色沉淀的化学式为.②在得到的滤液中加入足量的稀盐酸的目的是.③若实验过程中不考虑损耗,最终到的NaCl固体的质量(填“大于”、“小于”或“等于”)原精盐中NaCl的质量。

粗盐中CaCl2、MgCl2、Na2SO4杂质清除环节1、加入过量旳NaOH溶液。
【目旳:除去MgCl2。
】2、加入过量旳BaCl2溶液。
【目旳:除去Na2SO4。
】3、加入过量旳Na2CO3溶液。
【目旳:除去CaCl2与多余旳BaCl2。
】4、过滤。
【目旳:过滤出Mg(OH)2、BaSO4、CaCO3、BaCO3。
】5、加入过量稀盐酸。
【目旳:除去多余旳NaOH 与多余旳Na2CO3。
】6、蒸发结晶。
【要点】1、加氢氧化钠与加氯化钡旳顺序可以调换。
2、加氯化钡与加碳酸钠旳顺序不能颠倒。
3、加盐酸前先过滤。
专项训练1、粗盐中具有MgCl2、CaCl2等杂质,必须进行分离和提纯后才干用于工业生产和人们旳平常生活.粗盐提纯旳部分流程如下图:ﻫ请回答:ﻫ(1)环节②加入过量旳碳酸钠溶液旳目旳是______,反映旳化学方程式为________________________________________________________;2(ﻫ)环节④加入适量盐酸旳目旳是;ﻫ(3)若环节①和环节②旳顺序颠倒,则最后所得旳精盐水中还具有______(填化学式).2、通过海水提取旳粗盐中具有MgCl2、CaCl2、MgSO4。
以及泥沙等杂质。
如下是一种制备精盐旳实验方案(用于沉淀旳试剂均过量)。
ﻫ请回答问题:1(ﻫ)环节①中旳BaCl2不能改成Ba(NO3)2,其因素是什么?ﻫ(2)进行环节①后,如何判断BaCl2与否过量?(3)加入Na2CO3旳目旳是什么?ﻫ(4)以上粗盐提纯旳有关操作中需用到旳重要仪器有哪些?(5)该实验方案还需完善,请写出具体旳操作环节。
3、粗盐中具有一定旳杂质如MgCl2、CaCl2和硫酸盐,目前想除掉这些杂质,请选择合适旳试剂除杂.(1)除去Na2SO4,应加入,化学方程式(2)除去MgCl2,应加入,化学方程式(3)除去CaCl2,应加入, 化学方程式(4)过滤,所得滤液中除了NaCl还具有杂质,要除去这种杂质得到精致旳NaCl溶液应向滤液中加入至。
第一部分考点透析重难突破(九)粗盐中可溶性杂质的去除总分:9分挑战用时:20分钟实际得分:1.(2023南阳三模)为除去粗盐中混有的少量MgCl2、CaCl2、Na2SO4,得到纯净的氯化钠晶体,可将粗盐溶于水,进行以下操作:①加过量的Na2CO3溶液;②加过量的Ba(OH)2溶液;③加过量的稀盐酸;④过滤;⑤加热蒸发。
下列说法不正确的是(D)A.正确的操作顺序为②①④③⑤B.该实验过程中共发生7个复分解反应C.加入过量的稀盐酸不影响氯化钠的纯度D.理论上最终所得氯化钠质量与粗盐中氯化钠质量相等2.海水晒制得到的粗盐中除含NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,以下是将粗盐进行提纯的实验步骤。
(1)步骤Ⅰ和步骤Ⅱ都涉及的实验操作是过滤。
(2)为了除去溶液A中的可溶性杂质,应按顺序分别加入过量的NaOH溶液、BaCl2溶液、Na2CO3溶液,请写出加入NaOH时发生反映的化学方程式。
MgCl2+2NaOH Mg(OH)2↓+2NaCl-。
(3)除去溶液B中的杂质,不能选用稀硝酸的原因是会引入新的杂质离子N O33.(2023安阳模拟)为除去氯化钠中的CaCl2、MgCl2、Na2SO4杂质,某化学兴趣小组取粗盐水按以下流程进行实验探究。
(1)加入过量碳酸钠溶液的目的是什么?除去溶液中的氯化钙和氯化钡。
(2)请设计实验证明过滤后滤液中含有的杂质。
取样,向滤液中加入过量的氯化钡溶液,有白色沉淀产生,证明滤液中含有碳酸钠;静置,向上层清液中滴加无色酚酞溶液,溶液变红,证明溶液中含有氢氧化钠。
4.(2023洛阳三模)岩盐之都——河南叶县出产大量优质食盐。
粗盐中除泥沙外还含有氯化镁、硫酸钠、氯化钙杂质。
为了得到纯净的食盐水,进行了如下实验操作:(1)操作Ⅰ和Ⅴ中均用到玻璃棒,该仪器在操作Ⅰ和Ⅴ中的作用分别是什么?在操作Ⅰ中的作用是搅拌、加速溶解,在操作V中的作用是引流。
(2)为简化实验,可将步骤Ⅱ和Ⅲ合为一步,即只加入一种试剂就可达到实验目的,请写出一个加入该试剂后发生反应的化学方程式。