早期大肠癌内镜诊2016
- 格式:ppt
- 大小:28.40 MB
- 文档页数:78



内镜下早期大肠癌的诊断与治疗标签:大肠癌;诊断;治疗;内镜大肠癌(colorectal cancer)是最常见的消化道恶性肿瘤之一,起病隐匿,早期无明显症状,临床确诊时,常已到中晚期,疗效欠佳。
早期大肠癌为癌细胞的浸润在黏膜及黏膜下层这一范围的任意大小结直肠癌[1]。
由于病变对肠壁侵犯浅,复发及转移率低,预后良好,5年生存率可达97%,而进展期大肠癌5年生存率仅为40%~50%[2]。
因此,大肠癌的早期发现和诊治对预后至关重要。
本研究对此疾病的内镜诊断、治疗的情况进行综述如下。
1内镜下分型的情况早期大肠癌可根据其在内镜之下的表现分为侧方发育型(LST)、表面型、隆起型这三型。
隆起型又称Ⅰ型,可分为有蒂型(Ip)、亚蒂型(Isp)和广基型(Is)。
表面型还可以称为Ⅱ型,其可分为Ⅱa表面隆起型、Ⅱb表面平坦型、Ⅱc表面凹陷型三型。
Ⅱa还可以包括表面隆起中心凹陷(Ⅱa+Ⅱc)、表面隆起伴假性凹陷(Ⅱa+dep)两个特型。
Ⅱc还包括表面凹陷边缘隆起型(Ⅱc+Ⅱa)。
表面平坦型与表面凹陷型又称为denovo癌[3]。
侧方发育型(LST)为向侧方生长比向上方生长强的一种低隆起病变,瘤体较大,病变最大直径在10 mm以上,外观为颗粒状或结节状群集,又称Ⅱa群簇型。
分为颗粒型和非颗粒型。
前者又分为颗粒均一型(homogeneous type)和结节混合型(nodular-mixed type),后者分为扁平隆起型(flat elevate type,FLST) 和假凹陷型(pseudo depressed type,FLST)。
2早期大肠癌的内镜下诊断内镜对隆起型大肠癌的检出率很高,可在直视下观察并取活检,而平坦和凹陷型病变往往容易漏诊。
2.1内镜下黏膜染色技术用色素喷洒于大肠黏膜,使普通内镜不能观察到的病变变得明显,并使表面凹凸明显。
内镜下黏膜染色技术业已证明能明显提高微小病变的发现率,并能更清晰显示所见病变的边界与表面结构,有利于内镜下初步判断病变性质。


内镜下早期大肠癌的诊断与治疗大肠癌作为常见的恶性肿瘤之一,在我国的发病率、致死率也非常高,为此,加强对早期大肠癌病变的早期发现和诊治,对于提高患者的生活质量具有重要的临床意义。
早期大肠癌在过去主要以外科手术来进行综合治疗,而随着内镜诊治技术的发展,国内外关于早期大肠癌的内镜下治疗的报道也随之增多,同时因其手术创伤小,对患者手术并发症的控制效果好,提高患者术后康复速度等优势,日益受到医生和患者的关注和重视。
1 对早期大肠癌的诊断1.1 早期大肠癌的分期方法利用内镜技术,如结合电子结肠镜,放大内镜、超声结肠镜、显微内镜等医疗设备,可以对早期大肠癌的分期进行有效的定位,结合美国癌症联合会的分期指标,对早期大肠癌的界定主要有仅对结直肠的粘膜层进行侵犯,且无区域性淋巴结转移现象。
加强对早期大肠癌的科学分期,对于选择有效的治疗措施,增强患者的存活机会意义重大。
1.2 早期大肠癌的分型特征从早期大肠癌的临床特征来分析,可以分为表面型和隆起型两大类,而对于表面型则又细分为平坦型和凹陷型,对于隆起型则主要有息肉隆起型即I型,进一步细化则有蒂型Ip,亚蒂型Isp,广基型Is。
从国内的患者群进行分析多为息肉隆起型即I型病变。
2 对早期大肠癌的内镜诊断技术介绍结合内镜技术来进行早期大肠癌的诊断,对于隆起型大肠癌具有较高的检出率,而对于平坦型或凹陷型则很容易出现漏诊,因此,需要进行多种诊疗技术来进行深入分析。
2.1 内镜下借助于染色技术来判定在对早期大肠癌患者进行内镜下观察时,通过引入色素,使其能够喷洒于大肠黏膜之上,由此来进行病变观察,可以取得较好的检出效果,特别是在内镜下通过引入0.2%~0.4%的定胭脂水溶液,其能够更加清晰的显示出病变的边界与表面结构特征,具有最佳的黏膜染色判断病变的效果。
2.2 借助于放大内镜技术来判定放大内镜在进行医疗观察时可以通过将病灶进行一定倍数的放大,如放大100~150倍,从而可以对病灶进行正面、侧面、以及中、远距离的观察,来细致的分析出病灶的特征及发育形态,如有无凹陷,局部性状特征和病变范围等。

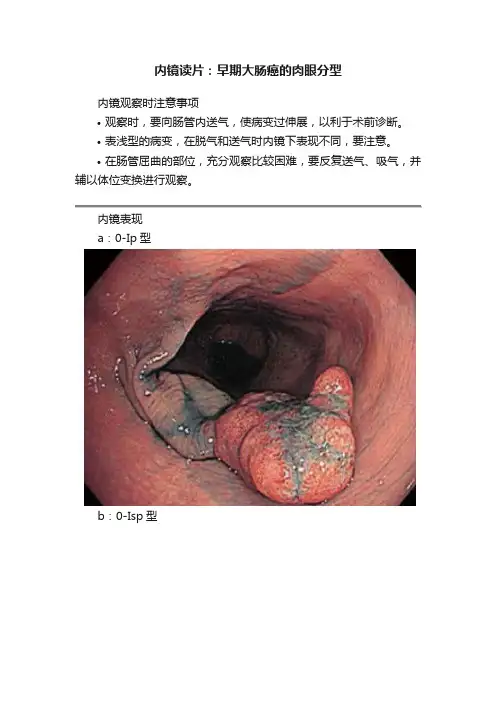
内镜读片:早期大肠癌的肉眼分型
内镜观察时注意事项
•观察时,要向肠管内送气,使病变过伸展,以利于术前诊断。
•表浅型的病变,在脱气和送气时内镜下表现不同,要注意。
•在肠管屈曲的部位,充分观察比较困难,要反复送气、吸气,并辅以体位变换进行观察。
内镜表现
a:0-Ip型
b:0-Isp型
c:0-Is型
d:0-IIa型
e:0-IIc型
f:0-IIa+IIc型.
0-Is+IIc型病变1例a 白光所见.
b NBI非放大所见.
c 靛胭脂色素撒布所见(インジゴカルミン撒布).
d 结晶紫染色后的放大观察所见.
病例分析
隆起型病变,内部出现表面凹陷,要考虑黏膜下层(SM)的深部浸润。
a,b:可见肿瘤边缘部位出现凹陷表现,考虑凹陷型的黏膜下层(SM)深部浸润癌。
c:喷洒色素后病变更加明显,肉眼分型为“0-Is+IIc”型
d:考虑为SM深部浸润癌。
文章来源:。

【注意事项】早期大肠癌内镜治疗指南早期大肠癌内镜治疗方法(手技)的实施1注意事项及要点热活检如果通电时钳子持续下压,通电有发生穿孔的危险性,要略向上提起通电。
高频电流设备有单极式和双极式2种,一般单极式比较普及,对安置起搏器等电子仪器的影响还是双极式较小。
为了避免圈套器将病变自身卷入,通过调整圈套器收发,确认口侧,肛侧都没有咬住病变在收紧圈套器。
息肉电切通电时,一般要防止息肉头部接触肠壁,但是如果头部较大,无论如何都无法避免接触肠壁时,为了减弱流向接触部的通电效果,不如压向对侧增加接触面积(图25-6)。
EMR以及EPMR时,局注液一般都用生理盐水,为了防止膨隆平坦化,使用甘油果糖也可。
为了预防切除后出血,添加肾上腺素(0.001%,100倍稀释),为了确认注入范围以及切除后的黏膜下层的存在,添加靛胭脂(0.004%,100倍稀释)也可。
不能直视病变,固定圈套器前端无法打开时,使用硬质圈套器,在全开的状态下压向病变周围全体的黏膜面,一边轻轻吸引一边收紧圈套器,将正常黏膜包含在内进行圈套切除比较容易。
但是难度高的病变不要勉强操作,交给经验丰富的医师操作。
因为EMR是分割切除,切除标本的重构比较困难,病理组织学的检查可能不充分。
因此分割数尽可能少,怀疑癌或sm浸润的部分不要分割并可能大范围切除,为了使病理学检查成为可能,必须计划性切除。
大肠的EMR因为壁薄,皱襞及屈曲较多,为了避免穿孔,用IT刀比较少,多使用Flex刀或Hook刀。
大肠的ESD与上消化道不同,操作过程中不存在判定病变范围的困难,所以标记不是必须的。
透明质酸钠形成的膨隆持续时间长,市售的阿尔治2倍稀释,爱维4倍稀释使用即可。
ESD剥离时,在内镜前端安装透明帽探入黏膜下层就比较容易。
ESD时,即使黏膜下层没有最后完全剥离,残留的一小部分通过圈套器切除也可以。
2术后处置EMR、EMPR、ESD当日或到次日禁食,只可饮水,第三日开始流食,逐日增加饮食。

早期大肠癌内镜下诊断大肠癌是严重危害人类健康的十大肿瘤之一,近年来我国发病率有逐年上升的趋势。
大肠癌及其癌前病变的早期发现及正确处理对病人的预后,生存率,治愈率的提高至关重要。
早期大肠癌常无明显症状,一旦确诊多属中晚期。
据文献报道早期大肠癌的5年生存率可达90%以上,而进展期大肠癌的5年生存率仅50%—60%,有远隔转移者5年生存率仅有10%[1-3]。
因此提高大肠癌患者的生存率关键在于提高早期大肠癌的检出率。
但目前早期大肠癌的检出率在各国差异较大,日本早期大肠癌的检出率居世界首位,约为17%-53%[4-6],而在欧美国家,早期大肠癌的检出率约为9%[7-9],我国早期大肠癌的资料并不完善,各地文献报告为1.7%-26.1%[10-16],差异较大,较之日本报道的早期大肠癌检出率明显偏低。
因此如何发现早期大肠癌,提高早期大肠癌的检出率,已成为消化系疾病中亟待解决的问题[17]。
目前内镜检查在大肠癌的诊断中具有各种影像学检查所无法替代的优势,其原因之一是内镜检查不仅能直观的发现大肠黏膜的早期病变,而且能借助活检对病变进行组织学评价,结肠镜检查及其相关技术的应用,大大提高了大肠癌的早期诊断与治疗。
随着染色内镜和放大内镜的应用,发现了越来越多的平坦型病变,且具有比隆起型肿瘤更高的恶变倾向,尤其是凹陷型病变甚尤。
平坦型病变包括:IIa、IIb、IIc、侧向发育型肿瘤(LST)等。
据报道LST与大肠癌关系密切,文献报道其癌变率从8.4 %-52.5 %不等[18-19 ] , 已有动态观察表明LST可在3 年内发展为大肠癌,而隆起型腺瘤发展成癌要经过5-10年[20]。
平坦型病变镜下表现为下列征象中的一种或多种共存:黏膜发红,黏膜苍白,黏膜灰暗,易出血,血管网消失,肠黏膜无名沟中断,病变周围白斑,中央凹陷,黏膜表面凹凸不平和肠壁轻度变形及吸气变形存在。
常规内镜检查若发现上述征象,应先用充气和吸气试验观察是否存在黏膜变形,随后用染色内镜技术观察病变表面形态和病变范围,再应用放大内镜仔细观察大肠腺管开口的形态,基本可以判断是否为肿瘤性病变及病变浸润的程度,从而确定治疗方案。

【指南】早期大肠癌内镜治疗方法(手技)的实施前言早期大肠癌指癌的浸润在粘膜层(m)、黏膜下层(sm)内。
常规内镜检查能确定早期癌的诊断大多不是容易的事,因此,就早期癌以及有其可能性的大肠肿瘤的内镜治疗方针加以概说。
1适应证及禁忌证内镜治疗的原则是以根治为目的但有时收到各种条件的制约只能进行姑息性治疗大肠癌治疗指南中,仅把高频电的内镜摘除作为内镜治疗,热活检不在摘除的范围内此外的烧灼等治疗或局注治疗也不在内镜治疗范围内在进行内镜治疗时,有关肿瘤的大小、预测浸润深度、组织型的信息是不可欠缺的。
1.适应的原则几乎没有淋巴结转移的可能性,肿瘤的大小及部位能够一次性切除。
2.具体的适应条件(图25-1)①腺瘤、粘膜癌(m癌),向黏膜下层的轻度浸润癌②最大径小于2cm③与肉眼型无关最大径小于2cm为原则的理由是,圈套器一次性切除的大小平均为20mm左右实际上最大径超过20mm的病变内镜治疗也是可能的作为术前内镜诊断sm高度浸润的诊断指标有“紧满感、糜烂、溃疡、黏膜集中、变形、硬化像”等根据需要,在常规内镜所见的基础上,还要参考X线造影、放大观察、超声内镜等所见术前深度诊断中,将黏膜下层3等分的相对分类(sm1、sm2、sm3)使用起来比较方便术前诊断sm1可以考虑为sm微小浸润sm浸润的1000um中,包括除了sm1以外还有sm2的一部分最近正积极使用内镜检查(常规观察、放大观察、超声内镜)在术前试行sm浸润1000um的诊断术前诊断如果确诊为黏膜内病变的,进行分割切除也可以一般情况下,多次分割切除的不完全切除率较高,局部再发率高,要加以注意大肠的内镜下黏膜下层剥离术(ESD)手技难度很高,穿孔等并发症的危险性高,目前不是一般性治疗。
内镜切除还兼有摘除活检的诊断手段的作用。
3.禁忌证不能取得患者的同意患者不配合有出血倾向,正在使用抗凝固药的表现为Vn型腺管开口分型(基于箱根共识)的病变内镜控制不充分的部位,在进行内镜治疗困难的同时,对出血、穿孔等并发症的对应处置也困难的应避免内镜治疗吸引透明帽法、在结肠穿孔的危险性高,是禁忌2术前准备1.知情同意大肠癌的场合要告知内镜下切除也是作为摘除活检的诊断手段,根据术后的病例组织诊断的结果,有必要进行手术等追加治疗时,要求能够理解说明穿孔发生率为1%以下,偶有并发症发生,有急诊手术的可能性说明偶有发生出血,但基本上术中可以止血,偶有术后出血,可以止血处置发生并发症时,需要禁食,延长住院时间,要求予以理解2.术前检查听取既往史、现病史,确认身体状态能否安全实施内镜治疗对糖尿病、高血压、动脉硬化性疾病要特别加以注意特别要确认有无妊娠、抗凝固药、各种内服药、药剂过敏等血液型、一般的血液、生化学检查,传染病(HBV、HCV、HIV、梅毒等)的检查检查出血倾向(出血时间、PT、PTT等)必要时通过X线造影检查、内镜检查、放大检查、超声内镜检查等进行术前浸润深度诊断明显的癌变,用体外式超声波检查、CT等检查有无淋巴结肿大、远隔转移。

隆起型肿瘤性病变(type 0-Ⅰ)图1. 食管(鳞状上皮):type 0-Ⅰ,未染色,粘膜下层癌(sm2)。
图2. 同图1病例,碘染色。
图3. 食管(鳞状上皮):type 0-Ⅰ,未染色,粘膜下层癌(sm2)。
图4. 同图3病例,碘染色。
图5. 贲门type 0-Ⅰ,翻转视野,未染色,粘膜下层癌(sm2)。
图6. 同图5病例,翻转视野,靛胭脂染色。
图7. 大肠type 0-Ⅰ,未染色,上皮内瘤变。
图8. 同图7病例,靛胭脂染色。
图9. 大肠type 0-Ⅰ,两个病变,未染色,上皮内瘤变。
图10. 同图9病例,靛胭脂染色。
表面隆起型肿瘤性病变(type 0-Ⅱa)图11. 食管(鳞状上皮):type 0-Ⅱa,未染色,粘膜内癌。
图12. 同图11病例,碘染色。
图13. 同图11病例:术后标本,未染色。
图14. 同图11病例:术后标本连续切片,碘染色。
图15. Barrett 食管:type 0-Ⅱa,多结节样病变,未染色,粘膜内腺癌。
图16. Barrett 食管:type 0-Ⅱa,小结节样病变,未染色,粘膜内腺癌。
图17. Barrett 食管:type 0-Ⅱa,多结节样病变,未染色,粘膜内腺癌。
图18. 贲门:type 0-Ⅱa,翻转视野,未染色,上皮内瘤变。
图19. 同图18病例,翻转视野,靛胭脂染色。
图20. 贲门旁:type 0-Ⅱa,未染色,粘膜内癌。
图21. 同图20病例,靛胭脂染色。
图22. 贲门旁:type 0-Ⅱa+Ⅰ,未染色,粘膜下层癌。
图23. 同图22病例,靛胭脂染色。
图24. 大肠:type 0-Ⅱa,侧性生长型,上皮内瘤变。
图25. 同图24病例,靛胭脂染色。
图26. 大肠:type 0-Ⅱa,未染色,侧性生长型,上皮内瘤变。
图27. 同图26病例,靛胭脂染色。
表面平坦型肿瘤性病变(type 0-Ⅱb)图28. 食管(鳞状上皮):type 0-Ⅱb,未染色,上皮内瘤变。