高中化学有机合成人教版
- 格式:ppt
- 大小:1.02 MB
- 文档页数:34

第五节有机合成一、有机合成的主要任务(一)构建碳骨架:1、碳链的增长:(1)炔烃与氢氰酸的加成反应(2)醛与氢氰酸的加成反应(3)酮与氢氰酸的加成反应(4)羟醛缩合反应:醛分子中在醛基邻位碳原子上的氢原子(α-H)受羰基吸电子作用的影响,具有一定的活泼性。
分子内含有α-H的醛在一定条件下可发生加成反应,生成β-羟基醛,该产物易失水,得到α,β-不饱和醛。
这类反应被称为羟醛缩合反应。
(5)加聚反应2、碳链的缩短:(1)烷烃的分解反应:(2)烯烃被酸性高锰酸钾溶液氧化,生成碳链缩短的羧酸或酮(3)炔烃被酸性高锰酸钾溶液氧化,生成碳链缩短的羧酸或酮举例:(4)芳香烃的侧链被酸性高锰酸钾溶液氧化,生成碳链缩短的羧酸OHOHBrBrBr3、成环反应:(1)第尔斯-阿尔德反应:共轭二烯烃(含有两个碳碳双键,且两个双键被一个单键隔开的烯烃,如1,3-丁二烯)与含碳碳双键的化合物在一定条件下发生第尔斯-阿尔德反应( Diels-Alder- reaction),得到环加成产物,构建了环状碳骨架。
例如:(2)形成环酯:(二)引入官能团1、引入碳碳双键:(1)醇或卤代烃的消去反应:CH 3CH 2OH浓硫酸 170℃CH 2=CH 2↑+H 2OCH 3CH 2Br +NaOH ――→乙醇△CH 2===CH 2↑+NaBr +H 2O (2)炔烃与氢气、卤化氢、卤素单质的不完全加成反应:CH≡CH+HCl催化剂 △CH 2=CHCl2、引入碳卤键:(1)烷烃或苯及其同系物的取代反应:CH 3CH 3+Cl 2−−→−光照CH 3CH 2Cl+HCl(2)醇或酚与氢卤酸的取代反应:CH 3CH 2OH +HBr ∆−−→ CH 3CH 2Br +H 2O +3Br 2→3HBr+ ↓C OCH 3CH3C CH 3OHHCH 3还原(3)烯烃或炔烃与卤素单质或卤化氢的加成反应:CH 2=CH 2+Br 2→CH 2BrCH 2BrCH≡CH+HCl催化剂 △CH 2=CHCl3、引入羟基:(1)烯烃与水加成:CH 2=CH 2+H 2O ∆−−−−→催化剂,加压CH 3CH 2OH (2)醛或酮与H 2加成:CH 3CHO +H 2催化剂 △CH 3CH 2OH+H 2催化剂△(3)卤代烃的水解反应:CH 3CH 2Br +NaOH ――→水△CH 3CH 2OH +NaBr (4)酯的水解反应:CH 3COOC 2H 5+H 2O 24H SO ∆稀CH 3COOH+C 2H 5OH(5)酚盐溶液与CO 2、HCl 等反应:4、引入醛基(或酮羰基):(1)醇的催化氧化:2CH 3CH 2OH+O 2gCu A ∆−−−→或 2CH 3CHO+2H 2O(2)某些烯烃被酸性高锰酸钾溶液氧化的反应:5、引入羧基:(1)醛的氧化反应:2CH 3CHO+O 2Cu∆−−→2CH 3COOH (2)酯的水解反应:CH 3COOC 2H 5+H 2O24H SO ∆稀 CH 3COOH+C 2H 5OH(3)某些烯烃、苯的同系物被酸性高锰酸钾溶液氧化的反应:4()KMnO H +−−−−−−→被氧化COOH(4)伯醇被酸性高锰酸钾溶液氧化的反应:(三)官能团的转化1、利用衍变关系进行转化:醇−−→−氧化醛−−→−氧化羧酸R CHCH2X X R CH CH 2OHOHC H3CH CH 3OH2、增加官能团个数:R-CH 2-CH 2OH −−→−消去R-CH=CH 2−−−→−加成与2X −−→−水解3、改变官能团位置:CH 3CH 2CH 2OH −−→−消去CH 3CH=CH 2−−→−加成 (四)官能团的消除1、加成−−→−消除不饱和键 2、取代、消去、酯化、氧化−−→−消除羟基 3、加成、氧化−−→−消除醛基 4、消去、水解−−→−消除卤原子 5、水解−−→−消除酯基 (五)官能团的衍变(六)官能团的保护——羟基的保护二、有机合成路线的设计与实施(一)分析方法1、正合成法:原料→中间产物→产品2、逆合成法:产品→中间产物→原料3、综合比较法:原料→中间产物←目标产物(二)原则1、原料溶剂和催化剂尽可能价廉易得、低毒性、低污染2、尽量选择步骤最少的合成路线,步骤越少,产率越高。





高中化学学习细节(人教版)之有机合成及糖类、油脂、蛋白质:官能团的变化Word版含解析有机合成是高考中不可缺少的题型,其命题方式如下:? 以烃及烃的衍生物的转化关系为内容的考查方式。
? 有机合成推断中渗透有机实验、有机物的相关信息处理等有机综合性问题。
有机合成的实质和相关知识:有机合成的实质是利用有机基本反应原理,进行必要的官能团反应,合成目标产物。
而有机推断的实质是具体物质的合成流程中的某个环节、物质、反应条件缺省,或通过已知的信息推断出未知物的各种信息。
在推断和合成过程中都常涉及到下列情况:官能团的引入、官能团的消除、官能团的衍变、碳骨架即碳链的增减等。
在解有机合成试题时首先要注意:1(合成方法:识别有机物的类别,含何官能团,以及与之有关的信息。
据现有原料,信息及反应原理,尽可能合理把目标分子分成若干片断,或寻求官能团的引入、转换,保护方法或设法将各片断拼接衍变。
正逆推,综合比较选择最佳方案。
一定要注意有机合成中断的什么线(化学键),连的什么点(原子)。
2(合成原则:原料价廉,原理正确路线简捷,便于操作,条件适宜易于分离,产率高3(解题思路:剖析要合成的物质(目标分子),选择原料,路线(正向、逆向思维,结合题给信息)。
合理的合成路线进行什么基本反应,目标分子骨架。
目标分子中官能团引入。
?原料分子(官能团有何不同)过渡中间产物(碎片分子中的官能团如何转化来的)碎片分子切割(断键部位要合理)目标分子【学习目标】认识有机合成中官能团之间的转化。
细节诠释一. 官能团的引入引入官能团有关反应烯烃与水加成,醛/酮加氢,卤代烃水解,酯的水解羟基-OH烃与X取代,不饱和烃与HX或X加成,(醇与HX取代) 22卤素原子(,X)某些醇或卤代烃的消去,炔烃不完全加氢碳碳双键C=C某些醇(,CHOH)氧化,烯氧化,糖类水解,(炔水化) 2醛基-CHO醛氧化, 酯酸性水解, 羧酸盐酸化,(苯的同系物被强氧化剂氧化) 羧基-COOH 酯化反应酯基-COO-二. 官能团的衍变:1. 烃和烃的衍生物转变主线2. 官能团的消除(1)与H加成消除不饱和键; 2(2)消去反应消除卤原子而形成新的C,C双键; (3)消去反应、氧化反应或酯化反应等消除羟基(—OH);(4)加成反应或氧化反应等消除醛基(—CHO); (5)酯水解消除酯基。

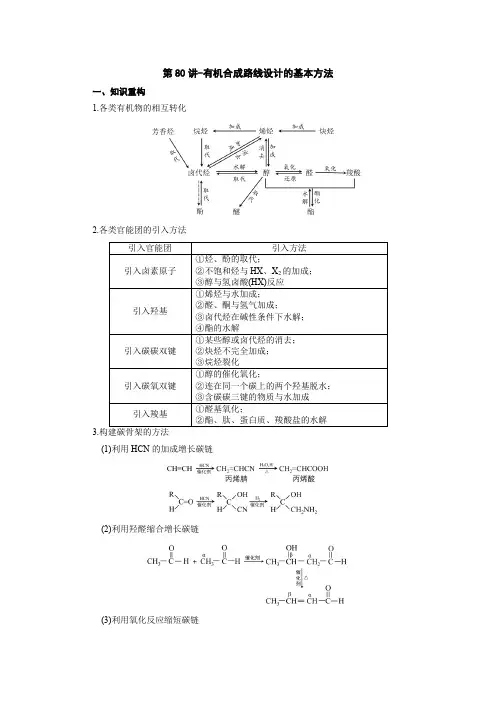
第80讲-有机合成路线设计的基本方法一、知识重构1.各类有机物的相互转化2.各类官能团的引入方法3.(1)利用HCN的加成增长碳链(2)利用羟醛缩合增长碳链(3)利用氧化反应缩短碳链(4)利用周环反应成环4.官能团的保护与恢复(1)碳碳双键:在氧化其他基团前可以利用其与HCl 等的加成反应将其保护起来,待氧化后再利用消去反应转变为碳碳双键。
HOCH 2CH=CHCH 2OH ――→HCl HOCH 2CH 2CHClCH 2OH ――――→KMnO 4/H+――――→1NaOH/醇2酸化HOOC—CH=CH—COOH 。
(2)酚羟基:在氧化其他基团前可以用NaOH 溶液或CH 3I 保护。
(3)醛基:在氧化其他基团前可以用乙醇(或乙二醇)加成保护。
①――→C 2H 5OHHCl――→H +/H 2O②――――――――→HO—CH 2CH 2—OH H+――→H +/H 2O(4)氨基:在氧化其他基团前可以用醋酸酐将氨基转化为酰胺,然后再水解转化为氨基。
――――→CH 3CO 2O ――――→H 2O H +或OH-(5)醇羟基、羧基可以成酯保护。
二、重温经典1.(2022年全国甲卷36题)用 N -杂环卡宾碱(NHC base)作为催化剂,可合成多环化合物。
下面是一种多环化合物 H 的合成路线(无需考虑部分中间体的立体化学)。
(6)如果要合成H 的类似物H'(),参照上述合成路线,写出相应的D'和G'的结构简式、。
【答案】、【解析】对比H()与H'()的结构可知,将合成H的原料D中的苯环换为,即得到D',将G中的苯环去掉即得到G',所以D'、G'分别为、。
2.(2022湖南19)物质J 是一种具有生物活性的化合物。
该化合物的合成路线如下:已知:①②参照上述合成路线,以和为原料,设计合成的路线(无机试剂任选)【答案】【解析】结合题给信息①、②,及由G到I的转化过程可知,可先将转化为,再使和反应生成,并最终转化为,即合成路线见答案。

一、构建碳骨架1. 碳链增长当原料分子中的碳原子数少于目标分子中的碳原子数时,可以通过引入含碳原子的官能团等方式使碳链增长。
①炔烃与HCN的加成反应:炔烃和醛中的不饱和键与HCN发生加成反应生成含有氰基(一CN)的物质,再经水解生成羧酸,或经催化加氢还原生成胺。
②醛与HCN的加成反应知识精讲知识导航第20讲有机合成的主要任务③(醛与醛)羟醛缩合反应:醛分子中在醛基邻位碳原子上的氢原子(αH)受羰基吸电子作用的影响,具有一定的活性。
分子内含有αH的醛在一定条件下可发生加成反应,生成β羟基醛,该产物易失水,得到α,β不饱和醛。
2. 碳链缩短氧化反应可以使烃分子链缩短。
如烯烃、炔烃及芳香烃的侧链被酸性高锰酸钾溶液氧化,生成碳链缩短的羧酸或酮。
①烯烃被酸性高锰酸钾溶液氧化②炔烃被酸性高锰酸钾溶液氧化③芳香烃的侧链被酸性高锰酸钾溶液氧化3. 碳链成环①第尔斯阿尔德反应:共轭二烯烃与含碳碳双键(三键)的化合物在一定条件下反应,得到环加成产物,构建了环状碳骨架。
②二元酸与二元醇的酯化反应二、引入官能团通过取代、加成、消去、氧化、还原等有机化学反应,可以实现有机化合物类别的转化,并引入目标官能团。
1. 引入碳碳双键:卤代烃的消去反应、醇的消去反应反应类型示例CH3CH2Br+ NaOH CH2==CH2↑+ NaBr + H2O2. 引入碳卤键烷烃、芳香烃与X2的取代反应烯烃、炔烃与X2、HX的加成反应醇的取代反应3. 引入羟基烯烃与水的加成反应卤代烃的水解反应醛或酮的还原反应4. 引入醛基或羰基醇的催化氧化烯烃的氧化反应5. 引入羧基 醇被强氧化剂氧化 醛的催化氧化三、官能团的保护含有多个官能团的有机化合物在进行反应时,非目标官能团也可能受到影响。
此时需要将该官能团保护起来,先将其转化为不受该反应影响的其他官能团,反应后再转化复原。
1. 羟基的保护2. 碳碳双键的保护碳碳双键易被氧化,在氧化其他基团前,可与卤素单质、卤化氢等加成,将其保护起来,待氧化其他基团后,再通过消去反应(NaOH 醇溶液)重新转化为碳碳双键。

《有机合成路线的设计与实施2》教学设计一、课标解读《有机合成路线的设计与实施》是普通高中化学课程标准选择性必修课程模块三有机化学基础主题1(有机化合物的组成与结构)部分的内容。
1、内容要求:认识有机合成的关键是碳骨架的构建和官能团的转化,了解设计有机合成路线的一般方法。
体会有机合成在创造新物质、提高人类生活质量及促进社会发展方面的重要贡献。
2、学业要求:能综合应用有关知识完成推断有机化合物、检验官能团、设计有机合成路线等任务。
二、教材分析有机化学路线的设计与实施是新人教版选择性必修3有机化学基础第3章烃的衍生物第5节的内容。
从章节整体来看,本章分类介绍了烃的衍生物的结构特点、物理性质、化学性质和用途;在本章的最后第5节,教材以有机合成为载体,对此前介绍的官能团的性质与转化、有机反应类型等内容进行系统化梳理和总结,并进行综合应用。
通过本章的学习,引导学生从碳骨架和官能团的视角认识有机化合物结构和性质,建立正向和逆向设计合成路线的方法模型。
在教学过程中落实化学学科核心素养,认识化学的应用价值,培养社会责任感。
本章的第5节有机合成,是对高中阶段学习的烃、卤代烃、醇、酚、醛、羧酸、酯等各类有机化合物性质的综合应用。
需要学生在熟练掌握上述有机化合物的结构特点和典型性质的基础上,能够利用其相互衍生关系及重要官能团的引入和消除方法,通过综合性问题的分析和解决,初步学会有机合成的方法,掌握有机合成过程的表示方法。
本节课为第5节有机合成第3课时,第一课时从碳骨架和官能团视角认识有机化合物结构和性质,并引入官能团保护的概念;第二课时构建了烃的衍生物转化模型,建立了正向和逆向设计合成路线的方法模型;本节课则立足于生活中的复杂有机化合物,巩固正向合成和逆向合成分析法,进一步锻炼在陌生情境中分析问题、解决问题的能力。
通过生活中常见的重要药物的合成路线设计,体会有机合成在创造新物质方面的重要贡献。
三、学情分析学生已经学习了烃、卤代烃、醇、酚、醛、羧酸、酯等各类有机化合物结构特点、物理性质、化学性质和用途,具备一定的有机化学知识基础;在烃的含氧衍生物的学习中,学生已经掌握了从结构(官能团)出发分析化学性质的思维方法;但是仍然缺乏对有机化合物知识的综合性、系统性的应用分析能力。

有机合成必备知识基础练1.(2020河北唐山高二检测)下列说法不正确的是()A.可发生消去反应引入碳碳双键B.可发生催化氧化引入羧基C.CH3CH2Br可发生取代反应引入羟基D.与CH2CH2可发生加成反应引入碳环解析中羰基碳原子上无氢原子,故不能发生催化氧化生成羧酸,B项不正确。
2.(2020山东泰安高二检测)在有机合成中,常会将官能团消除或增加,下列相关过程及涉及的反应类型和相关产物合理的是()A.乙醇乙烯:CH3CH2OH CH3CH2Br CH2CH2B.溴乙烷乙醇:CH3CH2Br CH2CH2CH3CH2OHC.乙炔CHClBr—CH2BrD.乙烯乙炔:CH2CH2CH≡CH解析A项中由乙醇乙烯,只需乙醇在浓硫酸、170 ℃条件下消去即可,路线不合理;B中由溴乙烷乙醇,只需溴乙烷在碱性条件下水解即可,路线不合理;C项中乙炔与HCl按物质的量之比1∶1混合发生加成反应,生成的产物再与HBr发生加成反应,可得CH2Cl—CH2Br或CHClBr—CH3,不合理。
3.已知:乙醇可被强氧化剂氧化为乙酸。
可经过三步反应制得。
设计最合理的三步反应类型依次是()A.加成、氧化、水解B.水解、加成、氧化C.水解、氧化、加成D.加成、水解、氧化解析先在NaOH的水溶液中发生水解反应生成,然后该物质和Cl2发生加成反应生成,再被强氧化剂氧化生成,故反应类型依次为水解反应、加成反应、氧化反应,故正确选项是B。
4.(2021山东济南高二检测)格林尼亚试剂简称“格氏试剂”,它是卤代烃与金属镁在无水乙醚中作用得到的,如:CH3CH2Br+Mg CH3CH2MgBr,它可与羰基发生加成反应,其中的“—MgBr”部分加到羰基的氧上,所得产物经水解可得醇。
今欲通过上述反应合成2-丙醇,选用的有机原料正确的一组是()A.氯乙烷和甲醛B.氯乙烷和丙醛C.一氯甲烷和丙酮D.一氯甲烷和乙醛,要得到2-丙醇,则必须有CH3CH(OMgCl)CH3生成,因此必须有CH3CHO和CH3MgX,分析选项中物质,则反应物为CH3CHO 和CH3Cl;答案选D。
有机合成❖ 教学目标1.掌握有机化学反应的主要类型:取代反应、加成反应、消去反应的概念,反应原理及其应用; 2.了解有机化学反应中的氧化还原反应,能根据碳原子的氧化数法判断有机化学反应是氧化反应还是还原反应;3.了解加成聚合反应和缩合聚合反应的特点,能写出简单的聚合反应的化学方程式;4.了解官能团与有机化学反应类型之间的关系,能判断有机反应类型,能正确书写有机化学反应的方程式。
❖ 知识梳理知识点一. 有机化学反应的主要类型1.取代反应。
(1)取代反应指的是有机物分子中的某些原子或原子团被其他原子或原子团所代替的反应。
(2)有机物与极性试剂发生取代反应的结果可以用下面的通式来表示。
888811221221A B A B A B A B +-+--+-→-+-(3)烃的卤代、芳香烃的硝化或磺化、卤代烃的水解、醇分子间的脱水反应、醇与氢卤酸的反应、酚的卤代、酯化反应、酯的水解和醇解,以及即将学到的蛋白质的水解等都属于取代反应。
①卤代。
CH 4+X 2−−→光CH 3X+HX②硝化。
③脱水CH 3CH 2OH+HOCH 2CH 3CH 3CH 2OCH 2CH 3+H 2O④酯化 CH 3COOH+HO —CH 3∆浓硫酸CH 3COOCH 3+H 2O⑤水解。
R —X+H 2ONaOH ∆−−−−→R —OH+HX R —COOR '+H 2OH +RCOOH+R 'OH(4)取代反应发生时,被代替的原子或原子团应与有机物分子中的碳原子直接相连,否则就不属于取代反应。
(5)在有机合成中,利用卤代烷的取代反应,将卤原子转化为羟基、氨基等官能团,从而制得用途广泛的醇、胺等有机物;也可通过取代反应增长碳链或制得新物质。
特别提示:取代反应的特点是“下一上一,有进有出”,类似于置换反应,如卤代烃在氢氧化钠存在下的水解反应CH 2Br+NaOH ∆−−→CH 3OH+NaBr 就是一个典型的取代反应,其实质是带负电的原子团(为OH -)代替卤代烃中的卤原子,上述反应可表示为CH 3Br+OH -∆−−→CH 3OH+Br -。
第四节有机合成1.掌握构建碳链骨架的方法和引入官能团的方法及有机物官能团之间的相互转化。
(重难点)2.掌握有机合成的途径和条件的合理选择,以及逆合成分析法。
(重难点) 3.了解有机合成对人类生产、生活的影响。
有机合成的过程[基础·初探]1.有机合成的概念有机合成指利用简单、易得的原料,通过有机反应,生成具有特定结构和功能的有机化合物的过程。
2.有机合成的任务有机合成的任务包括目标化合物分子骨架的构建和官能团的转化。
3.有机合成的过程4.官能团的引入(1)引入碳碳双键的方法①卤代烃的消去反应,②醇的消去反应,③炔烃的不完全加成反应。
(2)引入卤素原子的方法①醇(或酚)的取代,②烯烃(或炔烃)的加成,③烷烃(或苯及苯的同系物)的取代。
(3)引入羟基的方法①烯烃与水的加成,②卤代烃的水解,③酯的水解,④醛的还原。
[探究·升华][思考探究] 1.由怎样转变为?【提示】 由转化成的流程为――→NaOH――→通入CO 2。
2.如何由乙烯合成乙酸乙酯?【提示】 由乙烯合成乙酸乙酯的转化流程为 CH 2===CH 2――→HCl 加成CH 3CH 2Cl ――→NaOH/H 2O水解。
[认知升华]1.常见的取代反应中,官能团的引入或转化 (1)烷烃的取代,如CH 4+Cl 2――→光照CH 3Cl +HCl 。
(2)芳香烃的取代,如+Br 2――→FeBr 3+HBr 。
(3)卤代烃的水解,如CH 3CH 2X +NaOH ――→H 2O△CH 3CH 2OH +NaX 。
(4)酯的水解,如CH 3COOC 2H 5+H 2O CH 3COOH +C 2H 5OH 。
2.常见的加成反应中,官能团的引入或转化(1)烯烃的加成反应,如CH 2===CH 2+HX ―→CH 3CH 2X 。
其他如H 2O 、X 2等均可以引入或转化为新的官能团。
(2)炔与X 2、HX 、H 2O 等的加成 如HC ≡CH +HCl ――→催化剂△H 2C===CHCl 。