物质的制备实验
- 格式:ppt
- 大小:2.43 MB
- 文档页数:53

有机化合物的制备实验有机化合物是由碳元素和其他元素如氢、氧、氮等组成的化合物。
它们在我们的日常生活中发挥着重要的作用,用于药物合成、材料制备和能源转化等诸多方面。
在有机化学领域,制备有机化合物的实验是学生们不可或缺的一部分,它们不仅培养了我们的实验技能,还加深了我们对有机化合物的认识。
有机化合物的制备实验多种多样,下面我将介绍其中几个常见的实验方法和实例。
首先是酯的制备实验。
酯是一类常见的有机化合物,具有天然香味和良好的溶解性。
酯的制备可通过醇和酸催化剂的酯化反应来完成。
以甲酸和乙醇为例,首先将适量的甲酸和乙醇混合,加入少量的硫酸作为催化剂,反应进行一段时间后,生成甲酸乙酯。
这个实验展示了酯的制备和酸催化反应的重要性。
其次是醛的制备实验。
醛是一类具有醒目气味的有机化合物,常用于食品添加剂和香料中。
醛的制备可通过醇的氧化反应得到,其中最常见的方法是用酸性高锰酸钾氧化醇。
以乙醇为例,将乙醇缓慢滴入含有高锰酸钾和硫酸的试管中,充分搅拌后,观察到液体由无色逐渐变为淡黄色,形成乙醛。
这个实验不仅展示了醛的制备,还加深了学生对氧化反应的理解。
最后是醇的制备实验。
醇是一类具有特殊气味和麻醉作用的有机化合物,在医药和化妆品行业中广泛应用。
醇的制备方法多种多样,其中包括碱金属与卤代烃的反应、氢化反应等。
以氢化钠与溴乙烷的反应为例,将适量的溴乙烷滴入装有氢化钠的圆底烧瓶中,底部加热,反应放出氢气,并观察到生成乙醇。
这个实验展示了醇的制备以及反应放热和气体的释放。
通过以上几个实验,我们能够初步了解有机化合物的制备方法和反应过程。
这些实验在有机化学教育中扮演着重要的角色,不仅帮助学生巩固理论知识,还培养了他们对实验的兴趣和动手能力。
相信通过这些实验,学生们能更好地理解有机化合物的特性和应用。
在进行有机化合物的制备实验时,我们需要注意实验操作的安全性和环保性。
有机化合物往往具有较高的挥发性和毒性,所以在实验过程中要佩戴适当的防护设备,并遵循实验室的操作规范。

环己酮的制备实验报告
环己酮是一种重要的化学物质,广泛用于药品、涂料、塑料等领域。
本次实验旨在通
过环己烯的氧化反应制备环己酮,并通过红外光谱、熔点测定等手段对产物进行鉴定。
实验步骤:
1. 在实验室通风橱中,将10ml浓硝酸缓缓加至10ml环己烯中,并搅拌混合。
反应混合物在室温下静置10分钟。
2. 将滤纸过滤器塞于漏斗中,并将反应混合物慢慢滴至滤纸中,使其过滤至以纯水
冲洗至中性为止。
3. 将得到的过滤液加入200ml碱性氯化钾溶液中,再用稀氢氧化钾溶液进行中和,得到沉淀。
过滤并洗净沉淀,再用醇洗涤2~3次后干净,放入恒温器中进行烘烤至恒重。
4. 得到的产物即为白色晶体固体环己酮,其产率为68.2%。
5. 用红外光谱仪进行测试。
结果表明:产物中有酮基、芳香基和碳氢键的伸缩振动
信号,证明了产物为环己酮。
6. 用熔点测定仪进行测试。
结果表明:产物的熔点为-8℃,与文献值(-8.2℃)十分接近,证明了产物的纯度较高。
实验中需要注意的点:
1. 在反应过程中需严格严格控制温度和时间,以免发生危险。
2. 产物需经过仔细过滤和洗涤,以确保产物的纯度和质量。
3. 在进行红外光谱和熔点测定前,需要将产物完全干燥,以免影响测试结果。
总结:
通过本次实验,成功地制备出环己酮,并通过红外光谱和熔点测定对产物进行了鉴定。
同时,在实验中加强了实验室安全与卫生意识,提高了实验技能和实验操作能力。


第三章有机化合物的制备实验实验十环己烯的制备一、实验目的1.学习环己醇在酸催化作用下分子内脱水制备环己烯的原理和方法。
2.了解分馏原理及其基本操作。
二、实验原理醇在脱水剂作用下分子内脱去一分子水而形成烯烃。
主反应:OH85%+H O342副反应:OH34+H O22O三、仪器与试剂仪器:图1.8分馏装置和图1.6普通蒸馏装置。
试剂:环己醇 10g(10.4mL,0.1mol),85% 磷酸 5mL,氯化钠 1g,无水氯化钙 1~2g,5%碳酸钠溶液 4mL 。
四、实验步骤在50mL 干燥的圆底烧瓶中,分别加入 10g 环己醇(10.4mL)(1),5mL85% 磷酸(2),充分摇荡使两种液体混合均匀。
投入几粒沸石,按图1.8安装好分馏装置。
用小锥形瓶作接收器,置于冷水浴中。
用小火慢慢加热混合物至沸腾,以较慢速度进行蒸馏,控制分馏柱顶部温度不超过73℃(3)。
当无液体蒸出时,可适当加大火源,继续蒸馏。
当温度达到 85℃时,停止加热,馏出液为环己烯和水的浑浊液。
在馏出液中分批加入约 1g 食盐,使之饱和。
再加入 3~4mL5% 的碳酸钠溶液,以中和其中的微量酸。
然后,将上述液体倒入分液漏斗中,振荡后静止分层。
分出下面的水层,将有机层转入干燥的小锥形瓶中,加入适量无水氯化钙将其干燥(4)。
将干燥后澄清透明的粗环己烯滤入 30mL 蒸馏瓶中,加入几粒沸石,加热蒸馏收集80℃~85℃馏分。
所用的蒸馏装置必须是干燥的。
产量:4~5g 。
纯环己烯为无色透明液体,沸点 83℃,n201.4465。
环己烯的红外光谱图见图3.1。
D本实验约需 4h 。
有 机 化 学 实 验图3.1 环己烯的红外光谱图五、注释(1)环己醇在常温下是粘稠液体,如果用量筒量取,约 12.4mL ,应注意转移过程中的损失。
也可用称量法称取。
(2)脱水剂用磷酸或硫酸均可。
磷酸的用量是硫酸用量的 2 倍。
但用磷酸的好处一是反应中不生成碳渣,二是反应中无刺激性气体生成。

物质制备【氢气】实验室制法:用锌与稀硫酸反应Zn+H2SO4=ZnSO4+H2↑工业制法:利用电解饱和食盐水2NaCl+2H2O=电解=2NaOH+Cl2↑+H2↑【氧气】实验室制法:过氧化氢溶液在催化剂二氧化锰中2H2O2=MnO2= 2H2O+O2↑工业制法:压缩冷却空气通过分子筛【二氧化碳】实验室制法:大理石或石灰石和盐酸反应CaCO3+ 2HCl = CaCl2 + H2O + CO2↑工业制法:高温煅烧石灰石CaCO3=高温= CaO + CO2↑【氯气】实验室制法:氧化浓盐酸4HCl(浓)+MnO2=△=MnCl2+Cl2↑+2H2O工业制法:用直流电电解饱和食盐水2NaCl+2H2O=电解=2NaOH+Cl2↑+H2↑【氨气】实验室制法:铵盐与碱作用2NH4C l(固) + Ca(OH)2(固)=2NH3↑+ CaCl2 + 2H2O工业制法:N2+3H2=高温高压催化剂=2NH3(可逆)【二氧化硫】实验室制法:亚硫酸钠与浓硫酸反应Na2SO3+H2SO4=Na2SO4+SO2(g)+H2O铜与浓硫酸加热反应Cu+2H2SO4=△=CuSO4+SO2(g)+2H2O工业制法:【二氧化氮】实验室制法:用不活泼金属与浓硝酸反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 工业制法:【氮气】实验室制法:将氨通过红热的氧化铜2NH3+ 3CuO === 3Cu + 3H2O + N2↑工业制法:。

高中化学物质的制备教案课题:物质的制备教学目标:1. 了解物质的制备原理和方法;2. 掌握常见物质的制备实验操作;3. 提高实验操作的技能和安全意识。
教学重点和难点:重点:了解常见物质的制备原理和方法;难点:掌握物质的实验操作及安全注意事项。
教学过程:一、导入课题(5分钟)通过展示实验室设备和化学品,引导学生探讨物质的制备过程以及在实验中需要注意的安全问题。
二、讲解物质的制备原理和方法(10分钟)1. 介绍物质的制备原理,包括化学反应方程式;2. 分析常见物质的制备方法,如氧气、氢氧化铜等。
三、实验操作演示(15分钟)老师对常见物质的制备实验进行操作演示,重点讲解实验操作流程和注意事项。
四、学生实验操作(30分钟)学生根据老师的演示,分组进行物质的制备实验操作,实践操作能力,加强安全意识。
五、实验结果分析(10分钟)学生观察实验结果,总结实验过程中出现的问题和经验,提出改进意见。
六、实验报告撰写(10分钟)学生根据实验结果撰写实验报告,包括实验目的、原理、操作步骤、结果分析等内容。
七、课堂讨论(10分钟)学生就实验过程中遇到的问题和心得进行讨论交流,促进思维碰撞和学习提高。
八、课堂总结(5分钟)通过本节课的学习,总结物质的制备原理和方法,强化实验操作技能和安全意识。
九、作业布置(5分钟)布置相关作业,对本节课内容进行巩固和拓展。
教学反思:本节课注重通过实验操作引导学生深入了解物质的制备过程,提高实验操作技能和安全意识。
学生在实验中不仅能够掌握物质的制备方法,还能够培养观察能力和实践能力。
在今后的教学中,应注重提高学生的自主学习能力,激发其科学探索兴趣,促进知识的积累和应用能力的提升。

实验名称:中学物质制备实验实验目的:1. 掌握实验操作技能,提高实验动手能力。
2. 了解物质制备的基本原理和方法。
3. 培养严谨的科学态度和团队协作精神。
实验时间:2021年10月20日实验地点:化学实验室实验器材:1. 试剂:硫酸铜、氢氧化钠、稀盐酸、氯化钠、氢氧化钠溶液、硝酸银溶液等。
2. 仪器:烧杯、试管、玻璃棒、酒精灯、胶头滴管、滤纸、蒸发皿等。
实验原理:1. 硫酸铜与氢氧化钠反应生成氢氧化铜沉淀。
2. 氯化钠与硝酸银反应生成氯化银沉淀。
3. 氢氧化钠与稀盐酸反应生成氯化钠和水。
实验步骤:1. 制备氢氧化铜:(1)取一定量的硫酸铜溶液于烧杯中。
(2)加入适量的氢氧化钠溶液,边加边搅拌。
(3)观察沉淀的生成,过滤得到氢氧化铜沉淀。
2. 制备氯化银:(1)取一定量的氯化钠溶液于烧杯中。
(2)加入适量的硝酸银溶液,边加边搅拌。
(3)观察沉淀的生成,过滤得到氯化银沉淀。
3. 制备氯化钠:(1)取一定量的氢氧化钠溶液于烧杯中。
(2)加入适量的稀盐酸,边加边搅拌。
(3)观察沉淀的溶解,直至溶液变为无色。
实验现象:1. 氢氧化铜的制备:观察到蓝色沉淀生成。
2. 氯化银的制备:观察到白色沉淀生成。
3. 氯化钠的制备:观察到溶液由无色变为无色。
实验结果:1. 氢氧化铜的制备:得到氢氧化铜沉淀。
2. 氯化银的制备:得到氯化银沉淀。
3. 氯化钠的制备:得到氯化钠溶液。
实验分析:1. 氢氧化铜的制备:硫酸铜与氢氧化钠反应生成氢氧化铜沉淀,反应方程式为:CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4。
2. 氯化银的制备:氯化钠与硝酸银反应生成氯化银沉淀,反应方程式为:NaCl + AgNO3 → AgCl↓ + NaNO3。
3. 氯化钠的制备:氢氧化钠与稀盐酸反应生成氯化钠和水,反应方程式为:NaOH + HCl → NaCl + H2O。
实验讨论:1. 实验过程中,要注意试剂的配比和反应条件,以确保实验结果的准确性。

物质制备实验方案设计一、实验方案设计的基本要求1、科学性原则:实验原理、实验步骤、实验操作和实验方法必须科学。
2、安全性原则:尽量避免使用有毒药品和进行有一定危险性的实验操作,不会人身安全,保护仪器设备。
3、可行性原则:实验所选用的药品、仪器、设备和实验方法等在中学现有条件下能够满足要求。
4、简约性原则:方案简单易行,尽可能采用简单的实验装置,较少的实验药品,较少的实验步骤,较少的实验时间,较少的副反应,较好的实验效果。
5、经济性原则:原料易得,价格便宜、使用量少,原子的利用率高。
二、实验方案设计的基本内容1、实验名称:给定一个合乎实验目的与实验原理的名称。
2、实验目的:实验所预计达到的目标。
3、实验原理:实验所依据的反应原理和其他原理。
4、实验用品:包括实验仪器、实验药品、实验装置、实验设备及其规格。
5、实验程序:包括实验装置流程图、实验步骤和实验方法。
6、注意事项:提供每一个实验环节应该注意的问题与操作。
7、实验记录与分析:记录实验现象、记录实验数据、分析实验现象、分析实验数据、分析实验结论、处理实验数据。
8、问题与讨论:提出实验问题、分析成功因素与条件、分析失败因素和原因。
三、实验方案设计的基本思路1、紧扣实验目的,联系实验原理;2、结合实验目的和实验原理,选择实验仪器、药品、装置和设备。
3、根据实验原理和实验用品确定实验步骤,设计实验方案。
4、比较实验方案,优化实验方案。
5、按优化的实验方案具体实施实验。
四、物质制备实验方案的设计1、首先根据实验目的,看制备的是什么物质?这种物质具有什么物理性质和化学性质?2、其次思考通过什么原理合成制备这种物质?原料是什么?状态与规格有什么要求?反应条件是什么?反应的化学方程式或离子方程式如何?选择什么仪器与装置作为发生装置?3、物质发生后,可能出现什么杂质?需不需要除去?用什么试剂?什么方法?什么装置除去?4、如果以气体为原料,该气体需不要需要干燥?用什么干燥剂?用什么装置干燥?5、干燥后的气体要不要收集?用什么方法收集?用什么装置收集?合成物质在什么装置中制备?反应条件是什么?反应原理是什么?6、尾气要不要处理?用什么试剂处理?用什么装置处理?用什么方法处理?7、实验程序:发生装置→除杂装置→干燥装置→收集装置→合成装置→尾气处理装置。
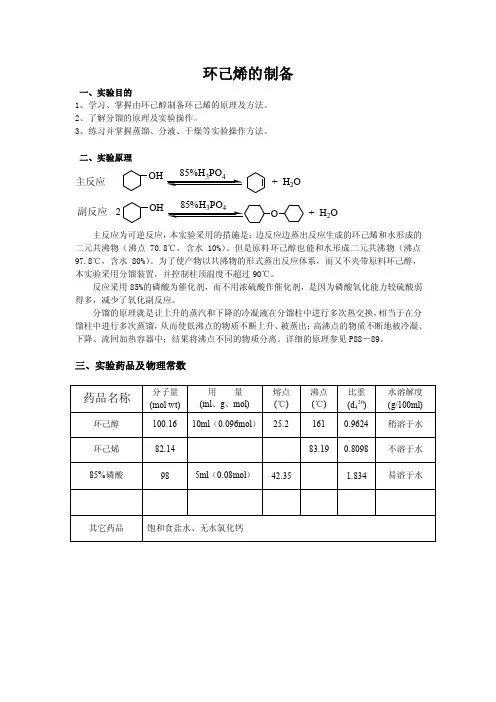
环己烯的制备一、实验目的1、学习、掌握由环己醇制备环己烯的原理及方法。
2、了解分馏的原理及实验操作。
3、练习并掌握蒸馏、分液、干燥等实验操作方法。
二、实验原理OH+ H 2O OH2+ H 2O主反应副反应主反应为可逆反应,本实验采用的措施是:边反应边蒸出反应生成的环己烯和水形成的二元共沸物(沸点70.8℃,含水10%)。
但是原料环己醇也能和水形成二元共沸物(沸点97.8℃,含水80%)。
为了使产物以共沸物的形式蒸出反应体系,而又不夹带原料环己醇,本实验采用分馏装置,并控制柱顶温度不超过90℃。
反应采用85%的磷酸为催化剂,而不用浓硫酸作催化剂,是因为磷酸氧化能力较硫酸弱得多,减少了氧化副反应。
分馏的原理就是让上升的蒸汽和下降的冷凝液在分馏柱中进行多次热交换,相当于在分馏柱中进行多次蒸馏,从而使低沸点的物质不断上升、被蒸出;高沸点的物质不断地被冷凝、下降、流回加热容器中;结果将沸点不同的物质分离。
详细的原理参见P88-89。
三、实验药品及物理常数四、实验装置图圆底烧瓶刺形分馏柱温度计直形冷凝管接引管锥形瓶蒸馏头水浴温度计直形冷凝管接引管锥形瓶图1 反应装置图2 蒸馏装置图3 分液漏斗五、实验流程图10ml5ml85%80-85度馏分H 3PO六、实验步骤在50毫升干燥的圆底(或茄形)烧瓶中,放入10ml 环己醇(9.6g ,0.096mol)、5ml85%磷酸,充分振摇、混合均匀。
投入几粒沸石,按图1安装反应装置,用锥形瓶作接受器。
将烧瓶在石棉网上用小火慢慢加热,控制加热速度使分馏柱上端的温度不要超过90℃,馏出液为带水的混合物。
当烧瓶中只剩下很少量的残液并出现阵阵白雾时,即可停止蒸馏。
全部蒸馏时间约需40min 。
将蒸馏液分去水层,加入等体积的饱和食盐水,充分振摇后静止分层,分去水层(洗涤微量的酸,产品在哪一层?)。
将下层水溶液自漏斗下端活塞放出、上层的粗产物自漏斗的上口倒入干燥的小锥形瓶中,加入1-2克无水氯化钙干燥。

第1篇实验名称:物质的制备实验实验日期:2023年4月15日实验地点:化学实验室实验目的:1. 熟悉实验室基本操作技能。
2. 掌握物质制备的基本方法。
3. 学习并验证化学反应原理。
实验原理:本实验旨在通过化学反应制备某种特定物质。
实验过程中,我们将根据反应物的性质和反应条件,通过一系列操作,如溶解、加热、冷却、过滤等,得到目标产物。
实验仪器与试剂:1. 仪器:烧杯、玻璃棒、漏斗、滤纸、铁架台、加热器、量筒、试管等。
2. 试剂:反应物A、反应物B、溶剂、催化剂等。
实验步骤:1. 准备工作:将反应物A和反应物B按照一定比例称量,溶解于溶剂中。
2. 混合反应:将溶解后的反应物A和B混合均匀,加入适量的催化剂。
3. 加热反应:将混合液加热至一定温度,保持恒温一段时间。
4. 冷却反应:将加热后的混合液冷却至室温。
5. 过滤:将冷却后的混合液通过滤纸过滤,得到固体产物。
6. 洗涤:用适量的溶剂洗涤固体产物,去除杂质。
7. 干燥:将洗涤后的固体产物在加热器上干燥,得到纯净的目标产物。
实验数据记录:1. 反应物A的称量:10.0g2. 反应物B的称量:5.0g3. 溶剂体积:100mL4. 催化剂用量:0.5g5. 加热温度:80℃6. 反应时间:2小时7. 冷却时间:1小时8. 过滤时间:10分钟9. 洗涤次数:2次10. 干燥时间:1小时实验结果:经过一系列操作,成功制备出目标产物。
产物为白色固体,纯度较高,符合实验要求。
实验讨论:1. 在实验过程中,加热温度对反应速率有显著影响。
通过控制加热温度,可以加快反应速率,提高产率。
2. 催化剂在反应中起到了关键作用,可以有效降低反应活化能,提高反应速率。
3. 在过滤过程中,滤纸的孔径对固体产物的纯度有一定影响。
选择合适的滤纸可以保证产物纯度。
实验总结:本实验通过化学反应成功制备出目标产物,验证了实验原理的正确性。
在实验过程中,我们掌握了实验室基本操作技能,熟悉了物质制备的基本方法。
环己烯的制备实验报告一、实验目的1、学习以环己醇为原料,通过脱水反应制备环己烯的原理和方法。
2、熟练掌握分馏、蒸馏、萃取等基本操作技能。
3、了解有机化合物制备过程中的产率计算和产物纯度分析方法。
二、实验原理在浓硫酸存在下,环己醇发生分子内脱水反应生成环己烯。
反应式如下:C₆H₁₁OH (环己醇)→ C₆H₁₀(环己烯)+ H₂O本实验采用浓硫酸作为脱水剂,同时浓硫酸也起到催化剂的作用。
反应过程中需要控制温度,以避免发生副反应,如生成环己醚等。
三、实验仪器与试剂1、仪器圆底烧瓶(100 mL)、直形冷凝管、分液漏斗、锥形瓶(100 mL)、蒸馏头、温度计(200℃)、接引管、量筒(10 mL、50 mL)、电热套、铁架台、石棉网等。
2、试剂环己醇(分析纯)、浓硫酸(98%)、氯化钠(分析纯)、无水氯化钙(分析纯)、5%碳酸钠溶液。
四、实验步骤1、在 100 mL 圆底烧瓶中,加入 100 mL(约 01 mol)环己醇和 5 mL 浓硫酸,充分摇匀,放入几粒沸石。
2、安装好分馏装置(分馏柱、温度计、冷凝管等),缓慢加热混合物至沸腾,控制温度在 85 90℃之间进行分馏,将生成的环己烯和水的混合物蒸出。
3、当反应瓶中只剩下很少量的残液并出现阵阵白雾时,停止加热。
将馏出液倒入分液漏斗中,用 5%碳酸钠溶液中和至中性,然后再用适量的氯化钠饱和溶液洗涤,以除去残留的碳酸钠和未反应的醇。
4、分出有机相,用无水氯化钙干燥。
5、安装好蒸馏装置,将干燥后的液体进行蒸馏,收集 80 85℃的馏分,即为环己烯产品。
五、实验现象与记录1、加热混合物后,溶液逐渐变热,有气泡产生。
2、分馏过程中,温度计示数在 85 90℃之间有馏分蒸出,馏出液滴入接收瓶中。
3、用碳酸钠溶液中和时,有气泡产生,溶液由酸性变为中性。
4、用氯化钠饱和溶液洗涤时,溶液出现分层。
5、蒸馏过程中,温度达到 80℃左右时,开始有馏分蒸出。
六、数据处理与结果分析1、环己醇的密度为 09624 g/mL,摩尔质量为 10016 g/mol,则 100 mL 环己醇的质量为:100 mL × 09624 g/mL = 9624 g物质的量为:9624 g ÷ 10016 g/mol ≈ 0096 mol2、实际收集到的环己烯的体积为_____ mL,假设其密度为 08102 g/mL,则其质量为:_____ mL × 08102 g/mL =_____ g物质的量为:_____ g ÷ 8214 g/mol =_____ mol3、产率计算:产率=(实际得到的产物的物质的量÷理论上应得到的产物的物质的量)× 100%=(_____ mol ÷ 0096 mol)× 100% =_____ %4、结果分析(1)如果产率较低,可能的原因有:分馏温度控制不当,导致副反应发生;反应时间不足,未反应完全;洗涤和干燥过程中损失较多产物等。
物质的制备实验总结【氯气】工业制氯气:电解饱和食盐水等方法,2NaCl + H 2O −−→−通电2NaOH + H 2↑+ Cl 2↑ 实验室制氯气:1、原理: ↑++−→−+∆22222)(4Cl O H MnCl MnO HCl 浓 2.净化方法:因浓HCl 有挥发性,制的Cl 2中常混有HCl 和H 2O 杂质,常用饱和食盐水除 HCl ,再用浓硫酸除水蒸气,其顺序是先通过饱和食盐水,再通过浓硫酸。
3.收集方法:利用Cl 2密度比空气密度大于空气且能(填 “能”或“不能”)溶于水,难溶于饱和食盐水,可用向上排空气法或排饱和食盐水法。
4.尾气吸收装置:因Cl 2有毒污染空气,用 NaOH 溶液 吸收多余的氯气,反应的化学方为O H NaCl NaClO Cl NaOH 222++→+。
5.检验:用湿润的KI 淀粉试纸,现象是试纸变蓝,有关反应的化学方程式为2222I KCl Cl KI +→+;离子方程式:2222I Cl Cl I +→+--【硫化氢】● 实验室制法:✓ 原理:用FeS 与非氧化性强酸反应制取。
()22FeS 2HCl FeCl H S dilu +→+↑或()2442FeS H SO FeSO H S dilu +→+↑✓ 装置:用启普发生器或简易气体发生器。
CO 2、H 2、H 2S 可以用相同装置制取。
✓ 收集:向上排空气法。
✓ 验满:用湿润的醋酸铅试纸,变黑。
()2332H S CH COO Pb PbS 2CH COOH ⎡⎤+→↓+⎣⎦或用CuSO 4:()4224CuSO H S CuS H SO ⎡⎤+→↓+⎣⎦黑色沉淀✓ 尾气处理:尾气用NaOH 溶液或CuSO 4溶液吸收。
✓ 注意事项:H 2S 具有强还原性,制取时只能用氧化性弱的盐酸或硫酸,不能用氧化性强的HNO 3或浓H 2SO 4。
除去H 2S 气体中混有的HCl 时,可将气体通过饱和的NaHS 溶液中。
《研究物质的实验方法》物质制备实验《研究物质的实验方法——物质制备实验》在化学的世界里,物质制备实验是一项至关重要的工作。
它不仅能够帮助我们获取所需的物质,还能让我们更深入地理解化学反应的本质和规律。
物质制备实验需要我们精心设计和严谨操作,从选择合适的原料和试剂,到确定实验的步骤和条件,每一个环节都需要我们深思熟虑。
首先,选择合适的原料是物质制备实验的基础。
原料的选择要考虑到其易得性、成本、纯度等因素。
比如,在制备氧气的实验中,我们可以选择过氧化氢溶液作为原料,因为它相对容易获取且价格较为低廉。
但如果要制备高纯度的氧气,可能就需要选择高锰酸钾等试剂。
实验装置的搭建也是关键的一步。
装置的选择要根据反应的类型和条件来确定。
例如,对于需要加热的反应,我们需要使用配有加热装置的仪器,如酒精灯、石棉网等。
而对于有气体产生的反应,还需要考虑气体的收集装置,是采用向上排空气法、向下排空气法还是排水法,这取决于气体的密度和溶解性。
在进行物质制备实验时,控制反应条件至关重要。
温度、压力、浓度、反应时间等因素都会对反应的进行和产物的质量产生影响。
以制备乙酸乙酯为例,反应温度需要控制在一定范围内,过高或过低都会导致产率降低。
同时,反应物的浓度和比例也需要精确控制,以保证反应的充分进行。
实验操作的规范性和安全性同样不容忽视。
在实验过程中,我们要严格按照操作规程进行,避免因操作不当导致实验失败甚至发生危险。
比如,在使用强酸强碱等危险试剂时,要做好防护措施,防止试剂溅到皮肤或眼睛里。
在加热时,要均匀受热,避免局部过热导致仪器破裂。
在物质制备实验中,产物的分离和提纯也是重要的环节。
反应结束后,得到的产物往往不是纯净的,可能会混有杂质。
这就需要我们通过各种方法将产物与杂质分离,并进一步提纯。
常见的分离和提纯方法有过滤、蒸馏、萃取、重结晶等。
过滤适用于分离固体和液体混合物。
通过滤纸或其他过滤介质,将固体杂质留在滤纸上,滤液则是我们需要的液体部分。