镍在不同电解质中阳极极化曲线的测定
- 格式:doc
- 大小:74.00 KB
- 文档页数:3
镍在不同电解质中阳极极化曲线的测定1电极极化当有电流通过电极时,电极电位偏离平衡电极电位的现象叫电极的极化。
1)阴极极化:电流通过阴极时,电极电位向负方向移动,即 EK 比 EK,e负 ,叫阴极极化。
2)阳极极化电流通过阳极时,电极电位向正方向移动 ,即EA 比EA, e正,叫阳极极化。
3)过电位当电极上有电流通过时,电极电位( EK 或 EA )将偏离平衡电极电位( EK,e 或 EA,e),二者之差值叫过电位,以ΔE表示。
ΔE= E –Ee阴极极化时, EK < EK,e,故ΔE < 0,阳极极化时, EA > EA,e,故ΔE > 0。
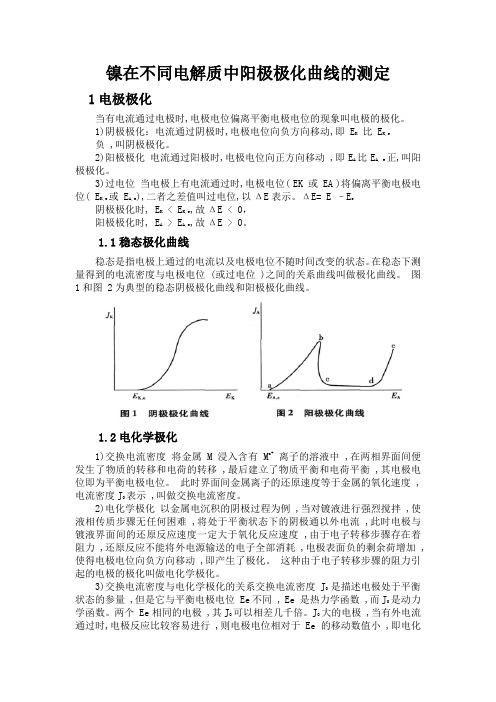
1.1稳态极化曲线稳态是指电极上通过的电流以及电极电位不随时间改变的状态。
在稳态下测量得到的电流密度与电极电位 (或过电位 )之间的关系曲线叫做极化曲线。
图1和图 2为典型的稳态阴极极化曲线和阳极极化曲线。
1.2电化学极化1)交换电流密度将金属 M 浸入含有 M z+离子的溶液中 ,在两相界面间便发生了物质的转移和电荷的转移 ,最后建立了物质平衡和电荷平衡 ,其电极电位即为平衡电极电位。
此时界面间金属离子的还原速度等于金属的氧化速度 ,电流密度J表示 ,叫做交换电流密度。
2)电化学极化以金属电沉积的阴极过程为例 ,当对镀液进行强烈搅拌 ,使液相传质步骤无任何困难 ,将处于平衡状态下的阴极通以外电流 ,此时电极与镀液界面间的还原反应速度一定大于氧化反应速度 ,由于电子转移步骤存在着阻力 ,还原反应不能将外电源输送的电子全部消耗 ,电极表面负的剩余荷增加 ,使得电极电位向负方向移动 ,即产生了极化。
这种由于电子转移步骤的阻力引起的电极的极化叫做电化学极化。
3)交换电流密度与电化学极化的关系交换电流密度 J是描述电极处于平衡状态的参量 ,但是它与平衡电极电位 Ee不同 , Ee 是热力学函数 ,而J是动力学函数。
两个 Ee相同的电极 ,其J0可以相差几千倍。
实验一极化曲线的测定一实验目的1.1掌握用“三电极”法测定金属沉积过程的电极电势。
1.2 通过对镍在玻碳电极上的沉积电势的测量加深理解过电位和极化曲线的概念。
1.3 了解控制电位法测量极化曲线的方法。
二实验原理2.1当把金属插入其盐溶液中时,金属表面上的正离子受到极性水分子的作用,有变成溶剂化离子进入溶液而将电子留在金属表面的倾向。
与此同时,溶液中的金属离子也有从溶液中沉积到金属表面的倾向。
当这种溶解与沉积达到平衡时,形成了双电层,在金属/溶液界面上建立起一个不变的电位差值,这个电位差值就是金属的平衡电位,E R表示。
当有电流通过电极时,电极电势偏离平衡电极电势,成为不可逆电极电势,用E IR表示;电极的电极电势偏离平衡电极电势的现象称为电极的极化。
通常把某一电流密度下的电势E R与E IR 之间的差值的绝对值称为超电势,即:η=│E IR-E R│。
影响超电势的因素很多,如电极材料,电极的表面状态,电流密度,温度,电解质的性质、浓度及溶液中的杂质等。
测定镍沉积超电势实际上就是测定电极在不同外电流下所对应的极化电极电势,以电流对电极电势作图I~E(阴极),所得曲线称为极化曲线。
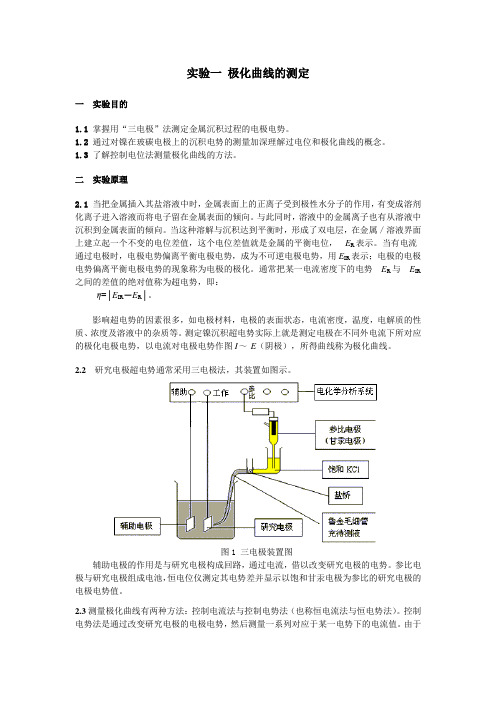
2.2研究电极超电势通常采用三电极法,其装置如图示。
图1 三电极装置图辅助电极的作用是与研究电极构成回路,通过电流,借以改变研究电极的电势。
参比电极与研究电极组成电池,恒电位仪测定其电势差并显示以饱和甘汞电极为参比的研究电极的电极电势值。
2.3测量极化曲线有两种方法:控制电流法与控制电势法(也称恒电流法与恒电势法)。
控制电势法是通过改变研究电极的电极电势,然后测量一系列对应于某一电势下的电流值。
由于电极表面状态在未建立稳定状态前,电流会随时间改变,故一般测出的曲线为“暂态”极化曲线。
本实验采用控制电势法测量极化曲线:控制电极电势以较慢的速度连续改变,并测量对应该电势下的瞬时电流值,以瞬时电流对电极电势作图得极化曲线。
图2 阴极极化曲线三仪器与试剂LK98A微机电化学分析系统一台;甘汞电极一枝;铂电极一枝;玻碳电极一枝;100ml 烧杯3个,500ml烧杯1个;瓦特型镀镍液50ml;稀硝酸50ml;乙醇50ml;蒸馏水500ml。

实验九 线性电位扫描法测定镍在硫酸介质中的钝化行为一.实验目的1.掌握准稳态法测定金属钝化曲线的基本方法,测定金属镍在硫酸介质中的钝化曲线及其维钝电流密度和维钝电位值。
2.学会处理电极表面,了解电极表面状态对钝化曲线测量的影响。
二.实验原理在以金属作阳极的电解池中,通过电流时,通常会发生阳极的电化学溶解过程M M +e n n +−⎯⎯→在金属的阳极溶解过程中,其电极电位必须正于其热力学电位(即平衡电位),电极过程才能发生。
这种电极电位偏离其热力学电位的现象称为极化。
当阳极的极化不太大时,溶解速率随着阳极电极电势(电极电位)的增大而增大,这是金属正常的阳极溶解。
但是在某些化学质介中,当阳极电极电势超过某一正值后,阳极的溶解速率随着阳极电极电势的增大反而大幅度地降低,这种现象称为金属的钝化。
研究金属的钝化过程需要测定钝化曲线,通常用恒电位法。
将被研究金属,例如铁、镍、铬等或其合金置于硫酸或硫酸盐溶液中即为研究电极,它与辅助电极(铂电极)组成一个电解池,同时它又与参比电极(甘汞电极)组成原电池,以镍为阳极为例。
其测量装置示意图如图9.1所示,分为两部分,一是研究电极和辅助电极形成的极化回路,由mA 表测量极化电流的大小。
二是参比电极与研究电极形成的电位测量回路。
图9.1 恒电位法测定金属钝化曲线实验装置示意图1—辅助电极;2—研究电极;3—参比电极通过恒电位仪对研究电极给定一个恒电位后,测量与之对应的准稳态电流值I 。
以通过研究电极的电流密度i 的对数lg{i }对超电势η作图,得金属钝化曲线如图9.2所示。
超电势η即为电流密度为i 时的阳极电极电势Ni ()E i 与i =0时的阳极电极电势Ni (0)E 之差为Ni Ni ()(0)E i E η=− (9.1)即22Hg Cl Ni ()()E i E E i =−22Hg Cl Ni (0)(0)E E E =−所以(0)()E E i η=− (9.2)图9.2 金属钝化曲线用控制电位的方法测定的阳极极化曲线如图9.2所示,可以分为四个区域。

实验一极化曲线的测定一实验目的1.1掌握用“三电极”法测定金属沉积过程的电极电势。
1.2 通过对镍在玻碳电极上的沉积电势的测量加深理解过电位和极化曲线的概念。
1.3 了解控制电位法测量极化曲线的方法。
二实验原理2.1当把金属插入其盐溶液中时,金属表面上的正离子受到极性水分子的作用,有变成溶剂化离子进入溶液而将电子留在金属表面的倾向。
与此同时,溶液中的金属离子也有从溶液中沉积到金属表面的倾向。
当这种溶解与沉积达到平衡时,形成了双电层,在金属/溶液界面上建立起一个不变的电位差值,这个电位差值就是金属的平衡电位,E R表示。
当有电流通过电极时,电极电势偏离平衡电极电势,成为不可逆电极电势,用E IR表示;电极的电极电势偏离平衡电极电势的现象称为电极的极化。
通常把某一电流密度下的电势E R与E IR 之间的差值的绝对值称为超电势,即:η=│E IR-E R│。
影响超电势的因素很多,如电极材料,电极的表面状态,电流密度,温度,电解质的性质、浓度及溶液中的杂质等。
测定镍沉积超电势实际上就是测定电极在不同外电流下所对应的极化电极电势,以电流对电极电势作图I~E(阴极),所得曲线称为极化曲线。
2.2研究电极超电势通常采用三电极法,其装置如图示。
图1 三电极装置图辅助电极的作用是与研究电极构成回路,通过电流,借以改变研究电极的电势。
参比电极与研究电极组成电池,恒电位仪测定其电势差并显示以饱和甘汞电极为参比的研究电极的电极电势值。
2.3测量极化曲线有两种方法:控制电流法与控制电势法(也称恒电流法与恒电势法)。
控制电势法是通过改变研究电极的电极电势,然后测量一系列对应于某一电势下的电流值。
由于电极表面状态在未建立稳定状态前,电流会随时间改变,故一般测出的曲线为“暂态”极化曲线。
本实验采用控制电势法测量极化曲线:控制电极电势以较慢的速度连续改变,并测量对应该电势下的瞬时电流值,以瞬时电流对电极电势作图得极化曲线。
图2 阴极极化曲线三仪器与试剂LK98A微机电化学分析系统一台;甘汞电极一枝;铂电极一枝;玻碳电极一枝;100ml 烧杯3个,500ml烧杯1个;瓦特型镀镍液50ml;稀硝酸50ml;乙醇50ml;蒸馏水500ml。

1实验目的2实验原理线性电势扫描法是指在一定的范围内控制施加在WE 上的电极电势,以一定的速度均匀变化,同时记录对应电极电势下电化学反应的响应电流密度,以电极电势为自变量,电流密度为因变量,用电极电势-电流密度曲线表示实验结果,即极化曲线。
线性电势扫描法可测定电极的阴极和阳极极化曲线。
用该法测得的阳极钝化曲线常为下图所示。
E E 钝化 ii 钝化 图1 线性电势扫描法得到的金属阳极钝化曲线示意图上图中整条曲线分为四个区域:(1)AB 区间为活性溶解区。
金属发生阳极溶解,阳极电流密度与电极电势(或超电势)符合Tafel 规律;(2)BC 区间为过渡钝化区。
由于金属表面开始发生钝化,随着电极电势逐渐正移,金属的溶解速率迅速减小;(3)CD 区间为钝化稳定区。
由于金属表面已经覆盖一层致密的钝化膜,金属的溶解速度保持在一个比较小的水平,溶解速率基本不随电极电势的正移而改变;(4)DE 区间为过度钝化区。
由于在高极化状态下,电极表面发生了析氧反应或生成更高价金属离子的反应,电流密度随电极电势的正移而增大。
从极化曲线可以看出,具有钝化现象的阳极极化曲线的一个重要特点是:在BCD 区间,同一电流密度值下对应几个不同的电极电势值。
这种极化曲线是无法用恒电流法进行测量的。
可见,线性电势扫描法是研究金属钝化现象的重要方法。
影响金属钝化的因素很多。
主要有:(1)金属的组成和结构。
各种金属的钝化能力不同,即所谓的“化学因素”。
在金属中引入其它金属成分,可以改变金属的钝化行为。
如,铁中掺入镍、铬可促进钝化,并提高钝化状态的稳定性。
(2)电解质溶液的组成。
溶液的pH 值、卤素离子和氧化性阴离子对金属的钝化行为存在显著影响,即所谓“溶液因素”。
在酸性和中性溶液中,随着pH 值的增大,有利于钝化的形成。
卤素离子,特别是Cl -离子则阻碍金属的钝化,并能破坏金属的钝态。
有些氧化性的阴离子,如NO 2-等,则可促进金属进入钝态。
(3)其它因素。
镍在硫酸介质中的阳极钝化行为——极化曲线法一、实验目的1.了解金属钝化的原因和钝化行为的测定方法;2.掌握运用静态和动态极化曲线法测定极化曲线的方法。
3. 技能要求:掌握DJS-292恒电位的使用方法。
二.实验原理金属的阳极过程是指金属作为阳极发生电化学溶解的过程。
在金属的阳极过程中存在着电极的极化。
当阳极极化不大时,阳极过程的速率随着电位的变正而逐渐增大,这是金属的正常溶解。
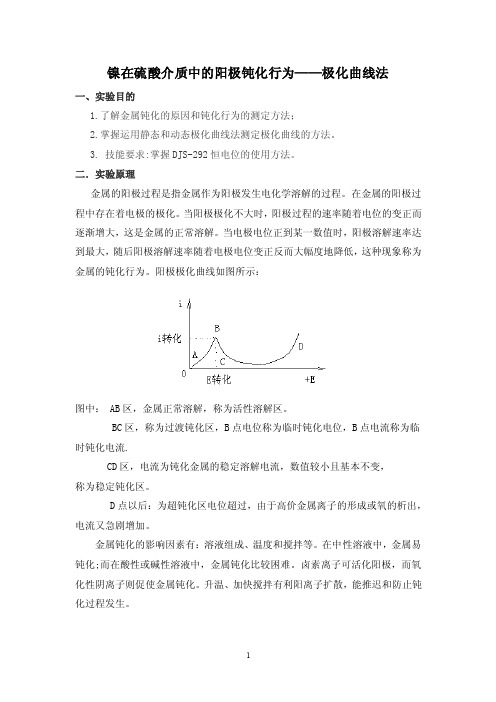
当电极电位正到某一数值时,阳极溶解速率达到最大,随后阳极溶解速率随着电极电位变正反而大幅度地降低,这种现象称为金属的钝化行为。
阳极极化曲线如图所示:图中: AB区,金属正常溶解,称为活性溶解区。
BC区,称为过渡钝化区,B点电位称为临时钝化电位,B点电流称为临时钝化电流.CD区,电流为钝化金属的稳定溶解电流,数值较小且基本不变,称为稳定钝化区。
D点以后:为超钝化区电位超过,由于高价金属离子的形成或氧的析出,电流又急剧增加。
金属钝化的影响因素有:溶液组成、温度和搅拌等。
在中性溶液中,金属易钝化;而在酸性或碱性溶液中,金属钝化比较困难。
卤素离子可活化阳极,而氧化性阴离子则促使金属钝化。
升温、加快搅拌有利阳离子扩散,能推迟和防止钝化过程发生。
恒电位极化曲线的测定有静态法和动态法。
静态法是在一个恒定电位下,观察电流随时间的变化,直至电流基本达到某种稳定值,此值为该电位下的稳定电流。
本实验利用恒电位仪按照一定的规律改变阳极的电位,同时测定相应的电流的值。
从而通过作图得到镍在硫酸介质中的极化曲线图以及氯离子对镍在硫酸介质中阳极敦化曲线行为的影响。
实验线路图:三、实验试剂与仪器镍电极;甘汞电极;硫酸溶液(0.5mol•L-1);H2SO4+KCl 溶液(H2SO40.5mol•L-1 + KCl 0.5mol•L-1)。
DJS-292恒电位仪;四、实验步骤(1).准备工作:1.用金相砂纸蘸水打磨镍电极,尽量打磨发亮,将较亮的一极作为工作极,插入左孔中。
阳极极化曲线的测定一.实验目的1.掌握恒电位法测定金属极化曲线的原理和方法。
2.了解极化曲线的意义和应用。
二.实验原理1.极化现象为了探索电极过程的机理及影响电极过程的各种因素,需要对电极过程进行研究,而在该研究过程中极化曲线的测定又是重要的方法之一。
在研究可逆电池的电动势和电池反应时电极上几乎没有电流通过,每个电极或电池反应都是在无限接近于平衡下进行的,因此电极反应是可逆的,测定的电极电势为平衡电势。
但当有电流明显地通过电池时,则电极的平衡状态被破坏,此时电极反应处于不可逆状态,随着电极上电流密度的增加,电极反应的不可逆程度也随之增大。
在有电流通过电极时,由于电极反应的不可逆而使电极电位偏离平衡值的现象称作电极的极化。
根据实验测出的数据来描述电流密度与电极电位之间关系的曲线称作极化曲线。
通常,金属的阳极过程是指金属作为阳极时在一定的外电势下发生的阳极溶解过程,如下此过程只有在电极电位正于其热力学电位时才能发生。
阳极的溶解速度随电位变正而逐渐增大,这是正常的阳极溶出。
但当阳极电位正到某一数值时,其溶解速度达到一最大值。
此后阳极溶解速度随着电位变正,反而大幅度地降低,这种现象称为金属的钝化现象。
极化曲线表明,电位从A 点开始上升(即电位向正方向移动),电流密度也随之增加,电位超过C 点以后,电流密度迅速减至很小,这是因为在金属表面上生成了一层电阻高、耐腐蚀的钝化膜。
到达D 点以后,电位再继续上升,电流仍保持在一个基本不变的很小的数值上,电位升到E 点时,电流又随电位的上升而增大。
如图1所示。
2.影响金属钝化过程的几个因素金属钝化现象是常见的,人们已对它进行了大量的研究工作。
影响金属钝化过程及钝化性质的因素,可归纳为以下几点:(1)溶液的组成。
溶液中存在的H +、卤素离子以及某些具有氧化性的阴离子,对金属的钝化起着颇为显著的影响。
在中性溶液中,金属一般比较容易钝化,而在酸性或某些碱 性的溶液中,钝化则困难得多,这与阳极反应产物的溶解度有关系。
镍电极阳极极化曲线的影响因素研究一、引言镍电极是一种常用的阳极材料,广泛应用于电化学反应中。
阳极极化曲线是研究镍电极性能的重要手段之一,通过分析阳极极化曲线可以了解镍电极在不同条件下的性能表现。
本文旨在探讨影响镍电极阳极极化曲线的因素,并对其进行全面详细的研究。
二、影响因素1. 电解液成分电解液成分对镍电极阳极极化曲线有着重要影响。
不同的电解液成分会改变镍电极与溶液之间的相互作用,从而影响阳极氧化反应的进行。
常见的影响因素包括pH值、金属离子浓度等。
2. 温度温度是影响镍电极阳极氧化反应速率的重要因素之一。
通常情况下,随着温度升高,阳极氧化反应速率增加。
这是由于高温下溶液中金属离子扩散速率增加,导致氧化反应更容易发生。
3. 表面处理镍电极的表面处理对阳极极化曲线有着重要影响。
常见的表面处理方法包括机械抛光、酸洗等。
这些处理方法可以改变镍电极表面的形貌和化学性质,从而影响阳极氧化反应的进行。
4. 电流密度电流密度是指单位面积上通过的电流量。
电流密度对镍电极阳极极化曲线有着显著影响。
通常情况下,随着电流密度增大,阳极氧化反应速率增加。
这是由于更大的电流密度能够提供更多的活化能,促进氧化反应的进行。
5. 阳极材料阳极材料是指与溶液接触并参与反应的材料。
不同材料具有不同的氧化特性,因此会对阳极极化曲线产生影响。
在镍电极中,常见的阳极材料包括纯镍、合金等。
三、实验研究为了探究以上因素对镍电极阳极氧化反应及其产物形成过程的影响,我们进行了一系列实验研究。
我们选取不同组成和浓度的电解液,并在相同的实验条件下测量了镍电极的阳极极化曲线。
结果显示,不同电解液成分会导致阳极氧化反应速率和产物形成程度的差异。
在pH值较高的溶液中,镍电极的阳极氧化速率更快,产生的氧化膜也更厚。
我们将温度作为变量进行实验研究。
通过控制温度,我们观察到随着温度升高,镍电极的阳极氧化速率增加。
这是由于高温下金属离子扩散速率增加,促进了氧化反应的进行。
线性电位扫描法测定镍在硫酸溶液中的钝化行为1. 请绘制一下镍在硫酸溶液中的阳极极化曲线草图,并指出钝化电流,钝化电势,稳定钝化区间,稳定钝化区电流。
如何测定镍在硫酸溶液中的阳极极化曲线?答:采用三电极体系用线性电位扫描法测定镍在硫酸溶液中的阳极极化曲线,在阳极极化曲线测量线路中,参比电极与工作镍电极构成测量回路,对工作镍电极的电势进行测量和控制,回路中没有极化电流流过,只有极小的测量电流,不会对工作电极的极化状态、参比电极的稳定性造成干扰。
辅助电极与工作镍电极构成极化回路,极化电路中流过极化电流,并对极化电流进行测量和控制。
2. 在线性电位扫描法测定镍在硫酸溶液中的钝化行为的实验中,为什么要用恒电势法而不能用恒电流法?答:由于恒电势法能测得完整的阳极极化曲线,因此,在金属钝化研究中比恒电流法更能反映电极的实际过程。
3. 在阳极极化曲线测量中,参比电极和辅助电极各起什么作用?答:在阳极极化曲线测量线路中,参比电极与工作电极构成测量回路,对工作电极的电势进行测量和控制,回路中没有极化电流流过,只有极小的测量电流,不会对工作电极的极化状态、参比电i c 一临界钝化电流E c 一临界钝化电位i p 一稳定钝化电流 AB 一活性溶解区BC 一过渡钝化区CD 一稳定钝化区DE 一过钝化区极的稳定性造成干扰。
辅助电极与工作电极构成极化回路,极化电路中流过极化电流,并对极化电流进行测量和控制。
4. 在恒电势法测定极化曲线时,何谓静态法?何谓动态法?答:(1)静态法将研究电极的电势恒定在某一数值,同时测量相应极化状况下达到稳定后的电流。
如此逐点测量一系列恒定电势时所对应的稳定电流值,将测得的数据绘制成电流-电势图,从图中即可得到钝化电位。
(2)动态法将研究电极的电势随时间线性连续地变化(见图1),同时记录随电势改变而变化的瞬时电流,就可得完整的极化曲线图。
所采用的扫描速率(单位时间电势变化的速率)需根据研究体系的性质而定。
应用电化学实验本课程安排4个综合实验,每个实验4个学时,共16个学时,按照10人一组分别进行。
自编实验讲义。
实验仪器有:分析天平;直流稳压稳流电源;电化学工作站;恒温水浴;饱和甘汞电极;鲁金毛细管;H 型电解槽;Pt 电极;电解槽;赫尔槽;电力搅拌器、磁力搅拌器;pH 计。
实验1:极化曲线的测定实验内容:测定Ni 2+离子、Co 2+离子单金属电沉积、以及Ni-Co 合金共电沉积的稳态阴极极化曲线。
一、 实验目的1.掌握三电极体系装置和电化学工作站的应用。
2.掌握用线性电位扫描法测量极化曲线的原理和实验方法,学会从极化曲线上分析电极过程特征。
2.测定金属电沉积的阴极极化曲线。
3.学会数据的分析和处理。
二、 实验原理研究电极过程的基本方法是测定极化曲线。
电极上电势随电流密度变化的关系曲线称为极化曲线。
极化曲线表示了电极电位与电流密度之间的关系,从极化曲线上可以求得任一电流密度下的过电势(超电势),看出不同电流密度时电势变化的趋势,直观地反映了电极反应速度与电极电势的关系。
在某一电流密度下极化曲线的斜率i ∆∆ϕ称为极化度(极化率),极化度的大小可以衡量极化的程度,判断电极过程的难易。
极化度小,电极过程容易进行;极化度大,电极过程受到较大阻碍而难以进行。
从极化曲线还可求电极过程动力学参数,如交换电流密度i 0、电子传递系数α、标准速度常数、以及扩散系数;还可以测定反应级数、电化学反应活化能等。
被控制的变量电极电位是随时间连续线性变化的。
随时间连续线性变化的电位可用线性方程表示:Vt i +=ϕϕ;其中:ϕ——扫描电位,t ——扫描时间,V ——扫描速度,i ϕ——扫描起点电位。
常以研究电极相对于参比电极的开路电位作为扫描的起点电位。
扫描电位与时间的关系如图1所示。
图1 电位与时间的关系三、实验仪器、测量线路及试剂1. 实验主要仪器:电化学工作站、计算机、H电解槽,铜丝电极(研究电极),箔片(辅助电极),饱和甘汞电极(参比电极)、Luggin毛细管。
镍在不同电解质中阳极极化曲线的测定
1电极极化
当有电流通过电极时,电极电位偏离平衡电极电位的现象叫电极的极化。
1)阴极极化:电流通过阴极时,电极电位向负方向移动,即 E
K 比 E
K,e
负 ,叫阴极极化。
2)阳极极化电流通过阳极时,电极电位向正方向移动 ,即E
A 比E
A, e
正,叫阳
极极化。
3)过电位当电极上有电流通过时,电极电位( EK 或 EA )将偏离平衡电极电
位( E
K,e 或 E
A,e
),二者之差值叫过电位,以ΔE表示。
ΔE= E –E
e
阴极极化时, E
K < E
K,e
,故ΔE < 0,
阳极极化时, E
A > E
A,e
,故ΔE > 0。
1.1稳态极化曲线
稳态是指电极上通过的电流以及电极电位不随时间改变的状态。
在稳态下测量得到的电流密度与电极电位 (或过电位 )之间的关系曲线叫做极化曲线。
图1和图 2为典型的稳态阴极极化曲线和阳极极化曲线。
1.2电化学极化
1)交换电流密度将金属 M 浸入含有 M z+离子的溶液中 ,在两相界面间便发生了物质的转移和电荷的转移 ,最后建立了物质平衡和电荷平衡 ,其电极电位即为平衡电极电位。
此时界面间金属离子的还原速度等于金属的氧化速度 ,电流密度J
表示 ,叫做交换电流密度。
2)电化学极化以金属电沉积的阴极过程为例 ,当对镀液进行强烈搅拌 ,使液相传质步骤无任何困难 ,将处于平衡状态下的阴极通以外电流 ,此时电极与镀液界面间的还原反应速度一定大于氧化反应速度 ,由于电子转移步骤存在着阻力 ,还原反应不能将外电源输送的电子全部消耗 ,电极表面负的剩余荷增加 ,使得电极电位向负方向移动 ,即产生了极化。
这种由于电子转移步骤的阻力引起的电极的极化叫做电化学极化。
3)交换电流密度与电化学极化的关系交换电流密度 J
是描述电极处于平衡
状态的参量 ,但是它与平衡电极电位 Ee不同 , Ee 是热力学函数 ,而J
是动力
学函数。
两个 Ee相同的电极 ,其J
0可以相差几千倍。
J
大的电极 ,当有外电流
通过时,电极反应比较容易进行 ,则电极电位相对于 Ee 的移动数值小 ,即电化
学极化小。
相反,J
小的电极 ,当有外电流通过时,电极反应的阻力大 ,电极电0
的数值可以从手册上查出 ,也位相对于 Ee的移动数值大 ,即电化学极化大。
J
与电极反应的本性、温度及反应物的浓度有关。
在电镀中 ,可以实验测量。
J
无论哪种使用场合的镀层 ,都要求结构致密 ,表面光滑平整 ,这样的镀层只能在电化学极化比较大的条件下完成。
分析一下生产中沿用多年的电镀液可以发现 ,只有电镀铁、钴和镍能够从不加添加剂的简单盐镀液中获得结晶细致、平整
小 ,产生比较大的电化学极光滑的镀层 ,这是因为铁、钴及镍的电极反应的J
化。
而与它们的J
相差几千倍的锌及铜等 ,若采用简单盐电镀液 ,则需加入添0
加剂 ,或者采用络合物电解液 ,以增大电化学极化 ,获得合格的镀层。
1.3浓度极化
1)什么叫浓度极化浓度极化又叫做浓差极化 ,有些电极反应的交换电流密度很大 ,也即是电子转移步骤的阻力很小 ,液相传质步骤成为控制步骤 ,由于液相传质困难 ,使得电极电位偏离平衡电位的现象叫浓度极化。
2)极限电流密度某金属离子还原为金属的电极过程 ,若液相传质为控制步骤时 ,随着阴极电流密度的增加 ,紧靠电极表面附近液层中反应物的浓度将逐
表渐减小 ,极限情况下降到 0,此时的电流密度最大 ,叫做极限电流密度 ,以J
d 示。
在电镀工艺规范中 ,一般都给出阴极电流密度的上限和下限值 ,其中下限值是为了保证一定的沉积速度 ,而上限值则是为了避免金属电沉积发生浓度极化 ,因为浓度极化控制下得到的是疏松多孔或海绵状镀层 ,毫无实用价值。
通常生产中采用阴极移动、机械搅拌、空气搅拌及镀液循环等措施来减小液相传质的阻力 ,增大允许使用的电流密度上限值。
但是金属电沉积的另一个特例 ,即电化学方法制取金属粉末 ,则是要在液相传质步骤控制下进行 ,使电极反应在极限电流密度下进行
2金属钝化曲线(即阳极极化曲线)各转折点的意义是什么(1)AB段为阳极的活性溶解区:随着电极电势的升高,阳极电流逐渐增大,表示金属的活性腐蚀增强,此时金属晶格上的金属原子溶解进入溶液中形成水合离子(或络离子) B点对应的电流jB称为最大腐蚀电流。
(2)BC段为过渡钝化区:随着电极电势的逐渐升高,电流逐渐减小。
这是因为此时电极表面逐渐形成某种吸附膜或氧化膜,致使电阻增大,电极过程受阻所致。
(3)CD段为稳定钝化区:电极电势急剧升高,而电流基本保持不变。
这是因为电极表面已经形成一层致密的电阻膜。
该电阻膜极大地阻止了电极过程的进
称为稳定钝化电流或维钝一步进行,因而电流基本保持不变。
C点对应的电流J
C
电流,亦即最小腐蚀电流。
如果要对金属进行阳极保护,则必须把金属构件的电势控制在CD段。
(4)DE段为过钝化区:随着电极电势的进一步升高,电流复又增加。
这是由于电极表面发生了其他阳极过程,例如氧气的析出和/或由于电阻膜破裂而造成金属的二次腐蚀。
3测定极化曲线时,三个电极的作用分别是什么?
工作电极:以测定请在铜电极上的反应极化曲线为例,工作电极(即研究电极)是发生析氢反应的场所.
参比电极:作为基准来测量其他电极的过电位.
辅助电极:用来通过电流以实现研究电极的极化.研究阴极过程时,辅助电极作阳极;研究阳极过程时,辅助电极作阴极.
工作电极与辅助电极组成电解池,测定极化电流值
工作电极与参比电极组成原电池,测定电极过程中研究电极的电势变化值4明确本实验要考察哪些因素对金属钝化性能的影响
(1)溶液组成
①中性电极溶液容易钝化,酸性或者某些碱性容易钝化困难
②Cl-存在破坏金属表面钝化膜,明显阻止钝化
③氧化性阴离子促进金属钝化
(2)金属化学组成及结构
易钝化顺序:Cr>Ni>Fe
(3)外界因素
温度升高或者加剧搅拌都可以推迟或防止钝化发生
5实验步骤
(1)打开并预热仪器,将研究电极放入0.1mol/l 的硫酸电解液,装好辅助电极和参比电极,并接好测量电路。
(2)使用CHI仪器进入工作界面,设定参数后测量阳极曲线。
(3)在原有溶液中添加KCL使之成为0.1mol/l 硫酸+0.1mol/l 氯化钾+0.04mol/l 氯化钾和01mol/l 氯化钾,重复上述步骤。