阴极极化曲线的测定(精)
- 格式:ppt
- 大小:186.50 KB
- 文档页数:19

实验八 极化曲线的测定一、实验目的1、掌握稳态恒电势法测定金属极化曲线的基本原理和测试方法。
2、了解极化曲线的意义和应用。
3、掌握恒电势仪的使用方法。
二、实验原理1、极化现象与极化曲线当电极处于平衡状态,电极上无电流通过时,这时的电极电势称为平衡电势。
当有电流明显地通过电极时,电极的平衡状态被破坏,电极电势偏离平衡值,而且随着电极上电流密度的增加,电极反应的不可逆程度也随之增大,电极电势将越来越偏离平衡电势。
这种由于有电流存在而造成电极电势偏离平衡电极电势的现象称为电极的极化。
在某一电流密度下,实际发生电解的电极电势与平衡电极电势之间的差值称为超电势。
阳极上由于超电势使电极电势变大,阴极上由于超电势使电极电势变小。
超电势的大小与流经电极的电流密度有关,电极电势(或超电势)与电流密度的关系曲线称为极化曲线,极化曲线的形状和变化规律反映了电化学过程的动力学特征。
除电流密度外,影响超电势的因素还有很多,如电极材料,电极的表面状态,温度,电解质的性质、浓度及溶液中的杂质等。
金属的阳极过程是指金属作为阳极时在一定的外电势下发生的阳极溶解过程,如下式所示:M →M n++n e此过程只有在电极电势正于其热力学电势时才能发生。
阳极的溶解速度(用电流密度表示)随电势变正而逐渐增大,这是正常的阳极溶出,但当阳极电势正到某一数值时,其溶解速度达到最大值,此后阳极溶解速度随电势变正反而大幅度降低,这种现象称为金属的钝化现象。
图3-8-1为钢在硫酸溶液中的阳极极化曲线。
图中曲线表明,从A 点开始,随着电势向正方向移动,电流密度也随之增加,电势超过B点后,电流密度随电势增加迅速减至最小,这是因为在金属表面生产了一层电阻高,耐腐蚀的钝化膜。
B 点对应的电势称为临界钝化电势,对应的电流称为临界钝化电流。
电势到达C点以后,随着电势的继续增加,电流却保持在一个基本不变的很小的数值上,该电流称为维钝电流,直到电势升到D 点,电流才有随着电势的上升而增大,表示阳极又发生了氧化过程,可能是高价金属离子产生也可能是水分子放电析出氧气,DE 段称为过钝化区。

北京理工大学能源与化学工程实验预习报告姓名班级学号实验日期2016年 4 月 27 日指导教师____________________ 同组姓名成绩_______________实验名称阴极极化曲线的测量一、实验目的1.掌握测量极化曲线的基本原理和测量方法2.测定铁电极在碱性溶液中的阴极极化曲线3.学会根据极化曲线分析溶液中添加剂作用的方法二、实验内容和原理在电化学研究中,很多电化学反应表现在电极的计划上,因此测量电极的极化曲线是很重要的研究方法。
在电流通过电极与电解液界面时,电极电位将偏离平衡电极电位,当电位向负向偏离时,称之为阴极极化,向正向偏离时,称之为阳极极化。
在电镀工艺中,用测定阴极极化的方法研究电镀液各组分及工艺条件对阴极极化的影响,而阳极极化可用来研究阳极行为或腐蚀现象。
所谓极化曲线就是电位与电流密度之间的关系曲线。
测量极化曲线的方法分为恒电流法和恒电位法,而每种方法又可分为稳流法和暂态法。
本实验是测量在碱性镀锌溶液中,香草醛光亮对阴极极化的影响。
三、主要仪器设备1.实验仪器CHI电化学工作站1台,电解池1个。
2.试剂及材料ZnO,NaOH,香草醛,低碳钢电极(表面积为1cm2),铂片电极1块,硫酸亚汞电极1个。
四、操作方法与步骤本实验采用CHI电化学工作站中的线性电位扫描法分别测量以下两种电解液中的阴极极化曲线:(1)ZnO 12g/L+NaOH 120g/L(2)ZnO 12g/L+NaOH 120g/L+香草醛 0.2g/L扫描速度:2mV/s;电位扫描范围:-1.18~ -2.18V。
1.接好线路。
2.测量阴极极化曲线(1)研究电极为低碳钢电极,表面积为1cm2(注意测试面积一定要准确,不测部分要用绝缘漆涂好)。
将待测的电极用金相砂纸打磨,除去氧化膜,用丙酮洗涤涂油。
再用脱脂棉蘸酒精擦洗,用蒸馏水冲洗干净,再用滤纸吸干,放进电解池中。
(2)电解池中的辅助电极为铂电极,参比电极为硫酸亚汞电极。


阴极极化曲线测定实验报告阴极极化曲线测定实验报告引言:阴极极化曲线测定实验是电化学领域中常用的实验方法之一。
通过测定阴极电流与电位之间的关系,可以了解阴极在不同电位下的电化学反应过程,从而研究电极的耐蚀性、活性等性质。
本实验旨在通过测定不同电位下的阴极电流,绘制阴极极化曲线,并分析实验结果。
实验原理:阴极极化曲线实验基于极化现象的原理。
在电化学反应中,当电极电位发生变化时,电极表面的反应速率也会发生变化,从而导致电流的变化。
在阴极极化曲线实验中,通过改变电位,观察阴极电流的变化,可以推断出阴极反应的特性。
实验步骤:1. 准备工作:将实验所需的电化学池装置搭建好,并保证电极表面的洁净。
2. 测定开路电位:将电化学池接通电源,记录下电极在不施加外加电压时的电位,即开路电位。
3. 测定极化曲线:通过改变电位,记录下不同电位下的阴极电流值。
可采用逐步增加或逐步减小电位的方法,确保测定的数据准确可靠。
4. 绘制阴极极化曲线:将测定得到的电位和阴极电流数据绘制成图表,得到阴极极化曲线。
实验结果:根据实验数据,绘制出了阴极极化曲线。
曲线呈现出一定的特征,根据曲线的形状和趋势,可以分析出阴极反应的性质。
例如,曲线的斜率越大,说明阴极反应速率越快;曲线的平缓区域表示阴极反应基本停止;曲线的峰值处表示阴极反应达到最大速率。
实验讨论:阴极极化曲线实验是研究电极反应的重要手段之一。
通过该实验可以了解电极的耐蚀性、活性以及电极反应的速率等性质。
实验结果对于材料的选择、腐蚀防护、电池设计等方面都具有重要意义。
然而,阴极极化曲线实验也存在一定的局限性。
首先,实验结果受到实验条件的影响,如温度、溶液浓度等。
其次,实验结果只能反映出阴极反应的整体性质,无法提供关于反应机理的详细信息。
因此,在实际应用中,还需要结合其他实验方法和理论模型,进一步研究电极反应过程。
结论:通过阴极极化曲线测定实验,我们成功地绘制出了阴极极化曲线,并通过曲线的形状和趋势分析了阴极反应的性质。

实验二稳态恒流法阴极极化曲线的测量一、实验目的1.理解并掌握经典恒电流法测量稳态阴极极化曲线的基本原理和测量技术。
2.测定锌电极在碱性溶液中的阴极极化曲线。
3.熟知阴极极化曲线的应用二、实验原理恒电流法是控制电流密度使其依次恒定在不同的数值,同时测定相应的稳定电极电位值,然后把测得的一系列电流密度和电极电位绘成曲线,就是恒流稳态极化曲线。
在此情况下,电流密度是自变量,极化曲线表示表示电极电位和电流密度之间的函数关系:φ=f(i)。
在恒电流极化中,电流的恒定可用两种方法来实现:一种是恒电流仪,它通过电子线路的反馈作用自动调整,使电流维持稳定。
另一种是经典恒电流法,即利用高压直流电源串联一组高电阻来维持电流恒定。
本实验采用高压高阻法恒流。
由于电解池的阻抗远远小于外线路中串联的限流电阻,所以在测量过程中由于电极极化、钝化等原因引起电解池的阻抗变化或电路中接触点电阻的变化相对于限流电阻而言是微不足道的,因此,它引起的电流变化可以忽略不计,达到恒定电流的目的。
与控制电位法相比,控制电流法所用仪器简单,容易实现,所以应用较早。
但控制电流法只适用于测量单值函数的稳态极化曲线,即一个电流密度值对应于一个电极电位值。
一个电流密度对应几个电极电位值时必须采用控制电位法才能测得一条完整的极化曲线。
采用恒电流法测量极化曲线时,在每一个给定的电流密度下,读取相应的电极电位值。
但由于种种原因,在给定电流后,电流不能立即达到稳态,即电极电位还将随时间发生变化。
不同的电极体系,电位趋于稳定所需要的时间也不同。
那么,在实际测量时应该怎样来读取实验数据呢?大家知道,所谓稳态是相对于暂态而言的,绝对的稳态是不存在的,暂态与稳态的划分是以物理量变化是否显著为标准,这种划分也是相对的,因为其还与采用仪器的灵敏度及观察的时间长短有关。
所以,在实际测量中,往往电位接近稳定时(即1~3分钟内读数无大变化)就读取电位值,或者硬性规定时间间隔,给定电流后停一定时间(如3、5或10分钟)测取电位值。
实验一极化曲线的测定一实验目的1.1掌握用“三电极”法测定金属沉积过程的电极电势。
1.2 通过对镍在玻碳电极上的沉积电势的测量加深理解过电位和极化曲线的概念。
1.3 了解控制电位法测量极化曲线的方法。
二实验原理2.1当把金属插入其盐溶液中时,金属表面上的正离子受到极性水分子的作用,有变成溶剂化离子进入溶液而将电子留在金属表面的倾向。
与此同时,溶液中的金属离子也有从溶液中沉积到金属表面的倾向。
当这种溶解与沉积达到平衡时,形成了双电层,在金属/溶液界面上建立起一个不变的电位差值,这个电位差值就是金属的平衡电位,E R表示。
当有电流通过电极时,电极电势偏离平衡电极电势,成为不可逆电极电势,用E IR表示;电极的电极电势偏离平衡电极电势的现象称为电极的极化。
通常把某一电流密度下的电势E R与E IR 之间的差值的绝对值称为超电势,即:η=│E IR-E R│。
影响超电势的因素很多,如电极材料,电极的表面状态,电流密度,温度,电解质的性质、浓度及溶液中的杂质等。
测定镍沉积超电势实际上就是测定电极在不同外电流下所对应的极化电极电势,以电流对电极电势作图I~E(阴极),所得曲线称为极化曲线。
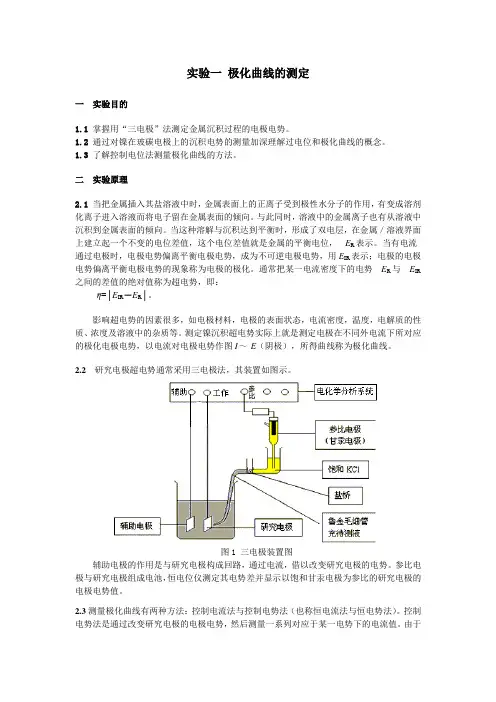
2.2研究电极超电势通常采用三电极法,其装置如图示。
图1 三电极装置图辅助电极的作用是与研究电极构成回路,通过电流,借以改变研究电极的电势。
参比电极与研究电极组成电池,恒电位仪测定其电势差并显示以饱和甘汞电极为参比的研究电极的电极电势值。
2.3测量极化曲线有两种方法:控制电流法与控制电势法(也称恒电流法与恒电势法)。
控制电势法是通过改变研究电极的电极电势,然后测量一系列对应于某一电势下的电流值。
由于电极表面状态在未建立稳定状态前,电流会随时间改变,故一般测出的曲线为“暂态”极化曲线。
本实验采用控制电势法测量极化曲线:控制电极电势以较慢的速度连续改变,并测量对应该电势下的瞬时电流值,以瞬时电流对电极电势作图得极化曲线。
图2 阴极极化曲线三仪器与试剂LK98A微机电化学分析系统一台;甘汞电极一枝;铂电极一枝;玻碳电极一枝;100ml 烧杯3个,500ml烧杯1个;瓦特型镀镍液50ml;稀硝酸50ml;乙醇50ml;蒸馏水500ml。

阴极极化曲线是用于描述电极的极化过程的一种图示方法。
它是通过对电压和电流的关系进行测量和分析,揭示电化学反应的机理和特征。
在电化学系统中,阴极是电化学反应的位置,它是电流的输出端。
当电化学反应进行时,阴极的电压会发生变化,这种变化被称为阴极极化。
是用电流密度和电压之间的关系描绘阴极极化过程的图形。
图中,电流密度是沿着X轴,电压是沿着Y轴。
可以提供许多有用的信息,可以用来分析电化学反应的特性和参数,比如活化能、扩散系数、反应机理、反应速率等。
它还可以用来评估电极表面的性能和稳定性,以及设计和优化电化学过程。
的形状和斜率取决于电化学系统中的许多因素,包括反应物和产物的浓度、反应速率、电解质浓度和性质、电极表面活性和形态等。
因此,可以被用来描述不同环境条件下的电极反应过程,如酸性、碱性和中性环境等。
的常见形式有三种:Tafel曲线、极限电流密度曲线和电流电位曲线。
Tafel曲线是许多电化学反应表现出来的典型曲线,它是用来描述电极氢化和氧化反应过程的。
这种曲线通常是呈线性的,其斜率可以用来计算电极的kinetic 参数,如反应速率系数和表观活化能等。
极限电流密度曲线是用于描述电极间电荷传递速率的,它可以用来衡量反应速率的极限和表征电极的过极反应。
此外,这种曲线还可以用来评估电极表面的催化性能和电极材料的稳定性。
电流电位曲线是用于测量电极的极化电压的,它可以反映电极极化的整个过程和性质,包括耗散、临界和热力学稳定性等。
在使用的过程中,我们需要注意以下几点:首先,我们需要选择一种合适的电化学系统和电极,并使其达到稳定状态。
此外,我们还需要控制好电压和电流的范围,以避免电解质的电解效应和电极的不可逆反应。
其次,我们需要准确地测量电流密度和电势,并通过对数据进行处理和分析,得出的参数和特征。
最后,我们需要根据的特点和参数来判断电极反应的机理和稳定性,并进行相应的改进和优化。
总之,是一种非常重要的测量和分析工具,它可以帮助我们更好地理解电化学反应的本质和特性,从而优化电化学系统和电极的设计和运用。


阴极极化曲线的测定The measurement of cathode polarization curve一、实验目的及要求1.测定氢在光亮铂电极上的活化超电势,并求出塔菲尔公式中的两个常数a和b以及交换电流密度i;2.了解超电势的种类和影响超电势的因素;3.掌握采用三电极恒电流法测定阴极极化曲线的实验方法。
二、实验基本原理本实验采用三电极恒电流法测定阴极极化曲线。
在电解H2SO4溶液时,阴极上产生H2,电极反应成为成为单向不可逆过程,电极表面产生极化,其氢超电势为η=ΦH+/H2-φc不可逆电极电势为φc=φ甘汞-E对于阴极极化的电化学极化,在一定电流密度范围内塔菲尔公式为η=a+b log i 式中,η为氢超电势,单位为V;a和b为常数,b为该线性方程的斜率,b值随电极性质等的变化影响不大;a为电流密度为1A•cm-1时的超电势值,a值的大小与电极材料、表面状态、电流密度、溶液组成和温度等有关,基本代表了电极反应的不可逆程度的大小。
a值越大,在所给电流密度氢超电势也越大。
铂电极材料属于低氢超电势金属,其a值在0.1-0.3V 之间。
当电流密度极低时,氢超电势不服从上述塔菲尔公式,此时η与电流密度i成正比关系。
所以,氢超电势的测量就是如何测量在一定范围内一系列不同电流密度下的电极电势,以及在实验中如何采取措施消除电阻超电势和浓差超电势等问题。
实验选择甘汞电极作辅助电极与被测电极组成一个电解池使氢在电极上电解;同时选择一个掺比电极与被测电极组成一个原电池,测量电动势,获得被测电极的电极电势。
对于电阻超电势可采用鲁金毛细管消除。
当η=0时,交换电流密度为log i0=-a/b同时,作i-φc图,可从图上获得氢在电极上显著析出时的最小析出电势。
三、仪器试剂恒电流法测定极化曲线装置一套。
标准电流电压发生器一台,数字式酸度计一台,电流表一个,饱和甘汞惦记、铂电极各一支。
四.实验步骤1.测量研究电极的面积后,清洗研究电极和辅助电极,清洗极化曲线测定装置。
实验八恒电流法测定金属阴极极化曲线一、实验目的:1.掌握恒电流法测定阴极极化曲线的基本原理和方法;2.运用极化曲线初步判定实施阴极保护的可能性;二、基本原理:对于构成腐蚀体系的金属电极,在外加电流的作用下,阴极的电位偏离其自腐蚀电位向负的方向移动,这种现象称为阴极极化。
电极上通过的电流密度越大,电极电位偏离的程度也越大。
控制外加电流密度,使其由小到大逐渐增加,便可测得一系列对应于各电流值的电位值。
做阴极电位与电流密度的关系曲线,即为恒电流阴极极化曲线。
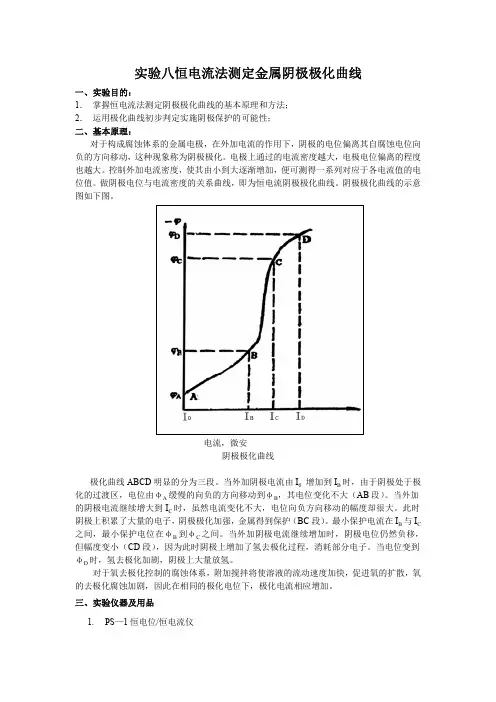
阴极极化曲线的示意图如下图。
I电流,微安阴极极化曲线极化曲线ABCD明显的分为三段。
当外加阴极电流由I0增加到I B时,由于阴极处于极化的过渡区,电位由φA缓慢的向负的方向移动到φB,其电位变化不大(AB段)。
当外加的阴极电流继续增大到I C时,虽然电流变化不大,电位向负方向移动的幅度却很大。
此时阴极上积累了大量的电子,阴极极化加强,金属得到保护(BC段)。
最小保护电流在I B与I C 之间,最小保护电位在φB到φC之间。
当外加阴极电流继续增加时,阴极电位仍然负移,但幅度变小(CD段),因为此时阴极上增加了氢去极化过程,消耗部分电子。
当电位变到φD时,氢去极化加剧,阴极上大量放氢。
对于氧去极化控制的腐蚀体系,附加搅拌将使溶液的流动速度加快,促进氧的扩散,氧的去极化腐蚀加剧,因此在相同的极化电位下,极化电流相应增加。
三、实验仪器及用品1.PS—1恒电位/恒电流仪2.饱和甘汞电极,铂电极,金属试件(碳钢)3.盐桥(饱和氯化钾溶液)4.试剂瓶2个(一个放饱和KCl,一个放3%NaCl)5.铁夹6.1200#金相砂纸无水乙醇棉球四、实验步骤1.将以打磨的试件用1200#金相砂纸打磨,无水乙醇清洗,脱脂,测面积1cm2。
2.按下面接线3.测自腐蚀电位(1)预热15分钟(2)“断”“恒电位”“电流”“参比”此时,电位显示为自腐蚀电位,但符号相反。
加阴极电流“恒电流”“参比”“通”“电流”(给定电流-50μA)2min,重测自腐蚀电位Φa。

极化曲线的测定与分析极化曲线是指在电化学反应中,电极电势随着电流密度的变化而发生的变化规律,是研究电极反应动力学和电化学测量的基础。
极化曲线的测定和分析是电化学实验中的一项重要内容。
测定方法1. 构建电化学池:将工作电极和参比电极用电极线连接起来,并将它们放置在电解液中,形成电化学池。
2. 测量参比电极的电位:使用电位计对参比电极进行电位测量,并将参比电极作为电位的基准来测量工作电极的电势差。
3. 测量工作电极的电势差:在电极上施加一个小的电压,然后通过电位计测量电极上的电势差,以确定电势差和电流密度之间的关系。
在测量中应尽量控制电极的电流密度,因为过大的电流密度会使电极受到极化和电化学反应速率增加,导致实验结果出现误差。
4. 计算电极反应的动力学参数:在测定的极化曲线中,可以根据电极电势的变化来计算电极反应的动力学参数,如电极动力学参数、反应速率常数等。
这些参数对于优化电化学反应条件、设计电化学反应器和研究电化学反应机理都有重要的实际应用。
分析方法1. 极化曲线分析法:将极化曲线按照电势和电流密度的变化趋势进行分析,可判断电极反应的状态,包括电极未极化状态、极化状态和过极化状态。
在极化状态下,电极电势始终低于理论电势,电极表面存在大量的无法逆反应的电荷,电极反应速率与电流密度成非线性关系。
2. 填充曲线分析法:在填充曲线中,电极电位随着电流密度的增加而上升,然后在某一电流密度上达到峰值,再随着电流密度的增加而下降。
通过分析填充曲线,可以确定电极反应的动力学参数,如电极氧化还原反应的标准电位、反应速率常数、传递系数等。
3. 动力学分析法:动力学分析法是通过测量电极电势与时间的变化来研究电极反应的速率和机制。
在实验中,通过改变反应物浓度、电极的表面积和温度等条件,探究电极反应速率的变化规律,确定电极反应的反应级数、反应速率常数和反应机理等。
阴极极化曲线测定实验报告实验目的本实验旨在通过阴极极化曲线测定的方法,研究金属在不同电位下的电化学行为,并探索阴极极化曲线在材料表征中的应用。
实验原理阴极极化曲线是一种描述金属在电解质溶液中的电化学行为的曲线。
通过在恒定电流下改变电位,可以得到一条曲线,称为阴极极化曲线。
该曲线通常包括三个区域:Tafel区、过渡区和析气区。
Tafel区是曲线的起点,对应着金属表面的电化学反应速率受到电势控制的过程。
在该区域,电流随电位的变化呈线性关系。
过渡区是在Tafel区和析气区之间的区域,此时电流密度增加,但电位变化较小。
析气区是曲线的终点,电流密度随电位的变化呈非线性关系,电位继续增加但电流密度不再增加。
阴极极化曲线可以提供有关金属电化学反应动力学和电极过程的信息。
通过分析曲线的斜率和形态,可以了解金属在特定电位下的电极反应速率、电子传递速率和电化学反应机制。
实验步骤1.准备实验材料:金属试样、电解质溶液、参比电极等。
2.清洗金属试样:使用去离子水和乙醇等溶剂,将金属试样表面的杂质彻底清洗干净。
3.准备电解质溶液:根据实验要求配制合适的电解质溶液,确保其浓度和pH值符合要求。
4.搭建实验电化学池:将准备好的电解质溶液倒入电化学池中,将金属试样和参比电极分别插入池中,并连接电位计和电流计等仪器设备。
5.开始实验:通过改变电位,记录不同电位下的电流密度,并根据测量数据绘制阴极极化曲线。
6.数据处理:根据阴极极化曲线的斜率和形态,分析金属试样在不同电位下的电化学行为,如电极反应速率、电子传递速率等。
7.结果分析:根据实验结果,对金属试样的电化学性能进行评估,并与理论预期进行比较和讨论。
实验结果与讨论根据测得的阴极极化曲线,我们可以得到金属试样在不同电位下的电流密度随电位的变化关系。
通过分析曲线的斜率和形态,我们可以得到以下结论: 1. 在Tafel区,金属试样表面的电化学反应速率受到电势控制,电流密度随电位的变化呈线性关系。
应用电化学实验本课程安排4个综合实验,每个实验4个学时,共16个学时,按照10人一组分别进行。
自编实验讲义。
实验仪器有:分析天平;直流稳压稳流电源;电化学工作站;恒温水浴;饱和甘汞电极;鲁金毛细管;H 型电解槽;Pt 电极;电解槽;赫尔槽;电力搅拌器、磁力搅拌器;pH 计。
实验1:极化曲线的测定实验内容:测定Ni 2+离子、Co 2+离子单金属电沉积、以及Ni-Co 合金共电沉积的稳态阴极极化曲线。
一、实验目的1.掌握三电极体系装置和电化学工作站的应用。
2.掌握用线性电位扫描法测量极化曲线的原理和实验方法,学会从极化曲线上分析电极过程特征。
2.测定金属电沉积的阴极极化曲线。
3.学会数据的分析和处理。
二、实验原理研究电极过程的基本方法是测定极化曲线。
电极上电势随电流密度变化的关系曲线称为极化曲线。
极化曲线表示了电极电位与电流密度之间的关系,从极化曲线上可以求得任一电流密度下的过电势(超电势),看出不同电流密度时电势变化的趋势,直观地反映了电极反应速度与电极电势的关系。
在某一电流密度下极化曲线的斜率i ∆∆ϕ称为极化度(极化率),极化度的大小可以衡量极化的程度,判断电极过程的难易。
极化度小,电极过程容易进行;极化度大,电极过程受到较大阻碍而难以进行。
从极化曲线还可求电极过程动力学参数,如交换电流密度i 0、电子传递系数α、标准速度常数、以及扩散系数;还可以测定反应级数、电化学反应活化能等。
被控制的变量电极电位是随时间连续线性变化的。
随时间连续线性变化的电位可用线性方程表示:Vt i +=ϕϕ;其中:ϕ——扫描电位,t ——扫描时间,V ——扫描速度,i ϕ——扫描起点电位。
常以研究电极相对于参比电极的开路电位作为扫描的起点电位。
扫描电位与时间的关系如图1所示。
图1 电位与时间的关系三、实验仪器、测量线路及试剂电极),3—隔膜,4—电化学工作站,5—电脑,6—研究电极,7—盐桥,8—参比电极(饱和甘汞电极)。
实验八 极化曲线的测定一、实验目的1、掌握稳态恒电势法测定金属极化曲线的基本原理和测试方法。
2、了解极化曲线的意义和应用。
3、掌握恒电势仪的使用方法。
二、实验原理1、极化现象与极化曲线当电极处于平衡状态,电极上无电流通过时,这时的电极电势称为平衡电势。
当有电流明显地通过电极时,电极的平衡状态被破坏,电极电势偏离平衡值,而且随着电极上电流密度的增加,电极反应的不可逆程度也随之增大,电极电势将越来越偏离平衡电势。
这种由于有电流存在而造成电极电势偏离平衡电极电势的现象称为电极的极化。
在某一电流密度下,实际发生电解的电极电势与平衡电极电势之间的差值称为超电势。
阳极上由于超电势使电极电势变大,阴极上由于超电势使电极电势变小。
超电势的大小与流经电极的电流密度有关,电极电势(或超电势)与电流密度的关系曲线称为极化曲线,极化曲线的形状和变化规律反映了电化学过程的动力学特征。
除电流密度外,影响超电势的因素还有很多,如电极材料,电极的表面状态,温度,电解质的性质、浓度及溶液中的杂质等。
金属的阳极过程是指金属作为阳极时在一定的外电势下发生的阳极溶解过程,如下式所示:M →M n++n e此过程只有在电极电势正于其热力学电势时才能发生。
阳极的溶解速度(用电流密度表示)随电势变正而逐渐增大,这是正常的阳极溶出,但当阳极电势正到某一数值时,其溶解速度达到最大值,此后阳极溶解速度随电势变正反而大幅度降低,这种现象称为金属的钝化现象。
图3-8-1为钢在硫酸溶液中的阳极极化曲线。
图中曲线表明,从A 点开始,随着电势向正方向移动,电流密度也随之增加,电势超过B点后,电流密度随电势增加迅速减至最小,这是因为在金属表面生产了一层电阻高,耐腐蚀的钝化膜。
B 点对应的电势称为临界钝化电势,对应的电流称为临界钝化电流。
电势到达C点以后,随着电势的继续增加,电流却保持在一个基本不变的很小的数值上,该电流称为维钝电流,直到电势升到D 点,电流才有随着电势的上升而增大,表示阳极又发生了氧化过程,可能是高价金属离子产生也可能是水分子放电析出氧气,DE 段称为过钝化区。
阴极极化曲线的测定实验报告一、实验目的本实验旨在通过测定阴极极化曲线,掌握电化学腐蚀的基本概念和原理,了解阴极保护的方法和应用。
二、实验原理1. 电化学腐蚀电化学腐蚀是指金属在电解质溶液中发生的氧化还原反应,导致金属表面受到侵蚀和破坏的过程。
其主要原因是金属表面与溶液中存在的氧、水等物质发生氧化还原反应,形成氧化物或氢离子等产物,导致金属表面失去原有的结构和功能。
2. 阴极保护阴极保护是指通过在金属表面制造一定电位差,使其成为阴极而得到保护。
常用的阴极保护方法有阳极保护、外加电位法和牺牲阳极法。
3. 阴极极化曲线阴极极化曲线是指在一定条件下,测量阴极电位与对数电流密度之间关系得到的曲线。
该曲线可以反映出金属在特定条件下的耐蚀性和防护效果,是电化学腐蚀研究的重要工具之一。
三、实验步骤1. 准备工作(1)清洗试样:将试样用去离子水清洗干净,然后用酒精擦拭干净。
(2)制备电解质:取适量氯化钠和硫酸铜溶解于去离子水中,调节pH值至7左右。
(3)连接电路:将试样与电极连接好,接入电路中。
2. 测定阴极极化曲线(1)先进行开路电位测定,在无外加电压的情况下记录试样的开路电位。
(2)按照一定速率施加外加电压,记录不同外加电压下的阴极电位和对数电流密度。
(3)根据测得的数据绘制阴极极化曲线。
四、实验结果分析通过实验测定得到的阴极极化曲线可以反映出不同条件下金属表面的耐蚀性和防护效果。
一般来说,当阴极保护效果越好时,阴极极化曲线越平稳。
而当金属表面存在缺陷或者阴极保护效果不佳时,曲线会出现明显的波动和突变。
因此,通过对阴极极化曲线的测定和分析,可以评估金属表面的耐蚀性和防护效果,并选择合适的防腐措施进行保护。
五、实验注意事项1. 实验过程中应注意安全,避免触电和化学品溅出。
2. 试样应保持干燥清洁,避免污染和氧化。
3. 电解质的制备应按照一定比例和方法进行,pH值应控制在适宜范围内。
4. 测量数据时应注意记录准确,并进行有效处理和分析。
极化曲线的测定及应用一、目的要求1.掌握恒电位法测定电极极化曲线的原理和实验技术。
通过测定金属铁在H2SO4 溶液中的阴极极化和阳极极化曲线求算铁的自腐蚀电位、自腐蚀电流和钝化电位范围、钝化电流等参数。
2.了解不同pH值、Cl-浓度、缓蚀剂等因素对铁电极极化的影响。
3.讨论极化曲线在金属腐蚀与防护中的应用。
二、原理Fe在H2SO 4 溶液中会不断溶解,同时产生H2。
Fe溶解:Fe -2e =Fe 2+。
H2析出:2H+ +2e =H2。
Fe电极和H2电极及溶液构成了腐蚀原电池。
其腐蚀反应为:Fe +2H+ = Fe 2+ + H2。
这是Fe在酸性溶液中腐蚀的原因。
当电极不与外电路接通时,阳极反应速率和阴极反应速率相等,Fe溶解的阳极电流I Fe与H2析出的阴极电流I H在数值上相等但方向相反,此时其净电流为零。
I=I Fe + I H=0。
I corr=I Fe=-I H≠0。
I corr值的大小反映净了Fe在H2SO 4 溶液中的腐蚀速率,所以称I corr为Fe在H2SO 4 溶液中的自腐蚀电流。
其对应的电位称为Fe在H2SO 4 溶液中的自腐蚀电位E corr,此电位不是平衡电位。
虽然,阳极反应放出的电子全部被阴极还原所消耗,在电极与溶液界面上无净电荷存在,电荷是平衡的。
但电极反应不断向一个方向进行,I corr≠0,电极处于极化状态,腐蚀产物不断生成,物质是不平衡的,这种状态称为稳态极化。
它是热力学的不稳定状态。
自腐蚀电流I corr和自腐蚀电位E corr可以通过测定极化曲线获得。
极化曲线是指电极上流过的电流与电位之间的关系曲线,即I=f(E)。
图27-1是用电化学工作站测定的Fe在1.0mol/L H2SO4 溶液中的阴极极化和阳极极化曲线图。
ar为阴极极化曲线,当对电极进行阴极极化时,阳极反应被抑制,阴极反应加速, 电化学过程以H2析出为主。
ab为阳极极化曲线,当对电极进行阳极极化时,阴极反应被抑制,阳极反应加速,电化学过程以Fe溶解为主。
测定阴极极化的方法引言阴极极化是指在电化学反应中,阴极表面电子的传递速率小于阳极表面电子的传递速率,从而导致阴极表面电位升高的现象。
阴极极化的产生会影响金属材料的电化学腐蚀行为以及电池的性能,因此准确测定阴极极化是非常重要的。
本文将介绍几种常用的测定阴极极化的方法。
1. 极化曲线法极化曲线法是最常用的测定阴极极化的方法之一。
该方法通过测量电流和电压之间的关系来确定阴极极化的程度。
实验时,先在电化学系统中加入阴极和阳极,然后在一定电流密度范围内,测量电流与电压之间的关系,得到极化曲线。
根据极化曲线的形状,可以判断阴极极化的程度。
2. 电化学阻抗谱法电化学阻抗谱法是一种通过测量电化学系统的阻抗和频率之间的关系来测定阴极极化的方法。
在实验中,将一定频率的交流信号施加到电化学系统中,测量系统的阻抗,然后根据阻抗谱图来分析阴极极化的程度。
电化学阻抗谱法具有测量范围广、实验操作简便等优点。
3. 动电位扫描法动电位扫描法是一种通过扫描电位来测定阴极极化的方法。
实验时,通过改变电位的扫描速率和范围,测量电流和电位之间的关系,得到动电位扫描曲线。
根据曲线的形状,可以判断阴极极化的程度。
动电位扫描法适用于测定快速极化过程和反应速率较快的系统。
4. 阴极保护法阴极保护法是一种通过施加外部电位来抑制阴极极化的方法。
阴极保护法可以通过多种方式实现,如外加电源、阳极保护和阴极保护涂层等。
通过施加适当的外部电位,可以改变阴极表面的电位,从而减少或消除阴极极化的发生。
结论测定阴极极化的方法有很多种,每种方法都有其适用的场景和优点。
极化曲线法是最常用的方法之一,适用于静态和动态极化过程的测定;电化学阻抗谱法可以测定不同频率下的极化行为;动电位扫描法适用于快速极化过程的测定;阴极保护法可以通过施加外部电位来抑制阴极极化的发生。
通过选择合适的测定方法,可以准确测定阴极极化的程度,从而更好地了解电化学反应和电池性能。