第四章、多组分系统热力学
- 格式:doc
- 大小:77.00 KB
- 文档页数:6


第四章 多组分系统热力学及其在溶液中的应用§4.1 引 言1.基本概念1)多组分系统:由两种或两种以上物质所组成的系统。
(多组分系统可以是单相的也可以是多相的。
)2)混合物:由两种或两种相互均匀混合而构成的系统。
(可以是气相、液相或固相) 3)溶 液(1)定义:由两种或两种以上物质在分子级别呈均匀混合而成的系统。
(2)溶液组分命名:溶质,溶剂。
(3)分类:(1)固态溶液、液态溶液。
(2)电解质溶液、非电解质溶液。
(4)应注意问题:形成溶液后,一般溶质、溶剂受力 情况与纯组分受力情况不同,所以对它们研究方法是不同的。
2.溶液中物质受力情况溶剂-溶剂 f 11 ,溶质-溶质 f 22 ,溶剂-溶质 f 12。
1) 纯态: 溶质 f 22 溶剂 f 11 2) 稀溶液: 溶质 f 22 溶剂 f 11 3) 中等浓度: 溶质 f 22,f 12 溶剂 f 12, f 11 4) 高浓度: 溶质 f 22 溶剂 f 12 3.受力变化同热效应关系1) 放热2) 吸热3) 不吸热不放热§4.2 多组分系统的组成表示法1.组成表示法1)B 的质量浓度:单位体积混合物中所含B 的质量。
1211,22f f f >121122,f f f <121122f f f ==()B B m Vρ=单位 与T 有关2)B 的质量分数:单位质量混合物中所含B 的质量。
单位为1,与T 无关3)B 的浓度:单位体积混合物中所含B 的物质的量。
单位 或 同T 有关。
4)B 的摩尔分数( 或):组分B 的物质的量与混合物中总物质的量的比值。
单位为1,与T 无关液体用 ,气体用5)溶质B 的质量摩尔浓度:每千克溶剂中所含溶质的物质的量。
单位 与T 无关。
6)溶质B 的摩尔比:单位物质的量的溶剂中所含溶质的物质的量。
单位为1,与T 无关。
2.常用的浓度表示法之间的关系 1) 与 的关系:若取1000 g 溶剂对稀溶液 2) 与 关系:-3kg m ⋅B B W w W =B Bn c V =-3mol m ⋅-3mol dm ⋅B x B y B B n x n=B x By ()BB A n m m =⋅-1mol kg BB A n r n =B x B m B BB A B n n x n n n ==+∑AB B A B BB A10001000m x m m M M m M ==++∑∑A B 1000M m <<∑B AB 1000m M x =B x BC A B B BW W c M ρρ=-=-∑∑AB B B B A AB B B B B BB A A c c c M x W c M c M c M c c M M ρρ===--+++∑∑∑∑∑()B AB A B Bc M x c M M ρ=+-∑若溶液很稀则3) 同 的关系: 取 取若溶液很稀则 若 取 对水§4.3 偏摩尔量1.偏摩尔量的定义 1. 问题的引出对简单均相系统 ,要描述其状态,只需要两个状态性质(T 、p )就可以了。





第四章 多组分系统热力学§4.1 偏摩尔量 partial molar quantity 热力学状态函数:U 、H 、S 、A 、G 、 V 广度量X=X (T ,p ,n 1,n 2,…)偏摩尔量:,,,C B B mB T p n X X n ≠⎛⎫∂= ⎪∂⎝⎭1212,12,,,,,1,12,2,,0,01,12,2,.........i i i i i ip n T n T p n T p n m m p n T n dT dp m m B m BBX X X X dX dT dp dn dn T p n n X X dT dp X dn X dn T p X dn X dn X dn ≠≠==⎛⎫⎛⎫⎛⎫∂∂∂∂⎛⎫=++++ ⎪ ⎪ ⎪ ⎪∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭⎛⎫∂∂⎛⎫=++++ ⎪ ⎪∂∂⎝⎭⎝⎭=++=∑ 恒温恒压恒组成条件下,X B ,m为定值,积分上式,得11,22,,...m m B B m BX n X n X n X =++=∑此即偏摩尔量的集合公式组成变化时,X B ,m 随之变化,恒温恒压下对集合公式求微分,得,,B B m B m B BBdX n dX X dn =+∑∑比较,可得,0B B mBn dX=∑ 或,0BB m Bx dX =∑此即吉布斯-杜亥姆方程 Gibbs-Duhem ’s equation§4.2 化学势 chemical potential,,,C BB B mB T p n G G n μ≠⎛⎫∂== ⎪∂⎝⎭∵ G=G(T ,p ,n 1,n 2,…)1212,12,,,,,...i i i i p n T n T p n T p n B BBG G G G dG dT dp dn dn T p n n SdT Vdp dn μ≠≠⎛⎫⎛⎫⎛⎫∂∂∂∂⎛⎫=++++ ⎪ ⎪ ⎪ ⎪∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭=-++∑∵ U=G -pV +TS ,H=G +TS ,A=G -pV∴B BBB BBB BBdU TdS pdV dn dH TdS Vdp dn dA SdT pdV dn μμμ=-+=++=--+∑∑∑此即普遍形式的热力学基本方程。



第四章 多组分系统热力学 主要内容1.混合物和溶液(1)多组分系统的分类含一个以上组分的系统称为多组分系统。
多组分系统可以是均相(单相)的,也可以是非均相(多相)的。
将多组分均相系统区分为混合物和溶液,并以不同的方法加以研究:(Ⅰ)混合物:各组分均选用同样的标准态和方法处理;(Ⅱ)溶液:组分要区分为溶剂及溶质,对溶剂及溶质则选用不同的标准态和方法加以研究。
(2)混合物及溶液的分类混合物有气态混合物液态混合物和固态混合物;溶液亦有气态溶液液态溶液和固态溶液。
按溶液中溶质的导电性能来区分,溶液又分为电解质溶液和非电解质溶液(分子溶液)。
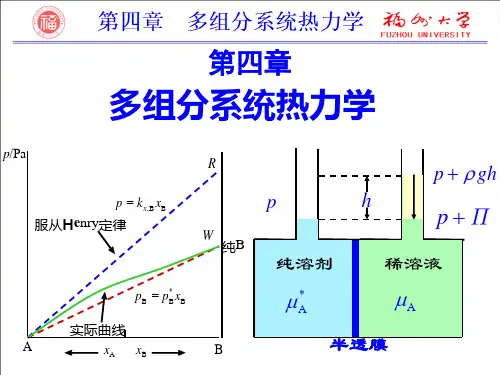
2.拉乌尔定律与亨利定律拉乌尔定律与亨利定律是稀溶液中两个重要的经验规律。
(1)拉乌尔定律平衡时,稀溶液中溶剂A 在气相中的蒸气分压A p 等于纯溶剂在同一温度下的饱和蒸气压与该溶液中溶剂的摩尔分数A x 的乘积。
这就是拉乌尔定律。
用数学式表达拉乌尔定律为 A *A Ax p p = (2)亨利定律一定温度下,微溶气体B 在溶剂A 中的溶解度B x 与该气体在气相中的分压B p 成正比。
也可表述为:一定温度下,稀溶液中挥发性溶质B 在平衡气相中的分压力B p 与该溶质B 在平衡液相中的摩尔分数B x 成正比。
这就是亨利定律。
用数学式表达亨利定律为: B B ,B x k p x =B ,x k 、B ,b k 为以不同组成标度表示的亨利系数,其单位分别为Pa ,Pa·kg·mol -1。
应用亨利定律时,要注意其不同表达式所对应的亨利系数及其单位。
还要注意亨利定律适用于稀溶液中的溶质分子同气相同种分子相平衡,即亨利定律适用于稀溶液中的溶质在液相及气相中具有相同分子形态的场合。
3.偏摩尔量(1)偏摩尔量的定义设X 代表V ,U ,H,S ,A ,G 这些广度性质,则对多组份系统(混合物或溶液)即 X =f (T ,p ,n A ,n B ,…)定义 ()B C C,,,B B def ≠⎪⎪⎭⎫ ⎝⎛∂∂n p T n X X式中,X B称为广度性质X (X=V ,U ,H ,S ,A ,G 等)的偏摩尔量,它们分别为只有系统的广延量才具有偏摩尔量,偏摩尔量是强度量。
第四章,多组分系统热力学一、选择题1. 在 298K 时,A 和 B 两种气体单独在某一溶剂中溶解,遵守亨利定律,亨利常数分别为 kA 和 KB,且知 KA>KB,则当 A 和 B 压力(平衡时的)相同时,在一定量的该溶剂中所溶解的关系为 ( ) B (A) A 的量大于 B 的量 (B) A 的量小于 B 的量(C) A 的量等于 B 的量 (D) A 的量与 B 的量无法比较2. 在 400K 时,液体 A 的蒸气压为 4×104Pa,液体 B 的蒸气压为 6×104Pa,两者组成理想液体混合物,平衡时,溶液中 A 的物质的量分数为 0.6,则气相中 B 的物质的量分数为: ( ) B(A) 0.60 (B) 0.50 (C) 0.40 (D) 0.313. 已知挥发性纯溶质 A 液体的蒸气压为 67 Pa,纯溶剂 B 的蒸气压为 26665Pa,该溶质在此溶剂的饱和溶液的物质的量分数为 0.02,则此饱和溶液(假设为理想液体混合物)的蒸气压为:( ) C(A) 600 Pa (B) 26198 Pa (C) 26133 Pa (D) 599 Pa4. 已知 373.2K 时,液体 A 的饱和蒸气压为 133.32 kPa,另一液体 B 可与 A构成理想液体混合物。
当 A 在溶液中的物质的量分数为 0.5 时,A 在气相中的物质量分数为 2/3 时,则在 373.2K时,液体 B 的饱和蒸气压应为: ( ) A(A) 66.66 kPa (B) 88.88 kPa (C) 133.32 kPa (D) 266.64 kPa5. 已知 373K 时液体 A 的饱和蒸气压为 133.24kPa,液体 B 的饱和蒸气压为66.62kPa。
设 A 和 B形成理想溶液,当 A 在溶液中的摩尔分数为 0.5 时,在气相中 A 的摩尔分数为: ( ) D(A) 1 (B) 1/2 (C) 1/3 (D) 2/36. 关于亨利系数,下列说法中正确的是: ( ) D(A) 其值与温度、浓度和压力有关(B) 其值与温度、溶剂性质和浓度有关(C) 其值与温度、溶质性质和浓度有关(D) 其值与温度、溶质和溶剂性质及浓度的标度有关7. 已知 373K 时,液体 A 的饱和蒸气压为 5×104 Pa,液体 B 的饱和蒸气压为 105Pa,A 和 B构成理想液体混合物,当 A 在溶液中的物质的量分数为 0.5时,气相中 B 的物质的量分数为:( ) A(A) 1/1.5 (B) 1/2 (C) 1/2.5 (D) 1/38.2molA物质和3molB物质在等温、等压下,混合形成理想液态混合物,该系统中A和B的偏摩尔体积分别为1.79×10-5m3×mol-1,2.15×10-5m3×mol-1,则混合物的总体积为:() C(A)9.67×10-5m3 (B)9.85×10-5m3(C)1.003×10-4m3 (D)8.95×10-5m39.298K,标准压力下,苯和甲苯形成理想液态混合物。
第一份混合物体积为2dm3,苯的摩尔分数为0.25,苯的化学势为μ1,第二份混合物的体积为1 dm3,苯的摩尔分数为0.5,化学势为μ2,则:()B(A)μ1>μ2(B)μ1<μ2(C) μ1=μ2(D) 不确定10.已知在 373K 时,液体 A 的饱和蒸气压为66662Pa,液体B的饱和蒸气压为1.01325×105 Pa,设A和B构成理想液体混合物,则当A在溶液中的物质的量分数为 0.5 时,气相中A的物质的量分数应为: ( ) C(A) 0.200 (B) 0.300 (C) 0.397 (D) 0.60311. 在 298K 时,向甲苯的物质的量分数为 0.6 的大量的苯-甲苯理想溶液中,加入 1 mol纯苯,这一过程苯的△G、△H、△S 为: ( ) C△G/J △H/J △S/J·K-1(A) 0 0 0(B) -1266 0 4.274(C) -2270 0 7.618(D) -542.6 0 1.82112. 273.15K,101.3kPa 下,1dm 水中能溶解 49mol 氧或 23.5mol 氮。
在标准情况下,1dm 水中能溶解多少空气? ( ) B(A)25.5mol (B)28.6mol (C)96mol (D)72.5mol13.下述说法哪一个正确? 某物质在临界点的性质: ( ) D(A) 与外界温度有关 (B) 与外界压力有关(C) 与外界物质有关 (D) 是该物质本身特性14. 设N2和O2皆为理想气体,它们的温度、压力相同,均为 298K、p⊙ ,则这两种气体的化学势应该: ( ) D(A) 相等 (B) 不一定相等(C) 与物质的量有关 (D) 不可比较15. 在恒温抽空的玻璃罩中,封入两杯液面相同的糖水(A杯)和纯水(B杯)。
经历若干时间后,两杯液面的高度将是:()AA. A杯高于B杯B. A杯等于B杯C. A杯低于B杯D. 视温度而定二、判断题1.若溶液中溶剂在某浓度区间遵从拉乌尔定律,则在该浓度区间组分 B 必遵从亨定律(×)2.温度越高、压力越低,亨利定律越正确(×)3.因为亨利定律是稀溶液定律,所以任何溶质在稀溶液范围内都遵守亨利定律(√)4.温度一定时,在一定体积的溶液中溶解的气体体积与该气体的分压力无关(×)5. 溶液的化学势等于溶液中各组分的化学势之和 (×)6. 对于纯组分、则化学势等于其摩尔吉布斯函数 (√)7. 理想溶液各组分在其全部浓度范围内服从 Henry 定律 (√)8. 理想溶液各组分在其全部浓度范围内服从 Raoult定律 (×)9. 假设 A、B 两组分混合可以形成理想液体混合物,A、B 分子之间的作用力很微弱 (×)10. 对于非电解质溶液, 在有限浓度范围内,真实溶液的某些热力学性质与理想溶液相近似 (√)三、填空题1.选择“>”、“<”、“=”苯和甲苯在恒温恒压条件下,混合形成理想液体混合物,其△mix H 0 ,△mix S 0。
(= ) (>)2.已知在373K 时,液体A 的饱和蒸气压为66662Pa,液体B的饱和蒸气压为1.01325 10 Pa,设A和B构成理想液体混合物,则当A在溶液中的物质的量分数为0.5时,气相中A的物质的量分数应为。
(0.397)3.在400K,液体A的蒸气压为4×104N·m-2 ,液体B的蒸气压为6×104N·m-2,两者组成理想液体混合物。
当气─液平衡时,在溶液中 A 的摩尔分数为0.6,则在气相中B 的摩尔分数应为:(0.50)4.在50℃时液体A的饱和蒸气压是液体B饱和蒸气压的3倍,A、B 两液体形成理想溶液.气液平衡时,在液相中A的物质的量分数为0.5,则在气相中B的物质的量分数为。
(0.25)5. 2molA物质和3molB物质在等温等压下混合形成理想液体混合物,该系统中A 和B的偏摩尔体积分别为 1.79×10-5m3·mol-1 ,2.15×10-5m3·mol-1 ,则混合物的总体积为。
(1.003×10-4 m3)6. 冰的熔点随压力(降低)而升高;正交硫的熔点随压力的而降低。
(降低)7. 1000 g 水中加入0.01mol的食盐,其沸点升高0.01K,则373K左右时,水的蒸气压随温度的变化率dp/dT为。
(3647.7 P a·K-1)8.已知水在正常冰点时的摩尔熔化热△fus H⊙=6025J·mol-1,某水溶液的凝固点为258.15K,该溶液的浓度x B为。
(0.1429)9.含有非挥发性溶质B的水溶液,在101325Pa下,270.15K开始析出冰,已知水的K f=1.86K·k g·mol-1 ,K b =0.52K·k g·mol-1,该溶液的正常沸点是。
(373.99K)10.已知H2O(l)在正常沸点时的气化热为40.67k J·mol-1 ,某非挥发性物质B溶于H2 O(l)后,其沸点升高10K,该物质B在溶液中的摩尔分数为。
(0.290)四、计算题1. 有溶剂A与溶质B形成一定组成的溶液。
此溶液中B的浓度为cB,质量摩尔浓度为bB,此溶液的密度为。
以MA,MB分别代表溶剂和溶质的摩尔质量,若溶液的组成用B的摩尔分数xB表示时,试导出xB与cB,xB与bB之间的关系。
解:根据各组成表示的定义2. D-果糖溶于水(A)中形成的某溶液,质量分数,此溶液在20℃时的密度。
求:此溶液中D-果糖的(1)摩尔分数;(2)浓度;(3)质量摩尔浓度。
解:质量分数的定义为3. 在25℃,1 kg水(A)中溶有醋酸(B),当醋酸的质量摩尔浓度bB介于和之间时,溶液的总体积求:(1)把水(A)和醋酸(B)的偏摩尔体积分别表示成bB的函数关系。
(2)时水和醋酸的偏摩尔体积。
解:根据定义当时。