2019届中考化学复习第2编重点专题突破篇专题突破3分离与除杂(精练)练习
- 格式:pdf
- 大小:64.71 KB
- 文档页数:3

一、中考初中化学除杂分离和提纯1.某混合溶液含有一定量的硝酸银、硝酸铜和硝酸钡,为逐一分离其中的金属元素,所加试剂均过量,且理论上氢氧化钠的消耗量最少。
所加试剂1-3顺序正确的是A.氢氧化钠、氯化钠、硫酸钠B.氯化钠、氢氧化钠、硫酸钠C.氯化钠、稀硫酸、氢氧化钠D.硫酸钠、氯化钠、氢氧化钠【答案】B【解析】【分析】【详解】A、先加入氢氧化钠,氢氧化钠会和硝酸铜反应生成蓝色沉淀和硝酸钠,但同时也会和硝酸银反应生成氢氧化银后迅速分解成氧化银,无法将金属元素逐一分离,故A错误;B、先加入氯化钠,氯化钠只和硝酸银反应生成白色沉淀和硝酸钠,不与其他物质反应,将沉淀过滤出来即可分离出银元素,再加入氢氧化钠,氢氧化钠只和硝酸铜反应生成氢氧化铜的沉淀和硝酸钠,将沉淀过滤出来即可分离出铜元素,再加入硫酸钠,硫酸钠和硝酸钡反应生成硫酸钡沉淀和硝酸钠,将沉淀过滤出来即可分离出钡元素,所加试剂顺序正确,故B正确;C、第二个所加试剂为稀硫酸的话,又因试剂均过量,那么在第三种加入氢氧化钠试剂时氢氧化钠要和过量的稀硫酸反应,氢氧化钠的消耗量就比B选项中的多了,故C错误。
D、硫酸银是微溶物,溶液中多了也会沉淀下来,所以第一步试剂加入硫酸钠的话,无法将硫酸钡和硫酸银给逐一分离,故D错误。
故选B。
2.下列方法不能达到除杂目的的是选项物质(括号内为杂质)方法A CO(CO2)通过灼热的氧化铜B MnO2(KCl)溶解、过滤、洗涤、干燥C CaO 固体(CaCO3)高温煅烧A.A B.B C.C D.D【答案】A【解析】【分析】【详解】A、CO能与灼热的氧化铜反应生成铜和二氧化碳,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
B、氯化钾易溶于水,MnO2难溶于水,可采取加水溶解、过滤、洗涤、干燥的方法进行分离除杂,故选项所采取的方法正确。
C、CaCO3在高温下煅烧生成氧化钙和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
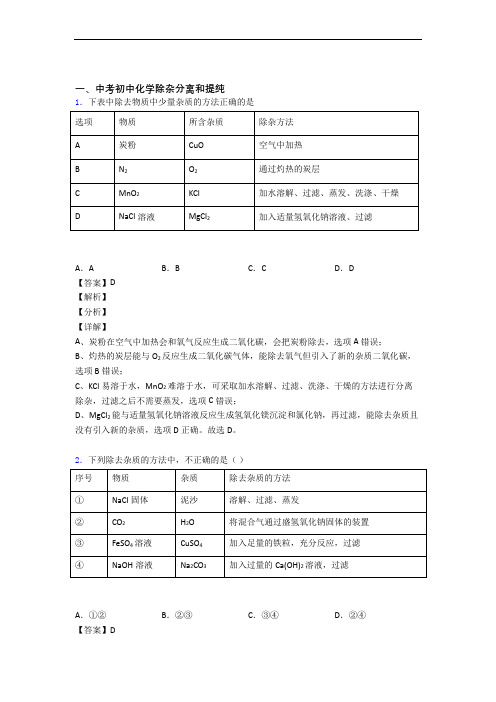
一、中考初中化学除杂分离和提纯1.下表中除去物质中少量杂质的方法正确的是A.A B.B C.C D.D【答案】D【解析】【分析】【详解】A、炭粉在空气中加热会和氧气反应生成二氧化碳,会把炭粉除去,选项A错误;B、灼热的炭层能与O2反应生成二氧化碳气体,能除去氧气但引入了新的杂质二氧化碳,选项B错误;C、KCl易溶于水,MnO2难溶于水,可采取加水溶解、过滤、洗涤、干燥的方法进行分离除杂,过滤之后不需要蒸发,选项C错误;D、MgCl2能与适量氢氧化钠溶液反应生成氢氧化镁沉淀和氯化钠,再过滤,能除去杂质且没有引入新的杂质,选项D正确。
故选D。
2.下列除去杂质的方法中,不正确的是()A.①②B.②③C.③④D.②④【答案】D【解析】【分析】【详解】①氯化钠易溶于水,泥沙难溶于水,可采取加水溶解、过滤、蒸发的方法进行分离除杂,故选项所采取的方法正确;②二氧化碳能与氢氧化钠固体反应生成碳酸钠和水,氢氧化钠固体具有吸水性,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误;③铁粉能与CuSO4反应生成硫酸亚铁和铜,再过滤除去不溶物,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确;④Na2CO3能与过量的Ca(OH)2溶液反应生成碳酸钙沉淀和氢氧化钠,能除去杂质但引入了新的杂质氢氧化钙,不符合除杂原则,故选项所采取的方法错误,故②④方法不正确,故选D。
【点睛】本题为除杂题,是中考的重点,也是难点,解决除杂问题时,抓住除杂的必需条件(加入的试剂只与杂质反应,反应后不能引入新杂质)是正确解题的关键。
3.下表中,除去物质所含少量杂质的方法和反应类型归类均正确的是A.A B.B C.C D.D【答案】A【解析】【分析】【详解】A、铜和氧气加热生成氧化铜,反应为化合反应,氧化铜和氧气加热不反应,可以除去铜粉,故A正确;B、一氧化碳和氧化铜反应生成铜和二氧化碳,反应不属于置换反应,故B不正确;C、盐酸和氢氧化钠反应生成氯化钠和水,反应类型为复分解反应,故C不正确;D、硫酸钾和硝酸钡反应生成硫酸钡和硝酸钾,引进新杂质硝酸钾,故D不正确。

一、中考初中化学除杂分离和提纯1.下表中除去物质中少量杂质的方法正确的是A.A B.B C.C D.D【答案】D【解析】【分析】【详解】A、炭粉在空气中加热会和氧气反应生成二氧化碳,会把炭粉除去,选项A错误;B、灼热的炭层能与O2反应生成二氧化碳气体,能除去氧气但引入了新的杂质二氧化碳,选项B错误;C、KCl易溶于水,MnO2难溶于水,可采取加水溶解、过滤、洗涤、干燥的方法进行分离除杂,过滤之后不需要蒸发,选项C错误;D、MgCl2能与适量氢氧化钠溶液反应生成氢氧化镁沉淀和氯化钠,再过滤,能除去杂质且没有引入新的杂质,选项D正确。
故选D。
2.下列除去杂质(在括号内)选用的试剂(在箭头右侧)不正确的是A.CO2(CO)→CuOB.CaCl2溶液(HCl)→碳酸钙C.NaCl(泥沙)→水D.NaOH溶液(Na2CO3)→稀盐酸【答案】D【解析】【分析】【详解】A、CO能与灼热的氧化铜反应生成铜和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则,选项A正确;B、HCl能与碳酸钙反应生成氯化钙、水和二氧化碳,碳酸钙不溶于水,过量的碳酸钙可以采用过滤的方法除去,能除去杂质且没有引入新的杂质,符合除杂原则,选项B正确;C、氯化钠易溶于水,泥沙难溶于水,可采取加水溶解、过滤、蒸发的方法进行分离除杂,选项C正确;D、NaOH溶液和Na2CO3均能与稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,选项D不正确。
故选D。
3.除去下列物质中混有的杂质所用试剂和操作方法均正确的是( )A.A B.B C.C D.D【答案】B【解析】【分析】除杂(提纯),是指除去杂质,同时被提纯物质不得改变。
【详解】A、氢氧化钠和硫酸铜反应生成氢氧化铜和硫酸钠,引入了硫酸钠杂质,故A不正确;B、铁粉与足量稀硫酸反应生成硫酸亚铁溶液和氢气,铜不能与稀硫酸反应,再过滤、洗涤、干燥,能除去杂质且没有引入新的杂质,符合除杂原则,故B正确;C、石灰水吸收二氧化碳的能力较弱,将气体依次通过盛有石灰水、浓硫酸的洗气瓶不能除去杂质,故C不正确;D、二氧化碳不能与氯化钙溶液反应,故D不正确。
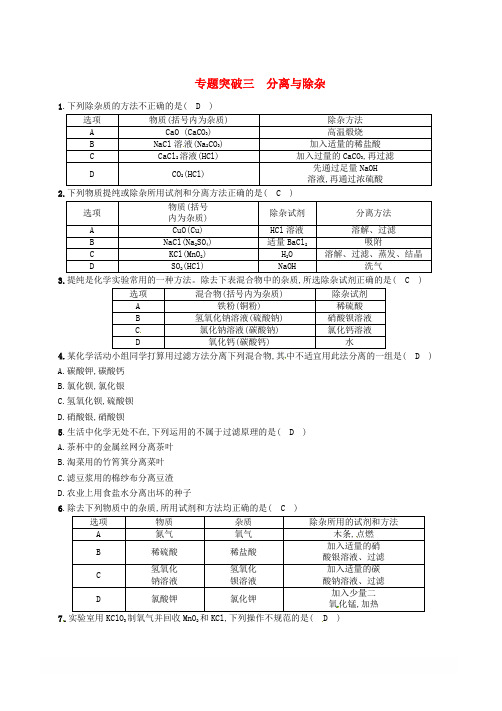
专题突破三分离与除杂1.下列除杂质的方法不正确的是( D )液D CO2(HCl)溶液,再通过浓硫酸2.下列物质提纯或除杂所用试剂和分离方法正确的是( C )3.提纯是化学实验常用的一种方法。
除去下表混合物中的杂质,所选除杂试剂正确的是( C )选项混合物(括号内为杂质) 除杂试剂A 铁粉(铜粉) 稀硫酸B 氢氧化钠溶液(硫酸钠) 硝酸钡溶液C氯化钠溶液(碳酸钠) 氯化钙溶液D 氧化钙(碳酸钙) 水4.某化学活动小组同学打算用过滤方法分离下列混合物,其中不适宜用此法分离的一组是( D )A.碳酸钾,碳酸钙B.氯化钡,氯化银C.氢氧化钡,硫酸钡D.硝酸银,硝酸钡5.生活中化学无处不在,下列运用的不属于过滤原理的是( D )A.茶杯中的金属丝网分离茶叶B.淘菜用的竹筲箕分离菜叶C.滤豆浆用的棉纱布分离豆渣D.农业上用食盐水分离出坏的种子6.除去下列物质中的杂质,所用试剂和方法均正确的是( C )点燃化锰7.实验室用KClO3制氧气并回收MnO2和KCl,下列操作不规范的是( D )A.用装置甲收集氧气B.用装置乙溶解完全反应后的固体C.用装置丙分离M nO2和KCl溶液D.用装置丁蒸干分离后的溶液得KCl晶体8.在“粗盐中难溶性杂质的去除”实验中,玻璃棒的用途不正确的是( A )A.称取粗盐后,把粗盐研磨细B.溶解时搅拌,加速粗盐溶解C.称量精盐前,把精盐固体转移到纸上D.蒸发时搅拌,防止局部温度过高,造成液滴飞溅9.除去下列物质中含有的少量杂质,所用试剂或方法正确的是( B )序号混合物(括号内为杂质) 除杂试剂或方法A Fe 粉(Cu) CuSO4溶液B NaCl (沙子) 加水溶解,过滤、蒸发结晶C Na2SO4溶液( Na2CO3) 过量稀盐酸D CO2(CO) 点燃10.除去下列物质中混有的少量杂质(括号内为杂质),拟定的实验方案不可行的是( B )A.FeCl2溶液(CuCl2) ——加入过量的铁粉,过滤B.KCl固体(KClO3)——加入少量的二氧化锰,并加热C.C O气体(CO2)——通过足量的氢氧化钠溶液,并干燥D.NaCl溶液(MgCl2) ——加入过量的氢氧化钠溶液,过滤,滤液中加稀盐酸至中性11.下表中各物质都含有少量杂质,分别写出除去杂质应选用的试剂及有关反应的化学方程。
一、中考初中化学除杂分离和提纯1.下表中,除去物质所含少量杂质的方法和反应类型归类均正确的是A.A B.B C.C D.D【答案】A【解析】【分析】【详解】A、铜和氧气加热生成氧化铜,反应为化合反应,氧化铜和氧气加热不反应,可以除去铜粉,故A正确;B、一氧化碳和氧化铜反应生成铜和二氧化碳,反应不属于置换反应,故B不正确;C、盐酸和氢氧化钠反应生成氯化钠和水,反应类型为复分解反应,故C不正确;D、硫酸钾和硝酸钡反应生成硫酸钡和硝酸钾,引进新杂质硝酸钾,故D不正确。
故选A。
2.下列对某一主题的知识归纳,完全正确的一组是()A.A B.B C.C D.D【答案】A【解析】【分析】【详解】A、硬水和软水的区别在于所含的钙镁离子的多少,可用肥皂水来区分硬水和软水,加入肥皂水,若产生泡沫较多,则是软水,若产生泡沫较少,则是硬水,可以鉴别;铝制品与铜制品分别为银白色、紫红色(或黄色等),用观察物品颜色的方法可以鉴别,故选项正确;B、纯碱是碳酸钠,烧碱是氢氧化钠,均能与稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则;铁粉能被磁铁吸引,炭粉不能,能除去杂质且没有引入新的杂质,符合除杂原则,故选项错误;C、油的密度比水小,加少量水后,油会漂浮于水面上,与氧气的接触面积更大,更容易燃烧,炒菜时油锅不慎着火,不能用水浇灭,可用锅盖隔绝空气;实验室取用化学药品,根据三不原则,不能用手接触药品,故选项错误;D、干冰是固态二氧化碳,是由二氧化碳分子构成的;食盐是含有金属元素和非金属元素的化合物,食盐是由钠离子和氯离子构成的,故选项错误。
故选A。
【点睛】硬水和软水的区别在于所含的钙镁离子的多少,可用肥皂水来区分硬水和软水,加入肥皂水,若产生泡沫较多,则是软水,若产生泡沫较少,则是硬水,可以鉴别;3.下列除去物质中少量杂质的方法正确的是( )A.A B.B C.C D.D【答案】A【解析】【分析】【详解】A、铁粉能被磁铁吸引,木炭粉不能,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。

专题3 常见物质的分离、除杂、提纯一、知识梳理:物质的分离、除杂和提纯是化学实验中的一个重要环节。
所谓分离就是用物理或化学的方法将混合物中的各组分一一分开。
分离完成后各组分要保持(经过化学反应使混合物的组分经过转化而分离还要恢复为)原有的物质组成和状态。
除杂和提纯是将混合物中的某组分用物理或化学的方法除去而得到纯物质。
在提纯物质的过程中除了选择合适的试剂外,还应选择适宜的杂质(或产物),以便于同被提纯物进行分离。
现将有关要点归纳如下:1、应注意几个“不”⑴不能“玉石俱焚”。
即试剂一般与杂质反应,不与要保留的物质反应。
但特殊情况下,所加试剂需要和保留物质反应,但最终要转化成需要保留的物质。
如除去FeCl3溶液中的NaCl,可加过量的NaOH溶液→过滤→洗涤→加适量稀盐酸。
⑵“不增”、“不减”。
即不增加新的杂质,不减少要保留的物质。
⑶不污染环境。
即要求所选用的除杂方法,不能产生可污染环境的物质。
⑷不能“旧貌变新颜”。
即除杂结束前,要恢复保留物质的原有状态。
2、除杂方法的几个优化原则⑴若同时有多种方法能除去杂质,要选择那些简单易行、除杂彻底的方法。
⑵应尽量选择既可除去杂质,又可增加保留物质的方法,即“一举两得”。
⑶先考虑物理方法,再用化学方法。
拓展延伸一、气体的净化与干燥1、气体净化的几种方法⑴吸收法:用吸收剂将杂质气体吸收除去。
如,除去CO中混有的少量CO2,可先用浓NaOH溶液吸收CO2,再用浓硫酸等干燥剂除去水蒸气。
常见气体吸收剂见下表:⑵转化法:通过化学反应,将杂质气体转化为所要得到的气体。
如,除去CO 2中的少量CO ,可将混合气体通过足量的灼热CuO ,CO + CuO △ Cu + CO 2。
2、气体的干燥气体的干燥是通过干燥剂来实现的,选择干燥要根据气体的性质,一般原则是:酸性干燥剂不能用来干燥碱性气体,碱性干燥剂不能用来干燥酸性气体,干燥装置由干燥剂状态决定。
⑴常见的干燥剂⑵常用干燥装置如下:注意:选择吸收装置时,要注意进、出气体导管的连接方法,若用“洗气瓶”,要注意“长进短出”,若用干燥管要注意“大进小出”。
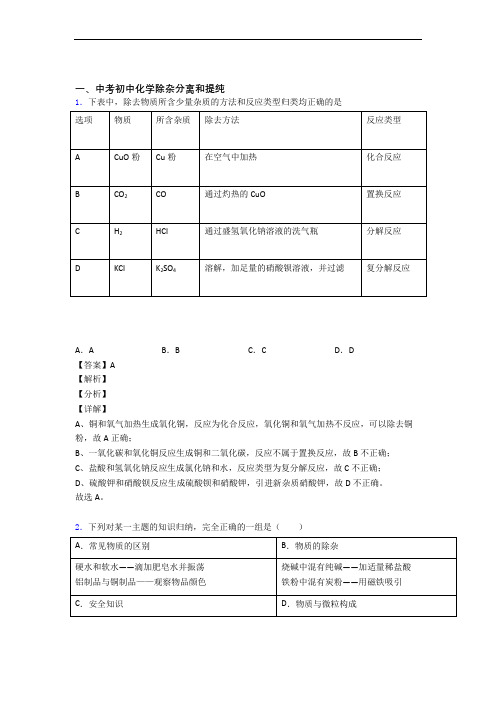
一、中考初中化学除杂分离和提纯1.下表中,除去物质所含少量杂质的方法和反应类型归类均正确的是A.A B.B C.C D.D【答案】A【解析】【分析】【详解】A、铜和氧气加热生成氧化铜,反应为化合反应,氧化铜和氧气加热不反应,可以除去铜粉,故A正确;B、一氧化碳和氧化铜反应生成铜和二氧化碳,反应不属于置换反应,故B不正确;C、盐酸和氢氧化钠反应生成氯化钠和水,反应类型为复分解反应,故C不正确;D、硫酸钾和硝酸钡反应生成硫酸钡和硝酸钾,引进新杂质硝酸钾,故D不正确。
故选A。
2.下列方法不能达到除杂目的的是A.A B.B C.C D.D【答案】A【解析】【分析】【详解】A、CO能与灼热的氧化铜反应生成铜和二氧化碳,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
B、氯化钾易溶于水,MnO2难溶于水,可采取加水溶解、过滤、洗涤、干燥的方法进行分离除杂,故选项所采取的方法正确。
C、CaCO3在高温下煅烧生成氧化钙和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
D、足量的铁粉能与CuCl2溶液反应生成氯化亚铁溶液和铜,再过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
故选:A。
【点睛】根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
3.除去下列物质中的少量杂质,所选用的试剂和操作方法均正确的是A.A B.B C.C D.D【答案】C【解析】【分析】【详解】A、氯化铜与铁反应生成氯化亚铁和铜,除去杂质氯化铜后会引入新杂质氯化亚铁,不符合除杂原则,选项错误;B、在加热的条件下,不但一氧化碳能与氧化铜反应,碳粉也能与氧化铜反应,该方法会将欲保留的物质反应掉,不符合除杂原则,选项错误;C、碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,将杂质转化为欲保留的物质,且碳酸钙不溶于水,反应后过滤掉过量的碳酸钙,滤液中的溶质只有氯化钙,符合除杂原则,选项正确;D、碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,将杂质转化为欲保留的物质,但蒸发时过量的盐酸挥发到空气中会污染空气,选项错误,故选C。
一、中考初中化学除杂分离和提纯1.除去下列物质中混有的杂质所用试剂和操作方法均正确的是( )A.A B.B C.C D.D【答案】B【解析】【分析】除杂(提纯),是指除去杂质,同时被提纯物质不得改变。
【详解】A、氢氧化钠和硫酸铜反应生成氢氧化铜和硫酸钠,引入了硫酸钠杂质,故A不正确;B、铁粉与足量稀硫酸反应生成硫酸亚铁溶液和氢气,铜不能与稀硫酸反应,再过滤、洗涤、干燥,能除去杂质且没有引入新的杂质,符合除杂原则,故B正确;C、石灰水吸收二氧化碳的能力较弱,将气体依次通过盛有石灰水、浓硫酸的洗气瓶不能除去杂质,故C不正确;D、二氧化碳不能与氯化钙溶液反应,故D不正确。
故选B。
【点睛】除杂条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
2.除去下列物质中的少量杂质,所选试剂及操作都正确的是()A.A B.B C.C D.D【答案】D【解析】【分析】【详解】A、过量铁粉能与CuCl2溶液反应生成氯化亚铁溶液和铜,应再进行过滤,故选项所采取的方法错误;B、CO2能与氢氧化钠溶液反应生成碳酸钠和水,CO不与氢氧化钠溶液反应,应再进行干燥,故选项所采取的方法错误;C、Na2CO3能与适量CaCl2溶液反应生成碳酸钡沉淀和氯化钠,能除去杂质但引入了新的杂质氯化钠,不符合除杂原则,故选项所采取的方法错误;D、铁粉能与过量盐酸反应生成氯化亚铁溶液和氢气,铜不与过量盐酸反应,再过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
【点睛】除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
3.下列对某一主题的知识归纳,完全正确的一组是()A.A B.B C.C D.D【答案】A【解析】【分析】【详解】A、硬水和软水的区别在于所含的钙镁离子的多少,可用肥皂水来区分硬水和软水,加入肥皂水,若产生泡沫较多,则是软水,若产生泡沫较少,则是硬水,可以鉴别;铝制品与铜制品分别为银白色、紫红色(或黄色等),用观察物品颜色的方法可以鉴别,故选项正确;B、纯碱是碳酸钠,烧碱是氢氧化钠,均能与稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则;铁粉能被磁铁吸引,炭粉不能,能除去杂质且没有引入新的杂质,符合除杂原则,故选项错误;C、油的密度比水小,加少量水后,油会漂浮于水面上,与氧气的接触面积更大,更容易燃烧,炒菜时油锅不慎着火,不能用水浇灭,可用锅盖隔绝空气;实验室取用化学药品,根据三不原则,不能用手接触药品,故选项错误;D、干冰是固态二氧化碳,是由二氧化碳分子构成的;食盐是含有金属元素和非金属元素的化合物,食盐是由钠离子和氯离子构成的,故选项错误。
一、中考初中化学除杂分离和提纯1.下列除去杂质的方法中,不正确的是()A.①②B.②③C.③④D.②④【答案】D【解析】【分析】【详解】①氯化钠易溶于水,泥沙难溶于水,可采取加水溶解、过滤、蒸发的方法进行分离除杂,故选项所采取的方法正确;②二氧化碳能与氢氧化钠固体反应生成碳酸钠和水,氢氧化钠固体具有吸水性,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误;③铁粉能与CuSO4反应生成硫酸亚铁和铜,再过滤除去不溶物,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确;④Na2CO3能与过量的Ca(OH)2溶液反应生成碳酸钙沉淀和氢氧化钠,能除去杂质但引入了新的杂质氢氧化钙,不符合除杂原则,故选项所采取的方法错误,故②④方法不正确,故选D。
【点睛】本题为除杂题,是中考的重点,也是难点,解决除杂问题时,抓住除杂的必需条件(加入的试剂只与杂质反应,反应后不能引入新杂质)是正确解题的关键。
2.下列选项中的除杂方法不能达到目的的是()A.A B.B C.C D.D【答案】D【解析】【分析】除杂(提纯),是指除去杂质,同时被提纯物质不得改变。
【详解】A、二氧化碳与氢氧化钠溶液反应生成碳酸钠和水,氧气不与氢氧化钠溶液反应,再通过浓硫酸干燥,得到氧气,符合除杂原则,故A正确;B、碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,氯化钠的溶解度受温度的影响较小,充分反应后蒸发结晶得到氯化钠,故B正确;C、碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,充分反应后过滤,得到氢氧化钠,故C 正确;D、氧化铜和铁均与稀盐酸反应,把原物质除去了,不符合除杂原则,故D不正确。
故选D。
【点睛】除杂条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
3.下列除去物质中少量杂质的方法正确的是( )A.A B.B C.C D.D【答案】A【解析】【分析】【详解】A、铁粉能被磁铁吸引,木炭粉不能,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
专题突破三分离与除杂
1.下列除杂质的方法不正确的是( D )
选项物质(括号内为杂质) 除杂方法
A CaO (CaCO3) 高温煅烧
B NaCl溶液(Na2CO3) 加入适量的稀盐酸
C CaCl2溶液(HCl) 加入过量的CaCO3,再过滤
D CO2(HCl)
先通过足量NaOH 溶液,再通过浓硫酸
2.下列物质提纯或除杂所用试剂和分离方法正确的是( C )
选项物质(括号
内为杂质)
除杂试剂分离方法
A CuO(Cu) HCl溶液溶解、过滤
B NaCl(Na2SO4) 适量BaCl2吸附
C KCl(MnO2) H2O 溶解、过滤、蒸发、结晶
D SO2(HCl) NaOH 洗气
3.提纯是化学实验常用的一种方法。
除去下表混合物中的杂质,所选除杂试剂正确的是( C )
选项混合物(括号内为杂质) 除杂试剂
A 铁粉(铜粉) 稀硫酸
B 氢氧化钠溶液(硫酸钠) 硝酸钡溶液
C氯化钠溶液(碳酸钠) 氯化钙溶液
D 氧化钙(碳酸钙) 水
4.某化学活动小组同学打算用过滤方法分离下列混合物,其中不适宜用此法分离的一组是( D )
A.碳酸钾,碳酸钙
B.氯化钡,氯化银
C.氢氧化钡,硫酸钡
D.硝酸银,硝酸钡
5.生活中化学无处不在,下列运用的不属于过滤原理的是( D )
A.茶杯中的金属丝网分离茶叶
B.淘菜用的竹筲箕分离菜叶
C.滤豆浆用的棉纱布分离豆渣
D.农业上用食盐水分离出坏的种子
6.除去下列物质中的杂质,所用试剂和方法均正确的是( C )
选项物质杂质除杂所用的试剂和方法
A 氮气氧气木条,点燃
B 稀硫酸稀盐酸
加入适量的硝酸银溶液、过滤
C 氢氧化
钠溶液
氢氧化
钡溶液
加入适量的碳
酸钠溶液、过滤
D 氯酸钾氯化钾
加入少量二氧化锰,加热
7.实验室用KClO3制氧气并回收MnO2和KCl,下列操作不规范的是( D )
A.用装置甲收集氧气
B.用装置乙溶解完全反应后的固体
C.用装置丙分离MnO2和KCl溶液
D.用装置丁蒸干分离后的溶液得KCl晶体
8.在“粗盐中难溶性杂质的去除”实验中,玻璃棒的用途不正确的是( A )
A.称取粗盐后,把粗盐研磨细
B.溶解时搅拌,加速粗盐溶解
C.称量精盐前,把精盐固体转移到纸上
D.蒸发时搅拌,防止局部温度过高,造成液滴飞溅
9.除去下列物质中含有的少量杂质,所用试剂或方法正确的是( B )
序号混合物(括号内为杂质) 除杂试剂或方法
A Fe 粉(Cu) CuSO4溶液
B NaCl (沙子) 加水溶解,过滤、蒸发结晶
C Na2SO4溶液( Na2CO3) 过量稀盐酸
D CO2(CO) 点燃
10.除去下列物质中混有的少量杂质(括号内为杂质),拟定的实验方案不可行的是( B )
A.FeCl2溶液(CuCl2) ——加入过量的铁粉,过滤
B.KCl固体(KClO3)——加入少量的二氧化锰,并加热
C.C O气体(CO2)——通过足量的氢氧化钠溶液,并干燥
D.NaCl溶液(MgCl2) ——加入过量的氢氧化钠溶液,过滤,滤液中加稀盐酸至中性
11.下表中各物质都含有少量杂质,分别写出除去杂质应选用的试剂及有关反应的化学方程。
物质杂质除去杂质应选用的试剂反应的化学方程式
KNO3KCl __硝酸银溶液__ __KCl+AgNO3===AgCl↓+KNO3__
H2CO2__氢氧化钠溶液__ __CO2+2NaOH===Na2CO3+H2O__
Cu CuO __稀硫酸__ __CuO+H2SO4===CuSO4+H2O__
12.通过海水晾晒可得粗盐。
粗盐除NaCl外,还含有MgCl2、CaCl2以及泥沙等杂质。
为了有效将粗盐提纯,实验的各步操作流程如图所示。
根据以上信息回答:
(1)在完成操作Ⅰ之前,必须加入的X物质是__水__。
(2)操作Ⅰ和操作Ⅱ的名称是__过滤__。
该操作中需要将圆形滤纸折叠处理,下列图示中不该出现的情。