高三化学总复习水溶液中的离子平衡单元综合测试
- 格式:doc
- 大小:226.50 KB
- 文档页数:15

湖南省湘潭市凤凰中学2015届高三化学 真题训练 水溶液中的离子平衡1. [2014·山东卷] 知某温度下CH 3COOH 和NH 3·H 2O 的电离常数相等,现向10 mL 浓度为0.1 mol·L -1的CH 3COOH 溶液中滴加相同浓度的氨水,在滴加过程中( )A .水的电离程度始终增大 B.c (NH +4)c (NH 3·H 2O )先增大再减小 C .c (CH 3COOH)与c (CH 3COO -)之和始终保持不变D .当加入氨水的体积为10 mL 时,c (NH +4)=c (CH 3COO -)2.[2014·新课标全国卷Ⅱ] 一定温度下,下列溶液的离子浓度关系式正确的是( )A .pH =5的H 2S 溶液中,c (H +)=c (HS -)=1×10-5 mol·L-1 B .pH =a 的氨水溶液,稀释10倍后,其pH =b ,则a =b +1C .pH =2的H 2C 2O 4溶液与pH =12的NaOH 溶液任意比例混合:c (Na +)+c (H +)=c (OH-)+c (HC 2O -4)D .pH 相同的①CH 3COONa 、②NaHCO 3、③NaClO 三种溶液的c (Na +):①>②>③3. [2013·海南卷] 0.1 mol/L HF 溶液的pH =2,则该溶液中有关浓度关系式不正确的是( )A .c (H +)>c (F -)B .c (H +)>c (HF)C .c (OH -)>c (HF)D .c (HF)>c (F -)4. [2014·北京卷] 下列解释事实的方程式不正确的是( )A .测0.1 mol/L 氨水的pH 为11:NH 3·H 2O NH +4+OH -B .将Na 块放入水中,产生气体:2Na +2H 2O===2NaOH +H 2↑C .用CuCl 2溶液做导电实验,灯泡发光:CuCl 2=====通电Cu 2++2Cl -D .Al 片溶于NaOH 溶液中,产生气体:2Al +2OH -+2H 2O===2AlO -2+3H 2↑5. [2014·福建卷] 下列关于0.10 mol·L -1 NaHCO 3溶液的说法正确的是( )A .溶质的电离方程式为NaHCO 3===Na ++H ++CO 2-3B .25 ℃时,加水稀释后,n (H +)与n (OH -)的乘积变大C .离子浓度关系:c (Na +)+c (H +)=c (OH -)+c (HCO -3)+c (CO 2-3)D. 温度升高,c (HCO -3)增大6. [2014·天津卷] 下列有关电解质溶液中粒子浓度关系正确的是( )A .pH =1的NaHSO 4溶液:c (H +)=c (SO 2-4)+c (OH -)B .含有AgCl 和AgI 固体的悬浊液:c (Ag +)>c (Cl -)=c (I -)C .CO 2的水溶液:c (H +)>c (HCO -3)=2c (CO 2-3)D .含等物质的量的NaHC 2O 4和Na 2C 2O 4的溶液:3c (Na +)=2[c (HC 2O -4)+c (C 2O 2-4)+c (H 2C 2O 4)]7. [2014·海南卷] 室温下,用0.100 mol·L -1 NaOH 溶液分别滴定20.00mL 0.100 mol·L -1的盐酸和醋酸,滴定曲线如图所示。

绝密★ 启用前山东省济南市高新区新高三化学2019-2020 学年一轮复习测试专题《水溶液中的离子均衡》一、单项选择题 (共 20 小题 ,每题 3.0 分 ,共 60分 )1.25℃时,在等体积的① pH = 0 的 H 2SO4溶液② 0.05 mol/L的 Ba(OH) 2溶液③ pH = 10 的 Na2S 溶液④ pH = 5 的 NH 4NO 3溶液中,发生电离的水的物质的量之比是( )A . 1:10:10 10:109B. 1:5:5 10×9:5 ×108C. 1:20:10 10:109D. 1:10:10 4:1092.必定条件下, CH 3COONa 溶液存在水解均衡:CH3COO-+ H 2O CH 3COOH + OH-,以下说法正确的选项是()-A .加入少量 NaOH 固体, c(CH 3COO )增大B.加入少量 FeCl3固体, c(CH 3 COO- )增大C.稀释溶液,溶液的 pH 增大D.加入适当醋酸获得的酸性混淆溶液:+)> c(CH 3COO-+-c(Na)> c(H)> c(OH )3.今有室温下四种溶液,有关表达不正确的选项是()A .③④中分别加入适当的醋酸钠晶体后,两溶液的pH 均增大B.②③两溶液等体积混淆,所得溶液中+-c(H )> c(OH )C.分别加水稀释10 倍,四种溶液的pH ①>②>④>③D. V1L ④与 V2L ①溶液混淆后,若混淆后溶液pH= 7,则 V1< V24.以下说法正确的选项是( )A .常温下,将pH =3 的醋酸溶液稀释到原体积的10倍后,溶液的 pH=4B.为确立某酸H 2A 是强酸仍是弱酸,可测NaHA 溶液的 pH。
若 pH> 7,则 H 2A 是弱酸;若 pH <7,则 H2A 是强酸C.用 0.2 000mol/L NaOH 标准溶液滴定HCl 与 CH 3COOH 的混淆溶液 (混淆液中两种酸的浓度均约为 0.1 mol/L), 至中性时,溶液中的酸未被完整中和D .同样温度下,将足量氯化银固体分别放入同样体积的① 蒸馏水、② 0.1 mol/L HCl 、③ 0.1 mol/LMgCl 2溶液、④ 0.1mol/L AgNO3溶液中, Ag +浓度:①>④=②>③5.有关 AgCl 积淀溶解均衡的说法中,不正确的选项是()A . AgCl 积淀的生成和溶解不断进行,但速率相等B. AgCl 难溶于水,溶液中没有Ag +和 Cl -C.高升温度, AgCl 积淀的溶解度增大D.向 AgCl 积淀中加入 NaCl 固体, AgCl 积淀的溶解度降低6.以下对积淀溶解均衡的描绘正确的选项是()A .反响开始时,溶液中各离子浓度相等B.积淀溶解达到均衡时,积淀的速率和溶解的速率相等C.积淀溶解达到均衡时,溶液中溶质的离子浓度相等,且保持不变D.积淀溶解达到均衡时,假如再加入难溶性的该积淀物,将促进溶解7.以下依照有关实验得出的结论正确的选项是( )A .在硫酸钡积淀中加入浓碳酸钠溶液充足搅拌后,取积淀(洗净 )放入盐酸中有气泡产生,说明K sp(BaCO 3) <K sp(BaSO4)B.将某无色气体通入品红溶液中,品红溶液退色,则此气体必定是SO2C.取少量某溶液并滴加数滴硫氰化钾溶液,无明展现象;再另取少量该原溶液,先滴加少量新制氯水,再滴加数滴硫氰化钾溶液,溶液变血红色,则原溶液中必定含Fe2+D.在淀粉溶液中加入稀硫酸并加热片晌再加入适当银氨溶液,水浴加热后没有银镜生成,说明淀粉没有水解8.以下水解方程式正确的选项是()A. CO +H2O2OH -+ CO2↑B. NH +H 2O+NH 3·H2O+ H3++ 3H2O Fe(OH)3↓3H+C. Fe+-HF+ OH -D. F +H2O9.对常温下 0.1 mol-1L·的醋酸溶液 ,以下说法不正确的选项是 ( )A .由水电离出来的c(H +)>1.0×10-13mol ·L-1B. c(CH 3COOH)> c(H +)>c(CH 3COO -)>c(OH- )C.与同浓度的盐酸分别加水稀释10 倍 :pH( 醋酸 )>pH( 盐酸 )D.与等浓度等体积NaOH 溶液反响后的溶液中 :c(CH 3COOH)+ c(CH 3COO --1 )=0.1 mol L ·10.以下说法正确的选项是()A .常温下,将pH =10 的氨水稀释,溶液中全部离子的浓度都减小B.某温度下,氢氧化钠溶液中+- 9- 1,该溶液的pH =9 H浓度为 10 mol ·LC.中和 pH 与体积均同样的盐酸和醋酸,耗费NaOH 的物质的量同样D.水的离子积常数w 随温度的高升而增大,说明水的电离是放热反响K11.常温下 ,向 20.00 mL 0.100 0 mol L -1CH·3COONa 溶液中逐滴加入-1盐酸 ,溶液的 pH0.100 0 mol L ·与所加盐酸体积的关系以下图(不考虑挥发 ) 。
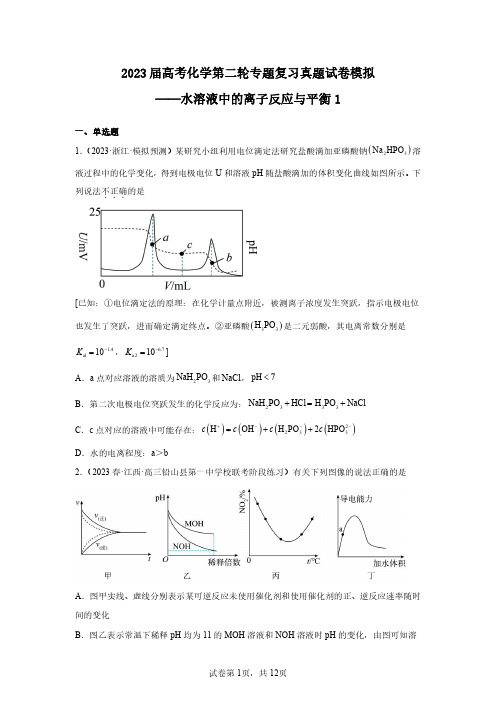
2023届高考化学第二轮专题复习真题试卷模拟——水溶液中的离子反应与平衡1一、单选题[已知:①电位滴定法的原理:在化学计量点附近,被测离子浓度发生突跃,指示电极电位也发生了突跃,进而确定滴定终点。
②亚磷酸(H 1.4al 10K -=, 6.7a 210K -=]A .a 点对应溶液的溶质为32NaH PO 和NaCl ,pHB .第二次电极电位突跃发生的化学反应为:NaHC .c 点对应的溶液中可能存在:()()H OH c c +-=D .水的电离程度:a >b2.(2023春·江西·高三铅山县第一中学校联考阶段练习)有关下列图像的说法正确的是A .图甲实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化B .图乙表示常温下稀释pH 均为11的MOH 溶液和NOH 溶液时pH 的变化,由图可知溶A .()-2.3b K ROH =10B .P 、Q 点对应溶液中()()++c R c H 的值:P Q>C .若将溶液无限稀释,溶液中()(+2-4c R 2c SO ≈D .相同条件下,若改为()124c R SO =0.2mol L -⋅4.(2023秋·浙江宁波·高三统考期末)下列溶液因盐的水解而呈酸性的是A .K SO 溶液B .NaHCO 溶液CA .完全沉淀废液中的2Pb +,I -的效果不如B .z 点,()()(2-2+3sp Q=c CO c Pb <K PbCO ⋅C .()sp 2K PbI 的数量级为1410-A .A -是HA 的共轭碱C .增大pH 过程中,()()A HA c c -的值减小()()HA A 1.0δδ-+=9.(2023·辽宁·模拟预测)难溶物2SrF 可溶于盐酸。
常温下,用A .1L 代表()2+-lgc Sr 与()()+c HF lg c H ⎡⎤⎢⎥⎢⎥⎣⎦的变化曲线B .a 、c 两点的溶液中均存在(2c Sr C .()a K HF 的数量级为710-D .c 点的溶液中存在()(2+-c Sr>c Cl 10.(2023·全国·模拟预测)某元素M(OH)3(s)M 3+(aq)+3OH -(aq)、A .曲线①代表lgc(M 3+)与pH 的关系B .M(OH)3的K sp 为1×10-33.5C .4.5≤pH≤9.3时,体系中元素M 主要以D .M(OH)4-与M 3+在溶液中可以大量共存11.(2023·山东·模拟预测)室温下,向柠檬酸A .C 6H 8O 7的K a1为10−3.13B .曲线b 表示δ(677C H O -)随pH 的变化C .在C 6H 6Na 2O 7溶液中,(677C H O -)>(66C H OD .pH 大于6时,发生的反应主要为2667C H O -12.(2023·辽宁·模拟预测)25℃时,用同一NaOH 溶液,pM[p 表示负对数,M 表示()()-c A c HA 、(c CuA .HA 为一元弱酸,25℃时7.4a K =10-B .线①代表滴定4CuSO 溶液时pM 与溶液C .滴定HA 溶液至x 点时,溶液中()()()()()-++-c HA >c A >c Na >c H >c OH D .滴定4CuSO 溶液至x 点时,改为滴加HA 溶液,沉淀逐渐完全溶解二、多选题A .25℃时,BOH 的电离平衡常数的数量级为10-4B .t=0.5,2c(H +)+c(B +)=2c(OH -)+c(BOH)C .P 1所示溶液:c(Cl -)>0.05mol·L -1D .P 2所示溶液:c(B +)>100c(BOH)14.(2023春·山东滨州·高三统考开学考试)25℃时,用HCl 气体调节0.1mol 体系中微粒浓度的对数值(lgc)与pH 的关系如图1所示(a 、b 、c 、d 线分别对应体系中除下列说法错误的是A .4NH Cl 水解平衡常数的数量级为1010-B .3P 对应溶液;()-1c Cl 0.05mol L-<⋅C .水的电离程度:123P P P <<D .4P 对应溶液:()()()-+4323c Cl =2c NH +2c NH H O⋅三、工业流程题常温下,有关金属离子开始沉淀和沉淀完全的pH 见下表:金属离子3Fe +3Al +2Mg +2Ca +(1)萃取塔中经过______(填写操作名称)可将含酚有机层分离出来。

2020-2021高考化学化水溶液中的离子平衡-经典压轴题及答案解析一、水溶液中的离子平衡1.氢叠氮酸(HN3)和莫尔盐[(NH4)2SO4·FeSO4·6H2O]是两种常用原料。
(1)氢叠氮酸易溶于水,25℃时,该酸的电离常数为Ka=10×10-5。
①氢叠氮酸在水溶液中的电离方程式为_______②0.2mol/L的HN3溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,此时,溶液呈酸性,则混合溶液中各离子和HN3分子浓度由大到小的顺序为_______。
(2)在FeSO4溶液中,加入(NH4)2SO4固体可制备莫尔盐晶体[(NH4)2Fe(SO4)2·6H2O],为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下:(已知莫尔盐的分子量为392)实验次数第一次第二次第三次消耗KMnO4溶液体积/mL25.5225.0224.98①配制莫尔盐溶液,所使用的玻璃仪器除了烧杯和玻璃棒外还有_______②滴定终点的现象是_______,通过实验数据,计算该产品的纯度为_______(用含字母a、c的式子表示)。
③上表第一次实验中记录数据明显大于后两次,其原因可能是_______。
A 第一次滴定时,锥形瓶用待装液润洗B 该酸性高锰酸钾标准液保存时间过长,部分变质C 滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失【来源】海南省海口市海南中学2020届高三下学期第七次月考化学试题【答案】HN3⇌H++N3- c(N3-)>c(Na+)>c(HN3+)>c(H+)>c(OH-) 500mL容量瓶,胶头滴管滴入最后一滴标准液,溶液变为浅紫红色,且半分钟不变色(980c/a)×100% AC【解析】【分析】(1)①氢叠氮酸是一元弱酸;②0.2mol/L的HN3溶液与0.1mol/L 的NaOH溶液等体积混合后,溶液中含有等物质的量浓度的HN3和NaN3;(2)溶液的配置需要的仪器有:烧杯、玻璃棒、容量瓶、胶头滴管;高锰酸钾溶液本身是紫色的,可以根据高锰酸钾溶液颜色变化判断滴定终点;第一次实验中记录数据明显大于后两次,即高锰酸钾溶液体积偏大。

精品资料欢迎下载1 / 3高三化学一轮复习水溶液中的离子平衡专题测试卷1. 0.1mol/L HF 溶液的ph=2,则该溶液中有关浓度关系式不正确的是(双选)()A .c (H +)>c (F -) B .c (H +)<c (HF )C .c (OH -)>c (HF )D .c (HF )>c (F -)2. 室温时,将浓度和体积分别为c 1、V 1的NaOH 溶液和c 2、V 2的CH 3COOH 溶液相混合,下列关于该混合溶液的叙述错误的是( ) A .若PH >7时,则一定是c 1V 1=c 2V 2B .在任何情况下都是c (Na +)+c (H +)=c (CH 3COO -)+c (OH -) C .当pH=7时,若V 1=V 2,则一定是c 2>c 1D .若V 1=V 2、c 1=c 2,则c (CH 3COO -)+c (CH 3COOH )=c (Na +) 3. 下列说法正确的是 ( )A .KClO 3和SO 3溶于水后能导电,故KClO 3和SO 3为电解质B .25℃时、用醋酸溶液滴定等浓度NaOH 溶液至pH=7,V(醋酸)<V(NaOH)C .向NaAlO 2溶液中滴加NaHCO 3溶液,有沉淀和气体生成D .AgCl 易转化为AgI 沉淀且K(AgX)=c(Ag +) c(X -),故K(AgI)<K(AgCl) 4.下列叙述正确的是( )A .盐酸中滴加氨水至中性,溶液中溶质为氯化铵B .稀醋酸加水稀释,醋酸电离程度增大,溶液的pH 减小C .饱和石灰水中加入少量CaO ,恢复至室温后溶液的pH 值不变D .沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强5. 25℃时,有c (CH 3COOH )+c (CH 3COO -)=0.1mol•L -1的一组醋酸、醋酸钠混合溶液,溶液中c (CH 3COOH )、c (CH3COO-)与pH 的关系如图所示.下列有关溶液中离子浓度关系的叙述正确的是( )A .pH=5.5的溶液中:c (CH 3COOH )>c (CH 3COO -)>c (H +)>c (OH -)B .W 点所表示的溶液中:c (Na +)+c (H +)=c (CH 3COOH )+c (OH -)C .pH=3.5的溶液中:c (Na+)+c (H+)-c (OH-)+c (CH3COOH )=0.1mol•L -1D .向W 点所表示的1.0L 溶液中通入0.05molHCl 气体(溶液体积变化可忽略):c (H+)=c (CH3COOH )+c (OH-)6.常温下0.1mol•L -1醋酸溶液的pH=a ,下列能使溶液pH=(a+1)的措施是( ) A. 将溶液稀释到原体积的10倍B. 加入适量的醋酸钠固体C. 加入等体积0.2 mol•L -1盐酸D. 提高溶液的温度7.已知温度T 时水的离子积常数为KW ,该温度下,将浓度为a mol•L ‾1的一元酸HA 与b mol•L ‾1的一元碱BOH 等体积混合,可判定该溶液呈中性的依据是( ) A .a=bB .混合溶液的pH=7C .混合溶液中,c(H+)=mol•L ‾1D .混合溶液中,c(H +)+c(B +)=c(OH‾)+c(A‾)8.水中加入下列溶液对水的电离平衡不产生影响的是( )A .NaHSO4溶液B .KF 溶液C .KAl (SO 4)2溶液D .NaI 溶液9.25 ℃时,在等体积的①pH =0的H 2SO 4溶液,②0.05 mol·L -1的Ba(OH)2溶液,③pH =10的Na 2S 溶液,④pH =5的NH 4NO 3溶液中,发生电离的水的物质的量之比是( ) A .1∶10∶1010∶109 B .1∶5∶5×109∶5×108C .1∶20∶1010∶109D .1∶10∶104∶10910.下列溶液中粒子的物质的量浓度关系正确的是( )A .0.1mol/L NaHCO 3溶液与0.1mol/L NaOH 溶液等体积混合,所得溶液中:c (Na +)>c (CO 32-)>c (HCO 3-)>c (OH -)B .20mL 0.1mol/L CH 3COONa 溶液与10mL 0.1mol/L HCl 溶液混合后溶液呈酸性,所得溶液中:c (CH 3COO-)>c (Cl-)>c (CH 3COOH )>c (H +)C .室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c (Cl -)+c (H +)>c (NH 4+)+c (OH -)D .0.1mol/L CH 3COOH 溶液与0.1mol/L NaOH 溶液等体积混合,所得溶液中:c (OH -)>c (H +)+c (CH 3COOH )11.下列说法正确的是( )2 / 3欢迎下载3 / 3。

专题11水溶液中的离子平衡1.(2021 •河北沧州市高三三模)常温下,向20mL0.1mol-L-'H2S03溶液中滴加O.lmol K1的NaOH溶液时,pH、pc(X)[pc(X) = -lgc(X)(X = H2SO3, HSO;或SO;)随V(NaOH 溶液)变化的曲线如图。
下列叙述不正确的是•- ‘r I•' I••I0 10.0 20.0 40.0V(NaOH 溶液)/mLA.常温下,H2SO3的第一步电离平衡常数K al = lxl0-22B.当V(NaOH溶液)=10mL 时,c(H2SO3) + 2c(H+) = c(HSO;) + 2c(QH )C.V(NaOH溶液)=40mL时,水的电离程度最大D.常温下,当pH = 7.6 时,有3c(HSO;)<c(Na+)【答案】B【解析】A.当pH = 2.2 时,c(HSO3)=c(H2SO3),则7T al = = c(H+) = 1 x 10 22, A项正确;B.当V(NaOH溶液)=10mL 时,根据电荷守恒得c(Na+) + c(H+) = c(HSO;) + C(OH~) + 2c(SO^-), 根据物料守恒得2c(Na+) = c(HSO3)+ C(H2SO3)+ C(SO;),综上可得C(H2SO3) + 2c(H+) = c(HSO~) + 2c(0H")+3c(SO^ ) , B 项错误;C.当V(NaOH溶液)=40mL时,溶液中溶质为Na2SO3 , NazSC^是强碱弱酸盐,在水中水解,促进水的电离,所以当V(NaOH溶液)=40mL时,水的电离程度最大,C项正确;D.当pH = 7.6时,c(HSO:) = c(SO;),根据电荷守恒得c (Na +) + c (H +) = c (HS0;) + c (0H") + 2c (S0;"), c (Na +) + c (H +) = 3c (HS0;) + c (0H -),此时 c (H +)<c (OH ), 3c (HSO ;)<c (Na +), D 项正确;答案选B 。
水溶液中的离子守恒(三大守恒)专项练习(选择题25题)一、单选题(共25题,每题4分,共100分)1.NH4Cl溶液中,下列叙述错误的是()A.c(NH4+)>c(Cl-)>c(OH-)>c( H+)B.c(Cl-)>c(NH4+)>c( H+)>c(OH-)C.c(NH4+)+c( H+)=c(Cl-)+c(OH-)D.c(NH4+)+c( NH3·H2O)=c(Cl-)2.常温下,下列各溶液的叙述中正确的是()A.pH=7的NaHSO3与Na2SO3混合溶液中:c(Na+)=c(HSO3−)+c(SO32−)B.等物质的量浓度的下列溶液中:①NH4Al(SO4)2②NH4Cl③CH3COONH4④NH3·H2O,c(NH4+)由大到小的顺序是①>②>③>④C.0.1 mol·L-1的醋酸的pH=a,0.01 mol·L-1的醋酸的pH=b,则a+1=bD.0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1的盐酸10 mL混合后溶液显酸性,则有:c(CH3COOH)>c(H+)>c(Cl-)>c(CH3COO-)3.如图为向25mL 0.1 mol·L-1 NaOH溶液中逐滴滴加0. 2 mol·L-1 CH3COOH溶液过程中溶液pH的变化曲线。
AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是:()A.c(OH-)一定大于c(CH3COO-)B.c(OH-)一定小于c(CH3COO-)C.c(OH-)一定等于c(CH3COO-)D.c(OH-)大于、小于或等于c(CH3COO-)4.NH3与O2作用分别生成N2、NO、N2O的反应均为放热反应。
工业尾气中的NH3可通过催化氧化为N2除去。
将一定比例NH3、O2和N2的混合气体以一定流速通过装有催化剂的反应管,NH3的转化率、N2的选择性[2n生成(N2)n总转化(NH3)×100%]与温度的关系如图所示。
高考化学压轴题之化水溶液中的离子平衡(高考题型整理,突破提升)附答案解析一、水溶液中的离子平衡1.水合肼(N2H4·H2O)是一种强还原性的碱性液体,常用作火箭燃料。
利用尿素法生产水合肼的原理为CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl。
实验1:制备NaClO溶液(己知:3NaClO2NaCl+NaClO3)。
(1)图甲装置Ⅰ中烧瓶内发生反应的离子方程式为________________________。
(2)用NaOH固体配制溶质质量分数为30%的NaOH溶液时,所需玻璃仪器有_______________。
(3)图甲装置Ⅱ中用冰水浴控制温度的目的是________________________。
实验2:制取水合肼(4)图乙中若分液漏斗滴液速度过快,部分N2H4·H2O会参与A 中反应并产生大量氮气,降低产品产率,该过程中反应生成氮气的化学方程式为__________________。
充分反应后,蒸馏A中溶液即可得到水合肼的粗产品。
实验3:测定馏分中水合肼的含量(5)称取馏分3.0g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH 保持在6.5 左右),加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加2~3 滴淀粉溶液。
用0.15mol·L-1的碘的标准溶液滴定。
(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)①滴定操作中若不加入适量NaHCO3固体,则测量结果会___________“偏大”“ 偏小”“ 无影响”)。
②下列能导致馏分中水合肼的含量测定结果偏高的是___________(填字母)。
a.锥形瓶清洗干净后未干燥b.滴定前,滴定管内无气泡,滴定后有气泡c.读数时,滴定前平视,滴定后俯视d.盛标准液的滴定管水洗后,直接装标准液③实验测得消耗I2溶液的平均值为20.00mL,馏分中水合肼(N2H4·H2O)的质量分数为___________________。
章末综合检测(时间:90分钟分值:100分)一、选择题:本题共10小题,每小题2分,共20分。
每小题只有一个选项符合题意。
1.(教材改编题)下列说法正确的是() A.K w随浓度的改变而改变B.一般情况下,一元弱酸HA的K a越大,表明该酸的酸性越弱C.对已达到化学平衡的反应,改变压强,平衡常数(K)一定改变D.温度升高,难溶电解质的K sp不一定增大解析:选D。
水的离子积常数只受温度的影响,故A项错误;电离平衡常数用于衡量电离程度,电离平衡常数越大,说明电离程度越强,对酸来说,酸性越强,故B项错误;平衡常数只受温度的影响,改变压强,平衡常数不变,故C项错误;对Ca(OH)2来说,温度升高,其K sp减小,故D项正确。
2.常温下,有关0.1 mol·L-1 NH4Cl溶液(pH<7)的说法不正确的是() A.根据以上信息,可推断NH3·H2O为弱电解质B.加水稀释过程中,c(H+)·c(OH-)的值增大C.加入K2CO3固体可促进NH+4的水解D.相同pH的NH4Cl溶液和CH3COOH溶液,由水电离出的c(H+)前者大解析:选B。
0.1 mol·L-1 NH4Cl溶液的pH<7,说明NH4Cl为强酸弱碱盐,可推断NH3·H2O 为弱电解质,故A项说法正确;K w=c(H+)·c(OH-),K w只与温度有关,温度不变K w不变,加水稀释过程中K w不变,故B项说法错误;加入K2CO3固体后,CO2-3能与NH4Cl水解产生的H+反应,促进NH+4的水解,故C项说法正确;NH4Cl水解促进水的电离,CH3COOH抑制水的电离,所以由水电离出的c(H+)前者大,故D项说法正确。
3.(教材改编题)化学平衡常数(K)、弱酸的电离平衡常数(K a)、难溶物的溶度积常数(K sp)是判断物质性质或变化的重要平衡常数。
下列关于这些常数的说法中,正确的是() A.平衡常数的大小与温度、浓度、压强、催化剂等有关B.当温度升高时,弱酸的电离平衡常数K a变小C.K sp(AgCl)>K sp(AgI),由此可以判断AgCl(s)+I-(aq)===AgI(s)+Cl-(aq)能够发生D.K a(HCN)<K a(CH3COOH),说明物质的量浓度相同时,氢氰酸的酸性比醋酸强解析:选C。
高三化学高考复习《水溶液中的离子平衡》(附参考答案)第I卷选择题一、选择题1.下列说法不正确的是A.因为Na2S水解,所以浓硫化钠溶液有臭味B.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等C.Fe3++3H 2O Fe(OH)3+3H+,FeCl3可以净水D.CO32-+H2O HCO3-+OH-热的纯碱溶液去油污2.室温时,将浓度和体积分别为c1、v1的NaOH溶液和c2、v2的CH3COOH溶液相混合,下列关于该混合溶液的叙述正确的是A.若pH>7时,则一定是c1v1=c2v2B.在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-)C.当pH=7时,可能有c1/c2 > v2/v1D.若V1=V2,c1=c2,则c(CH3COO-)+C(CH3COOH)=C(Na+)3.如图,abcd分别代表酸碱溶液加水稀释后pH与加水的体积的关系。
下列判断正确的是()A.a和b为强电解质B.等体积的c和d分别与足量的镁粉反应,放出H2一样多C.c和d的物质的量浓度相同D.pH相等的a和b分别加水稀释m和n倍后pH仍相等,则m < n4.室温下,往0.001mol·L-1的氨水中滴入几滴酚酞试液时,溶液呈现粉红色。
现采取下列措施,其中能使滴有酚酞的氨水溶液颜色变浅的是A.往溶液中滴入0.2mol·L-1的氨水B.往溶液中加入NH4Cl晶体C.往溶液中加入CH3COONa固体D.往溶液中加入NaOH固体5.下列有关电解质溶液的说法正确的是A.在蒸馏水中滴加浓H2S04,K w不变B.CaC03不易溶于稀硫酸,也不易溶于醋酸C.NaCI溶液和CH3 COONH4溶液均显中性,两溶液中水的电离程度相同D.在Na2S稀溶液中,c(H+) =c( OH-)-2c(H2S) -c(HS-)6.下列表述或判断正确的是()A.25℃时,pH=10的NaOH溶液与pH =10的氨水中:c(Na+)=c(NH4+);B.相同条件下等物质的量浓度的①NaCl溶液;②NaOH溶液;③HCl溶液中由水电离出的c(H+) :③>①>②C.在Na2CO3、NaHC03两种溶液中,离子种类不相同D.25 ℃时,浓度为0.2mol/L的Na2CO3溶液中只存在水解平衡,不存在电离平衡7. 0.1mol/LNaHCO3的溶液的pH最接近于()A.5.6 B.7.0 C.8.4 D.13.08.下列关于强、弱电解质的叙述,正确的是A.强电解质全部是离子化合物B.强电解质在水中的溶解度一定大于弱电解质C.强电解质在水溶液中完全电离D.强电解质溶液的导电能力一定强于弱电解质9.下列说法正确的是:A.相同温度时,1mol/L氨水与0.5mol/L氨水中,C(OH-)之比是2∶1B.1mol/L NH4Cl溶液中 C(NH4+) = C(Cl-)C.0.1mol/LCH3COONa溶液中加少量CH3COOH溶液,使溶液呈中性,此时混合液中C (Na+) = C (CH3COO-)D.硫化钠溶液中,C (Na+) = 2 C (S2-)10.取20.00 mL 0.50 mol·L-1 NaOH溶液,恰好将未知浓度的H2SO4溶液20.00 mL滴定至终点,下列说法正确的是()A.该实验不需要指示剂B.用量筒量取上述硫酸的体积C.H2SO4的浓度为1.00 mol·L-1D.参加反应的H+和OH-的物质的量相等11.下列浓度关系正确的是A.等体积等浓度的氢氧化钠与醋酸混合:c(Na+)=c(CH3COO-)B.Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO-3)>c(H+)C.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) D.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) 12.0.1mol·L-1HF溶液的pH=2,则该溶液中有关浓度关系式不正确的是()A.c(H+)>c(F-) B.c(H+)>c(HF)C.c(OH-)<c(HF) D.c(HF)>c(F-)第II卷非选择题二、非选择题13.常温下,两种溶液①0.1 mol•L-1 NH3·H2O ②0.1 mol•L-1 NH4Cl中:(1)溶液①的pH 7(填“>”、“<”或“=”),其原因是:(用电离方程式表示)。
高三化学总复习水溶液中的离子平衡单元综合测试一、选择题(本题共16小题,每小题3分,共48分。
每小题只有一个选项符合题意)1.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,不正确的是()A.加热饱和三氯化铁溶液制备氢氧化铁胶体:Fe3++3H2O △Fe(OH)3(胶体)+3H+B.硫氢根电离的离子方程式:HS-+H2O H3O++S2-C.少量氢氧化钙溶液与碳酸氢钠溶液混合的离子方程式:Ca2++2HCO-3+2OH-===CaCO3↓+2H2O+CO2-3D.在0.5 mol·L-1的K2Cr2O7溶液中存在如下平衡:Cr2O2-7+H2O2CrO2-4+2H+,其平衡常数K的表达式为K=c2(CrO2-4)·c2(H+) c(Cr2O2-7)[答案]A[解析]利用FeCl3溶液制胶体Fe(OH)3,不是一个可逆过程,不用“”,A项错误;B、C项明显正确;平衡常数K为生成物浓度幂之积与反应物浓度幂之积的比值,水的浓度是一常数,不在平衡常数表达式中出现,D项正确。
2.(2011·四川,9)25 ℃时,在等体积的①pH=0的H2SO4溶液,②0.05 mol/L的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是()A.1∶10∶1010∶109B.1∶5∶5×109∶5×108C.1∶20∶1010∶109D.1∶10∶104∶109[答案]A[解析]本题主要考查了水的电离和水解的实质。
pH=0的硫酸中,由水电离出的[H+]=10-14mol·L-1,0.05 mol·L-1的Ba(OH)2溶液中由水电离出的[H+]=10-13mol/L,pH=10的Na2S溶液中由水电离出的[H+]=10-4mol/L,pH=5的NH4NO3溶液中由水电离出的[H+]=10-5mol/L,故发生电离的水的物质的量之比为:10-14∶10-13∶10-4∶10-5,即答案A正确。
3.下列液体均处于25 ℃,有关叙述正确的是()A.某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐B.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同D.pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-)[答案]B[解析]本题考查电解质溶液的性质,考查考生定量或半定量分析问题的能力。
A项还可能是酸式盐溶液,如NaHSO4;番茄汁中c(H+)=10-4.5 mol/L,牛奶中c(H+)=10-6.5 mol/L,故二者的H+之比为:10-4.5/10-6.5=100,B项正确;C项CaCl2溶液中的Cl-浓度是NaCl 溶液中的二倍,故C项不正确;根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),pH=5.6的溶液中c(H+)>c(OH-),则c(Na+)<c(CH3COO-),D项不正确。
4.下列根据反应原理设计的应用,不正确的是()A.CO2-3+H2O HCO-3+OH-用热的纯碱溶液清洗油污B.Al3++3H2O Al(OH)3+3H+明矾净水C.TiCl4+(x+2)H2O(过量)TiO2·x H2O↓+4HCl制备TiO2纳米粉D.SnCl2+H2O Sn(OH)Cl↓+HCl配制氯化亚锡溶液时加入氢氧化钠[答案]D[解析]纯碱溶液中由于CO2-3的水解溶液呈碱性,加热时水解程度增大,溶液中c(OH-)增大,清洗油污能力增强,A对;明矾溶于水,Al3+发生水解生成Al(OH)3胶体,能够吸附水中悬浮物,B对,D项中应加入盐酸。
5.下列说法正确的是()A.水解反应是吸热反应B.升高温度可以抑制盐类的水解C.正盐水溶液pH均为7D.硫酸钠水溶液pH小于7[答案]A[解析]水解反应是吸热反应,升高温度可以促进盐类的水解;正盐水溶液在常温条件下pH可能为7也可能不为7(盐的水解);硫酸钠水溶液pH的大小,关键看温度,在常温下pH等于7,在100 ℃时就小于7。
6.下列解释实验事实的方程式不准确...的是()A.0.1 mol/L CH3COOH溶液的pH>1:CH3COOH CH3COO-+H+B.“NO2球”浸泡在冷水中,颜色变浅:2NO2(g)N2O4(g) ΔH<0(红棕色)(无色)C.铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO-3===3Fe2++2NO↑+4H2OD.向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO2-3+H2O HCO-3+OH-[答案]C[解析]本题考查了离子方程式、电离方程式、热化学方程式、水解方程式等化学用语的书写。
铁溶于稀硝酸,溶液变黄发生的离子方程式为Fe+4H++NO-3===Fe3++NO↑+2H2O。
7.下列事实说明HNO2为弱电解质的是()①0.1 mol/L HNO2溶液的pH=2.1②常温下NaNO2溶液的pH>7③用HNO2溶液做导电实验时,灯泡很暗④HNO2溶液和KCl溶液不发生反应⑤HNO2能与碳酸钠反应制CO2⑥HNO2不稳定,易分解A.①②③⑤B.①②④⑤C.①②⑥D.①②[答案]D[解析]①说明HNO2不能完全电离,②说明NaNO2是强碱弱酸盐,①②都能说明HNO2为弱电解质;③中溶液的导电能力与电解质的强弱无关;④不符合复分解反应发生的条件;⑤只能说明HNO2的酸性比H2CO3的强,但不能说明HNO2为弱电解质;⑥稳定性与是否为弱电解质没有必然的联系。
8.下列判断不正确的是()①若NaA、NaB溶液的pH分别为9和8,则酸性一定是HA<HB;②FeCl3溶液蒸干得FeCl3固体,Na2CO3溶液蒸干得Na2CO3固体;③CH3COONa水解产生CH3COOH和OH-,向水解液中加入少量冰醋酸会因其中和OH-而使水解平衡右移;④因Fe3++3H2O Fe(OH)3+3H+,为抑制水解,配制FeCl3溶液时需将FeCl3溶解在稀H2SO4中;⑤中和pH和体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同A.只有①②B.只有②③⑤C.只有①②③⑤D.全部[答案]D[解析]①NaA、NaB溶液的浓度没有说明,因此无法判断HA、HB酸性的强弱。
②FeCl3溶液蒸干过程中,由于水解生成HCl,因HCl易挥发,因此最终得Fe(OH)3。
③加入冰醋酸会增大CH3COOH的浓度而使CH3COO-的水解受到抑制。
④配制FeCl3溶液时,不能加入H2SO4,否则会引入杂质。
⑤pH相同的盐酸和醋酸溶液,醋酸的浓度大,故消耗的NaOH多。
9.(2011·广东,11)对于0.1mol·L-1 Na2SO3溶液,正确的是()A.升高温度,溶液pH降低B.c(Na+)===2c(SO2-3)+c(HSO-3)+c(H2SO3)C.c(Na+)+c(H+)=2c(SO2-3)+2c(HSO-3)+c(OH―)D.加入少量NaOH固体,c(SO2-3)与c(Na+)均增大[答案]D[解析]本题考查了盐类水解的影响因素、溶液中离子浓度的比较等。
Na2SO3是强碱弱酸盐,溶液呈碱性。
盐类水解是吸热过程,升高温度水解程度增大,氢氧根离子浓度增大,溶液pH升高,故A错误;由物料守恒可得:c(Na+)=2{c(SO2-3)+c(HSO-3)+c(H2SO3)},B项错误;由电荷守恒得:c(Na+)+c(H+)===2c(SO2-3)+c(HSO-3)+c(OH-),C项错误;加入少量NaOH固体,能抑制SO2-3的水解,溶液中c(SO2-3)和c(Na+)均增大,D项正确。
10.在不同温度下,水达到电离平衡时c(H+)与c(OH-)的关系如图所示,下列说法正确的是()A.100 ℃时,pH=12的NaOH溶液和pH=2的H2SO4溶液恰好中和,所得溶液的pH等于7B.25 ℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl溶液等体积混合,所得溶液的pH 等于7C.25 ℃时,0.2 mol/L NaOH溶液和0.2 mol/L乙酸溶液恰好中和,所得溶液的pH等于7D.25 ℃时,pH=12的氨水和pH=2的H2SO4溶液等体积混合,所得溶液的pH大于7[答案]D[解析]根据图像可知25 ℃时,水的离子积为10-14;100 ℃时为10-12,所以一定要注意反应所处的温度,100 ℃时,pH=12的NaOH溶液和pH=2的H2SO4溶液恰好中和,pH应为6,A项错误;25 ℃时,0.2 mol/L Ba(OH)2溶液与等浓度HCl溶液等体积混合,Ba(OH)2是二元碱,碱过量溶液显碱性,B项错误;25 ℃时,0.2 mol/L NaOH溶液与等浓度乙酸等体积混合恰好反应,但乙酸是弱酸,溶液显碱性,C项也错误;25 ℃时,pH=12的氨水和pH=2的H2SO4溶液等体积混合,氨水是弱碱,氨水过量,所以溶液呈碱性,D 项正确。
11.根据以下事实得出的判断一定正确的是()A.HA的酸性比HB的强,则HA溶液pH比HB溶液的小B.A+和B-的电子层结构相同,则A原子的核电荷数比B原子的大C.A盐的溶解度在同温下比B盐的大,则A盐溶液的溶质质量分数比B盐溶液的大D.A原子失去的电子比B原子的多,则A单质的还原性比B单质的强[答案]B[解析]A项中由于两种酸的浓度不知,无法比较pH大小,故错误。
C项没有限定是饱和溶液,C项也错误。
单质还原性强弱与失电子难易有关,与数目没有必然关系,故D错误。
12.下列叙述正确的是()A.0.1 mol/L C6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)B.Na2CO3溶液加水稀释后,恢复至原温度,pH和K w均减小C.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等D.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降[答案]D[解析]A项中溶液呈碱性,c(H+)<c(OH-),故A错;B项中K w不变;C项,pH=5的两溶液c(H+)相等,但水的电离程度不同;D项向Na2S溶液中加入AgCl 会生成溶解度更小的Ag2S,故c(S2-)减小,D正确。
13.下列关于电解质溶液的正确判断是()A.在pH=12的溶液中,K+、Cl-、HCO-3、Na+可以大量共存B.在pH=0的溶液中,Na+、NO-3、SO2-3、K+可以大量共存C.由0.1 mol·L-1一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH===B++OH-D.由0.1 mol·L-1一元酸HA溶液的pH=3,可推知NaA溶液存在A-+H2O HA+OH-[答案]D[解析]本题考查了弱电解质的电离、盐类水解方程式的书写、离子共存等知识。