芳香烃 亲电取代反应性质
- 格式:pdf
- 大小:921.21 KB
- 文档页数:15

有机化学基础知识点芳香性与芳香烃的性质有机化学基础知识点——芳香性与芳香烃的性质有机化学是研究有机物质及其反应机理的一门学科,其中芳香性与芳香烃是其中重要的知识点之一。
本文将着重介绍芳香性以及芳香烃的性质,帮助读者更好地理解有机化学中的这一概念。
一、芳香性的定义与特点芳香性是指具有特殊结构和性质的有机化合物所表现出的香味和稳定的π电子结构。
根据芳香性的定义,芳香性化合物需要满足以下几个条件:1. 分子结构中含有一个或多个芳环(由6个共轭π电子组成的环状结构);2. 芳环中每个原子都以杂化sp2形式存在,磁性势能相对稳定;3. 芳环中的每个杂化的p轨道上都有一个未被配对的π电子。
值得注意的是,非芳香性化合物虽然可能具有香味,但其分子结构不符合芳香性的定义。
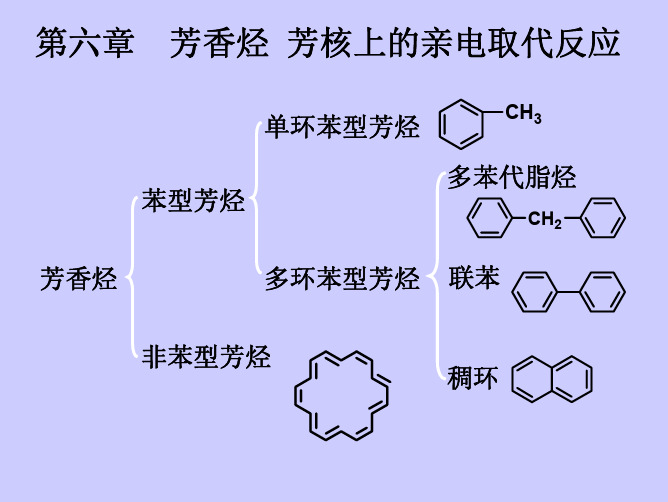
二、芳香烃的分类与性质芳香烃是一类基础的有机化合物,其分子中至少含有一个芳环。
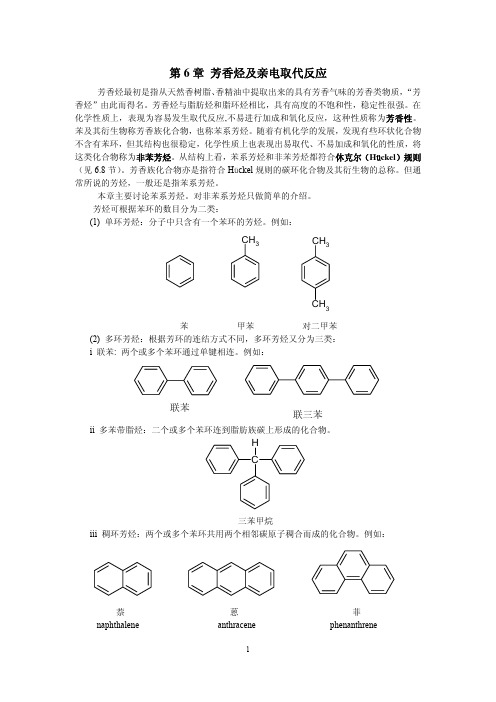
根据芳香烃分子中芳环的个数及其它官能团,芳香烃可以分为以下几类:1. 单核芳香烃:只含有一个芳环的芳香烃。
例如,苯(C6H6)是最简单的芳香烃,其分子结构中含有一个六元环。
2. 多核芳香烃:含有两个或多个连接在一起的芳环的芳香烃。
最常见的多核芳香烃是萘(C10H8),它由一个苯环和一个呈共轭连结的五元环组成。
3. 取代芳香烃:分子中的芳环上存在取代基的芳香烃。
通过对芳环中的氢原子进行取代,可以获得各种不同性质和用途的化合物。
芳香烃的一些重要性质包括:1. 稳定性:芳香烃具有相对较高的稳定性,这是因为芳香烃分子中的共轭π电子系统能够稳定结构和分子。
2. 可溶性:大多数芳香烃在非极性溶剂中具有较好的溶解性,但在水中溶解度较低。
3. 反应性:芳香烃在化学反应中常常表现出亲电取代反应、脱氢反应等特性。
三、应用与实际意义芳香烃是有机化学中重要的化合物类别之一,其应用领域非常广泛。
以下是一些芳香烃的应用和实际意义:1. 燃料:芳香烃类化合物广泛应用于燃料行业,用作汽车燃料和燃气等能源。

化学芳香烃知识点化学芳香烃是一类具有特殊结构和性质的有机分子,也是化学领域中的一个研究热点。
在生物学、医学、化学、材料科学等领域均有广泛应用。
本文将从化学芳香烃的定义、命名、结构、性质、应用等方面详细介绍相关知识点。
一、定义化学芳香烃是一类含有芳香环的有机分子,由多个苯环和其它非苯环组成。
它们的分子结构是平面的,具有环状、稳定、共轭的特点,容易形成基质吸附、氢键、π-π相互作用以及疏水力等相互作用。
其中,苯是最简单的芳香烃,分子式为C6H6。
芳香烃的共轭π电子体系,使它们具有较好的稳定性和化学反应性。
此外,芳香性质是指化合物分子中存在着独特的含π的共轭体系,从而对某些化学反应出现特异性,如亲电取代、自由基反应等。
二、命名芳香烃的命名方法与一般有机化合物的命名方法类似,但有一些特殊的规则需要遵守。
以苯为例,苯的一般命名是根据连续的碳原子数目来命名,但由于苯分子中的碳-碳键长相等,分子呈环状,所以苯分子的C-C键名叫做“芳香键”。
根据用于描述苯分子具有芳香性的π电子云体系,苯环可写为Ph,乘以下标明确位置则表示为Ph-X(X=H或某基团)。
三、结构芳香烃的分子结构是由苯环和其他非苯环组成的,有单环、多环等。
它们的分子结构是平面的,具有环状、共轭和芳香的特征。
共轭π电子体系是芳香烃分子最为特殊的结构。
苯环是含有6个碳原子和6个氢原子的圆形结构,其分子中的所有碳原子均在同一平面上,而且相邻两个C-C键长度相等,为1.39Å,C-H键长度相等,为1.08Å,而C-C键之间夹角为120°。
四、性质芳香烃具有一系列独特的性质,包括物理性、化学性等,主要表现为以下几个方面:1. 稳定性:芳香烃分子的圆形结构使其结构紧凑,难于活性分子的取代反应,因此具有良好的化学稳定性。
2. 香味性:许多芳香烃分子具有香味,如苯、甲苯、香兰素等。
芳香烃分子的结构呈现平面,共轭的π电子体系,让它们对光的吸收和发射有很好的稳定性和独特的性质。

高二化学芳香烃知识点芳香烃,通常指分子中含有苯环结构的碳氢化合物。
接下来店铺为你整理了高二化学芳香烃知识点,一起来看看吧。
高二化学芳香烃知识点1、亲电取代反应芳香烃图册主要包含五个方面:卤代:与卤素及铁粉或相应的三卤化铁存在的条件下,可以发生苯环上的H被取代的反应。
卤素的反应活性为:F>Cl>Br>I不同的苯的衍生物发生的活性是:烷基苯>苯>苯环上有吸电子基的衍生物。
烷基苯发生卤代的时候,如果是上述催化剂,可发生苯环上H取代的反应;如在光照条件下,可发生侧链上的H被取代的反应。
应用:鉴别。
(溴水或溴的四氯化碳溶液)如:鉴别:苯、己烷、苯乙烯。
(答案:step1:溴水;step2:溴水、Fe粉)。
硝化:与浓硫酸及浓硝酸(混酸)存在的条件下,在水浴温度为55摄氏度至60摄氏度范围内,可向苯环上引入硝基,生成硝基苯。
不同化合物发生硝化的速度同上。
磺化:与浓硫酸发生的反应,可向苯环引入磺酸基。
该反应是个可逆的反应。
在酸性水溶液中,磺酸基可脱离,故可用于基团的保护。
烷基苯的磺化产物随温度变化:高温时主要得到对位的产物,低温时主要得到邻位的产物。
F-C烷基化:条件是无水AlX3等Lewis酸存在的情况下,苯及衍生物可与RX、烯烃、醇发生烷基化反应,向苯环中引入烷基。
这是个可逆反应,常生成多元取代物,并且在反应的过程中会发生C正离子的重排,常常得不到需要的产物。
该反应当苯环上连接有吸电子基团时不能进行。
如:由苯合成甲苯、乙苯、异丙苯。
F-C酰基化:条件同上。
苯及衍生物可与RCOX、酸酐等发生反应,将RCO-基团引入苯环上。
此反应不会重排,但苯环上连接有吸电子基团时也不能发生。
如:苯合成正丙苯、苯乙酮。
亲电取代反应活性小结:连接给电子基的苯取代物反应速度大于苯,且连接的给电子基越多,活性越大;相反,连接吸电子基的苯取代物反应速度小于苯,且连接的吸电子基越多,活性越小。
2、加成反应与H2:在催化剂Pt、Pd、Ni等存在条件下,可与氢气发生加成反应,最终生成环己烷。

烷烃烯烃和芳香烃的性质与反应烷烃、烯烃和芳香烃是有机化合物中常见的三类碳氢化合物。
它们在化学性质上有着明显的差异,具有不同的物理性质和反应特点。
本文将就烷烃、烯烃和芳香烃的性质和反应进行论述。
一、烷烃的性质与反应烷烃是一类只含有碳碳单键和碳氢键的有机化合物。
它们的分子结构简单且稳定,因此物理性质相对较为单一。
烷烃通常是无色、无味的气体或液体,密度较小。
由于其分子结构稳定,烷烃的化学性质相对较为迟钝,不容易与其他物质发生反应。
烷烃的主要反应是燃烧反应。
烷烃与氧气在适宜条件下可以发生完全燃烧,生成二氧化碳和水。
这是烷烃最常见的反应,也是其最重要的应用之一。
例如,甲烷与氧气反应可以产生二氧化碳和水,生成的热能可用于供暖、发电等领域。
除了燃烧反应外,烷烃还可以参与部分氧化反应。
一些高级烷烃可以通过催化剂作用进行氧气与部分燃料的反应,产生醇、醛等有机化合物。
此反应在有机合成领域具有重要意义。
二、烯烃的性质与反应烯烃是一类含有碳碳双键的有机化合物。
烯烃的分子结构比烷烃更加复杂,由于烯烃中存在共轭体系,烯烃分子通常呈现较为稳定的结构。
烯烃可以是液体或气体,但很少有固体存在。
与烷烃相比,烯烃具有更为活泼的化学性质。
烯烃可以参与加成反应,双键可以与其他物质发生加成反应,生成新的化合物。
例如,乙烯可以与氢气在适当条件下发生加成反应,生成乙烷;乙烯也可以与氯气反应,生成氯乙烷。
此外,烯烃还可以进行聚合反应。
烯烃分子中的双键可以与其他烯烃分子的双键进行开环聚合反应,形成高分子化合物。
聚乙烯作为最常见的烯烃聚合物之一,具有广泛的应用。
三、芳香烃的性质与反应芳香烃是一类含有苯环结构的有机化合物。
芳香烃的分子结构稳定,具有特殊的芳香性质。
芳香烃的物理性质较为复杂,可以是固体、液体或气体。
芳香烃的芳香性质来源于苯环的共轭π电子体系。
芳香烃分子中存在的π电子使其具有一系列特殊的化学性质,如亲电取代反应和电子取代反应等。
亲电取代反应是最常见的芳香烃反应之一。