第一节 化学反应中的质量守恒
- 格式:doc
- 大小:71.50 KB
- 文档页数:1


第一节化学反应中的质量守恒一、备课标(一)课程标准:“四、物质的化学变化”之(三)“质量守恒定律”1、认识质量守恒定律,能说明化学反应中的质量关系。
4、认识定量研究对于化学科学发展的重大作用。
(二)化学具体目标:1.形成一些最基本的化学概念;初步认识物质的微粒观、变化观。
2.了解化学与社会和技术的关系,能用变化和联系的观点分析常见的化学现象,解释简单的化学问题。
3.初步形成基本的化学实验技能,初步学会设计完成一些简单的化学实验。
4. 能通过“提出问题、猜想与假设、制定计划、进行实验、收集证据、解释与结论、反思与评价、表达与交流”进行简单的探究活动。
5.初步学习运用观察、实验等方法获取信息,能用文字、图表和化学语言表述有关的信息,初步学习运用比较、分类、归纳、概括等方法进行信息进行加工。
6.能主动交流和讨论,清楚地表达自己的观点,逐步形成良好的学习习惯和学习方法。
7.初步养成勤于思考、敢于质疑、严谨求实、乐于实践、善于合作、勇于创新等科学品质。
二、备重点、难点教材分析:本节课主要涉及三方面的内容,一是学生认识到化学变化这一基本的自然规律,二是通过从微观和定量角度认识化学变化,三是认识定量研究对于化学科学、工农业生产的重要意义。
其核心内容是质量守恒定律的含义及实质,即物质在化学变化过程中总质量是否改变、为什么不变?教材重点确定为:通过对化学反应中反应物和生成物的质量关系的实验探究,认识质量守恒定律,并能解释质量守恒的原因。
重点知识:质量守恒定律的含义及实质重点过程与方法:1.通过对化学反应前后物质的质量有无变化的科学探究,经历“猜想与假设、制定计划、进行实验、收集证据、解释与结论、反思与评价、表达与交流”等科学探究的一般过程。
2.初步学习运用观察、实验等方法获取信息,并用化学语言表述质量守恒定律的相关内容,初步学习运用比较、归纳、概括等方法进行信息加工。
重点情感类目标:1.体验合作学习和科学探究的乐趣。



第五单元定量研究化学反应第一节化学反应中的质量守恒1.理解并能正确说出质量守恒定律的内容。
2.能用微粒的观点说明质量守恒的本质原因。
3.能用质量守恒定律解释常见的化学现象。
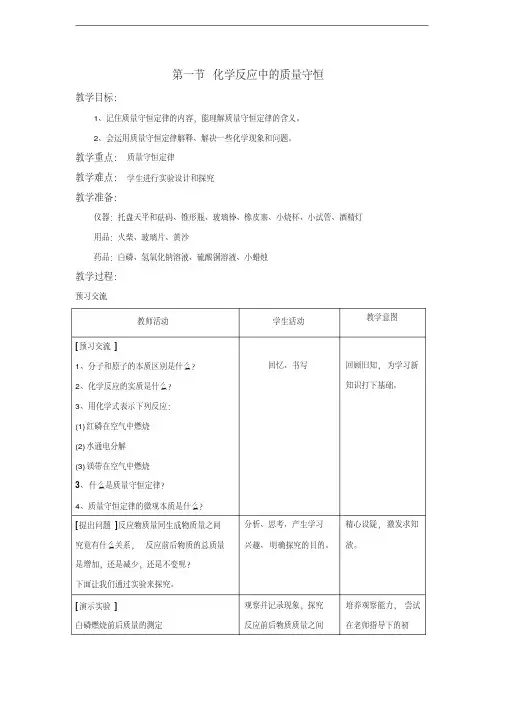
探究化学反应前后物质的质量有无变化阅读教材第101-102页的实验探究5-1,完成下列填空:1.根据下列3个实验方案分组进行实验,并将结果填入下表中。
2.根据小组桌面上提供的药品和仪器填写表格中的内容。
探究内容化学反应前后物质的总质量有无变化我的推测反应物的总质量=(填“>”“=”或“<”)生成物的总质量我选择的化学反应(用“√”选一个)1.盐酸和大理石反应()2.氢氧化钠溶液和硫酸铜溶液反应(√)3.白磷在空气中燃烧()我不选另外化学反应的原因方案1生成的二氧化碳是气体,质量不好测量;方案3有氧气参加,质量也不好测量我选择的实验仪器托盘天平、锥形瓶、试管、胶头滴管、细线我设计的实验方案实验步骤观察到的现象1.称量反应物和反应容器的总质量2.将试管中的硫酸铜溶液和锥形瓶中的氢氧化钠溶液混合3.称量生成物和反应容器的总质量4.比较反应前后的总质量1.有蓝色絮状沉淀生成2.天平平衡我的结论实验证明,在化学反应前后,物质的总质量是不变的反思与评价1.你的实验是否验证了自己的推测?是2.你的实验过程是否存在失误?是否影响了你的实验结果?答:略表达与交流在化学反应中,若用没有气体生成或参加的实验来验证质量守恒时,可以在敞口容器中进行3.无数实验证明:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和,这个规律就叫质量守恒定律。
1.该定律能不能推广应用于物理变化?答:不能。
2.该定律中的守恒是否包含体积呢?答:不包含。
3.该定律中的质量总和是否包含没有参加反应的物质的质量呢?答:不包含。
4.该定律在运用时能不能遗漏气态物质?答:不能。
5.在叙述质量守恒定律的内容时,应特别注意哪几个关键字眼?答:参加化学反应、质量总和、生成的各物质。

第五单元定量研究化学反应第一节化学反应中的质量守恒教材分析在本节课之前,学生已经知道化学变化的微观本质是构成物质的原子重新结合成分子的过程,已经知道在化学变化中分子可以再分,而原子不能再分,而对化学反应前后物质的总质量有无变化并不知道,但这一内容又是今后学习化学方程式的书写,化学反应的有关计算的基础,这一守恒思想一直贯穿于化学学习的始终。
本节的编写目的就是让学生认识到化学反应的前后物质的总质量是不改变的,并引导学生从微观上进行分析得出质量不变的本质原因,为后面的学习化学方程式的书写和化学反应中的有关计算打下基础,也为高中阶段其他守恒思想的学习埋下伏笔。
学习目标:⑴通过实验探究理解质量守恒定律。
⑵能用微粒观点解释质量守恒的本质原因。
⑶运用质量守恒定律解决一些相关问题.学习重难点:重点:化学反应中质量守恒的探究。
难点:质量守恒定律的微观解释。
学习准备师:完成本课所需的仪器药品准备;生:课前完成导学案上自主学习部分内容。
课前学生完成导学案上的自主学习的展示和点评或核对答案。
教学过程:一、情景导入展示火柴燃烧,蜡烛,酒精燃烧的图片。
问题:这些物质燃烧后留下什么?难道物质从世界上消失了吗?讲述:没有,我们知道物质发生化学变化会生成新物质,那么化学反应的前后物质的质量是否也会发生变化呢?今天我们要对化学变化进行定量研究。
板书:§5—1 化学反应中的质量守恒展示:本节课的学习目标二、探究新知情景1:化学反应前后物质的总质量是否改变呢?我们以过氧化氢分解为例,课本P100活动天地5-1插图。
问题1:图中两位同学的观点,你赞成谁的? 你有别的猜想吗?情景2:课本P101上小丽同学所画的3个表示过氧化氢分解生成水和氧气的微粒示意图问题组2:你认为那个图示是正确的,为什么?过渡:同学们,通过以上情景组的学习,可能你对化学反应前后物质的质量是否改变已经做出了自己的猜想?那么,如何设计实验来验证你的猜想是否正确呢?设计实验时应该注意什么?讲述:课本P101为我们提供了三个化学反应作为研究对象,由于时间的关系,老师为你们准备了前两个实验的仪器和药品.(当然也可选择其他你们熟悉的反应,但限于仪器药品原因,感兴趣的学习小组课后可进实验室完成.)在此,老师也选择了一个反应作为研究对象来探究这一问题,下面请同学们观看老师的实验过程,然后模仿老师的操作方法,按要求完成导学案上探究任务一的内容.演示:用白磷燃烧实验探究化学反应中的质量关系,演示完以后立即让学生按要求完成实验探究实验探究:多媒体展示探究要求展示:学生分组展示实验记录点评:学生分组点评展示结果教师点拨总结:根据学生的点评结果,教师点拨升华,并让学生做好记录。




授课日期:2013年11 月22日星期五第4节课
课型:新授
课题:第五单元定量研究化学反应第一节化学反应中的质量守恒
学习目标:
1.通过实验探究化学反应中反应物与生成物之间的质量关系,理解并描述质量守恒定律的内容。
2.认识定律发现史,通过亲历探究实验的过程,对科学家锲而不舍的努力和严谨的科学作风抱以崇敬和学习的态度.
3。
质量守恒定律的微观解释。
4。
运用质量守恒定律解决相关的问题。
知识点(重点、难点):
重点:是质量守恒定律的理解、微观解释.
难点:是运用质量守恒定律解决相关的问题。
教学准备:
多媒体课件、锥形瓶、具支锥形瓶、玻璃管、橡皮塞、小试管、气球、酒精灯、托盘天平、氢氧化钠溶液、硫酸铜溶液、稀盐酸、石灰石、白磷等.
板书设计:
(思维导图)
学习过程:
成功之处:本节课的设计,注重学生之间的交流与合作,合作学习是现在所提倡的一种学习方式,它所产生的交互作用是其它学习方式所不能代替的,本节课利用课堂内划分的活动小组,课堂教学中有小组内部的交流,也有小组之间的竞学,学生以小组为单位,对重点、关键的问题进行了讨论,以合作的方式进行取得了良好的效果。
另外分组实验,激发了学生学习兴趣,使课堂气氛非常活跃,学生的思维也始终处于活跃状态.
不足之处:由于分组动手实验,使时间变得非常紧张,最后“课堂小结”、“课堂检测”均草草收场,有些虎头蛇尾的感觉。
适当的习题练习是必要的,利用习题课时间,结合《助学》进行补救。
第五单元定量研究化学反应
第一节化学反应中的质量守恒
一、学习目标:
1.通过探究活动能说出质量守恒定律的内容2.从微观角度知道质量守恒定律的实质
3.质量守恒定律的应用
二、知识回顾:
1.化学反应的实质是:分子分解成,原子重新组合成。
2.写出蜡烛燃烧的文字表达式:。
三、自主探究:(定量研究物质的化学变化的学习过程)
1.实验探究(分小组实行实验)
实验结论:参加的各物质的,等于反应后生成的各物质的,这个规律叫做质量守恒定律。
练习1:1、填空
1)24克镁与16克氧气恰好完全反应,则生成氧化镁的质量为____ 克
2)6克碳与一定量的氧气恰好完全反应,生成二氧化碳22克,有______克氧气参加了反应。
2、请判断下列说法是否准确,不准确的请说明理由。
1)5克水受热变成5克水蒸气,遵守质量守恒定律。
2)根据质量守恒定律,1L氢气和1L氧气反应能生成2L水。
3)已知1克氢气和8克氧气恰好完全生成9克水,那么2克氢气和8克氧气反应一定生成10克水。
2.质量守恒定律的原因:
从微观解释质量守恒定律:化学变化中,___ 可分,不可分。
所以反应前后原子的______、______、_____不变。
练习2:
1)物质A受热分解的反应为A = CO2+ H2O ,则组成物质A的元素是()
2) A+O2 = CO2+H2O ,则A一定含有 ( )元素,可能含有( ) 元素;3)2R+O2=2SO3,则R的化学式为()
我的收获:,
四、当堂检测:
1.下列说法准确的是()
A.根据质量守恒定律,1 L氢气和1 L氧气反应能生成2 L水
B.蜡烛完全燃烧后,蜡烛没有了,违背了质量守恒定律
C.只有固体、液体间的物质反应才遵守质量守恒定律
D.铁丝在氧气中燃烧,生成物的质量等于参加反应的铁丝和氧气的质量之和。
2、化学反应中,不发生改变且能解释质量守恒定律原理的是下列①---⑥中的()
①物质种类②分子种类③分子数目④原子种类⑤原子数目⑥原子质量
A、①
B、②③
C、④⑤⑥
D、①②③④⑤⑥
3、下列变化中,能用质量守恒定律解释的是()
A 5g水受热变成5g水蒸气
B 5g食盐溶解在95g水中,成为100g食盐溶液
C 100mL水加入100mL酒精,成为体积小于200mL的溶液
D 木炭燃烧后质量减少
4.在A+B→C+D反应中,反应物中A、B质量比为5:2,若反应生成的C和D总质量为
28g,则反应消耗反应物A的质量为()
A、14g
B、8g
C、20g
D、16。