内源性药物干粉吸入给药的研究进展
- 格式:pdf
- 大小:287.92 KB
- 文档页数:3

◇慢性气道疾病药物治疗新进展◇摘要全球超过3亿人饱受哮喘困扰,且发病率逐年增加,作为最常见的慢性疾病之一,哮喘激发机制复杂,异质性强,是一类免疫介导的炎症疾病。
随着基于生理、病理等机制深入研究,陆续推出的治疗性小分子和激素药物已实现对大多数患者的控制和治疗,但仍有5%~10%的患者为难控制、难治疗性哮喘,即重度哮喘。
近十年来,得益于生物医药的迅猛发展,蛋白、抗体类药物凭借高有效性、高特异性、高安全性成为关键的重度哮喘治疗药物,然而由于生物制剂通常经注射给药,不可无创、快速地递送药物直接入肺迅速吸收起效,故而临床中亟需起效快、便捷、经济、安全的吸入式生物制剂。
本综述通过对哮喘发病机制的阐释,概括现行的小分子、激素类和生物类治疗药物,并总结吸入式哮喘生物制剂的研发历程,对其未来前景进行分析,旨在加深对大分子吸入药物研究方向的认知,更新该领域前沿动态,以期为更多吸入式生物制剂的开发提供参考。
关键词哮喘;给药途径;吸入给药;生物制剂中图分类号:R256.12文献标志码:A文章编号:1009-2501(2024)04-0406-08doi :10.12092/j.issn.1009-2501.2024.04.007支气管哮喘简称哮喘,以呼吸急促、咳嗽和胸闷等多种症状为特征,与慢性气道炎症,广泛、可逆性呼气性气流阻塞和气道高反应性等症状有关[1]。
全球超过3亿人饱受哮喘困扰,且发病率逐年增加。
根据全球哮喘指南全球哮喘防治创议(global initiative for asthma ,GINA )建议,需对患者采用阶梯式治疗方案,尤其推荐个性化治疗方案。
随着生物制剂的发展,抗体类生物制剂已成功应用至哮喘治疗,为中重度哮喘患者带来了更有效、更安全的药物选择,但其注射的给药方式,缓慢的起效速度,频繁的入院用药、高昂的用药成本在很大程度上限制了药物的推广,故而吸入式抗体药物的临床呼声日益高涨。
本综述对哮喘机制、现有治疗药物及吸入抗体药物的开发历程进行了调查研究,以期加深对哮喘发病机制及治疗药物的全面认识,同时对吸入式抗体药物的开发必要性、开发难度、研发现状进行汇总更新。

关于干粉末吸入剂研究进展综述摘要:由于肺部具有特殊的生理结构,决定肺部给药系统将在所有给药系统中占重要地位,而干粉末吸入剂突破了常规气雾剂的局限性,开拓了新型给药系统的又一新领域,具有较好的前景,有取代常规气雾剂的趋势。
本文就粉雾剂的粉末处方,粉体性质及给药装置,体内外沉积量性质等方面进行综述。
关键词:粉雾剂,载体,粉体性质,装置,沉积量吸入粉雾剂是肺部给药的一种新剂型,肺功能,哮喘,肺气肿,慢性阻塞性肺病(COPD)和囊性纤维化(CF)等疾病[1],肺部给药具有吸收表面积大,吸收部位血流丰富,能避免肝脏首过效应,酶活性较低,上皮屏障薄及膜透性高等优点,尤其适用于蛋白多肽类药物给药、β-肾上腺素拮抗剂、抗胆碱剂、皮质激素、强效麻醉剂、抗偏头痛等小分子药物以及胰岛素、生长激素、疫苗和新的生物技术产品等大分子药物也可制成肺部给药制剂,起局部或全身治疗作用。
干粉吸入剂(DPFs)又称粉雾剂,是一种借助患者的吸气气流将装置内的药物或(和)载体微粉,经气流雾化吸入呼吸道,使药物进入治疗部位或人体肺部而起到治疗作用的一类制剂,具有所荷剂量大,易协同,生物利用度高等特点。
粉雾剂的处方一般由药物、载体和附加剂组成,附加剂包括表面活性剂、分散剂、润滑剂、抗静电剂等,主要作用是提高粉雾剂的流动性。
[2]DPIs作为肺部给药剂型可克服定量吸入气雾剂(MDIs)所带来的许多问题。
(1)抛射剂CFC类使用所造成的环境污染;(2)所能递送药物剂量小;(3)许多病人尤其是儿童不能协调自身呼吸和吸入装置的释药而无法合理用药。
对于蛋白和多肽类药物来说,干粉比液体气雾剂还有如下优势:(1)干粉的室温稳定性好,且吸入效率高;(2)干粉不易被微生物污染。
[3]在过去10年中DPI方法广泛研究用于肺部给药及呼吸道疾病治疗,甚至于可解决蛋白多肽类等生物大分子药物给药困难这一难题,可提高其生物利用度,从而提高疗效。
1.载体肺的生理结构要求药物粒子非常微细,且能渗透到肺的周边,一般认为理想的药物粒径为0.5-7μm,大于此范围粒子会在上呼吸道截留,更小的粒子易随呼吸气流排出。

干粉吸入剂吸入粉雾剂(又名粉雾吸入剂, 干粉吸入剂, 粉雾剂) 是1 种或1 种以上的微粉化药物与载体(或无) 以胶囊、或泡囊等多剂量储库形式, 经特殊的给药装置给药后以干粉形式进入呼吸道, 发挥全身或局部作用的一种给药系统。
根据给药部位的不同, 可分为经鼻用粉雾剂和经口腔用(肺吸入) 粉雾剂。
目前粉雾剂上市产品一般经口腔吸入肺部, 包括用于治疗哮喘的抗组织胺药物、支气管解痉药物和甾体激素等。
与气雾剂及雾化剂相比, 粉雾吸入剂有以下特点: ①易于使用, 患者主动吸入药粉; ②无抛射剂氟里昂, 可避免对大气环境的污染; ③药物可以胶囊或泡囊形式给药, 剂量准确, 无超剂量给药的危险; ④不含防腐剂酒精等溶剂, 对病变黏膜无刺激性; ⑤药物呈干粉状, 稳定性好, 干扰因素少, 尤其适用于多肽和蛋白类药物的给药。
粉雾剂由粉末吸入装置和供吸入用的干粉组成。
粒径大小是影响吸入的关键因素。
评价粉雾剂中粒子粒径较为合理的方法是使用空气动力学直径来表征。
一般认为, 供肺部给药合适的空气动力学直径为1~5 μm。
胰岛素粉雾剂Exubera 的撤市事件无疑对国内外多家研究机构进行的粉雾剂的研究有一定的启示, 即在产品的研制推广过程中, 应进一步重视装置的设计, 提高患者依从性,主动式DPI通过压缩空气(如Exubera@)、电动涡轮或电子振动等方式来分散药物,可避免依赖患者吸气气流的缺陷。
这些装置结构更复杂,但更利于患者使用。
因为使用了外加动力装置,所以这类DPI可实现与呼吸气流无关、更精确的药物传递。
一个理想的DPI所必须具备的条件有:①方便使用和携带,储有多次药物剂量,并能保持药物干燥,具有药物剩余量或使用量的反馈显示系统。
②不论吸气速率如何变化,每次传递的药物剂量始终精确并一致。
③理想的药物颗粒尺寸。
④适合多种药物、多种剂型。
⑤药物与装置之间的附着力极小。
⑥良好的稳定性。
【理想的粉雾剂应当具备以下条件:装置内预先装入一定剂量,使患者易于使用;在低气流量时,易于吸人;小剂量时,粉末剂量准确;对湿不敏感;处方流动性许可时,无添加剂的纯药物也可吸入;计数装置可提示患者吸入了多少剂量,无过剂量危险;重量与体积与MDI相似,且价格合理。

吸入制剂研究报告1. 背景介绍吸入制剂是一种通过呼吸道直接给药的药物剂型。
它具有快速起效、局部作用好、生物利用度高和副作用低等优点,因此在治疗呼吸系统疾病和局部病变方面得到广泛应用。
本报告将对吸入制剂的研究进行深入探讨,并通过实验数据对比和临床应用评估,探讨吸入制剂在药物研究和治疗中的潜力和前景。
2. 吸入制剂的分类根据制剂的物理状态和用途,吸入制剂可以分为固体颗粒吸入制剂、液体吸入制剂和气雾吸入制剂三类。
2.1 固体颗粒吸入制剂固体颗粒吸入制剂是将药物制备成粉末状,通过吸入装置送达到呼吸道。
它常用于治疗哮喘、慢性阻塞性肺疾病等疾病。
目前市场上常见的固体颗粒吸入制剂有干粉吸入剂和吸入霧化剂。
2.2 液体吸入制剂液体吸入制剂是将药物溶解在适当的溶剂中,以液体形式通过吸入装置给药。
它常用于治疗支气管扩张和炎症等疾病。
常见的液体吸入制剂有雾化溶液和溶液吸入产品。
2.3 气雾吸入制剂气雾吸入制剂是将药物溶解在推动气体中,通过雾化器产生气雾形式的吸入制剂。
它广泛应用于呼吸系统疾病和支气管哮喘的治疗。
常见的气雾吸入制剂有喷雾剂和喷粉剂。
3. 吸入制剂的研究方法吸入制剂的研究主要包括药物选择、制剂设计和性能评价三个方面。
3.1 药物选择药物选择是吸入制剂研究的首要问题。
要选择适合吸入给药的药物,需要考虑其化学性质、药物动力学和药物效应等因素。
对于呼吸系统疾病的治疗,一般选择具有局部作用和抗炎、抗病毒等特殊药效的药物。
3.2 制剂设计制剂设计是吸入制剂研究的核心环节。
要设计出适合吸入给药的制剂,需要考虑药物溶解度、稳定性、药物释放速度和吸入器械的兼容性等因素。
制剂设计的目标是实现药物的有效吸入和药物的合理释放,以达到疗效最大化和副作用最小化的效果。
3.3 性能评价吸入制剂的性能评价主要包括药物粒度分析、吸入性能评价和药物沉积分析等。
药物粒度分析用于评估制剂的颗粒大小和分布,以及颗粒对吸入性能和吸入深度的影响。
吸入性能评价是评估制剂的吸入特性和性能,包括吸入速度、药物沉积情况和吸入修正因子等。
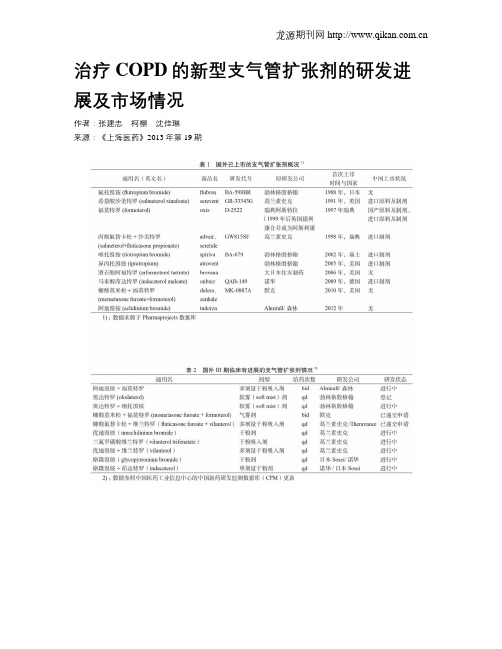
治疗COPD的新型支气管扩张剂的研发进展及市场情况作者:张建忠柯樱沈佳琳来源:《上海医药》2013年第19期摘要 COPD是常见的呼吸系统疾病。
支气管舒张剂是控制COPD症状的主要药物,支气管扩张剂又分为β2-受体激动剂、抗胆碱药和茶碱类药物。
临床研究表明,长效β2-激动剂+抗胆碱药、长效β2-激动剂+糖皮质激素合用有明显的控制COPD症状的作用,具有支气管舒张作用明显增强、作用持续时间长、不良反应减少等特点。
近年来已经成为COPD治疗药物研究开发的热点之一。
本文就其作用机制、国外上市开发现状、国外销售情况及国内研究开发进展等进行综述。
关键词支气管扩张剂β2-受体激动剂抗胆碱药 COPD中图分类号:R974 文献标识码:C 文章编号:1006-1533(2013)19-0050-06慢性阻塞性肺疾病(chronic obstructive pulmonary disease,以下简称COPD)是常见的呼吸系统疾病,严重危害患者的身心健康。
COPD是一种具有气流受限特征的可以预防和治疗的肺部疾病,其气流受限不完全可逆、呈进行性发展,与肺脏对吸入烟草烟雾等有害气体或颗粒的异常炎症反应有关[1]。
近年来,全球COPD治疗药物的市场增长势头强劲,目前临床使用治疗COPD药物主要有支气管扩张剂、广谱抗炎药物、抗氧化药物、蛋白酶抑制剂、大环内酯类抗生素和黏液调节剂等。
支气管扩张剂是控制COPD症状的主要药物,近期研究表明,支气管扩张剂有可能逆转COPD的肺功能下降[2]。
支气管扩张剂又分为β2-受体激动剂、抗胆碱药和茶碱类药物[3],以往β2-受体激动剂的主要适应证为哮喘,新在研的β2-受体激动剂多数在临床试验中已被证明COPD为主要适应证。
现就支气管扩张剂中的β2-受体激动剂和抗胆碱药的作用机制、国内外上市开发现状及销售情况等进行综述。
1 药理作用机制β2-受体激动剂(全称为:β2-肾上腺素能受体激动剂)的主要机制是其进入体内后与气道平滑肌细胞表面具有高亲和力状态的β2-肾上腺素能受体结合并相互作用,借助核苷酸偶合蛋白,激活腺苷酸活化酶,将三磷酸腺苷转变成3,5-环磷酸腺苷(cAMP),使cAMP在细胞内的浓度增加。

生物中代谢物和药物代谢的分子毒理学研究进展代谢物是人体内产生的物质,包括内源性代谢物和外源性代谢物。
内源性代谢物是指人体内自身产生的物质,如激素、氨基酸、类固醇等。
外源性代谢物则是指人体摄入的、吸入的或者经皮肤吸收的物质,如食物、化学试剂、药物等。
这些代谢物会被身体代谢掉或者排出体外,但有些代谢产物会对人体造成毒性,因此对代谢物进行分子毒理学研究非常重要。
药物代谢是指药物在体内被转化、代谢和消除的过程。
这些过程产生的代谢物可以有治疗作用,也可以有毒性作用。
因此,药物代谢的研究对于发现药物的毒性作用、寻求减少药物毒性的策略和改变药物代谢的途径都具有重要的意义。
目前,研究已经发现很多药物的代谢途径,如酯化、羟化、氧化等,而且逐渐开始关注代谢酶在药物代谢中的重要性。
在生物代谢产物和药物代谢研究中,代谢酶是一个非常重要的研究对象。
代谢酶是指参与代谢反应的酶,主要包括细胞色素P450(CYP)、葡萄糖异构酶(GIs)和转移酶等。
CYP是目前最为关注的代谢酶,负责氧化反应,可以在肝脏和肠道等组织内发挥作用。
GIs则能够在糖代谢中发挥重要作用,由于研究比较少,目前还存在很多未知的部分。
转移酶则负责尿羟化反应等,在药物代谢中发挥重要作用。
事实上,不同的酶对不同的代谢物质有不同的选择性。
例如,在选择氧化反应方式时,CYP1A2对芬顿二型的代谢选择性最高,而CYP2C19则对氨基苯环的代谢选择性最高。
这些不同的选择性表明,不同的代谢酶对不同的代谢产物的毒性可能存在一定的差异。
因此,对不同的代谢酶进行相关研究对于推动毒性研究的深入发展是再必要不过的了。
最近的研究表明,饮食和环境污染物中的多环芳族烃(PAHs)也会对代谢酶的表达再次影响。
这些化合物可以引起CYP1A1和CYP1A2的迅速升高,已被认定为这些代谢酶中最为重要的一类。
研究发现CYP1A1和CYP1A2所产生的活性中间体具有一定的毒性,可能对心血管疾病和癌症等疾病的发展有影响。
肺部吸入制剂的研究进展
陈婷婷;王东凯
【期刊名称】《中国药剂学杂志(网络版)》
【年(卷),期】2024(22)2
【摘要】目的肺部吸入给药是将原料药物以蒸汽、干粉或者气溶胶形式递送至肺部起到局部或全身治疗作用。
肺部吸入给药具有毒副作用小、生物利用度高、无肝脏首过效应、疗效好、起效快、使用方便等优点。
目前,已成为倍受关注的药物新型给药方式。
笔者通过综述肺部吸入制剂的特点、影响因素、吸入装置、临床应用等几方面来介绍肺部吸入制剂近几年的研究进展。
方法以国内外文献为依据,综述肺部吸入制剂的研究进展。
结果与结论肺部吸入制剂可以分为吸入气雾剂、吸入粉雾剂、吸入喷雾剂及吸入液体制剂四大类。
笔者综述了近年来各类肺部吸入制剂的研究进展,为今后肺部吸入制剂的进一步的创新和研发提供了新思路。
【总页数】10页(P62-71)
【作者】陈婷婷;王东凯
【作者单位】沈阳药科大学药学院
【正文语种】中文
【中图分类】R94
【相关文献】
1.胰岛素肺部吸入制剂的研究进展
2.肺部吸入纳米制剂治疗肺癌的研究进展
3.2016~2018年我院肺部吸入制剂的使用情况分析
4.吸入制剂在肺部感染性疾病治疗中的应用
5.2011—2015年南京市第一医院肺部吸入制剂的使用情况分析
因版权原因,仅展示原文概要,查看原文内容请购买。
药物经呼吸道递送研究进展近年来,开发非侵犯性药物输送技术已成为新的技术热点,随着对哮喘、肺气肿、慢性阻塞性肺病和囊性纤维化等疾病的深入了解,人们更加认识到经呼吸道给药是一种集靶向与非侵犯性于一身的药物递送系统。
本文对近年来出现的经呼吸道递送给药的新剂型进行综述。
1肺部给药新剂型肺部给药系统受到青睐,主要是因为药物经呼吸道给药,可直接进入肺部。
肺部具有较大的吸收面积,肺泡表皮薄,肺血容量丰富,肺泡与周围的毛细血管衔接紧密,药物易通过肺泡表面被快速吸收,且可避免肝脏首过作用而递送到全身,使用较为方便。
目前,除传统的气雾剂、喷雾剂外,雾化吸入方式在临床上被广泛使用,干粉吸入剂则极有可能成为今后呼吸道给药剂型的重点之一。
1.1干粉吸入方式1.1.1干粉吸入剂我国食品药品监督管理局明确规定,氯氟化碳类物质(以下简称CFCs)2007年7月1日起停止作为外用气雾剂的药用辅料使用,2010年1月1日起停止作为吸入式气雾剂的药用辅料使用。
CFCs的停止使用,会导致从药物研发到生产工艺过程等各环节的变化。
干粉吸入剂由于不含抛射剂,相比气雾剂,其优势在于:⑴避免使用氟氯烷烃抛射剂造成的环境污染;⑵给药剂量大,尤其是可用于蛋白质类、多肽类等大分子药物;⑶适用于不能协调自身呼吸的儿童和老弱患者;⑷室温稳定性好且吸入的效率高,不易被微生物污染。
2005年3月,美国FDA批准先灵葆雅公司的220μg糠酸莫米松干粉吸入剂(AsmanexTwisthaler)治疗12岁及以上哮喘患者和哮喘的一线维持治疗。
对于以往接受过支气管扩张剂单药或吸入型糖皮质激素治疗的哮喘患者,本品是目前获准以一日1次用药的吸入型哮喘控制疗法的药物。
辉瑞公司的胰岛素干粉吸入剂(商品名:Exubera),2006年1月27日获美国FDA批准进入市场,Exubera中的胰岛素为基因重组人胰岛素,以干粉的形式封装于泡囊中,通过一种特制的吸入装置,经患者口腔吸入,进入肺部吸收。
山㊀东㊀化㊀工㊀㊀收稿日期:2021-01-30㊀㊀基金项目:国家自然科学基金项目资助(81473272,81503148,82003877);中央高校基本科研业务费专项资金项目资助(2632018PT02,2632020ZD01);中国药科大学 双一流 创新团队项目资助(CPU2018GY29,CPU2018GF11);江苏省自然科学基金项目资助(BK20190557)㊀㊀作者简介:宁晨(1996 ),河南开封人,中国药科大学硕士,研究方向:药物代谢动力学;通信作者:陈西敬(1963 ),河南平顶山人,博士,教授,博士生导师,研究方向:药物代谢动力学㊂吸入药物经肺吸收过程研究进展宁晨,苏圣迪,李宁,张永杰,陈西敬(中国药科大学基础医学与临床药学学院临床药物代谢动力学研究室,江苏南京㊀211198)摘要:随着吸入给药药物不断发展,药物经肺吸收过程的研究在肺部给药药物开发过程中愈发显示出其重要性㊂本文综述目前关于药物经肺吸收的研究方法及影响因素,可以为肺部给药药物开发的过程提供参考㊂关键词:吸入药物;吸收;药代动力学中图分类号:R965.2㊀㊀㊀㊀文献标识码:A㊀㊀㊀㊀文章编号:1008-021X(2021)09-0054-03ResearchProgressontheAbsorptionProcessofInhaledDrugsThroughLungNingChen,SuShengdi,LiNing,ZhangYongjie,ChenXijing(ClinicalPharmacokineticsLaboratory,SchoolofBasicMedicineandClinicalPharmacy,ChinaPharmaceuticalUniversity,Nanjing㊀211198,China)Abstract:Withthecontinuousdevelopmentofdrugsdeliveredbyinhalation,thestudyofdrugabsorptionprocessinthelunghasbecomemoreandmoreimportantintheprocessofdrugdevelopmentforpulmonarydrugdelivery.Thisreviewsaimedtothecurrentresearchmethodsandinfluencingfactorsonthedrugabsorptionprocess.Wehopeitwillprovideaguidancefortheprocessofdrugdevelopmentforpulmonarydrugdelivery.Keywords:inhalationdrug;absorption;pharmacokinetics㊀㊀吸入药物是指通过特定的给药装置,将药物以雾化形式通过呼吸道递送到肺部后发挥局部或全身作用的一类药物㊂近年来,肺部吸入给药作为一种较传统给药方式具有多方面优越性的给药方式,正在受到越来越多的关注㊂肺部给药常用于呼吸系统疾病的治疗,如哮喘㊁慢性阻塞性肺病㊁肺纤维化㊁肺部感染等[1]㊂而通过肺部作为吸收部位使药物避免肝肠首过,发挥全身作用的药物如吸入式人胰岛素,近年来也有了巨大的突破[2-3]㊂随着需要通过吸入方式给药的的药物种类不断扩展,更好地了解肺部吸收过程及其影响因素将有助于避免药物吸入后无法成功与药物靶标接触,以及确定药物在肺部蓄积或全身暴露不足或过度暴露的可能性㊂肺部吸入药物的吸收过程研究正成为吸入药物临床前研究的重要一环㊂由于肺具有表面积巨大,肺泡壁薄,血流量高等独特的生理性质,进入肺部的药物易快速吸收继而从肺部消除,随动脉血流分布到全身,对于在肺局部发挥药效和全身作用的药物提出了不同的挑战[3]㊂对于局部作用的吸入制剂来说,药物快速的起效时间,稳定的药物释放速率,较高的气道选择性,较快的全身清除速率是十分重要的[4]㊂而对于吸入给药起全身作用的药物来说,需要在避免肺部过度暴露的同时克服肺部防御,保证足够的全身暴露水平,才能保证靶部位有效的药物浓度[5]㊂本文综述近年来肺吸入药物在肺内吸收过程的评价手段,包括通过动物在体方法,离体器官-组织法和体外细胞模型法,并对目前对于肺吸入药物分子性质,药物剂型,肺部转运体等影响肺部药物吸收过程的因素的认识进行了讨论㊂1㊀肺内吸收研究方法1.1㊀动物体内方法对肺部吸入药物的吸收的全面表征是一项复杂的任务,涉及药物沉积与溶解,纤毛清除,巨噬细胞吞噬与跨膜转运等[6]㊂由于肺部的复杂组织结构与生理状态难以在体外模拟,因此体内全动物模型仍然是吸入药物开发的关键㊂常用的吸入实验动物包括大鼠㊁小鼠㊁豚鼠㊁犬㊁猪㊁兔等[7]㊂对于口服给药的药物,通过采集给药后不同时间点外周循环血即可对胃肠道吸收进行评价㊂而就目前而言,大多数吸入剂仍是沉积在肺部发挥局部药效的药物,血浆药物浓度难以准确表征肺部药物量,因此在动物水平研究中,常添加使用支气管肺泡灌洗法与组织分布实验分别对上皮衬里液及肺组织中浓度进行测定[8]㊂由于支气管肺泡灌洗法会加入难以确定的容量误差,上皮衬里液中药物浓度可通过采用尿素,肌酐或白蛋白等内源物质进行校正[9]㊂为了考察肺内药物进入血液循环的速度,可同时采集动脉与静脉侧血液,直接通过测定血液通过肺组织前后的药物净增加量来研究肺吸收过程[10]㊂Janet等人采用大鼠左肺灌洗后,将灌洗液药物浓度以肺叶重量进行归一化,对多种蛋白药物入肺后未吸收部分药物进行测定,并比较了衬里液中与肺组织中药物相较于循环血清中药物含量比例,对药物入肺及入血过程进行了完整表征[11]㊂1.2㊀离体器官-组织法离体通气灌注肺模型(IPL)提供了一种离体情况下模拟肺呼吸与血液循环过程的方法㊂通过多次取样灌注缓冲液,可对吸入药物的吸收动力学进行描述㊂离体组织-器官法独特的优势在于可控且易于取样的药物池,可以较好的评估药物在肺内的溶解和释放过程,同时保留了药物在组织中的的扩散行为及转运体活性[12]㊂但较短的活性持续时间与不可避免的生理状况改变,仍限制此模型使用㊂此外,由于实验室间所采用模型构建方式及雾化方式不同,离体器官模型所得到的吸收速率会在相当程度上受实验操作的影响[13]㊂Cynthia等人采用了一种更简单的大鼠IPL来测量肺部的药物渗透性,即用药物溶液直接给药来替代雾化过程,用以专门以获取吸收性药物转运数据[14]㊂㊃45㊃SHANDONGCHEMICALINDUSTRY㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀2021年第50卷㊀第9期1.3㊀细胞模型细胞模型对于研究药物渗透过程及其机制具有许多优势,如高通量㊁操作性好㊁无伦理问题等㊂商品化的Calu-3,16HBE14o-,NHBE,BEAS-2B细胞等永生化的呼吸道及肺泡上皮细胞模型为评价肺吸收渗透性提供了便利[15]㊂但常用的永生肺细胞系与正常生理状态差异较大,其中对于转运体的表达和功能一直存在争议[15]㊂原代肺泡上皮细胞模型可一定程度弥补这一缺点,但也存在着获取困难,操作复杂,实验室间差异等问题[16]㊂采用气液界面培养的极化的单层细胞模型可用于模拟体内气血屏障,所形成的紧密单层细胞存在与体内近似的细胞形态[17]㊂但与评价胃肠道渗透性中以Caco-2细胞单层模型为标准不同,肺部药物渗透性研究的细胞模型的选择尚无共识㊂而这些细胞系间的差异,如来源部位,是否为癌细胞系等,均会对吸收过程产生影响㊂Cynthia及其同事采用Calu-3,16HBE14o-和NHEB三种单层细胞模型对7中化合物的渗透性进行评价,发现与Calu-3细胞相比,在16HBE14o-和NHBE中获得了更高的表观通透性系数[14]㊂2㊀影响药物经肺吸收的因素2.1㊀药物分子性质药物跨膜转运的速率与药物分子自身的性质息息相关,对于口服药物,目前公认的根据药物溶解性与肠道渗透性进行分类的BSC(BiopharmaceuticsClassificationSystem)分类模型是预测药物吸收最常见,最简单的指导原则[18]㊂对于固定的给药剂量,药物的溶解度㊁渗透性和制剂这三个因素决定着药物在体内吸收的速度与程度㊂虽然目前尚未对肺吸入药物建立起公认的生物药剂学分类系统,但对于将BSC分类扩展到肺部给药药物的研究正在不断进行[19-20]㊂药物通过气道上皮的吸收途径包括被动和主动转运机制,包括细胞旁和跨细胞转运,孔道形成,囊泡转运以及淋巴排泄[21]㊂因此药物从肺部的吸收与它们的分子量,解离度,油水分配系数,极性表面积等理化性质有关,并且与血浆蛋白结合率与组织结合率等都存在联系[22-24]㊂亲脂性小分子化合物一般被认为是通过跨膜扩散吸收的,而亲水性小分子通过细胞旁途径㊂由于与孔内衬的蛋白质和脂质的相互作用较少,离子化程度较低的水溶性小分子一般吸收得更快[25]㊂大分子药物的跨肺上皮吸收被认为由细胞旁途径或者胞吞两种方式介导[26]㊂据报道,在1 500kDa的范围内,吸收率和分子量大致为负相关关系[26]㊂然而,在一项对多种蛋白药物吸入速率的研究中并未发现分子量与吸收率之间存在联系[11]㊂2.2㊀药物制剂吸入药物沉积后,溶解㊁纤毛清除和巨噬细胞摄取三种主要的清除机制相互竞争,通过影响药物吸收过程从而影响药物的生物利用度和药效的程度与持续时间[27]㊂药物分子被吸收入血之前,大多首先要通过从制剂中释放溶解的过程㊂药物分子溶解度与渗透性通常难以改变,为了提高肺吸收速率的可控性,保证吸入治疗的安全有效,提高有效作用时间,通常会对药物进行制剂开发[28]㊂因此制剂驱动的药代动力学和分子固有的药代动力学一样值得关注㊂赋形剂,吸收促进剂,表面活性剂,药物晶体水平各种新型载体系统等都会影响药物分子进入肺后的吸收过程[29-32]㊂无定形或多晶型制剂通常会有更高的溶解度和更快的溶解速率[33]㊂表面活性剂可增加亲脂性小的药物分子的溶解度,从而提高吸收速率和吸收程度[34]㊂Masateru等以花生四烯酸与牛磺酸作为吸收促进剂,显著提高了干扰素-α和异硫氰酸荧光素4000的系统暴露[35]㊂2.3㊀转运体由于肺部的吸收面积大,血流量高和气血屏障薄,转运体对肺部药物分布的影响并不像胃肠道转运体一样受到重视[36]㊂但随着吸入药物的不断发展,学界和工业界对肺部药物转运蛋白的兴趣不断增加㊂药物进入肺组织的方式分为被动扩散和主动转运,被动扩散能力较低的亲水性或大分子药物的吸收过程更依赖于转运体的介导㊂肺部转运体可能影响药物从黏液层到肺组织的吸收,由肺组织向循环系统的分布以及药物在肺内停留的时间㊂ATSUSHI等人对原代培养的气管,支气管和肺泡上皮细胞进行了直接定量分析,全面确定了人肺组织中药物转运蛋白的蛋白表达水平[37]㊂人肺组织中有机阳离子/肉碱转运蛋白1(OCTN1)蛋白表达最高,其次是多药耐药相关蛋白1(MRP1)和乳腺癌耐药蛋白(BCRP)㊂由于目前大多数对肺转运体研究是在离体器官-组织或细胞模型中进行的,药物转运蛋白的表达水平与功能可能与人体内不同,可能会为临床应用带来阻碍[36-37]㊂3㊀结论与展望随着吸入药物种类和数量的不断扩展,越来多新型的药物经肺吸收的评价手段也正在不断进步,以帮助高质量开发肺部吸入药物㊂目前而言,吸入产品的测试重点仍在在于肺内剂量和区域沉积这些被认为是吸入产品功效,安全性和质量的最相关预测因子[27]㊂尽管吸入药物颗粒的上皮前过程在确定吸入疗法的治疗效果中至关重要,但对肺部吸收过程,包括溶解和释放,克服组织和细胞屏障的研究也同样重要[38]㊂目前,部分肺吸入制剂开发的研究中往往未涉及肺部吸收过程评价或评价方式单一,而肺部给药的独特性使得其药动学评价往往无法使用传统的药动学研究方式,应根据制剂的药效及特点运用体外,离体和体内肺吸收等多种吸收动力学评价手段从而为吸入药物开发提供足够的理论,为药物开发的安全性和有效性提供更多保证㊂参考文献[1]GRONEBERGDA,WITTC,WAGNERU,etal.Fundamentalsofpulmonarydrugdelivery[J].RespiratoryMedicine,2003,97(4):382-387.[2]KLONOFFDC.Afrezzainhaledinsulin:Thefastest-actingFDA-approvedinsulinonthemarkethasfavorableproperties[J].JournalofDiabetesScience&Technology,2014,8(6):1071-1073.[3]PATTONJS,BYRONPR.Inhalingmedicines:deliveringdrugstothebodythroughthelungs[J].NatureReviewsDrugDiscovery,2007,6(1):67-74.[4]MARKUSBJ,CHARLOTTEK,ASHISHS.Inhaledtherapyinrespiratorydisease:Thecomplexinterplayofpulmonarykineticprocesses[J].CanadianRespiratoryJournal,2018,2018:2732017.[5]KUZMOVA,MINKOT.Nanotechnologyapproachesforinhalationtreatmentoflungdiseases[J].JournalofControlledRelease,2015,219:500-518.[6]LABIRISNR,DOLOVICHMB.Pulmonarydrugdelivery.PartI:Physiologicalfactorsaffectingtherapeuticeffectivenessofaerosolizedmedications[J].BritishJournalofClinicalPharmacology,2003,56(6):588-599.[7]TANNERL,SINGLEAB.Animalmodelsreflectingchronicobstructivepulmonarydiseaseandrelatedrespiratorydisorders:translatingpre-clinicaldataintoclinicalrelevance[J].JournalofInnateImmunity,2020,12(3):203-225.[8]KONDURUN,KELLERJ,MA-HOCKL,etal.Biokineticsandeffectsofbariumsulfatenanoparticles[J].ParticleandFibreToxicology,2014,11(55):55-57.[9]RENNARDSI,BASSETG,LECOSSIERD,etal.Estimationofvolumeofepithelialliningfluidrecoveredbylavageusingureaasmarkerofdilution[J].JournalofAppliedPhysiology,1986,60(2):532-538.[10]RABINOWITZJD,LLOYDPM,MUNZARP,etal.Ultra-fast㊃55㊃宁晨,等:吸入药物经肺吸收过程研究进展山㊀东㊀化㊀工absorptionofamorphouspuredrugaerosolsviadeeplunginhalation[J].JournalofPharmaceuticalSciences,2006,95(11):2438-2451.[11]JANETC,CARVAJALI,DAVIDSONT,etal.Bioavailabilityofproteintherapeuticsinratsfollowinginhalationexposure:Relevancetooccupationalexposurelimitcalculations[J].RegulatoryToxicology&Pharmacology,2018,100:35-44.[12]TRONDEA,BOSQUILLONC,FORBESB.Theisolatedperfusedlungfordrugabsorptionstudies[M]//EhrhardtC,KimKJ.Drugabsorptionstudies:Insitu,invitroandinsilicomodels.Boston:Springer,2018:135-163.[13]SAKAGAMIM.Invitro,exvivoandinvivomethodsoflungabsorptionforinhaleddrugs[J].AdvancedDrugDeliveryReviews,2020,161/162:63-74.[14]BOSQUILLONC,MADLOVAM,PATELN,etal.Acomparisonofdrugtransportinpulmonaryabsorptionmodels:isolatedperfusedratlungs,respiratoryepithelialcelllinesandprimarycellculture[J].PharmaceuticalResearch,2017,34(1):2532-2540.[15]HUTTERV,HILGENDORFC,COOPERA,etal.EvaluationoflayersoftheratairwayepithelialcelllineRL-65forpermeabilityscreeningofinhaleddrugcandidates[J].EuropeanJournalofPharmaceuticalSciences,2012,47(2):481-489.[16]HIEMSTRAPS,GROOTAERSG,VANDERDOESAM,etal.Humanlungepithelialcellculturesforanalysisofinhaledtoxicants:Lessonslearnedandfuturedirections[J].ToxicologyinVitro,2018,47:137-146.[17]KUEHNA,KLETTINGS,CARVALHO-WODARZCDS,etal.Humanalveolarepithelialcellsexpressingtightjunctionstomodeltheair-bloodbarrier[J].ALTEX,2016,33(3):251-260.[18]AMIDONGL,LENNERNÄSHL,SHAHVP,etal.Atheoreticalbasisforabiopharmaceuticdrugclassification:Thecorrelationofinvitrodrugproductdissolutionandinvivobioavailability[J].PharmaceuticalResearch,1995,12(3):413-420.[19]EIXARCHH,HALTNER-UKOMADUE,BEISSWENGERC,etal.Drugdeliverytothelung:Permeabilityandphysicochemicalcharacteristicsofdrugsasthebasisforapulmonarybiopharmaceuticalclassificationsystem(pBCS)[J].JournalofEpithelialBiology&Pharmacology,2010,3:1-14.[20]HASTEDTJE,BÄCKMANP,CLARKAR,etal.Erratumto:ScopeandrelevanceofapulmonarybiopharmaceuticalclassificationsystemAAPS/FDA/USPWorkshopMarch16-17th,2015inBaltimore,MD[J].AAPSOpen,2016,2:4.[21]CRYANSA,SIVADASN,GARCIA-CONTRERASL.Invivoanimalmodelsfordrugdeliveryacrossthelungmucosalbarrier[J].AdvancedDrugDeliveryReviews,2007,59(11):1133-1151.[22]TAYLORG.Theabsorptionandmetabolismofxenobioticsinthelung[J].AdvancedDrugDeliveryReviews,1990,5(1/2):37-61.[23]TRONDEA,NORDÉNB,JEPPSSONAB,etal.Drugabsorptionfromtheisolatedperfusedratlung-correlationswithdrugphysicochemicalpropertiesandepithelialpermeability[J].JournalofDrugTargeting,2003,11(1):61-74.[24]TRONDEA.PulmonaryDrugAbsorption:Invitroandinvivoinvestigationsofdrugabsorptionacrossthelungbarrieranditsrelationtodrugphysicochemicalproperties[M].ActaUniversitatisUpsaliensis,2002.[25]PATTONJS,FISHBURNCS,WEERSJG.Thelungsasaportalofentryforsystemicdrugdelivery[J].ProceedingsoftheAmericanThoracicSociety,2004,1(4):338-344.[26]PATTONJS.Mechanismsofmacromoleculeabsorptionbythelungs[J].AdvDrugDelivRev,1996,19(1):3-36.[27]FORBESB,RICHERNH,BUTTINIF.Dissolution:Acriticalperformancecharacteristicofinhaledproducts?[M]//NokhodchiA,MartinGP.PulmonaryDrugDelivery:AdvancesandChallenges.Chichester:JohnWiley&Sons,Ltd.,2015:223-240.[28]GESSLERT,SEEGERW,SCHMEHLT.Inhaledprostanoidsinthetherapyofpulmonaryhypertension[J].JournalofAerosolMedicineandPulmonaryDrugDelivery,2008,21(1):1-12.[29]PILCERG,AMIGHIK.Formulationstrategyanduseofexcipientsinpulmonarydrugdelivery[J].InternationalJournalofPharmaceutics,2010,392(1/2):1-19.[30]XIANMZ,MARTINGP,MARRIOTTC,etal.Thecontrolleddeliveryofdrugstothelung[J].InternationalJournalofPharmaceutics,1995,124(2):149-164.[31]ZHANGJ,LVH,JIANGK,etal.Enhancedbioavailabilityafteroralandpulmonaryadministrationofbaicaleinnanocrystal[J].InternationalJournalofPharmaceutics,2011,420(1):180-188.[32]ABDELAZIZHM,GABERM,ABD-ELWAKILMM,etal.Inhalableparticulatedrugdeliverysystemsforlungcancertherapy:Nanoparticles,microparticles,nanocompositesandnanoaggregates[J].JournalofControlledRelease,2018,269:374-392.[33]DURETC,WAUTHOZN,SEBTIT,etal.Soliddispersionsofitraconazoleforinhalationwithenhanceddissolution,solubilityanddispersionproperties[J].InternationalJournalofPharmaceutics,2012,428(1/2):103-113.[34]WIEDMANNTS,BHATIAR,WATTENBERGLW.Drugsolubilizationinlungsurfactant[J].JournalofControlledRelease,2000,65(1):43-47.[35]MIYAKEM,MINAMIT,YAMAZAKIH,etal.Arachidonicacidwithtaurineenhancespulmonaryabsorptionofmacromoleculeswithoutanyserioushistopathologicaldamages[J].EuropeanJournalofPharmaceuticsandBiopharmaceutics,2017,114:22-28.[36]BOSQUILLONC.Drugtransportersinthelung-dotheyplayaroleinthebiopharmaceuticsofinhaleddrugs?[J].JournalofPharmaceuticalSciences,2010,99(5):2240-2255.[37]SAKAMOTOA,MATSUMARUT,YAMAMURAN,etal.Quantitativeexpressionofhumandrugtransporterproteinsinlungtissues:Analysisofregional,gender,andinterindividualdifferencesbyliquidchromatography–tandemmassspectrometry[J].JournalofPharmaceuticalSciences,2013,102(9):3395-3406.[38]UNGAROF,ANGELOID,MIROA,etal.EngineeredPLGAnano-andmicro-carriersforpulmonarydelivery:Challengesandpromises[J].JournalofPharmacy&Pharmacology,2012,64(9):1217-1235.(本文文献格式:宁晨,苏圣迪,李宁,等.吸入药物经肺吸收过程研究进展[J].山东化工,2021,50(9):54-56.)㊃65㊃SHANDONGCHEMICALINDUSTRY㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀2021年第50卷。
干粉吸入器及其进展吸入给药的主要目的是将药物直接靶向至病灶以提高疗效、降低副作用。
当前,吸入给药是治疗哮喘病的首选途径。
在WHO最近发布的《哮喘全球负担》报告中指出,全球当前有3亿哮喘患者,而每年死于该病的人数高达18万。
预计到2025年,哮喘病患者将新增10亿。
而吸入途径还可用于流感、肺气肿、肺癌以及其他肺部感染等的治疗,其中最引人注目的当是作为蛋白和多肽类药物的颇具希望的非注射给药途径。
吸入疗法主要借助于雾化吸入器(nebulizer,NEB)、定量吸入器(pressured metered-dose inhaler,pMDI)和干粉吸入器(dry powder inhaler,DPI)等器具和技术来进行(注:在本文xxNEB、pMDI和DPI既可以指给药器具,又可以指给药剂型)。
1概述雾化吸入器虽然问世最早,但是诸如笨重、用药时间长、不易携带、昂贵、转运剂量变化大、需要动力供应等缺点大大限制了其应用。
自1956年的Medihaler问世以来,pMDI 已经成为使用最为广泛的吸入器,80%以上的哮喘患者均采用此法;但是pMDI具有诸如触发与吸入协同困难、含有氟利昂作抛射剂对臭氧层的破坏作用等缺点。
1987年签署的蒙特利尔条约要求逐步淘汰氯氟碳化合物(CFC),至2005年全面禁止使用氯氟烷抛射剂。
为此,无氯氟烷抛射剂吸入剂的开发在近年来得到了前所未有的关注,主要着重于以氢氟烷(HFA)作为抛射剂的pMDI和干粉吸入剂的研究上。
HFA-134a和HFA -227的研究虽然表明是安全的,但是其溶剂性能很差,对传统使用的表面活性剂(用于助悬)几乎不溶,因而HFA很不利于解决混悬液中药物颗粒的稳定性问题。
另外,新的pMDI 具有不同的等效剂量,这使得医师难以作出选择,因而迫切需要分清pMDI产品的临床等效性以及减少HFA处方重组出现的问题。
而DPI因不含抛射剂,越来越引起人们的关注,其开发格外令人期待。