偶联反应小结
- 格式:ppt
- 大小:2.81 MB
- 文档页数:98

金属催化偶联反应小结一、Buchwald_Hartwig反应,布赫瓦尔德-哈特维希偶联反应(Buchwald-Hartwig cross coupling)Buchwald–Hartwig芳胺化反应是非常常用的由芳基卤代物或芳基磺酸酯制备芳胺的反应。
此反应的主要特点是利用催化量的钯和富电子配体进行催化反应。
另外强碱(如叔丁醇钠)对于催化循环是至关重要的。
二、Cadiot-Chodkiewicz偶联反应一价铜作为催化剂,端基炔和炔基卤化物反应生成非对称性二炔的反应三、羰基化偶联反应 Carbonylative Cross Coupling利用一氧化碳能插入碳-金属键这一特性,在偶联反应中同时引入羰基,生成酯,酰胺,酮,醇等产物。
在有机合成中是一个非常有效率的反应。
常用于钯催化偶联反应。
我们知道一氧化碳很容易插入碳-金属键之间。
用钯催化剂,有基卤化物,一氧化碳,醇一起反应会生成酯。
用胺代替其中的醇会得到酰胺,用氢源替代醇会得到醛,换成有机金属试剂就会得到酮。
四、Castro–Stephens偶联反应(Castro-Stephens Coupling)炔化亚铜与芳卤发生交叉偶联,生成二取代炔及卤化亚铜。
这个反应由 C. E. Castro 和 R. D. Stephens 在 1963 年发现。
现在被大家所熟知的是其改良法Sonogashira偶联.五、Chan–Lam C–X偶联反应,Chan-Lam-Evans偶联反应(Chan-Lam-Evans Coupling)含有NH/OH/SH基团的底物在弱碱条件下,在空气中通过醋酸铜催化,与有机硼酸化合物氧化交叉偶联进行芳基,烯基和烷基化的反应。
六、交叉脱氢偶联反应(Cross Dehydrogenative Coupling (CDC))在两个底物的C-H被活化的情况下,利用氢acceptor(氧化剂)的作用,进行的交叉型C-C偶联反应。
如果氧化剂是分子状的氧气的话,理论上生成的副产物就是水而已,这样这样的反应就是非常优秀的绿色化学。


偶联反应名词解释偶联反应是有机化学中用于将两种有机化合物联合制备新物质的重要方法,是近代化学研究中常见的一种反应。
偶联反应是经典的有机反应,以其特有的反应机理和广泛的应用范围而闻名。
一般来说,偶联反应涉及将两种不同的有机物,通过一种中间过渡物质形成新的产物物质。
例如,部分偶联反应使用光催化剂当做一种特殊的中间过渡物质来联结反应物,从而产生新的物质。
一般来说,偶联反应使两种不同的有机分子在活性位点发生反应,经过一系列反应步骤后,新的物质产生。
例如,偶联反应可用于合成芳香族烃、含硫化合物和脂肪酸类有机物等。
偶联反应的机理可以分为可分子机理和不可分子机理两大类。
可分子机理也称为海森堡机理,是一种经典机理,通常将偶联反应作为一种可分子机理进行研究。
可分子机理的基本步骤是,反应物分子在相互作用过程中,共价键被强化,由此产生的激发态分子重组,两个原子被从共价键中分离,并产生新的共价键,最后形成反应产物,而反应速率取决于原子间的距离与激发态的能量。
不可分子机理也称为上下机理,是一种以分子像的方式进行研究的机理。
不可分子机理的基本原理是,反应物分子两个活性位点间的距离很近,分子形状接近,可以形成共价键。
中间位置处有一个活性中间物质,可以催化反应物形成活性位点,从而形成新的产物。
在有机合成和自然产物的生物合成中,偶联反应扮演着重要的角色。
偶联反应的发展为有机化学的发展和发现一些新的有机化合物奠定了基础,也加深了人们对有机物分子结构和反应机理的理解。
另外,偶联反应还可以应用于生物反应中,例如抗癌药物的合成、酶催化反应和活性生物分子的合成等。
此外,还可以应用于材料科学中,用于合成一些导电性良好的新型材料,以及其他各种用途。
综上所述,偶联反应是有机化学中的一种重要的反应形式,以其特有的反应机理和广泛的应用范围而闻名。
偶联反应可以用于有机合成,也可用于生物反应,还可以应用于材料科学中,具有广泛的应用前景。

偶联反应[编辑]偶联反应,也写作偶合反应或耦联反应,是两个化学实体(或单位)结合生成一个分子的有机化学反应。
狭义的偶联反应是涉及有机金属催化剂的碳-碳键形成反应,根据类型的不同,又可分为交叉偶联和自身偶联反应。
在偶联反应中有一类重要的反应,RM( R = 有机片段,M = 主基团中心)与 R'X的有机卤素化合物反应,形成具有新碳-碳键的产物R-R'o [1]由于在偶联反应的突出贡献,根岸英一、铃木章与理查德赫克共同被授予了 2010年度诺贝尔化学奖。
[2]偶联反应大体可分为两种类型:«交叉偶联反应:两种不同的片段连接成一个分子,如:溴苯(PhBr)与氯乙烯形成苯乙烯(PhCH=CH2)。
自身偶联反应:相同的两个片段形成一个分子,如:碘苯(PhI )自身形成联苯(Ph-Ph)o反应机理[编辑]偶联反应的反应机理通常起始于有机卤代烃和催化剂的氧化加成。
第二步则是另一分子与其发生金属交换,即将两个待偶联的分子接于同一金属中心上。
最后一步是还原消除,即两个待偶联的分子结合在一起形成新分子并再生催化剂。
不饱和的有机基团通常易于发生偶联,这是由于它们在加合一步速度更快。
中间体通常不倾向发生3 -氢消除反应° [3]在一项计算化学研究中表明,不饱和有机基团更易于在金属中心上发生偶联反应。
[4]还原消除的速率高低如下:乙烯基-乙烯基> 苯基-苯基> 炔基-炔基> 烷基-烷基不对称的R-R'形式偶联反应,其活化能垒与反应能量与相应的对称偶联反应R-R与R' -R'的平均值相近,如:乙烯基—乙烯基> 乙烯基—烷基> 烷基—烷基。
另一种假说认为,在水溶液当中的偶联反应其实是通过自由基机理进行,而不是金属-参与机理。
[5]§崔化剂[编辑]偶联反应中最常用的金属催化剂是钯催化剂,有时也使用镍与铜催化剂。
钯催化剂当中常用的如:四(三苯基膦)钯等。


钯催化的偶联反应(1)背景五十年前,钯刚刚进入有机化学家的视野,当时的C-C键形成还主要依赖化学计量的反应——活泼的亲核试剂与亲电试剂反应。
上世纪六十年代末,Richard Heck 首先将钯引入了有机化学反应,在催化量的二价钯存在下完成了芳香化合物的偶联,这标志着在钯催化C-C键形成反应这一领域取得的引人注目的突破。
在接下来的很多年中,研究人员报道了更多钯介导的C-C偶联反应。
如今,钯催化的偶联反应为有机合成提供了很有用并且应用广泛的工具,其中有代表性的有Heck反应,Negishi反应和Suzuki反应,2010年的诺贝尔化学奖肯定了这种发现的重要性。
# 研究进展钯催化具有与众不同的特点与优势。
温和的反应条件减小了副产物的生成,因此可以完成高的立体选择性。
并且,钯催化的反应对于底物的官能团都有很好的耐受性,因此,相比于传统的化学计量的反应,利用钯催化可以用更少的步骤构建复杂的有机分子。
此外,配体和助催化剂可以对反应活性进行微调。
有机钯化合物对水和空气的高稳定性(除一些磷配合物外)使反应更容易加工,并且降低了成本。
那么,钯催化的偶联反应应用广泛也是情理之中的。
事实上,除了在均相溶液中的钯催化剂外,衍生出一系列全新的、高选择性的催化剂,近年来已经出现了高效的的多相(负载)钯催化剂,他们可以重复使用,因此在偶联反应中有很好的经济效益。
显然,很多交叉偶联反应已经足够高效地在工业上进行吨量级的合成,在过去的二十年中,这些钯催化的偶联反应已经从实验室中的克级合成转变为制药、农化和精细化工行业的吨级生产。
和所有钯催化的C-C偶联反应一样,Heck 反应与Heck-Matsuda 反应(Scheme 1.2)始于芳基卤化物对钯的氧化加成,但是如果另一个底物是烯烃,Heck反应的机理明显不同。
通常的偶联反应都在均相条件下进行,使用的膦配体要求隔绝氧气,而Matsuda 和 Kikukawa 将芳基卤化物替换为芳香重氮盐,这一优化条件使Heck反应能够兼容含氧的条件,不需要使用对氧气敏感的有机膦配体。

反应名称--年代--反应物A--反应物B --类型--催化剂--注Wurtz反应1855 R-X sp³ 自身偶联NaGlaser偶联反应1869 R-X sp自身偶联CuUllmann反应1901 R-X sp² 自身偶联CuGomberg-Bachmann反应1924 R-N2X sp² 自身偶联以碱作介质Cadiot-Chodkiewicz偶联反应1957炔烃sp R-X sp交叉偶联Cu 以碱作介质Castro-Stephens偶联反应1963 R-Cu sp R-X sp² 交叉偶联Kumada偶联反应1972 R-MgBr sp²;、sp³ R-X sp² 交叉偶联Pd 或NiHeck反应1972烯烃sp² R-X sp² 交叉偶联Pd以碱作介质Sonogashira偶联反应1973炔烃sp R-X sp³ sp² 交叉偶联Pd、Cu 以碱作介质Negishi偶联反应1977 R-Zn-X sp² R-X sp³ sp² 交叉偶联Pd或NiStille偶联反应1977 R-SnR3 sp² R-X sp³ sp² 交叉偶联PdSuzuki反应1979 R-B(OR)2 sp² R-X sp³ sp² 交叉偶联Pd以碱作介质Hiyama偶联反应1988 R-SiR3 sp² R-X sp³ sp² 交叉偶联Pd以碱作介质Buchwald-Hartwig反应1994 R2N-R SnR3 sp R-X sp² 交叉偶联Pd N-C偶联Fukuyama偶联反应1998 RCO(SEt) sp2 R-Zn-I sp3 交叉偶联Pd。

有机化学四大偶联反应有机化学是研究碳元素及其化合物的科学,是化学学科中的一个重要分支。
在有机化学中,有机合成反应是一项重要的研究内容。
有机化学四大偶联反应是有机合成中常用的四种反应类型,包括:Suzuki偶联反应、Stille偶联反应、Heck偶联反应和Sonogashira 偶联反应。
这些反应在有机合成中起到了重要的作用,为有机化学的发展做出了巨大的贡献。
我们来介绍Suzuki偶联反应。
Suzuki偶联反应是一种重要的芳香化合物合成方法,它是基于钯催化剂的反应。
该反应将有机硼酸酯和有机卤化物或磺酸酯作为底物,在适当的条件下,经过交叉偶联反应,生成目标产物。
Suzuki偶联反应在药物合成和材料科学中有着广泛的应用,可以高效地合成出具有重要生物活性和物理性质的化合物。
接下来是Stille偶联反应,它是一种重要的碳-碳键形成反应。
该反应是通过钯催化剂催化下的亲核取代反应来实现的,底物包括有机卤化物和有机锡化合物。
Stille偶联反应具有底物适用范围广、反应条件温和等优点,在天然产物的合成和药物研发中得到了广泛的应用。
第三种偶联反应是Heck偶联反应,它是一种重要的芳香化合物合成方法。
该反应是通过钯催化下的芳香取代反应实现的,底物包括有机卤化物和烯烃。
Heck偶联反应是一种高效、高选择性的反应,在药物研发和天然产物的合成中得到了广泛的应用。
最后是Sonogashira偶联反应,它是一种重要的炔烃合成方法。
该反应是通过钯催化下的炔烃与有机卤化物的偶联反应实现的。
Sonogashira偶联反应可以高效地合成炔烃化合物,对于合成具有炔烃结构的药物和功能材料具有重要意义。
在有机化学四大偶联反应中,每一种反应都有其独特的应用领域和优点。
这些反应的发展和应用为有机合成提供了新的思路和方法,为有机化学的发展做出了重要贡献。
总结起来,有机化学四大偶联反应包括Suzuki偶联反应、Stille偶联反应、Heck偶联反应和Sonogashira偶联反应。


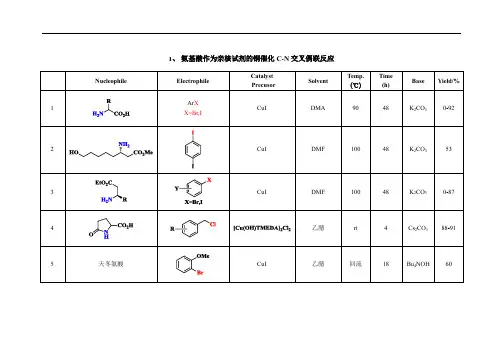
Chan-Lam偶联反应最全总结近年来, 过渡金属催化的氧化交叉偶联反应已经被证明是构建碳-碳键、碳-杂键最有效和最直接的策略之一, 在医药、农药、染料及日用化工品等领域中都起到了非常重要的作用[1,2]. 1998年, Chan、Evans和Lam三个课题组[3]分别独立地报道了铜盐促进下不同杂原子作为亲核试剂与芳基硼酸进行偶联反应构建碳-杂键的方法. 与其它过渡金属(如钯、镍等)参与的偶联反应相比, 此类反应具有铜盐价格便宜(铜金属约0.01美元/克, 而钯金属约350美元/克)、反应条件温和、不需要复杂配体、操作简便、在空气氛围中搅拌就能顺利进行等特点[4]. 因此, 铜盐促进不同原子类型的亲核试剂与有机硼试剂进行的偶联反应被称之为Chan-Evans-Lam偶联反应[5], 此反应由于在空气中就能进行, 又被称为open- flask Chemistry (Eq. 1).普遍认为Chan-Evans-Lam反应的机理是(Scheme1): 芳基硼酸首先与二价铜络合物E发生转金属形成中间体A和硼酸. 中间体A与亲核试剂(RXH)配位得到络合物B. 在氧气存在下, 络合物B被氧化形成三价铜中间体C. 中间体C发生还原消除生成偶联产物(Ar—X—R)和一价铜络合物D. 络合物D在氧气和水的作用下转化成二价铜络合物E, 从而完成催化循环. 另外一种可能的反应机理则认为: 亲核试剂(RXH)进攻有可能发生在二价铜与芳基硼酸转金属之前. 尽管很多有机化学家如Stahl[6], Norrby[7], Das[8]等通过密度泛函理论(DFT)对反应机理做了深入的化学计算研究, 但目前Chan- Evans-Lam反应的机理仍无明确定论.自从反应被发现以来, 引起了很多有机化学家及生物化学家的广泛关注, 在有机合成中不仅被广泛地应用于构建C—N, C—O, C—S, C—C键, 也成功地应用于复杂天然产物的全合成中, 特别是在药物分子的结构修饰中占有重要的地位. Lam 小组[9]在2011年和Wu小组[10]在2012年分别对Chan-Evans-Lam 偶联反应的最新研究进展进行了综述, 而之后这类偶联反应的研究并无相关综述的报道. 但近些年铜参与的Chan-Evans- Lam偶联反应在碳-杂键交叉偶联化学的应用中又取得了很多新的进展. 因此, 本文针对2012 年之后通过Chan-Evans-Lam反应构建C—N, C—O, C—S, C—C键的最新进展进行了综述, 主要涉及不同原子(氮、氧、硫和碳原子)的亲核试剂与有机硼试剂进行偶联反应构建C—N, C—O, C—S和C—C键的新策略, 以及Chan- Evans-Lam反应在复杂天然产物和生物碱全合成中的一些应用.1.1 芳基硼试剂参与的C—N键偶联反应1.2 烯基硼酸参与的C—N键偶联反应1.3 烷基硼试剂参与的C—N键偶联反应2.1 芳基硼试剂参与C—O键偶联反应2.2 烯基硼试剂参与的C—O键偶联反应3.1 硫酚参与的C—S键偶联反应4.1 TMSCF3参与的C—C键偶联反应4.2 丙二酸酯衍生物参与的C—C键偶联反应恶性疟原虫是发展中国家非常普遍引起疟疾的一种致病性寄生物. 2014 年, Bogyo 小组[63]鉴定了一类可以选择性抑制这类疾病的帽型多肽123. 这类帽型多肽具有很好的生物活性(IC50=35 nmol/L). 为了进一步研究这类多肽的生物活性, Bogyo小组以Boc保护的3-溴苯丙氨酸120为起始原料通过9步合成了该多肽. 其中在关键成环步骤化合物121到化合物122合成中, 就使用Chan-Evans-Lam反应进行关环生成二苯醚骨架, 脱除Boc保护基得到目标多肽123。
Stille偶联反应旧闻重发,温故知新Stille偶联反应是指有机锡试剂和卤代物或类卤代物在钯催化下进行CC键偶联的反应。
此反应对卤代物的R基团限制较少。
反应的条件比较多,另外正如下方介绍的卤代物和有机锡试剂种类很多,互相进行偶联,因此此反应可以合成的产物也很多。
反应一般在无水无氧惰性环境中进行,反应条件较温和(接近中性条件),等计量的Cu(I)可以提高反应的专一性及反应速率。
氧气会使钯催化剂发生氧化,并导致有机锡化合物发生自身偶联。
本反应的缺点就是,有机锡试剂毒性较大,而且其极性较小,在水中的溶解度很低。
虽然有机锡试剂很稳定,但是由于与Stille偶联反应效果几乎相同的Suzuki反应的发现,Suzuki 反应使用有机硼酸及其衍生物,使用方便并且没有有机锡试剂的那些缺点,因此此反应的重要性迅速降低。
对于一些不易制备得到的硼酸(如2-吡啶硼酸),可以用有机锡试剂代替,可以得到很好的效果。
一些简单的亲电试剂和有机锡试剂:添加LiCl能加速反应,可以解释为通过形成较强的Sn-Cl键而加速金属迁移化。
而使用过量的配体会抑制金属迁移化步骤。
在有些反应中,添加CuI作为过量配体的络合剂能缓解其对迁移金属化的抑制作用。
也可能是由于有机铜有作为中间体促进反应。
使用电中性的配体(比如想三苯基砷Ph3As)效果也很好。
CsF等氟源也能增加反应速度,产生的溶解性低的氟化锡有利于反应进行。
反应结束后体系中的有机锡化合物,经常在用柱层析分离时发生拖尾使纯化困难。
在体系中加入KF水溶液,搅拌一晩能使锡变成氟化锡。
此操作能使纯化和分离简化一些。
反应机理反应机理分为四个历程:氧化加成,金属迁移,异构化,还原消除。
金属迁移是反应的决速步骤。
添加剂能使金属迁移过程加速而提高反应速度【Angew. Chem. Int. Ed. 2004, 43, 4704.】。
锡的金属迁移速度:alkynyl > alkenyl > aryl > allyl benzyl > α-alkoxyalkyl > alkyl ,因此三丁基锡或三甲基锡上的甲基和丁基对反应性没有影响。
偶联反应名词解释偶联反应又称两步反应,是指在一个实验过程中发生两步化学反应形成最终产物,因此又被称为“两步反应”。
这种反应是大多数化学反应当中十分重要的,它可以帮助我们更好地去揭示反应机理并计算反应物之间的相互作用以及产物与反应物之间的相互作用。
偶联反应可以被分为四类:单配位偶联反应、多配位偶联反应、尖峰偶联反应和五步偶联反应。
单配位偶联反应指的是其中一种反应物在另一种反应物的一个官能团上形成一个单配位的键,然后使反应物的另一个官能团在另一种反应物的另一个官能团上形成另一个键,形成一个新的物质。
多配位偶联反应是指反应物间形成多配位键,这些键可以是金属-碳键、金属-氮键或者碳-氮键之类。
尖峰偶联反应指的是在一个实验过程中反应物可以形成一个共价键或一个非共价键,这可以将它们带到一个反应物,从而形成一个新的产物。
最后,五步偶联反应是指在一个实验过程中反应物通过一系列的反应,最终形成一个最终的产物。
这些四种偶联反应的执行机理不同,由此可以反映出反应的不同动力学以及化学性质。
对不同动力学行为以及化学性质,科学家们也开发出一系列有效的研究方法,以便更好地探究不同反应之间的关系,并优化反应条件以及产物的结构。
在实际应用中,偶联反应更加丰富了化学实验的可能性,可以将一系列的单步反应组合起来,使复杂的反应变得更加有效,节约时间和空间。
例如,有些药物的合成只能通过偶联反应实现,香烟的吸入需要偶联反应的产物来实现,也有些食品类的特性得益于偶联反应的体现。
总之,偶联反应在现今的化学反应当中具有重要的地位,它提供了一种高效、精准、可控的科学反应机制,被广泛应用于药物合成、材料研究、工业生产等多个领域。
此外,偶联反应还能够发现其他未被发现的新反应,为今后反应的研究提供重要的思路。
碳碳偶联反应总结简介碳碳偶联反应是有机合成中一种重要的反应,通过将两个碳原子连接起来形成碳-碳键。
这种反应具有高效、可重复等特点,被广泛应用于药物合成、材料科学等领域。
本文将对碳碳偶联反应的一些常见机制和应用进行总结。
常见的碳碳偶联反应Suzuki 偶联Suzuki 偶联反应是最为常见的碳碳偶联反应之一。
该反应是通过钯催化剂催化下的芳基硼酸和芳基卤化物之间的偶联反应。
Suzuki 偶联反应具有反应条件温和、底物选择广泛等优点,在制药领域得到广泛应用。
反应机制如下:芳基卤化物 + 芳基硼酸→ 偶联产物 + 钯催化剂 + 鹰嘴酸Heck 偶联Heck 偶联是一种通过钯催化剂催化下烯烃与芳基卤化物之间的偶联反应。
该反应具有高效、选择性高等优点,在有机合成中广泛应用。
Heck 偶联反应可以合成复杂的碳骨架,并且由于其底物选择性广泛,可以适用于不同类型的有机分子。
反应机制如下:烯烃 + 芳基卤化物→ 偶联产物 + 钯催化剂 + 鹰嘴酸Negishi 偶联Negishi 偶联反应是通过钯催化剂催化下的有机锌试剂和有机卤化物之间的偶联反应。
Negishi 偶联反应具有底物适用范围广、官能团兼容性好等特点,被广泛应用于有机合成中。
反应机制如下:有机锌试剂 + 有机卤化物→ 偶联产物 + 钯催化剂 + 锌盐碳碳偶联反应在药物合成中的应用碳碳偶联反应在药物合成中具有重要的应用价值。
通过合理的反应设计和催化体系选择,可以高效地合成药物分子的碳骨架。
以下是一些具体案例:1.使用 Suzuki 偶联反应合成药物 Artesunate 的碳骨架。
该反应在碳-碳偶联的过程中使用了催化的芳基硼酸和卤代芳烃。
2.使用 Heck 偶联反应合成抗癌药物 Erlotinib 的碳骨架。
该反应通过钯催化剂催化下的烯烃与芳基卤化物之间的偶联反应进行。
3.使用 Negishi 偶联反应合成药物 Palbociclib 的碳骨架。
该反应通过钯催化剂催化下的有机锌试剂和有机卤化物之间的偶联反应进行。
suzuki偶联反应总结报告模板suzuki偶联反应总结报告模板一、引言suzuki偶联反应是有机合成领域中一种重要的金属催化偶联反应。
在过去的几十年里,该反应已成为人们合成有机化合物中不可或缺的工具。
本文将从深度和广度两个层面对suzuki偶联反应进行全面评估,并据此撰写一篇有价值的文章。
二、基础知识概述1. suzuki偶联反应的原理:suzuki偶联反应是通过钯催化下,将含有芳基硼酸酯和卤代芳烃两种物质进行偶联,生成芳香烃的合成方法。
2. suzuki偶联反应的重要性:该反应能够高效实现碳-碳键的构建,为合成复杂有机分子提供了一种可行的途径。
三、反应条件探讨1. 底物选择:首先需要根据目标化合物的结构特点选择合适的底物,包括芳基硼酸酯和卤代芳烃的类型和取代基的位置。
2. 钯配体选择:不同的钯配体对反应的速率和产率有很大影响,需要根据具体需求进行选择。
3. 溶剂选择:溶剂的选择对反应速率和产率也具有重要作用,需要根据反应体系的特点进行选择。
四、反应机理分析1. cis-作用:suzuki偶联反应的反应机理中,cis-作用是合成芳烃的关键步骤之一。
通过分析该步骤的反应路径,可以更好地理解反应的原理。
2. 过渡态的形成:过渡态的形成对于反应速率和产率同样至关重要,本节将详细描述过渡态的生成机制和影响因素。
五、反应优化与改进1. 温度和压力的调节:温度和压力是影响反应速率和产率的重要因素,通过调节反应条件可以得到更好的结果。
2. 醇配体的引入:醇配体的引入可以提高反应的活性和选择性,但具体的影响机制尚待深入研究。
六、个人观点和理解1. suzuki偶联反应在有机合成中的重要性:suzuki偶联反应为有机合成提供了一种高效、可控的合成策略,对于合成药物、天然产物以及功能分子具有重要的应用价值。
2. 钯配体的研究:钯配体的选择和设计是优化suzuki偶联反应的关键,未来的研究中应加强对钯配体的研究,以提高反应的效率和选择性。
Coupling Reactions偶聯反應也作偶合反應、偶連反應、耦聯反應、氧化偶聯,是兩個化學實體(或單位)結合生成一個分子的有機化學反應。
狹義的偶聯反應是涉及有機金屬催化劑的碳-碳鍵生成反應,根據類型的不同,又可分為交叉偶聯和自身偶聯反應。
常見的偶聯反應包括:反應名稱年代反應物A 反應物B 類型催化劑注Wurtz反應1855 R-X sp³自身偶聯NaGlaser偶聯反應1869 R-X sp 自身偶聯Cu Ullmann反應1901 R-X sp²自身偶聯Cu Gomberg-Bachmann反應1924 R-N2X sp²自身偶聯需鹼Cadiot-Chodkiewicz偶聯反應1957 炔烴sp R-X sp 交叉偶聯Cu 需鹼Castro-Stephens偶聯反應1963 R-Cu sp R-X sp²交叉偶聯Kumada偶聯反應1972 R-MgBr sp²、sp³R-X sp²交叉偶聯Pd或NiHeck反應1972 烯烴sp²R-X sp²交叉偶聯Pd 需鹼Sonogashira偶聯反應1973 炔烴sp R-X sp³sp²交叉偶聯Pd、Cu 需鹼Negishi偶聯反應1977 R-Zn-X sp²R-X sp³sp²交叉偶聯Pd或NiStille偶聯反應1977 R-SnR3sp²R-X sp³sp²交叉偶聯PdSuzuki反應1979 R-B(OR)2sp²R-X sp³sp²交叉偶聯Pd 需鹼Hiyama偶聯反應1988 R-SiR3sp²R-X sp³sp²交叉偶聯Pd 需鹼Buchwald-Hartwig反應1994 R2N-RSnR3sp R-X sp²交叉偶聯PdN-C偶聯Fukuyama偶聯反應1998 RCO(SEt) sp2R-Zn-I sp3交叉偶聯Pd。