碱金属的原子结构
- 格式:ppt
- 大小:1.63 MB
- 文档页数:19

碱金属元素知识点总结碱金属元素是指周期表中第一族元素,包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr)。
这些元素具有相似的化学性质,如低密度、低熔点、高电导率等特点。
以下是对碱金属元素的一些重要知识点进行总结。
1. 物理性质:碱金属元素在室温下大多为银白色金属,具有低密度和低熔点。
它们是非常活泼的金属,可以用刀片切割,并且能够导电和导热。
2. 原子结构:碱金属元素的原子结构特点是外层电子数为1,在元素周期表中处于第1A族。
这使得碱金属元素容易失去外层电子,形成带正电荷的离子。
3. 化学反应:碱金属元素与非金属元素反应时,倾向于失去一个电子形成带正电荷的离子。
与水反应时,会产生氢气并生成碱性溶液。
例如钠与水反应的化学方程式为2Na + 2H2O → 2NaOH + H2。
4. 反应性:碱金属元素的反应性逐渐增加,从锂到钫依次增强。
这是由于原子半径的增加和电子层的扩展导致外层电子离子化能的降低。
5. 合金:碱金属元素可以与其他金属形成合金。
合金通常具有更好的机械性能和导电性能。
例如,钠钾合金(NaK)被广泛用作热传导介质和储热材料。
6. 应用:碱金属元素在许多领域有广泛的应用。
锂广泛用于电池、合金和药物制剂;钠用于制备肥皂、玻璃和金属处理;钾广泛用于农业肥料和肥皂;铷和铯用于原子钟和激光技术;钫由于其放射性特性,目前尚无实际应用。
7. 危险性:碱金属元素具有一定的危险性。
由于其与水反应放出氢气,可能引发爆炸。
此外,碱金属元素的化合物有毒,对人体和环境有一定危害。
8. 用途举例:锂可用于制造锂离子电池,是电动汽车和便携式电子设备的重要能源;钠在化工工业中用于制备氢氧化钠和制备其他化合物;钾广泛用于农业肥料,促进作物生长;铷和铯在激光技术和通信领域有应用;钫目前主要用于科学研究。
9. 碱金属离子:碱金属元素失去一个外层电子后会形成带正电荷的离子。
这些离子在溶液中具有很高的电导率,被广泛应用于化学分析和电化学研究中。
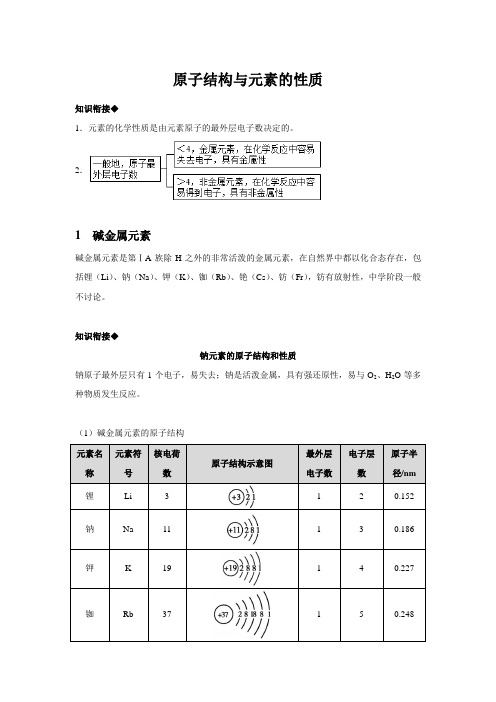
原子结构与元素的性质知识衔接◆1.元素的化学性质是由元素原子的最外层电子数决定的。
2.1 碱金属元素碱金属元素是第ⅠA族除H之外的非常活泼的金属元素,在自然界中都以化合态存在,包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr),钫有放射性,中学阶段一般不讨论。
知识衔接◆钠元素的原子结构和性质钠原子最外层只有1个电子,易失去;钠是活泼金属,具有强还原性,易与O2、H2O等多种物质发生反应。
(1)碱金属元素的原子结构由表中信息分析可知:(2)碱金属单质的主要物理性质(3)教材P94·探究碱金属化学性质的比较①碱金属与氧气的反应K+O2KO2(超氧化钾)2Na+O2Na2O2钾的焰色钠的焰色总结◆相同条件下,碱金属从Li到Cs,与O2反应越来越剧烈,产物越来越复杂,说明金属越来越活泼。
名师提醒(1)做碱金属化学性质的比较实验时,碱金属一般取绿豆大小为宜。
若用量过多,实验时易发生危险。
在使用前,要用滤纸吸干钾、钠等金属表面的煤油。
未用完的钾、钠要放回原试剂瓶。
(2)碱金属在空气中加热与O2反应,Li与O2反应主要生成Li2O,Na与O2反应生成Na2O2,K与O2反应生成KO2,Rb和Cs遇空气立即燃烧,生成更复杂的产物。
改变反应条件,K 也能与O2反应生成K2O、K2O2。
②碱金属与水的反应总结◆相同条件下,碱金属从Li到Cs,与水反应越来越剧烈,说明金属越来越活泼,反应方程式可用通式表示:2R+2H2O===2ROH+H2↑。
名师提醒(1)碱金属单质与H2O反应生成强碱和H2,Li反应剧烈(但比Na弱),Rb和Cs遇H2O 立即燃烧、甚至会爆炸。
着火时,不能用水灭火,必须用干燥的沙土扑灭(2)由于Li、Na、K能与O2和H2O反应,故实验室中Na、K保存在煤油中,Li(密度比煤油的小)常保存在液体石蜡中。
(3)碱金属与盐溶液反应时,可以看作是碱金属先与H2O反应生成碱和H2,而非直接与盐发生置换反应。


碱金属元素的原子结构和碱金属的性质教学目的使学生了解碱金属的物理性质和化学性质,并能运用原子结构的初步知识来了解它们在性质上的差异及递变规律,为今后学习元素周期律打好基础。
对学生进行科学方法的训练。
教学重点碱金属元素的性质以及原子结构的关系教学难点教学方法模式的训练教学方法启发、引导、讨论、实验、对比、练习等课时安排:1课时教学用具投影仪、铁架台(带铁圈)、石棉网、酒精灯、烧杯、玻璃片、水、金属钠、金属钾、酚酞试液。
教学过程[引入]前几节课我们共同学习了碱金属的代表性元素——钠及其化合物的主要性质,本节课我们继续学习第三节碱金属元素。
[板书]第三节碱金属元素[师]我先问大家两个问题:碱金属共包括哪几种元素?为什么把这几种元素统称为碱金属?[生]碱金属包括锂、钠、钾、铷、铯、钫,因为它们的氧化物的水化物是可熔于水的强碱,因此被统称为碱金属。
[板书](Li、Na、K、Rb、Cs、Fr)[师]回答得很好。
钫是一种放射性元素,我们现阶段不研究它。
人们把锂、钠、钾、铷、铯等叫做碱金属,并把它们放在一起研究,说明它们之间存在着某种内在的联系,这种联系我们可以从两个方面进行研究:即相似性和递变性。
因为结构决定性质,本节课我们首先从微观的原子结构特征入手。
[板书]一、原子结构[师]请同学们在本上写出Li、Na、K的原子结构图,同时观察它们之间有哪些联系?然后翻看36页表2-2中Rb、Cs的原子结构图,总结碱金属原子结构上的相似性和递变性。
[投影板书]一、碱金属的原子结构性质相似性:递变性:[生]相似性是最外电子层都有一个电子;递变性是随着核电荷数增加,原子的电子层数增多,原子半径增大。
[板书]相似性:最外电子层都有一个电子;递变性:随着核电荷数增加。
原子的电子层数增多。
原子半径增大[师]因为结构决定性质,先让我们共同学习一下碱金属的物理性质[板书]二、物理性质[讲]大家一定要注意看36页左上角的注解1对钾的密度反常的解释。


碱金属的定义碱金属是指周期表中第一族元素,包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和铪(Fr)。
碱金属具有一系列独特的物理和化学性质,其名称源自它们与水反应形成碱性溶液的特性。
以下是对碱金属的定义和相关特点的详细介绍。
1.原子结构和周期特点:碱金属位于周期表第一周期的1A族,具有非常相似的电子结构。
它们的原子结构特点是只有一个电子在最外层(价层),且这个电子相对容易失去,形成+1价阳离子。
这也使得碱金属具有相似的化学性质和反应活性。
2.物理性质:碱金属是固体,呈银白色,在常温下是软的且易弯曲。
它们具有低密度,是金属中密度最小的。
碱金属的熔点相对较低,铯是所有稳定存在的元素中熔点最低的,仅为28.5°C。
碱金属的导电性和热导性都很好,是良好的导体。
3.化学性质:碱金属具有很强的金属活性,与氧气、卤素和非金属元素等多种物质反应剧烈。
例如,碱金属与水反应生成氢气和碱性氢氧化物(碱),反应放热、产生火花和液体溶液发生蒸汽爆炸。
碱金属也与酸反应,生成盐和水。
4.重要应用:由于碱金属具有低密度、导电性和化学活性等特点,它们在许多领域中有广泛应用。
其中最重要的是钠和钾。
钠广泛用于制备钠化合物、化学反应的原料和照明元件。
钾在冶金、肥料、炸药、荧光材料等方面也有许多应用。
5.危险性:由于碱金属的高反应性和易燃性,它们在储存和处理时需要特别小心。
碱金属与空气中的水分和氧气反应,产生可燃性气体,容易引发火灾和爆炸。
因此,在实验室和工业中使用和操作碱金属必须遵循严格的安全操作规程。
6.新发现的碱金属元素:在最近几十年里,科学家还成功合成了一些高反应性的人造碱金属元素。
其中最知名的是铪(Fr),它是人类创造的在自然界中极为罕见的元素。
铪极为不稳定,具有极短的半衰期,因此很难研究和获得足够的样品。
综上所述,碱金属是周期表中第一族元素,具有一系列特殊的物理和化学性质。
它们的电子结构和周期特点使碱金属具有相似的化学性质和反应活性。
专题02 碱金属元素结构与性质一、碱金属元素的原子结构特点二、碱金属元素的性质1、碱金属单质物理性质变化规律随着原子序数的递增,碱金属单质的密度逐渐增大(钾反常),熔、沸点逐渐降低。
2、碱金属的原子结构与化学性质的关系(1)相似性原子都容易失去最外层的一个电子,化学性质活泼,它们的单质都具有较强的还原性,它们都能与氧气等非金属单质及水反应。
碱金属与水反应的通式为2R+2H2O===2ROH+H2↑(R表示碱金属元素)。
(2)递变性随着原子序数的递增,原子半径逐渐增大,原子核对最外层电子的引力逐渐减小,碱金属元素的原子失电子能力逐渐增强,金属性逐渐增强,单质还原性增强。
①与O2的反应越来越剧烈,产物更加复杂,如Li与O2反应只能生成Li2O,Na与O2反应还可以生成Na2O2,而K与O2反应能够生成KO2等。
②与H2O的反应越来越剧烈,如K与H2O反应可能会发生轻微爆炸,Rb、Cs遇水发生剧烈爆炸。
③最高价氧化物对应水化物的碱性逐渐增强,CsOH的碱性最强。
3、元素金属性强弱可以从单质与水(或酸)反应置换出氢的难易程度,或其最高价氧化物对应的水化物——氢氧化物的碱性强弱来判断。
【例1】下列各组比较中不正确的是()A.锂与水反应不如钠与水反应剧烈B.还原性:K>Na>Li,故K可以从NaCl溶液中置换出金属钠C.熔、沸点:Li>Na>KD.碱性:LiOH<NaOH<KOH【答案】B【解析】A、锂的活泼性比钠弱,与水反应不如钠剧烈;B、还原性,K>Na>Li,但K不能置换出NaCl溶液中的Na ,而是先与H 2O 反应;C 、碱金属元素从Li 到Cs ,熔、沸点逐渐降低,即Li >Na >K >Rb >Cs ;D 、从Li 到Cs ,碱金属元素的金属性逐渐增强,对应最高价氧化物的水化物的碱性依次增强,即碱性:LiOH <NaOH <KOH <RbOH <CsOH 。
碱金属的化学性质递变探究(1)碱金属与O 2反应①已知1.4 g 锂在空气中加热充分反应,可生成3.0 g 氧化物,该反应的化学方程式是 4Li +O 2=====△2Li 2O 。
第三章碱金属原子结构及光谱-e§3.1、碱金属的原子光谱与能级原子实一、光谱特点主线系锂原子漫线系线系限锐线系柏格曼系主线系:红色←→紫外漫线系:可见光, 由轮廓弥散的谱线组成。
漫线系:可见光,由轮廓弥散的谱线组成。
锐线系:红外,可见光,由轮廓细锐的谱线组成。
锐线系:红外, 可见光,由轮廓细锐的谱线组成。
柏格曼系:红外。
特点:结构相近, 明显分线系漫线系和锐线系有共同的线系限其他碱金属也有相仿的线系结构¾锂(Li)原子:l = 0, 1, 2, 3,Δs>Δp>Δd>Δf,,,0.4049, 0.0404, 0.001, 0.000可见,l 越小⇒Δ越大⇒能级越低l¾Na 原子的量子数亏损与锂原子类似三、能级玻尔的跃迁假设原子从一个定态跃迁到另一定态,会发射或吸收一个光子。
nE 玻尔频率关系n mh E E ν=−h νmE 相应的波数公式为发射n mhc E E ν=−Li 原子跃迁图原子物理SPDF4特点:4条谱线,4个线系;3柏格曼系3个终端:2S, 2P,3D;锐线系漫线系2个量子数:n, l ;22P1条选择定则。
2S 6707λ注:除四线系外,高能级到低能级的跃迁也有,只是强度小与1/n 3Li 基态成正比。
四、类氢轨道和轨道贯穿碱金属原子(如锂、钠等)中,最外层只有一个电子,称为价电子。
原子核和其它电子组成的实体称为原子实。
-e原子实碱金属原子的结构与氢原子有类似之处。
当原子中只有价电子的能量发生变化时,“原子的能量”常常是指其价电子的能量。
但是与氢原子不同的是:碱金属原子能级除与n 有关外还与l 有关,所以光谱与氢有差别n l原子实极化¾价电子对原子实中负电荷的排斥使原子实负电荷的重心向远离电子方向移动造成了原子实的极化¾−(Z −1)e Ze 负电荷重心偏移后价电子感受到的原子核●●●-e 使价电子附加的吸引作用增强了原子实极化了一部分负的电势能轨道贯穿¾对于不同的l 有不同的电子云分布对应于不l同的“轨道”对于那些l 小的轨道电子有可能进入原子实这称为轨道贯穿¾轨道贯穿使电子感受到了更多正电荷的作用因此能量要降低综合结果:¾l 比较大时(接近于n),不考虑原子实的极化l价电子仅感受到了一个有效正电荷的作用,价电子的轨道称之类氢轨道。
碱金属元素的原子结构的异同
碱金属元素包括钠、镁和铝等元素,它们均属于第二组元素,具有原子序数11、12、13,相同碱金属元素的原子结构异同如下:
首先,它们具有相同的外层电子配置模式,即属于ns,np,nd子层类型。
比如,钠
的核心电子配置模式为[Ne]3s,镁的核心电子配置模式为[Ne]3s2,铝的核心电子配置模
式为[Ne]3s2d1。
其中,Ne表示氦的核心电子配置模式,3s表示比核心电子多一层的子层,而3s2d1则表示有两个比核心电子多一层的子层。
其次,碱金属元素的原子半径从钠到铝呈增大趋势。
钠到镁之间的原子半径变化不大,但镁到铝的原子半径变化明显。
具体来说,钠的原子半径为0.97Å;镁的原子半径为
1.02Å;铝的原子半径为1.18Å,有所不同。
再次,碱金属元素的电子配置是不同的,从属性上讲,它们的外电子配置都是s2p3。
但当观察它们的内部电子配置时,发现它们有明显差异,比如,钠1s2 2s2 2p6 3s1,镁
1s2 2s2 2p6 3s2,铝1s2 2s2 2p6 3s2 3p1。
最后,碱金属元素utf-8在各种物理或化学性质上也有明显不同,如电离势,比较钠、镁、铝元素电离势梯度,会发现它们呈递减趋势,分别为:5.14eV,7.64eV,5.99eV。
电
熔点和电熔点也有所不同,钠、镁、铝的电熔点,分别为97.8,650,660℃。
总而言之,不管是原子半径、外/内部电子配置,还是电子电离势梯度、电解质溶解度、电熔点等性质,碱金属元素的不同之处可以从各个方面展现出来。