《元素周期表》(元素的性质与原子结构)
- 格式:ppt
- 大小:1.31 MB
- 文档页数:36

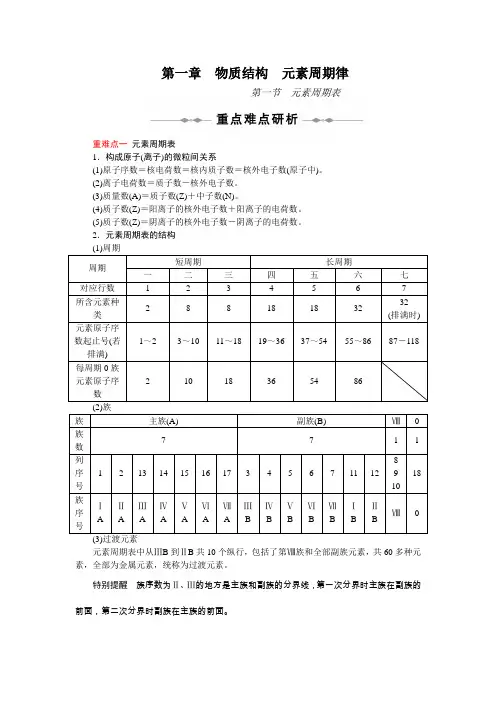
第一章物质结构元素周期律第一节元素周期表重难点一元素周期表1.构成原子(离子)的微粒间关系(1)原子序数=核电荷数=核内质子数=核外电子数(原子中)。
(2)离子电荷数=质子数-核外电子数。
(3)质量数(A)=质子数(Z)+中子数(N)。
(4)质子数(Z)=阳离子的核外电子数+阳离子的电荷数。
(5)质子数(Z)=阴离子的核外电子数-阴离子的电荷数。
2.元素周期表的结构(3)过渡元素元素周期表中从ⅢB到ⅡB共10个纵行,包括了第Ⅷ族和全部副族元素,共60多种元素,全部为金属元素,统称为过渡元素。
特别提醒族序数为Ⅱ、Ⅲ的地方是主族和副族的分界线,第一次分界时主族在副族的前面,第二次分界时副族在主族的前面。
“第一次”指ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ依次排列。
“第二次”指ⅠB ⅡB ⅢA ⅣA ⅤA ⅥA ⅦA 0依次排列。
重难点二 零族定位法确定元素的位置 1.2.比大小定周期比较该元素的原子序数与0族元素的原子序数大小,找出与其相邻近的两种0族元素,那么该元素就和序数大的0族元素处于同一周期。
3.求差值定族数(1)若某元素原子序数比相应的0族元素多1或2,则该元素应处在该0族元素所在周期的下一个周期的ⅠA 族或ⅡA 族。
(2)若比相应的0族元素少1~5时,则应处在同周期的ⅢA ~ⅦA 族。
(3)若差其他数,则由相应差值找出相应的族。
重难点三 元素的性质与原子结构 1.碱金属单质的相似性和递变性 (1)相似性①与O 2反应生成相应的氧化物,如Li 2O 、Na 2O 等。
②与Cl 2反应生成RCl ,如NaCl 、KCl 等。
③与H 2O 反应,能置换出H 2O 中的氢,反应通式为2R +2H 2O===2ROH +H 2↑。
④与非氧化性酸反应,生成H 2,反应通式为2R +2H +===2R ++H 2↑。
(R 表示碱金属元素)(2)递变性从Li 到Cs ,随着核电荷数的增加,碱金属元素原子的电子层数逐渐增多,原子核对核外电子的吸引能力逐渐减弱,失电子能力逐渐增强,金属性逐渐增强。




元素的性质与周期表元素是构成物质的基本单位,它们拥有特定的性质和特征。
通过对元素性质的研究,科学家们发现了元素之间的规律,并总结出了周期表。
本文将探讨元素的性质以及周期表的基本结构和意义。
一、元素的性质1. 原子结构:元素由原子组成,原子由质子、中子和电子构成。
质子位于原子核中,负责携带正电荷;中子也位于原子核中,质量和质子相近,不带电荷;电子围绕原子核运动,带有负电荷。
2. 原子量和原子序数:原子量代表一个原子质量的大小,原子量的单位是原子质量单位(amu);原子序数是元素在元素周期表中的顺序编号,也代表了元素中质子和电子的数量。
3. 电子层和能级:电子围绕原子核的轨道称为电子层,能级则是电子在电子层内分布的能力。
第一层能容纳2个电子,第二层能容纳8个电子,第三层能容纳18个电子。
4. 离子化倾向:元素的离子化倾向指的是元素失去或获取电子形成带电离子的能力。
离子化倾向较高的元素倾向于失去电子形成正离子,而离子化倾向较低的元素则倾向于获取电子形成负离子。
5. 化合价:元素的化合价是指元素形成化合物时所能与其他元素结合的能力。
元素的化合价决定了化合物中元素的比例和结构。
二、周期表的基本结构周期表是按照元素的原子序数排列的表格,以期望揭示出元素间的规律和周期性变化。
元素周期表的基本结构包括周期数、主族和过渡金属。
1. 周期数:元素周期表的纵向排列被称为周期数,每个周期数代表了一个电子层的填充情况。
一般来说,周期数越高,电子层数量越多。
2. 主族:主族是周期表中的垂直列,共有18个主族。
主族元素在化学性质上有一些共同特点,如原子结构、原子性质和化合价。
3. 过渡金属:过渡金属位于周期表的中间,它们是一类具有良好导电性和可变化化合价的金属元素。
三、周期表的意义周期表是化学研究中的基础工具,它意味着元素性质和规律的发现与总结。
具体来说,周期表的意义包括:1. 揭示元素之间的规律:周期表将元素按照一定的顺序排列,相邻元素之间往往具有相似的化学性质和反应规律。



元素周期表中元素及其化合物的递变性规律1 原子半径(1)除第1 周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小;(2 )同一族的元素从上到下,随电子层数增多,原子半径增大。
注意:原子半径在VIB 族及此后各副族元素中出现反常现象。
从钛至锆,其原子半径合乎规律地增加,这主要是增加电子层数造成的。
然而从锆至铪,尽管也增加了一个电子层,但半径反而减小了,这是与它们对应的前一族元素是钇至镧,原子半径也合乎规律地增加(电子层数增加)。
然而从镧至铪中间却经历了镧系的十四个元素,由于电子层数没有改变,随着有效核电荷数略有增加,原子半径依次收缩,这种现象称为“镧系收缩”。
镧系收缩的结果抵消了从锆至铪由于电子层数增加到来的原子半径应当增加的影响,出现了铪的原子半径反而比锆小的“反常”现象。
2 元素变化规律(1 )除第一周期外,其余每个周期都是以金属元素开始逐渐过渡到非金属元素,最后一稀有气体元素结束。
(2 )每一族的元素的化学性质相似3 元素化合价(1)除第1 周期外,同周期从左到右,元素最高正价由碱金属+1 递增到+7 ,非金属元素负价由碳族-4 递增到-1 (氟无正价,氧无+6 价,除外);(2 )同一主族的元素的最高正价、负价均相同(3)所有单质都显零价4 单质的熔点(1 )同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减;(2 )同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增5 元素的金属性与非金属性(1 )同一周期的元素电子层数相同。
因此随着核电荷数的增加,原子越容易得电子,从左到右金属性递减,非金属性递增;(2 )同一主族元素最外层电子数相同,因此随着电子层数的增加,原子越容易失电子,从上到下金属性递增,非金属性递减。
6 最高价氧化物和水化物的酸碱性元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强。


元素周期表的结构与性质元素周期表是现代化学中最基本的工具之一,它反映着元素之间的关系,可以帮助我们更好地理解化学反应和物质性质。
本文将介绍元素周期表的结构和性质。
一、周期表的结构元素周期表是由俄国化学家季莫费耶夫 (D.I.Mendeleev) 和德国化学家洛塔尔·迈耶 (J.Lothe) 独立开发的,它们都是基于元素物理和化学性质的相似性来组织的。
周期表的主体是由元素原子序数排列而成,它从左到右,由上到下按照原子序数的递增顺序排列,即“周期表周期上元素原子序数递增,周期表周期内元素原子序数递减”的基本规律。
常规的元素周期表按原子序数分为7个周期,每个周期由两个元素逐渐加入,形成18个元素族(有时称为“栏”或“列”)。
从第1周期中的氢(H)到第7周期中的钅(原子序数118),这些元素的数量不断增加,有时会存在括号中。
在周期表中,水平行称为“周期”,由左到右逐渐加上元素;垂直栏称为“族”,元素具有类似的性质。
周期表的左侧通常由金属和金属化合物组成,右侧则主要由非金属元素组成。
中间从碳到锗的元素则有时被称为“半金属”,拥有一些金属和非金属元素的性质。
元素的周期相应地反映了元素的原子结构,其中第1周期中只含有一个电子壳层——K壳,而最后一个周期则具有七个电子壳层——K、L、M、N、O、P、Q层,这就意味着周期表的右下角元素具有较多的电子层和较强的金属和非金属元素性质。
二、元素周期表的核心元素周期表中最重要的发现之一是化学元素之间的周期性性质。
尤其是元素周期表上的族性质,使我们可以根据元素的周期位置,预测它们在反应和化学性质方面的规律。
根据元素周期表,我们可以得出以下推论:1.元素具有周期性的物理性质周期表上的元素根据它们的原子结构,拥有周期性的电离势、电子亲和能、原子半径、电负性等性质。
例如,周期表上的右侧元素通常比左侧元素拥有更高的电离势和电子亲和能,这表明它们对电子的吸引力更强,并且更加稳定,因此不容易与其他元素发生化学反应。
原子结构与元素周期表解析原子结构与元素的性质原子是构成物质的基本单元,它的结构对物质的性质具有重要影响。
元素周期表是综合总结了众多元素的性质,并将其有序排列的表格,通过分析元素周期表的结构可以深入理解原子结构与元素的性质。
一、原子结构的组成原子由电子、质子和中子组成。
电子是负电荷带电粒子,质子是正电荷带电粒子,中子则不带电荷。
原子结构的基本模型是以质子和中子组成的原子核,而电子则绕着原子核运动。
二、电子的能级和轨道电子在原子中的能量分布是通过能级和轨道来描述的。
能级即电子的能量状态,轨道则为电子在该能级状态下的运动路径。
能级和轨道的不同组合决定了原子的化学性质。
根据量子力学理论,原子的能级分为不同的壳层,分别用数字1、2、3等表示,数字越大表示能级越高。
每个能级又分为不同的轨道,如s、p、d、f等轨道。
s轨道为球形,最接近原子核;p轨道为双圆柱形,比s轨道远离原子核;d轨道为四叶草形,比p轨道再远离原子核;f轨道为八叶草形,比d轨道再远离原子核。
三、元素周期表的结构元素周期表按照原子的电子构型和化学性质进行排列,可以分为横行和竖列。
横行称为周期,竖列称为族。
周期表中每一个元素的位置由其原子核中的质子数(即原子序数)决定。
原子序数越大,元素的质子数越多。
原子序数为1的元素是氢,具有一个质子和一个电子。
原子序数为2的元素是氦,具有两个质子和两个电子。
以此类推。
周期表中的竖列是由元素的外层电子数来划分的。
具有相同外层电子数的元素具有相似的化学性质,因为外层电子决定着元素的化学反应。
四、原子结构与元素性质的关系原子的电子结构决定了元素的化学性质。
主要体现在以下几个方面:1. 电子的能级和轨道决定了元素的化合价。
能级较低的元素倾向于失去电子,形成正离子;能级较高的元素倾向于获得电子,形成负离子。
2. 原子的外层电子数决定了元素的周期性变化。
周期表中的元素在同一族中具有相似的外层电子数,从而具有相似的化学性质。