生化检测系统性能验证
- 格式:ppt
- 大小:466.50 KB
- 文档页数:69


雅培ARCHEITECT C800全自动生化分析仪检测系统性能验证摘要】目的:对雅培ARCHEITECT C800全自动生化分析仪(简称雅培 C800)的肾功能三项,即尿素氮(BUN)、肌酐(CREN)、尿酸(UA)的精密度(批内、日间)、正确度、线性范围以及生物参考区间等相关分析性能进行评价。
方法:根据美国临床实验室标准化研究所(CLSI)文件(EP5-A2、EP15-A2)以及中华人民共和国卫生行业标准(简称卫生行业标准)的相关文件进行评价。
结果:BUN、CREN及UA的中、高值的批内精密度均小于1/4总误差(TEa),日间精密度均小于1/3总误差(TEa);BUN、CREN及UA的各项目线性良好,线性回归方程的斜率均在1.00±0.03范围内,R2均≥0.95,线性范围分别为0~38.83mmol/L、0~1289umol/L、0~884.5umol/L;对江苏省2015年第二次5份室间质控物的BUN、CREN、UA检测结果与靶值的偏倚分别为-2.30%~0.61%、-2.74%~0.79%、0.38%~2.86%之间,均小于1/2总误差;各项目的生物参考区间验证结果均在本实验室引用的参考区间内。
结论:雅培ARCHEITECT C800全自动生化分析仪对BUN、CREN、UA检测的主要性能符合质量目标要求,能够满足各个层次医院的临床检测需要。
【关键词】雅培 C800全自动生化分析仪;性能验证;精密度;正确度【中图分类号】R197.38 【文献标识码】A 【文章编号】1007-8231(2017)11-0277-02为保证临床实验室检验结果的准确和可靠,根据实验室的有关要求,应对非配套检验系统的精密度、正确度、可报告范围等进行评价,本文参照中华人民共和国卫生行业标准(WS/T 403-2012、WS/T 408-2012、WS/T 404.5-2015),对雅培C800全自动分析仪检测的BUN、CREN及UA三项进行分析验证,现报道如下:1.材料与方法1.1 材料1.1.1仪器雅培ARCHEITECT C800全自动生化分析仪。

OLYMPUS-AU2700生化检测系统的性能验证郑秀娥;李晋;柴谦;张俊国【摘要】目的:对OLYMPUS-AU2700生化检测系统进行性能验证.方法:对AST等9个生化项目的精密度、线性范围和携带污染率进行验证,并与OLYMPUS-AU5400生化检测系统进行相关性分析.结果:OLYMPUS-AU2700生化检测系统AST、CK、GLU、CREA、UA、CA、AMY、Mg和BNN 9个项目的精密度验证均合格;各项目在测定范围内都表现出较好的线性关系(斜率0.97~1.03,r≥0.95);AU2700生化分析仪内外圈携带污染率验证合格;两种仪器相关性较好(r2≥0.95,斜率0.9~1.1).结论:OLYMPUS-AU2700生化检测系统9项生化指标的精密度、线性、携带污染率和仪器相关性这四个方面基本满足临床生化检测的实验要求.【期刊名称】《中国医疗器械信息》【年(卷),期】2018(024)023【总页数】4页(P10-12,43)【关键词】OLYMPUS-AU2700;\r精密度;\r线性;\r携带污染;\r相关性;\r性能验证【作者】郑秀娥;李晋;柴谦;张俊国【作者单位】山东省食品药品监督管理局审评认证中心山东济南 250014;山东省疾病预防控制中心山东济南 250014;山东省食品药品监督管理局审评认证中心山东济南 250014;山东大学附属医院山东省立医院检验科山东济南 250000【正文语种】中文【中图分类】R197.39随着医学检验技术的快速发展全自动生化分析仪成为临床生化检验的主要仪器之一仪器性能的优劣直接关系检验质量。
为配合实验室申请ISO15189质量体系,同时也为了验证2009年购入OLYMPUS-AU2700全自动生化分析仪的性能,本实验室根据《医学实验室质量和能力的专用要求》(ISO15189)和美国病理家学会(CAP)要求[1],参考相关文献并结合实际工作,对OLYMPUS-AU2700全自动生化分析仪的精密度、线性范围、携带污染率、仪器相关性四个主要性能进行了验证实验。

性能验证(仅供参考)1 生化生化室项目需要验证的参数包括批内精密度,批间精密度,正确度,线性范围、参考区间,可报告区间等。
适用时,还要考虑分析灵敏度(仅对那些在接近0的低值有临床意义的项目有必要进行确定,必要时,可引用说明书中给出的低值)和干扰试验。
1.1 精密度1.1.1 标本准备及要求质控品、已经检测过的病人标本或具有血清基质的定值材料。
每个项目均需选择至少正常和病理两个浓度水平的验证材料进行验证。
所用样本一定要稳定,其基体组成应尽可能相似于实际检测的病人标本,样本中的分析物含量应在该项目的医学决定水平附近。
1.1.2 方案1.1.2.1 方案1:对验证材料每天分析1批次,2个浓度,每个浓度重复测定4次,连续5天。
记录结果并计算均值、标准差和批内精密度(%)。
1.1.2.2 方案2:批内精密度:浓度分别处于正常和病理水平的混合新鲜临床标本,按照临床标本相同的检测方法,同批次内检测混合的新鲜临床标本20次。
记录结果并计算均值(X)、标准差(SD)和批内变异系数CV(%)。
批间精密度:浓度分别处于正常和病理水平的混合新鲜临床标本,按照临床标本相同的检测方法(或将室内质控品按照常规标本的方法一样测定,测定结果在遵照厂商参数不出控的前提下),同批次内检测混合的新鲜临床标本20次,同一批号室内质控品某一时间段(至少20天)的室内质控数据逐步累积最终得出均值、标准差。
1.1.3结果判断从美国临床实验室室间质量评估允许误差表中查阅评价项目的允许误差范围,由实验数据统计的批内不精密度和批间不精密度小于允许误差范围的1/4和1/3作为检测系统不精密度性能的的可接受标准(或用卫生部临检中心的允许总误差、卫生标准等),且又小于厂商提供的精密度性能指标,说明由实验室评价的检测系统的不精密度性能可接受,符合要求。
若大于判断限,检测系统的不精密度是否符合要示,应再进一步做统计学处理作出判断。
1.2 正确度1.2.1 卫生部临检中心室间质评含盖的项目,则以卫生部临床检验中心室间质评结果为准;成绩在80%者即为验证通过。

基层医院中生化分析仪的性能验证方法何乐春;陈福军【摘要】Objective To establish an active and reliable performance verification method for automatic chemistry analyzer. Methods By referring to industry standards, this paper verified tow automatic chemistry analyzers for accuracy, repeatability, linearity range and the sample carry-over. Results Analyzer with slow testing speed was failed in testing accuracy, repeatability; analyzer with high testing speed met all standard requirements. Conclusion Because of the long period of absorbance observation, analyzer with slow testing speed was worse than the high speed analyzer, and performance verification for automatic chemistry analyzer should be carried out by using kinetic assay kit.%目的为基层医院建立一种可行性强、结果可靠的全自动生化分析仪性能验证方法.方法参考全自动生化分析仪行业标准,对两台国产生化仪的准确性、重复性、线性范围和样品污染携带进行检测.结果低测速生化仪在使用速率法试剂时,检测结果的准确性和重复性为不合格;高测速生化仪各项检测结果均合格.结论由于检测周期过长,低速生化仪在同样的时间内监测反应过程吸光度的次数少于高速生化仪,因此参照本文的验证方法时应多使用速率法试剂盒.【期刊名称】《中国医疗设备》【年(卷),期】2018(033)005【总页数】4页(P100-103)【关键词】生化分析仪;准确性;重复性;线性范围;污染携带【作者】何乐春;陈福军【作者单位】重庆医疗器械质量检验中心&重庆市医疗器械质量与安全控制工程技术研究中心,重庆 401147;辽宁省药械审评与监测中心,辽宁沈阳 110006【正文语种】中文【中图分类】R197.39引言生化分析仪对于所有医院的检验科都属于最基本和必不可少的诊断分析仪器。


谈谈生化检测系统分析性能的评价检测系统是完成检测项目测试所涉及的包括仪器、试剂、校准品、检验程序、质量控制、保养计划等一系列的模块的组合;大部分检测系统是开放的也就是非配套系统。
需要对检测系统的分析性能可否接受作出判断,决定取舍或以期逐步改进。
判断检测系统的可接受性,首先要确定各检测项目的分析性能标准-允许总误差(TEa);其次要明确各检测项目的总误差,既不精密度(CV)和不准确度(Bias),以此为操作点应用Westgard方法评价决定图,在图上根据预期操作点的所在区域,来判断分析性能的可接受性。
根据室内质控和室间质评得出的不精密度和不准确度作为操作点,应用Westgard方法评价决定图判断各项目的方法性能的可接受性。
结果钙(Ca)、尿素(Ur)、钠(Na)、氯(CL)、总胆红素(TB)、磷(P)、肌酐(Cr)、总蛋白(TP)方法性能属于临界水平;总胆固醇(TC)、淀粉酶(AMY)的方法性能属于良好水平,其他各检测项目的方法性能属于优秀水平。
现对参加室间质评活动中的17个检测项目作了分析性能可接受的判断,分析如下。
一、检测材料和方法1、检测系统仪器为东芝40-FR生化分析仪、康立AFT-500电解质分析仪。
室内质控品、校准品、试剂均为德塞诊断系统(上海)有限公司提供。
其中甘油三酯(TG)、总胆固醇(TC)试剂由中生北控试剂有限公司提供。
淀粉酶(AMY)试剂由温州津玛科技有限公司提供。
室间质控品,由自治区临检中心提供。
室内质控使用德塞诊断系统(上海)有限公司提供的正常值和病理值质控血清,所有检测程序按照仪器和试剂说明书设计,测试过程中除使用德塞诊断系统的正常值和病理值质控品外,还使用罗氏正常值和病理值质控血清验证,使用该系统检测患者标本可以溯源至参考方法或相应参考品或有关的技术标准。
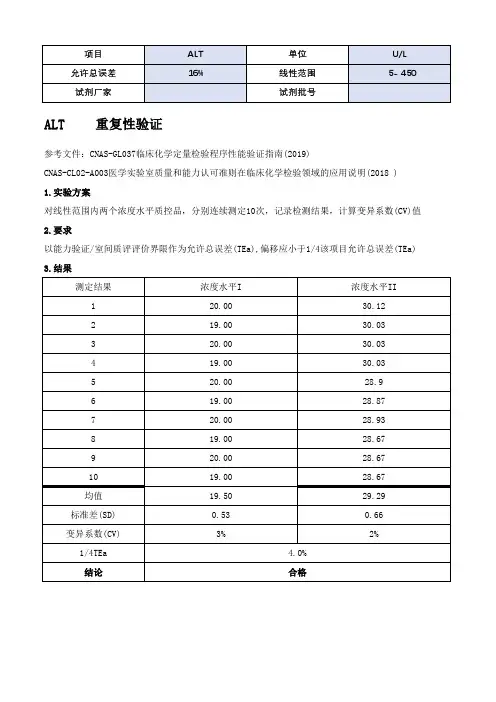
2、评价项目均为目前参加本地区的室间质评的检验项目,包括丙氨酸氨基转移酶(ALT)、总蛋白(TP)、白蛋白(ALB)、总胆红素(TB)、直接胆红素(DB)、尿素(Ur)、肌酐(Cr)、尿酸(UA)、葡萄糖(Glu)、TC、TG、钾(K)、钠(Na)、氯(CL)、钙(Ca)、磷(P)、AMY共17项。

短篇论著G L P实验室生化检测系统的性能验证∗赵映淑,林应学,黎良程,刘㊀春ә(海南省药品检验所/海南省药物研究重点实验室,海南海口570216)㊀㊀摘㊀要:目的㊀在良好实验室规范(G L P)体系下,对生化试剂改变后7100型全自动生化分析仪的性能进行验证.方法㊀根据美国临床和实验室标准化协会的评价标准,选择丙氨酸氨基转移酶㊁天门冬氨酸氨基转移酶㊁γG谷氨酰基转肽酶㊁碱性磷酸酶㊁总蛋白㊁清蛋白㊁总胆红素㊁总胆固醇㊁血糖㊁三酰甘油㊁肌酸激酶㊁尿素和肌酐13项生化指标,对7100型生化分析仪精密度㊁准确性㊁线性和携带污染率进行验证.结果㊀13项生化指标批内变异系数(C V%)<1/4美国临床实验室修正法规(C L I Aᶄ88)允许总误差(T E a),批间C V%<1/3C L I Aᶄ88T E a;准确度检测值与靶值比较,相对偏差<1/3C L I Aᶄ88T E a;线性验证相关系数均>0.995,且线性偏差<1/2C L I Aᶄ88T E a;携带污染率均<0.5%.结论㊀经G L P条件下的性能验证,该日立7100型全自动生化分析仪在更换试剂后各方面性能良好,可用于毒理学试验中的临床检验工作.关键词:实验室技术和方法;㊀生物化学/仪器和设备;㊀指示剂和试剂;㊀精密度;㊀准确度;㊀线性;㊀性能验证D O I:10.3969/j.i s s n.1673G4130.2019.01.030中图法分类号:R446.112文章编号:1673G4130(2019)01G0115G04文献标识码:B㊀㊀生化检测体系(系统)由生化分析仪与检测试剂及其校准品组成,该体系的性能在一定程度上受仪器本身和(或)试剂的影响,在进行常规工作前应该对其性能进行分析评价,以证实其能满足预期要求[1G2].除在仪器首次使用前进行安装验证㊁操作验证和性能验证外,仪器安装地点发生改变㊁有过重大维修㊁控制系统或检测方法发生改变也应该视情况对仪器重新进行3Q验证[3G4].这也是良好实验室规范(G L P)对仪器设备验证的最基本要求[5G7].医学实验室质量和能力认证也要求仪器设备在常规使用中能达到规定的性能指标[8G10].本实验室由日立7100型全自动生化分析仪与日本和光试剂及其校准品组成的生化检测体系在首次使用前已进行3Q验证,运行稳定良好,但因其运行成本较高,考虑使用国产试剂进行替代,故该体系的有效性必须加以验证[11].本研究所述生化指标体系改变后的验证,是在G L P条件下,以7100型日立全自动生化分析仪为依托,基于检测试剂改变(更换为国产科华生化检测试剂)后,选择血清丙氨酸氨基转移酶(A L T)㊁天门冬氨酸氨基转移酶(A S T)㊁γG谷氨酰基转肽酶(G G T)㊁碱性磷酸酶(A L P)㊁总蛋白(T P)㊁清蛋白(A L B)㊁总胆红素(T B I L)㊁总胆固醇(T C)㊁血糖(G L U)㊁三酰甘油(T G)㊁肌酸激酶(C K)㊁尿素(U r)和肌酐(C r)13项常规生化指标进行精密度㊁准确性㊁线性和携带污染率等性能的验证.1㊀材料与方法1.1㊀样本来源㊀质控血清Ⅰ(批号:T P738)㊁质控血清Ⅱ(批号:D P658)购于日本和光纯药株式会社,线性及携带污染率实验采用的血清样本由海南省肿瘤医院提供.1.2㊀仪器与试剂㊀仪器为日立7100型全自动生化分析仪(日本日立高新技术株式会社).A L T(批号:20170722)㊁A S T(批号:20170222)㊁A L P(批号:20170812)㊁G G T(批号:20170712)㊁C K(批号:20170712)㊁T P(批号:20170122)㊁A L B (批号:20170612)㊁T B I L(批号:20170722)㊁T G(批号:20170412)㊁C H O(批号:20170322)㊁G L U(批号:20170712)㊁C E R A(批号:20170622)㊁B U N(批号:20170512)及其校准品均购于上海科华生物工程有限公司.1.3㊀方法1.3.1㊀精密度㊀按照美国临床和实验室标准化协会(C L S I)E P15GA2[12]文件要求,将高㊁低水平质控血清复溶后每天重复测定3次,连续测定5d,记录每天的测定结果,计算批内变异系数(C V%)及批间C V%,并与美国临床实验室修正法规(C L I Aᶄ88)比较,若批内C V%<1/4允许总误差(T E a),批间C V%<1/3T E a证明其性能良好.1.3.2㊀准确度㊀将正常值质控血清连续测定5次,511国际检验医学杂志2019年1月第40卷第1期㊀I n t J L a bM e d,J a n u a r y2019,V o l.40,N o.1∗基金项目:海南省自然科学基金资助项目(20158364).ә㊀通信作者,EGm a i l:h n z h a o y s h@163.c o m.㊀㊀本文引用格式:赵映淑,林应学,黎良程,等.G L P实验室生化检测系统的性能验证[J].国际检验医学杂志,2019,40(1):115G118.求平均值,与质控血清靶值进行比较采用相对偏差判断各项的准确度[13].相对偏差=(检测值-靶值)/靶值ˑ100%.偏差小于C L I A ᶄ88对检测项目分析质量要求的T E a 的1/3则判定测定结果准确㊁可靠.1.3.3㊀线性㊀根据C L S IE P 6GP 2[14]文件要求进行实验.将高值(H )㊁低值(L )血清按一定比例混合(H ㊁4H+1L ㊁3H+2L ㊁2H+3L ㊁1H+4L ㊁L ),每个混合物重复检测4次,取均值.以稀释度为横轴㊁每个稀释度的测量均值为纵轴进行线性回归,根据线性回归方程求出每个稀释度的理论浓度,计算每一稀释度下实测浓度和理论浓度的差异,即线性偏差.若相关系数(R 2)>0.995㊁线性偏差ɤ1/2T E a 则可判断测定方法在实验所涉及的浓度范围内成线性.1.3.4㊀携带污染率㊀根据C L S IE P 10GA 2文件要求[15],将低水平血清分为3份(分别为L 1㊁L 2㊁L 3)和一份高水平血清(H ),按L 1㊁L 2㊁H ㊁L 3顺序排列进行测定,根据携带污染率计算公式[(L 3GL 2)/H ˑ100%],计算每项携带污染率,<0.5%为合格.1.4㊀统计学处理㊀采用E x c e l 2003软件对数据进行分析.2㊀结㊀㊀果2.1㊀精密度及准确度实验㊀13项生化指标水平Ⅰ和水平Ⅱ的批内C V %和批间C V %分别小于基于生物学变异确定1/4C L I A ᶄ88和1/3C L I A ᶄ88,均符合性能要求,说明该仪器具有较高的精密度.见表1.标准质控血清水平Ⅰ和水平Ⅱ测定值与靶值的相对偏差均小于C L I A ᶄ88对检测项目分析质量要求的总允许误差的1/3,13项生化指标中有10项相对偏差均在ʃ3%以内,其余3项指标也均符合该仪器的准确度要求.见表2.2.2㊀线性实验㊀13项生化指标的线性决定系数R 2值均>0.995,说明该仪器在定值血清的稀释范围内呈良好的线性关系.见表3.表1㊀㊀精密度检测结果与性能比较(n =5)检测项目水平Ⅰ批内C V %批间C V %水平Ⅱ批内C V %批间C V %1/4T E a(C L I A ᶄ88)1/3T E a(C L I A ᶄ88)A L T (U /L )3.182.650.660.655.006.67A S T (U /L )1.520.232.670.765.006.67G G T (U /L )1.190.461.410.515.006.67A L P (U /L )0.830.391.060.567.5010.00T P (g /L )0.600.330.500.492.503.33A LB (g /L )0.450.790.620.692.503.33T B I L (μm o l /L )0.850.500.980.605.006.67TC (m m o l /L )0.420.570.440.762.503.33G L U (m m o l /L )0.730.440.880.692.503.33T G (m m o l /L )0.290.570.390.506.258.33C K (U /L )0.690.480.900.437.5010.00U r (m m o l /L )0.610.581.080.512.253.00C r (μm o l /L )1.150.411.780.733.755.00表2㊀㊀准确度检测结果与性能比较(n =5)检测项目水平Ⅰ靶值检测值相对偏差(%)水平Ⅱ靶值检测值相对偏差(%)1/3T E a(C L I A ᶄ88)A L T (U /L )31.0031.000.00100.00104.00-4.676.67A S T (U /L )41.0038.336.50189.00192.00-1.416.67G G T (U /L )39.0038.002.56148.00149.00-0.906.67A L P (U /L )97.0094.003.44400.00402.00-0.4210.00T P (g /L )64.0062.302.6639.9041.10-2.923.33A LB (g /L )39.0036.207.1827.0026.601.603.33T B I L (μm o l /L )17.1017.39-1.6870.1171.53-2.036.67611 国际检验医学杂志2019年1月第40卷第1期㊀I n t J L a bM e d ,J a n u a r y 2019,V o l .40,N o .1续表2㊀㊀准确度检测结果与性能比较(n =5)检测项目水平Ⅰ靶值检测值相对偏差(%)水平Ⅱ靶值检测值相对偏差(%)1/3T E a(C L I A ᶄ88)T C (m m o l /L )6.446.184.092.562.521.693.33G L U (m m o l /L )4.554.0510.9216.6016.401.493.33T G (m m o l /L )2.031.992.130.931.01-8.248.33C K (U /L )137.00135.670.97413.00431.00-4.4410.00U r (m m o l /L )6.075.1914.5519.1718.602.973.00C r (μm o l /L )55.8155.67-1.56491.50493.67-0.445.00表3㊀㊀线性检测结果(n =4)检测项目线性公式R2测定线性范围验证线性范围1/2T E a (C L I A ᶄ88)结论A L T (U /L )Y =197.09X -206.950.99825.19~1000.001.00~962.5010.0合格A S T (U /L )Y =36.35X -27.600.99967.10~1000.0010.50~191.5010.0合格G G T (U /L )Y =29.129X -25.0330.99966.570~450.0004.750~149.50010.0合格A L P (U /L )Y =149.79X -127.330.99950.00~1000.0028.00~767.2515.0合格T P (g /L )Y =17.961X -16.3150.99951.740~100.0001.430~90.0505.0合格A L B (g /L )Y =6.583X -3.0980.99970.310~60.003.40~36.1305.0合格T B I L (μm o l /L )Y =12.778X -5.2680.99972.000~684.007.140~71.52010.0合格T C (m m o l /L )Y =1.098X -0.4560.99880.090~25.8500.610~6.1805.0合格G L U (m m o l /L )Y =2.716X -1.0800.99910.000~25.0001.540~15.3505.0合格T G (m m o l /L )Y =1.767X -1.6980.99970.050~11.3000.020~8.79012.5合格C K (U /L )Y =86.360X -84.4670.998716.000~2000.0004.500~432.25015.0合格U r (m m o l /L )Y =3.114X -1.6650.99960.590~35.7001.600~17.1804.5合格C r (μm o l /L )Y =99.093X -96.7000.999712.700~8840.0005.000~495.0007.5合格2.3㊀样品携带污染率实验㊀13项生化指标检测的携带污染率均<0.5%,说明前一个样品对下一个样品测定结果不存在影响,符合该仪器的基本要求.见表4.表4㊀㊀携带污染率检测结果检测项目携带污染率(%)允许污染率(%)结果A L T (U /L )-0.100.50合格A S T (U /L )0.000.50合格G G T (U /L )0.000.50合格A L P (U /L )-0.170.50合格T P (g /L )-0.330.50合格A L B (g /L )-0.390.50合格T B I L (μm o l /L )0.140.50合格T C (m m o l /L )0.160.50合格G L U (m m o l /L )0.000.50合格T G (m m o l /L )0.000.50合格C K (U /L )-0.200.50合格U r (m m o l /L )-0.120.50合格C r (μm o l /L )0.200.50合格3㊀讨㊀㊀论㊀㊀本研究依据C L I A ᶄ88对13个常规生化项目检测的精密度㊁准确度及线性偏差的结果进行了判定,结果显示,批内C V %<1/4C L I A ᶄ88T E a ,批间C V %<1/3C L I A ᶄ88T E a ;准确度相对偏差明显小于1/3C L I A ᶄ88T E a ;线性验证R 2均>0.995,线性偏差均<1/2C L I A ᶄ88T E a.表明该仪器检测重复性㊁准确性和线性良好,也说明国产试剂和校准品与日立7100型全自动生化分析仪构成的新检测体系符合质量要求,能保证毒理学研究中的临床检验工作.G L P 实验室的临检对象是实验动物,一般以提供客观检测数据为主,不涉及疾病诊断,在检测方法㊁仪器选择和结果解释方面与临床存在差异,且实验动物饲养和样品采集的标准化也使临床常见的干扰现象减少.除定期测试精密度㊁准确度㊁线性范围和携带污染率外,首次验证还应该考虑最低检测限和最大稀释度.㊀㊀综上所述,经G L P 条件下的性能验证,本实验室日立7100型全自动生化分析仪在更换试剂后各方面性能良好.711 国际检验医学杂志2019年1月第40卷第1期㊀I n t J L a bM e d ,J a n u a r y 2019,V o l .40,N o .1参考文献[1]崔明,王惠民,鞠少卿,等.E x c e l在评价X EG2100全自动血细胞分析仪精密度中的应用[J].国际检验医学杂志,2017,38(23):3240G3242.[2]蒋红君,蒋杰,王凡.全自动生化分析仪的检测精密度㊁正确度评价及参考区间的验证[J].国际检验医学杂志,2013,34(9):1147G1148.[3]于淼琛,孙芹敏,姜凤全.强生V I T R O S5600全自动生化免疫分析仪性能验证报告[J].国际检验医学杂志,2017,38(1):56G60.[4]贾栗,赵瑞勤,赵君,等.G L P体系下生化分析仪的3Q验证过程及要点[J].军事医学,2013,37(10):752G755.[5]吕会田.G L P条件下实验仪器的验证和管理[J].中国药理学与病毒学杂志,2013,27(3):457.[6]张谦,张微,吕晓丽,等.G L P体系下全自动血凝分析仪的3Q验证[J].国际检验医学杂志,2016,37(23):3241G3245.[7]刘晓萌,谢寅,孟建华,等.G L P实验室仪器验证的质量保证[J].中国药理学与病毒学杂志,2013,37(3):607.[8]林海标,范雪莲,王建兵,等.分析和评价强生V i t r o s5.1F S生化仪的精密度和正确度[J].检验医学与临床,2014,11(15):2047G2048.[9]郑自立,李燕.罗氏c o b a s8000全自动生化分析仪检测系统性能验证试验[J].检验医学与临床.2013,10(1):78G80.[10]陈渊博,郑文婷,尹志军,等.C A7000全自动凝血仪性能验证[J].国际检验医学杂志,2013,34(2):209G211.[11]刘玉侠,张凡,李兴武.C O B A S8000生化分析仪的性能评价[J].蚌埠医学院学报,2015,40(11):1567G1569.[12]C l i n i c a l a n dL a b o r a t o r y S t a n d a r d s I n s t i t u t e.U s e r v e r i f i c aGt i o no f p e r f o r m a n c e f o r p r e c i s i o na n dt r u e n e s s:E P15GA2[S].W a y n e,P A U S A:C L S I,2006.[13]尚红,王毓三,申子瑜.全国临床检验操作规程[M].4版.北京:人民卫生出版社,2015:1017G1018.[14]N a t i o n a l C o m m i t t e e f o rC l i n i c a l L a b o r a t o r y.E v a l u a t i o n o f t h el i n e a r i t y o f q u a n t i t a t i n e m e a s u r e m e n t p r o c e d u r e s:a s t a t i s t i c a l a p p r o a c h:E P6GP2[S].W a y n e,P A,U S A:N CGC L S,2003.[15]N a t i o n a lC o m m i t t e ef o rC l i n i c a lL a b o r a t o r y S t a n d a r d s.P r e l i m i n a r y E v a l u a t i o n o fQ u a n t i t a t i v eL a b o r a t o r y M e t hGo d s:E P10GA2[S].W a y n e,P A,U S A:N C C L S,2004.(收稿日期:2018G08G12㊀修回日期:2018G10G18)(上接第114页)[17]L A U YL,L A IM Y,T E O H BT,e t a l.C o l o r i m e t r i cd eGt e c t i o no fd e n g u eb y s i n g l et u b e R e v e r s eGT r a n s c r i p t i o nGL o o pGM e d i a t e d i s o t h e r m a la m p l i f i c a t i o n[J].P L o S O n e,2015,10(9):e0138694.[18]D AMH O R S T GL,D U A R T EGG U E V A R AC,C H E N W, e ta l.S m a r t p h o n eGI m a g e d H I VG1R e v e r s eGT r a n s c r i p t i o nL o o pGM e d i a t e d i s o t h e r m a l a m p l i f i c a t i o n(R TGL AM P)o n a c h i p f r o m w h o l e b l o o d[J].E n g i n e e r i n g(B e i j i n g),2015,1(3):324G335.[19]C HA N D E R Y,K O E L B LJ,P U C K E T TJ,e t a l.A n o v e l t h e r m o s t a b l e p o l y m e r a s e f o rR N Aa n dD N Al o o pGm e d i aGt e d i s o t h e r m a l a m p l i f i c a t i o n(L AM P)[J].F r o n tM i c r o b iGo l,2014,5(3):395.[20]Z HA N G Y,Y A O Y,D U W,e t a l.D e v e l o p m e n to f l o o pGm e d i a t e d i s o t h e r m a l a m p l i f i c a t i o nw i t hP l a s m o d i u mf a l c iGp a r u mu n i q u e g e n e s f o rm o l e c u l a r d i a g n o s i s o f h u m a nm aGl a r i a[J].P a t h o g G l o bH e a l t h,2017,111(5):247G255.[21]P O O L ECB,E T TW I L L E RL,T A N N E R N A,e t a l.G eGn o m e f i l t e r i n g f o r n e w D N Ab i o m a r k e r s o fL o a l o a i n f e cGt i o ns u i t a b l ef o rL o o pGM e d i a t e di s o t h e r m a l a m p l i f i c a t i o n [J].P L o SO n e,2015,10(9):e0139286.[22]N Z E L U CO,G OM E ZEA,C A C E R E SA G,e t a l.D e v e lGo p m e n t o f a l o o pGm e d i a t e d i s o t h e r m a l a m p l i f i c a t i o nm e t hGo d f o rr a p i d m a s sGs c r e e n i n g o f s a n df l i e s f o rL e i s h m a n i a i n f e c t i o n[J].A c t aT r o p,2014,132(2):1G6.[23]N K O U AWA A,S A K O Y,O K AMO T O M,e ta l.S i m p l e i d e n t i f i c a t i o no f h u m a n t a e n i a s p e c i e sb y m u l t i p l e xL o o pGM e d i a t e di s o t h e r m a la m p l i f i c a t i o ni n c o m b i n a t i o n w i t hd o tE n z y m eGL i n ke d i m m u n o s o r b e n t a s s a y[J].A mJT r o pM e dH y g,2016,94(6):1318G1323.[24]T A N N E R N A,Z HA N G Y,E V A N STCJR.V i s u a l d eGt e c t i o no f i s o t h e r m a l n u c l e i c a c i da m p l i f i c a t i o nu s i n gp HGs e n s i t i v e d y e s[J].B i o t e c h n i q u e s,2015,58(2):59G68.[25]MO R IY,K A N D A H,N O T OM IT.L o o pGm e d i a t e di s oGt h e r m a l a m p l i f i c a t i o n(L AM P):r e c e n t p r o g r e s si nr eGs e a r c ha n dd e v e l o p m e n t[J].J I n f e c tC h e m o t h e r,2013,19(3):404G411.[26]WA T T S M R,J AM E SG,S U L T A N A Y,e t a l.A L o o pGM e d i a t e di s o t h e r m a la m p l i f i c a t i o n(L AM P)a s s a y f o r s t r o n g y l o i d e s s t e r c o r a l i s i n s t o o l t h a tU s e s a v i s u a l d e t e cGt i o n m e t h o d w i t h S Y T OG82f l u o r e s c e n td y e[J].A m J T r o p M e dH y g,2014,90(2):306G311.(收稿日期:2018G08G08㊀修回日期:2018G10G14)811 国际检验医学杂志2019年1月第40卷第1期㊀I n t J L a bM e d,J a n u a r y2019,V o l.40,N o.1。


罗氏cobas c702全自动生化分析仪检测系统性能验证魏涛;钟志娟;许坚锋;孔伟圣【摘要】目的对新的检测系统罗氏cobas c702全自动生化分析仪的分析性能进行验证.方法按美国临床实验室标准化协会(CLSI)指南文件EP5-A2、EP15-A2、EP6-A2的要求,对罗氏cobas c702全自动生化分析仪的精密度、准确度、线性范围等3个性能进行验证,并与厂商声明的性能或公认的质量标准进行比较.结果该全自动生化分析仪检测的批内精密度小于1/4允许总误差(TEa),日间精密度和总精密度小于1/3 TEa,符合《医学实验室质量和能力认可准则在临床化学检验领域的应用说明》中对分析性能的要求;对卫生部20份室间质控品检测结果与靶值进行比对,结果全部满分,显示准确度良好;线性范围与厂商提供的性能指标相符.结论罗氏cobas c702生化分析仪检测系统精密度、准确度及线性范围等主要性能在该实验室均达到了相关标准的要求.【期刊名称】《检验医学与临床》【年(卷),期】2016(013)010【总页数】4页(P1403-1406)【关键词】全自动生化分析仪;精密度;准确度;线性范围;性能验证【作者】魏涛;钟志娟;许坚锋;孔伟圣【作者单位】广东省中医院珠海医院,广东珠海 519015;中山大学附属第五医院,广东珠海519000;广东省中医院珠海医院,广东珠海 519015;珠海贝索细胞科学技术有限公司,广东珠海519000【正文语种】中文根据《医疗机构临床实验室管理办法》和《医学实验室质量和能力认可准则》的规定要求,实验室应对设备、检测系统或方法的主要分析性能进行验证,证实其能够达到临床检测所要求的标准[1]。
本研究对罗氏cobas c702生化分析仪共28个项目的准确度、精密度和线性范围等3项主要性能进行了验证。
现报道如下。
1.1 一般资料标本均取自广东省中医院珠海医院2014年4~5月患者及健康体检者新鲜血液标本共56份。
生化校准方案1. 简介生化校准方案是一种用来验证生物感测器和生化分析仪器准确性的方法。
通过校准,可以保证生化分析结果的精确性和可靠性,从而提高实验结果的有效性。
本文档将介绍生化校准方案的目的、原理和步骤。
2. 目的生化校准的目的是确保生化仪器在测量生物样本时能够提供准确的数据。
通过校准,可以解决仪器的误差和偏差问题,消除系统性误差,以提高测量结果的可靠性。
3. 原理生化校准的基本原理是通过与已知浓度的标准溶液进行比较,确定仪器的测量值与实际浓度之间的偏差。
校准涉及到校准曲线的建立,根据标准溶液的浓度和对应的仪器测量值,绘制出校准曲线。
校准曲线可以用来将仪器测量结果转化为准确的浓度值。
4. 步骤生化校准通常包括以下步骤:4.1 准备标准溶液准备一系列已知浓度的标准溶液,这些标准溶液的浓度应覆盖待测样本的浓度范围。
标准溶液的制备需要依照相关实验方法和浓度计算,确保溶液浓度的准确性。
4.2 进行测量使用生化分析仪器对标准溶液进行测量。
确保仪器处于正常工作状态,并按照仪器操作手册进行操作。
4.3 记录测量值记录仪器对每个标准溶液的测量值,包括仪器显示的数值和对应的标准溶液浓度。
4.4 绘制校准曲线根据记录的测量值和对应的标准溶液浓度,绘制校准曲线。
通常使用散点图将测量值和浓度进行可视化表示,并通过拟合曲线来找到测量值和浓度之间的函数关系。
4.5 计算校准参数根据校准曲线的拟合函数,计算校准参数,包括斜率、截距和相关系数等。
这些校准参数将用于将仪器测量结果转化为准确的浓度值。
4.6 校准仪器利用校准参数对生化仪器进行校准。
校准的方法可以是手动调整仪器参数,也可以是通过仪器自动校准功能完成。
4.7 验证校准使用已知浓度的标准溶液进行校准后的仪器再次进行测量。
比较测量结果与标准溶液浓度的偏差,验证校准的准确性。
如果校准效果不理想,可以重新调整校准参数并重复此步骤。
4.8 记录校准结果最后,对校准过程中的关键步骤、参数和结果进行记录。
性能验证报告单位名称:AAAAA医院科室名称:检验科实验室:生化组仪器名称:贝克曼库尔特全自动生化分析仪型号规格:AU-5831仪器编号:SH027验证人员:审核人:批准人:验证日期:2012年11月26日—2012年12月12日AAAAA医院检验科性能验证报告目录碱性磷酸酶(ALP)方法学验证 (2)丙氨酸氨基转移酶(ALT)方法学验证 (9)载脂蛋白A1(apo AⅠ)方法学验证 (16)载脂蛋白B(apoB)方法学验证 (24)天冬氨酸氨基转移酶(AST)方法学验证 (31)总胆固醇(TC)方法学验证 (38)肌酸激酶(CK)方法学验证 (45)γ-谷氨酰基转移酶(GGT)方法学验证 (52)乳酸脱氢酶(LDH)方法学验证 (59)总胆红素(T-Bil)方法学验证 (66)甘油三酯(TG)方法学验证 (73)尿酸(UA)方法学验证 (80)白蛋白(Alb)方法学验证 (87)尿素(Urea)方法学验证 (96)肌酐(Cr)方法学验证 (105)葡萄糖(Glu)方法学验证 (114)总蛋白(TP)方法学验证 (123)碱性磷酸酶(ALP)方法学验证一.检测系统信息:项目:碱性磷酸酶(ALP)仪器名称:贝克曼库尔特全自动生化分析仪仪器型号: AU5831试剂及厂商:北京中生北控生物科技股份有限公司检测方法:速率法二.验证的相关参数:需验证参数厂商参数验证结果分析灵敏度(lower detectionlimit) 浓度为230U/L的ALP所引起的吸光度变化率(△A/min)应在0.020-0.090的范围内沿用厂商参数分析测量范围(AMR)1-1200U/L 已验证临床报告范围(CRR)1-16800U/L 根据厂家相关参数换算而来参考值区间(Expected values) 26-150U/L 已验证最大允许误差。
三.验证过程:1.精密度(Precision):1.1 批内精密度:●目的:考察方法的随机误差●标本来源:浓度分别处于正常和病理水平的混合新鲜临床标本,正常水平标本来源条码号:12061910922,12112810099,12112810107,12112810053 。
生化分析系统方法学性能验证标准操作程序1.目的对生免组检测项目进行性能验证,以保证所采用的相关试剂盒的分析性能能满足临床检测的要求和实验室的质量目标。
2.范围适用于生免组引进的检测系统,包括1.首次引入的检测系统2.引入的新项目3.修改原有检测系统或检测项目的检测参数4.仪器更换了涉及检测的部件。
3.验证前准备3.1仪器设备的准备:根据生免组仪器设备的维护保养程序, 验证前,实验人员或请仪器厂家工程师对验证过程中需要用到的仪器设备进行全面的维护保养,以确保所涉及的仪器设备处于正常运行状态。
3.2试剂的准备3.2.1试剂盒的准备:验证前,确保足够用于验证的同批号试剂盒,如可能,可以再适当准备一些另一批号的试剂。
3.2.1室内质控品的准备:按照《生化定量室内质量控制标准操作程序》规定的室内质控品购买和制备方法进行准备。
4.拟验证参数的确定按照ISO15189要求,生化项目需要验证的参数包括测量精密度、正确度、线性范围、生物学参考区间、可报告区间等。
要求检测过程中采取质量控制措施,尽可能保证检测系统处于一个稳定状态。
5.精密度实验5.1标本来源:两个浓度水平的质控品。
5.2验证周期5.2.1每个检测项目开展时验证一次。
5.2.2新装机时验证一次。
5.2.3设备更换检测部件重复性不能满足要求或更换检测系统时验证一次。
5.3验证方法5.3.1按照临床标本相同的检测方法,连续五天,每天做一批,每批每个水平4次重复测定,记录结果并计算均值、标准差和批内精密度、批间精密度(%)。
5.3.2 如果因为质量控制程序或操作问题判断一批失控,应剔除数据,并增加并执行一个分析批,剔除量小于综总测量数据的5%。
5.3.3正常使用每日质控品。
5.3.4按照厂家的操作说明进行校准。
5.3.5有效数据处理:见下表。
5.5结果判断结果判读:以批内变异系数<1/4TEa允许范围为最大允许偏移值;批间变异系数<1/3TEa允许范围为最大允许偏移值。
生化性能验证心得体会高中生化性能验证是生物学领域中的一种基础实验技术。
在高中生物课程中,这一实验常常作为一种必修实验展开,旨在帮助学生更好地理解细胞的结构和功能。
在我完成这一实验过程中,我不仅深入了解了生物学中的基础理论知识,还掌握了一种高效、精确的实验技能。
首先,生化性能验证需要掌握的基础知识包括:酸碱指示剂的性质、细胞膜的结构与功能、酶的结构与功能,以及蛋白质的特性等。
在理论基础方面的学习中,我清楚地认识到实验和生物学的紧密联系。
在实验过程中,我使用一种叫做“苹果酸酐”的指示剂,这种指示剂具有良好的溶解性,加入后可以快速将颜色变化表现出来。
我们将其加入到破碎的大肠杆菌单层上,然后观察颜色的变化。
通过实验,我学习了细胞膜的基本结构和功能,以及苹果酸酐的性质和用途。
另外,在实验中,我也学习了如何通过观察破碎的大肠杆菌单层,来判断酶的特性和功能。
我们将细胞膜分离开,并获得其内部物质进行实验。
通过添加不同酶类,我们可以观察到不同的化学反应。
这些反应帮助了我的学习,让我更快地了解酶的结构和功能,以及它们的重要性。
对于我的实验体验,我认为,掌握基础知识和理论非常重要。
同时,我还学会了如何操作实验工具、如何分离细胞膜、如何测量化学反应等。
与此同时,我也认识到了实验中的存在的风险,以及安全手段是多么重要。
因此,只有完成相关的理论课程、掌握实验技能、理解安全方面的要求,我们才能够更好地完成实验。
总的来说,生化性能验证是一种既必要又有趣味的实验。
我收获了大量的知识和技能,并学会了如何在实践中探究生物学的基础原理。
这一实验教育了我,让我更好地了解生物学,开阔了我的视野。
我深感荣幸,能够在我的高中学习中接触到如此精彩的实验技能。