物质组成的表示方法(1)
- 格式:doc
- 大小:48.50 KB
- 文档页数:2

第四讲 物质组成的表示 知识能力解读知能解读 (一)化学式 1.化学式的概念用元素符号和数字的组合来表示物质组成的式子。
注意每种纯净物的组成是固定不变的,表示每种物质组成的化学式只有一个,是通过实验测定的,不能臆造。
离子的数目;(3)化学式右下角的数字表示一个某粒子中某原子或原子团的数目;(4)离子符号右上角的数字表示该离子所带电荷数;(5)元素符号(原子团)正上方的数字表示该元素(原子团)的化合价。
3个二氧化碳分子个二氧化碳分子中含有1个碳原子2个氣原子-2+4注意化学式前面的化学计量数可变,化学式中各元素符号右下角的数字不能变。
(1)22K Hg Zn Si He Ne Ar H O ⎧⎪⎪⎨⎪⎪⎩金属单质:习惯上用元素符号表示,如、、等固态非金属单质:习惯上用元素符号表示,如C 、等单质稀有气体单质:用元素符号表示,如、、等气体非金属单质:在元素符号右下角写上表示分子中所含原子数的数字,如、等说明稀有气体和金属是由原子直接构成的,因此可用元素符号来表示它们的化学式;固态非金属单质,它们的结构非常复杂,因此化学式也用元素符号来表示。
(2)化合物化学式的写法书写化合物的化学式时,应注意以下四点: ①这种物质由哪些元素组成;②化合物中各元素的原子个数比是多少; ③化合物里元素排列顺序的规定;④表示原子个数的“小数字”的书写部位。
注意①一般正价元素在前、负价元素在后,每种元素的原子数目写在元素符号右下角。
②化学式中原子(或原子团)个数比一般是最简整数比。
③化合物中元素正、负化合价的代数和一定等于0。
④化学式中原子团的个数≥2时,原子团必须加“( )”,表示原子团个数的数字应标在“( )”的右下方;个数为1时,原子团不加“( )”,“1”省略不写。
5.化学式的读法(1)单质化学式的读法一般除双原子分子构成的气态单质在元素名称后加“气”字外,其余直接读元素名称。
如:2O 读作氧气,2I 读作碘等。


第三节物质组成的表示方法一.化学式反映物质的组成小结:纯净物都有固定的组成,化学式是物质客观组成的反映,化学式还能反映物质的微观构成情况,是国际通用的化学语言,一种物质只能有一种化学式。
1、化学式:就是用元素符号和数字的组合来表示纯净物组成的式子。
提出的依据:任何纯净物都有固定的组成,不同的物质组成不同。
①.单质化学式的写法小结:金属单质、稀有气体、一些固态的非金属单质(如碳、硅、硫、磷等)直接用元素符号表示化学式,如铝Al、铁Fe、氖气Ne。
由分子构成的单质,则在元素符号右下角标出分子中所含原子的数目,如氧气O2、臭氧O3、氮气N2、氯气Cl2、足球烯C60、氢气H2 。
②.化合物的化学式写法物质名称所含原子或离子个数比化学式氧化铜Cu、O 1∶1 CuO氯化钙Ca2+、Cl 1∶2二氧化硅Si、O 1∶2碳酸钙Ca2+、CO32- 1∶12、化学式表示的意义议一议:“CO2”能表示哪几层含义?(1)表示二氧化碳这种物质;(2)表示二氧化碳由碳、氧两种元素组成;(3)表示一个二氧化碳分子;(4)表示一个二氧化碳分子由一个碳原子和两个氧原子构成。
小结:化学式表示的意义:(1)表示一种物质;(2)表示该物质由哪些元素组成;(3)表示该物质的一个分子或原子;(4)表示该物质的一个分子的构成。
练习:(1)用化学用语表示:五个水分子;10个氢气分子;铜;一氧化碳;四氧化三铁;氖气。
(2)写出下列符号中数字的含义:2H2SO4第一个2表示,氢右下角的2表示,氧右下角的4表示。
(3)维生素C的化学式为C6H8O6,关于“C6H8O6”表示的意义正确的是()A.表示维生素C这种物质B.表示维生素C由碳、氢、氧三种元素组成C.表示1个维生素C分子D.表示维生素C由6个碳原子、8个氢原子、6个氧原子构成二.如何书写化合物的化学式想一想:根据下列物质的化学式,找一找元素符号编写顺序有什么规律?氧化铝Al 2O 3、氯化钙CaCl 2、水H 2O 、二氧化碳CO 2、碳酸钙CaCO 3指出:书写化合物的化学式必须知道化合物由哪些元素组成、原子或离子的个数比,同时还应了解符号的编写顺序。
课题:第二节物质组成的表示方法(第一课时)【学习目标】1.知识与技能①能对常见的物质进行简单分类,并能从组成上区分单质和化合物。
②记住一些常见元素的名称和符号;说出常见元素的化合价。
④能读懂某些商品标签上标示的物质成分为元素。
2.过程与方法①通过交流和讨论,使学生能清楚的表达自己的观点,形成良好的学习习惯和学习方法。
通过对纯净物和元素的分类,进一步体会分类的思想,学习分类的方法。
【教学内容分析】本节教材从学生在前几章教材中所见到的分子模型入手,把原子归类,建立元素的概念,并在次基础上学习单质和化合物的概念,顺势给出了表示元素的一些符号,这样把宏观物质、微观构成和抽象符号很自然地结合在一起,易于学习和掌握。
【教学对象分析】人类使用符号的历史源远流长,图形、标记、语言文字、数字、公式等这些符号的使用是学生在潜移默化中学会的,学生以前可能不曾体会绘画、做标记、书写各种文字都是在使用符号实现对事物的记载和与他人的交流,没有体会使用符号给人类带来的便捷。
当他们知道构成大千世界形形色色的物质的元素不外乎一百多种,每一种元素都有一种特定的便于书写和交流的符号,学会了这些符号和运用这些符号表示多样化的物质的规则,就可以与全世界的人方便地进行学术交流!他们可能会对学习充满兴趣。
【实验用品】分子模型、卡片、磁铁、铁钉、菠菜等【教学过程】【教学反思】这是一节思考讨论式的探究学习课,学生通过解决一系列问题来认识元素和元素符号,在学习知识的过程中体会科学方法的应用,建立物质的元素观。
本节课有两大特色:——通过分子模型的制作与拆分,建立起元素的概念。
在教师的引导下,学生通过一套“分子模型”自然而然,顺理成章地形成了对元素的认识。
——通过排列“纸牌”的活动,明确元素符号的书写和分类。
在教师的引导下,学生通过一幅幅“纸牌”非常愉快、轻松地掌握了元素符号的书写和分类。
在组织本节课的这两个主要的探究活动时,因问题的发散性较强,所以需要教师做好及时的调控和引导,使学生们在规定的时间内完成本节课的学习目标。


§3-4 物质组成的表示方法(一)一、学习目标:1、能说出物质化学式的含义;2、熟记常见元素的化合价及常用原子团;3、会根据元素及原子团化合价书写离子符号;二、教学重点、难点:常见元素的化合价及常用原子团化合价的熟记、正确书写化学式。
三、教学流程:(第一课时:化学式反映物质的组成、化合价)§3-4 物质组成的表示方法(二)一、学习目标:1、通过练习掌握化合价、化学式的表示;2、会根据化合价书写一般物质化学式;3、会根据化学式确定元素的化合价;4、了解化合物的命名。
二、教学重点、难点:掌握化学式的的含义§3-4 物质组成的表示方法(三)——根据化学式计算(第一课时)一、学习目标:1、学会根据化学式计算各原子的质量比;2、学会根据化学式计算纯净物中某元素的质量比。
二、教学重点、难点:根据化学式计算各原子的质量比、计算纯净物中某元素的质量比。
一、学习目标:1、加强相对分子质量、元素原子质量比、某元素的质量分数的计算训练。
2、不纯净物中元素质量分数、元素质量的计算。
二、教学重点、难点:物质中元素质量的计算一、教学目标了解不纯物的有关计算二、教学重点、难点:不纯物中元素质量分数的理解与应用三、教学过程:不纯物中,某纯物质的质量分数=混合物的质量纯物质的质量×100%公式转化:纯物质的质量=混合物的质量×某纯物质的质量分数混合物的质量=某纯物质的质量分数纯物质的质量练习:例1 硝酸铵样品中含有杂质10%(杂质中不含氮元素),求样品中氮元素的质量分数设不纯的硝酸铵中氮元素的质量分数为x ,则有如下关系:例2 某不纯的尿素[CO(NH2)2]中氮元素的质量分数为42.4%,求这种尿素中杂质(不含氮元素)的质量分数。
设不纯的尿素中含尿素的质量分数为x ,则有如下的关系。

第3章第三节物质的组成(第1课时)【学习目标】1、能知道一些常见元素和原子团的化合价,并熟记化合价2、能认识化学式的意义【学习重点、难点】1、能根据化合价原则书写化合物的化学式2、能认识化学式的意义【学习过程】一、课前预习〖阅读〗P81-83二、思考与交流(一)化学式反映物质的组成〖阅读〗P81,完成下列内容:1、化学式:用和表示纯净物组成的式子2、任何纯净物都有固定的组成,一种纯净物只有个化学式,一个化学式可以表示多种物质,如C可以表示、。
3、化学式表示的意义①、写在元素符号或化学式前面的数字,表示原子或分子个数,只有微观意义如2Fe表示2H2O表示②、写在化学式中元素符号右下角的数字,表示1个分子中所含的原子个数,如H2O中“2”表示③、写在元素符号右上角的数字,表示该元素的离子所带的电荷数,如Mg2+中的“2”表示5、书写单质的化学式①、金属单质、稀有气体及大多数固态非金属单质用其来表示。
如铁的化学式是,氦气的化学式是,碳的化学式是;②、非金属元素气体、液体、少数固体单质,在元素符号右下角写上表示分子中的数字,如H2、O2、N2、Cl2;溴常温下为液态,化学式为Br2;碘为固态,化学式为I2.(二)化合价1、元素在相互化合时,生成物中各元素的原子个数比一定。
若无此个数比,就不能形成稳定的化合物,反映这个比的,就是化合价。
2、化合价是元素的性质,它是用来表示原子之间相互化合的数目。
3、原子团:常作为一个整体参加反应的原子集团,也叫根。
〖阅读〗P83表3-7 常见元素和原子团的主要化合价,总结规律,并熟记。
6、化合价规律:(1)在化合物里,正负化合价的代数和为零。
(这是书写化学式和判断化学式正误的依据)(练习):净水剂铁酸钠Na2FeO4、绿矾FeSO4中铁元素的化合价分别是、A.+2 B.+3 C.+5 D.+6(2)在单质分子里,元素的化合价为零。
(为什么?)(练习):算出下列物质中氯元素的化合价:①KCl; ②Cl2; ③HClO; ④HClO3; ⑤NaClO4(3)同一种化合物里同一种元素的化合价可以不同。


物质构成的表示式知识点总结1.原子的构成 (1)原子是化学变化中的最小粒子(2)原子由带正电的原子核和带负电的电子构成,原子核以由带正电的质子和不带电的中子构成,核电荷数=核内质子数=核外电子数。
( 3)原子的质量、体积很小,原子在不断地运动,原子间存在一定的间隔。
(4)相对原子质量:以一种碳原子质量的1/12为标准,其他原子质量跟它相比较所等到的比。
原子的质量主要集中在原子核上。
相对原子质量=质子数+中子数。
2、元素(1)元素:具有相同核电荷数(即核内电子数)的一类原子的总称。
(决定元素种类的是核电荷数或核内电子数。
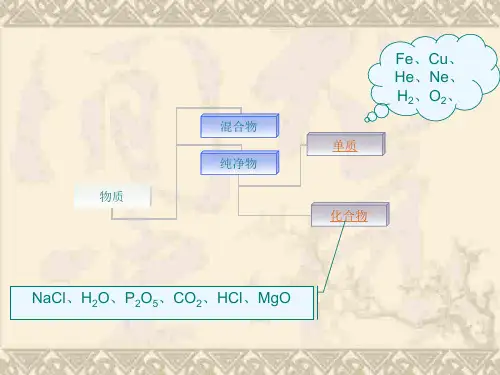
)(2)元素可以组成物质。
由同种元素组成的纯净物叫单质,由不同种元素组成纯净物叫化合物。
(3)元素的分类。
金属元素、非金属元素、稀有气体元素。
(4)元素符号①每种元素都用一个国际通用的符号来表示,这种符号叫做元素符号。
②元素符号表示的意义:表示一种元素、表示这种元素的一个原子。
(金属元素符号、稀有气体元素符号,还可以表示一种物质。
)(5)元素周期表①根据元素的原子结构和性质,把它们科学有序地排列起来就得到了元素周期表。
②元素周期表有7个横行,18个纵行,7个周期,16个簇。
3、离子 (1)离子是带电的原子或离子团,离子也是构成物质的一种粒子。
(2)核外电子的排布。
金属元素原子最外层电子一般少于4个,化学反应中很容易失去电子,从而带正电形成阳离子;非金属元素原子最外层电子一般多于4个,化学反应中很容易得到电子,从而带正电形成阴离子;稀有气体原子最外层具有8个(He为2个电子)的相对稳定结构。
决定元素化学性质的是原子的最外层电子数。
4、化学式与化合价(1)化学式:用元素符号表示物质组成的式子。
化学式表示的意义:①表示一种物质;②表示这种物质的元素组成;③表示该物质的一个分子;④表示该物质一个分子的组成。
(2)化学上用化合价表示元素原子之间相互化合的数目,单质中元素的化合价为0。
(3)应用化合价推求物质化学式的根据是:在化合物中正负化合价代数和等于零1、下列叙述正确的是()A、原子核都是由质子和中子构成的B、在原子中,核内质子数与核外电子数不一定相等C、不同种类的原子,核内质子数不同,核外电子数可以相同D、原子里有相对较大的空间,电子在这个空间里做高速运动2、已知一个碳12原子的质量为ag,某原子的质量为bg,该原子的相对原子质量为()A、12a/bB、a/12bC、12b/aD、b/12a3、博士伦隐形眼镜洗液的主要成份是双氧水,下列关于双氧水的叙述正确的是()A、双氧水由氧气和氢气组成B、双氧水由氢元素和氧元素组成C、双氧水分子由氧分子和氢分子组成D、双氧水分子由二个氢元素和二个氧元素组成4、国际互联网报道,目前世界上有近20亿人患有缺铁性贫血,我国政府即将启动“酱油补铁工程”,这里的铁是指()A、铁元素B、铁单质C、四氧化三铁D、氧化铁5、下列叙述中错误的是()A、在化合物中,金属元素一定显正价,非金属元素有时显正价,有时显负价B、在各种原子团中,各原子的化合价的代数和一定不等于0C、化合价是元素的原子在形成化合物时表现出来的一种性质D、在H2O和O2中氧元素的化合价相同6、有X、Y、Z三种元素,它们的化合价分别为+1、+5、-2,由这三种元素组成的化合物的化学式可能为()A、X2YZ3B、XYZ3C、X3YZ4D、X2YZ47、N2表示氮气,还可以表示()①氮元素②1个氮分子③2个氮原子④氮气由氮元素组成⑤1个氮分子由2个氮原子构成⑥2个氮分子A、①②③B、②④⑤C、②④⑥D、①②③④⑤⑥8、1991年,我国化学家测得了In元素的相对原子质量的新值,它核电荷数为49,相对原子质量为115,中子数为()A、115B、 49C、66D、1649、下列符号中,既能表示一种元素,又能表示一个原子和一种单质的是()A、MgB、HeC、H2D、O10、等质量的下列金属含原子数目最多的是()A、锌B、铁C、铝D、镁11、地壳中含量最多的非金属元素是氧元素,最多的金属元素是铝元素,由它们组成的化合物的化学式为()12、Fe、Fe2+、Fe3+三种粒子具有相同的(核内质子数),因而属于同种元素,但它们的化学性质,这是因为它们的不同。
物质组成的表示方法〖知识要点〗一、化学式反映物质的组成1、化学式:用元素符号和数字组合表示纯净物组成的式子,叫做化学式。
注意:任何纯净物都有固定的组成,不同的物质组成不同,化学式是对物质组成情况的真实反映。
2、化学式的涵义:(1)宏观上:a、表示一种物质;b:表示该物质由哪些元素组成。
(2)微观上:a、表示该物质的一个分子;b:表示一个分子里含有多少原子。
3、单质化学式的书写:(1)金属单质及稀有气体单质是由原子直接构成的。
因此它们的化学式直接用元素符号来表示,如铁用“Fe”表示,氦“He”用表示,常温下为固态的大多数非金属单质,由于它们的结构比较复杂,化学式也用元素符号来表示,如碳“C”用表示,磷用“P”表示。
(2)常见气态非金属单质,大多数是由两个原子构成一个分子(即双原子分子),它们的化学式是在其元素符号的右下角加小数字,以表示它们的组成,如氧气“O2”用表示;氢气用“H2”表示。
二、如何书写化合物的化学式1、化合价(1)在化合物中,不同元素原子的数目有确定的比值关系,体现这种关系的数值就是元素的化合价。
(2)常见元素和原子团的主要化合价常见元素的化合价口诀:氢钾钠银正一价;钙镁钡锌正二价;正三铝,氧负二,单质永远是零价。
常见原子团的化合价口诀:负一硝酸氢氧根,负二硫酸碳酸根,负三记住磷酸根,正一价的是铵根。
(3)化合价的表示方法通常标在元素符号或原子团的正上方,且“+”或“-”号写在前,价数写在后。
例,常见的正价元素:……常见的负价元素:……常见原子团化合价:……2、化合物化学式的书写:(1)写化学式时,正价元素通常写在左边,负价元素写在右边,原子的数目用阿拉伯数字写在元素符号的右下角;(2)在金属化合物中,金属元素一般呈正价,非金属元素一般呈负价,在非金属氧化物中,非金属元素一般呈正价;(3)根据化合物中各种元素化合价的代数和等于零的原则,确定化合物中各种元素的原子数目。
注意:化学式只能表示物质的组成,用化合价法则推算化学式,只有在该化合物实际存在时才有意义,不能根据化合价凭空臆造,随意书写化学式。
【高中化学】化学知识物质组成的表示方法总结任何纯净物都有固定的组成,一种物质只能有一个化学式。
一般来说,一些简单物质是由原子组成的,如金属、稀有气体、钻石等。
对于由原子组成的简单物质,其化学式直接由元素符号表示。
有的单质由分子构成,如氢气、氮气、氧气、氯气,它们的每一个分子中都含有2个原子,称为双原子分子,它们的化学式:先写出元素符号,在元素符号的右下角加上数字“2”。
例如氢气:h2。
当元素相互结合形成化合物时,所含原子或离子的数量比是固定的。
这个数比反映了元素的性质——价。
会根据化合物中化合价的代数和等于零的原则书写化学式即可。
该公式可用于记忆常见元素或原子团的化合价:一价钾钠氢氯银,二价钙镁钡锌氧铝、硅、铁、碳二四六硫都齐全,铜汞二价最常见常见原子团的价态:负一硝酸氢氧根负硫酸氢碳酸盐正一价的是铵根原子团:在化学反应中,并非所有时间都作为一个整体参与反应;原子团不能单独存在,必须与其他原子或原子团结合才能成为物质的化学式。
化合价只有在元素之间形成化合物时才能表现出来的,当元素以单质的形式存在时,其化合价一定为零。
根据化合价写出化学式是学习化学的基础。
如果你不能熟练地写出化学式,你就不能写出化学方程式供以后学习。
它的重要性不言而喻。
写化学公式是一项技能。
技能的培养在于更多的实践。
反复练习,熟能生巧。
一般来说,书写化学式的正确顺序是:正价前,负价后;金属左,非金右,氧化物中氧在后。
① 当原子团簇的数量为1时,1被省略,不需要写在括号中;如果原子簇的数量是2或3,则原子簇被括在括号中,数字标记在括号的右下角。
②+2价的铁称亚铁。
③ 事实上不存在的物质的化学式不能根据化合价随机生成。