大学化学(无机类)化学平衡的移动(授课讲义)
- 格式:ppt
- 大小:374.00 KB
- 文档页数:17


化学平衡的移动--化学平衡常数讲义(doc 33页)第三节化学平衡的移动化学平衡常数【高考目标定位】考纲导引考点梳理1.理解外界条件(温度、压强、催化剂)对化学反应平衡的影响,认识其一般规律。
2.了解化学平衡的调控在生活、生产和科学研究领域中的重要作用。
1.影响化学平衡的外界条件及原理。
2.化学反应进行的方向。
【考纲知识梳理】【要点名师精解】一、反应焓变与反应方向1.反应方向(1)多数能自发进行的化学反应是放热反应。
如氢氧化亚铁的水溶液在空气中被氧化为氢氧化铁的反应是自发的,其△H(298K)==-444.3kJ·mol—1(2)部分吸热反应也能自发进行。
如NH4HCO3(s)+CH3COOH(aq)==CH3COONH4(aq)+CO2 (g)+H2O(l),其△H(298K)== +37.30kJ·mol—1。
(3)有一些吸热反应在常温下不能自发进行,在较高温度下则能自发进行。
如碳酸钙的分解。
因此,反应焓变不是决定反应能否自发进行的唯一依据。
2.反应熵变(1)熵:描述大量粒子混乱度的物理量,符号为S,单位J·mol—1·K—1,熵值越大,体系的混乱度越大。
(2)化学反应的熵变..(△S):反应产物的总熵与反应物总熵之差。
(3)反应熵变与反应方向的关系①多数熵增加的反应在常温常压下均可自发进行。
产生气体的反应、气体物质的量增加的反应,熵变都是正值,为熵增加反应。
②有些熵增加的反应在常温下不能自发进行,但在较高温度下则可自发进行。
如碳酸钙的分解。
③个别熵减少的反应,在一定条件下也可自发进行。
如铝热反应的△S== —133.8 J·mol—1·K—1,在点燃的条件下即可自发进行。
yx ——++ⅠⅡ ⅢⅣ 4.焓变和熵变对反应方向的共同影响——“四象限法”判断化学反应的方向。
在二维平面内建立坐标系,第Ⅰ象限的符号为“+、+”,第Ⅱ象限的符号为“+、—”,第Ⅲ象限的符号为“—、—”,第Ⅳ象限的符号为“—、+”。


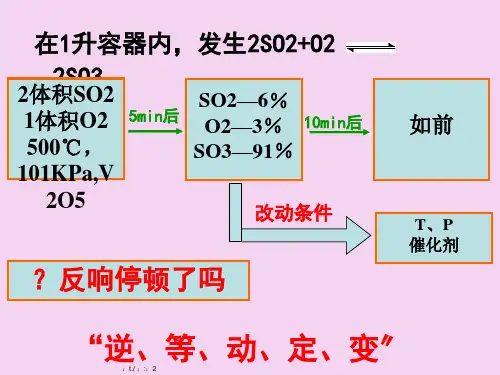
《化学平衡的移动》讲义一、化学平衡的概念在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态,叫做化学平衡状态。
化学平衡是一种动态平衡,表面上看起来反应好像停止了,但实际上正反应和逆反应仍在不断进行,只是正、逆反应速率相等,各物质的浓度不再发生变化。
二、化学平衡的特征1、“逆”:化学平衡研究的对象是可逆反应。
2、“等”:平衡时正反应速率和逆反应速率相等。
3、“动”:化学平衡是一种动态平衡,反应仍在进行。
4、“定”:平衡时各物质的浓度、百分含量等保持不变。
5、“变”:当外界条件改变时,平衡可能发生移动。
三、影响化学平衡移动的因素1、浓度(1)增加反应物浓度或减少生成物浓度,平衡向正反应方向移动。
(2)减少反应物浓度或增加生成物浓度,平衡向逆反应方向移动。
以反应 A + B ⇌ C 为例,如果增加 A 的浓度,那么 A 与 B 结合生成 C 的速率就会加快,正反应速率增大,平衡向正反应方向移动,从而使更多的 A 转化为 C,直到建立新的平衡。
2、压强(1)对于有气体参加且反应前后气体体积发生变化的反应,增大压强,平衡向气体体积减小的方向移动;减小压强,平衡向气体体积增大的方向移动。
(2)对于反应前后气体体积不变的反应,改变压强平衡不移动。
例如,对于反应 N₂+ 3H₂⇌ 2NH₃,反应前气体的计量数之和为4,反应后为2。
当增大压强时,体系的体积减小,各物质的浓度增大。
此时,正反应速率和逆反应速率都增大,但正反应速率增大的程度更大,所以平衡向正反应方向移动。
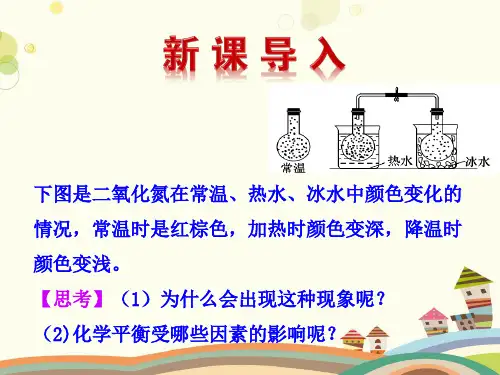
3、温度(1)升高温度,平衡向吸热反应方向移动。
(2)降低温度,平衡向放热反应方向移动。
在一个放热反应中,升高温度会使平衡向吸热的方向移动,以吸收多余的热量;反之,降低温度则会使平衡向放热的方向移动,以释放热量。
4、催化剂使用催化剂能同等程度地改变正、逆反应速率,平衡不移动。
催化剂只是加快了反应达到平衡的时间,但不会改变平衡的状态。