大学无机化学第五章试题及标准答案
- 格式:doc
- 大小:123.00 KB
- 文档页数:9

第五章答案1. (1) 3.8×10−17 mol·dm−3(2) 3.58×10−2 mol·dm−3(3) 3.3×10−3 mol·dm−32. 2.90×10−703. (1) 1.34×10−4 mol·dm−3(2) 1.8×10−7 mol·dm−3(3) 1.8×10−5 mol·dm−34. FeS能溶于1.00 mol·dm−3的盐酸中,HgS则不溶。
5. 1.19×10−46. [Ag+]=[Cl−]=1.3×10−5 mol·dm−3[Ba2+]=[SO42−]=1.3×10−5 mol·dm−37. 4.9×10−108. 无CaSO4沉淀产生,有BaSO4沉淀产生。
9. (1) 3.8×10−4 mol·dm−3(2) 不相等。
因为F-离子的存在,大大减少了Sr2+的存在,增加了CO32-的存在。
10. 平衡时无PbBr2固体存在。
11. 7.3×10−412. 无ZnS沉淀,有CuS沉淀。
[H+]=0.32 mol·dm−3[Zn2+]=0.01 mol·dm−3[Cu2+]=3.74×10−15 mol·dm−313. (1) 52.7 mg/100 cm3(2) 7.0×10−4 mol·dm−314. (1) 无CdS沉淀,(2) 有CdS沉淀。
15. (1) pH=1.08(2) 有CaC2O4沉淀,第一种沉淀后不会有BaC2O4沉淀。
16. (1) 有Mg(OH)2沉淀。
(2) 加入12.8 g NH4Cl(s)。
17. (1) 1.84×10−14 mol·dm−3(2) 5.8×10−11 mol·dm−318. [Ag+]=2.4×10−5 mol·dm−3[MoO42−]=4.6×10−2 mol·dm−319. 111 mL20. (1) [SO42−]=1.8×10−5 mol·dm−3(2) 18%(3) 2.16×10−3 mol 21. [Sr2+]=8.7×10−4 mol·dm−3[Ba2+]=1.7×10−6 mol·dm−3[SO42−]=8.7×10−4 mol·dm−322. (1) AgCl先沉淀(2) [Cl−]=4.03×10−5 mol·dm−3(3) 7.15×10−4 g23. 95.6 %24. (1) 3.67 (2) 6.3925. 无BaF2沉淀产生26. 无AgAc沉淀产生27.28. −1.37 < pH ≤ 1.3329. 1.06 g30. [Br−]=3.0×10−5 mol·dm−3[I−]=4.8×10−9 mol·dm−331. 1.0×10−5 mol·dm−332. 3.0×10−1033. 1.7 g34. [Ag+]=1.0×10−8 mol·dm−3[Cl−]=0.017 mol·dm−3[Br−]=5.0×10−5 mol·dm−3[Na+]=0.067 mol·dm−3[NO3−]=0.05 mol·dm−335. [Ag+]=0.0053 mol·dm−3[Cl−]=3.2×10−8 mol·dm−3[Ba2+]=5.6×10−7 mol·dm−3[SO42−]=0.0027 mol·dm−336. 有ZnS和NiS沉淀37. 0.35 g·dm−338. 无FeS沉淀产生39. [Ba2+]=1.4×10−8 mol·dm−3[SO42−]=1.3×10−4 mol·dm−3[Sr2+]=6.0×10−3 mol·dm−3[CrO42−]=6.0×10−3 mol·dm−340. [Ag+]=1.3×10−11 mol·dm−3[Cl−]=1.4×10−2 mol·dm−3[I−]=6.4×10−6 mol·dm−3[Tl+]=1.4×10−2 mol·dm−341. [I−]=1.0×10−8 mol·dm−342. [Ag+]=4.3×10−10 mol·dm−3[NO2−]=1.1×10−4 mol·dm−343. (1) K=5.88×10−3(2) K=1.18×104对于同种类型的难溶电解质,在某种离子浓度相近时,K sp大的沉淀可以转化成K sp小的沉淀。

大连理工大学无机化学第六版第五章课后思考题答案1、香豆素与浓度高的碱长时间加热生成的产物是()[单选题] *A脱水化合物B顺式邻羟基桂皮酸(正确答案)C反式邻羟基桂皮酸D醌式结构2、从香豆素类的结构与分类看,下列属于简单香豆素类的是()[单选题] *A龙脑B七叶内酯(正确答案)C薄荷醇D西瑞香素3、使游离香豆素呈现红色的是()[单选题] *A异羟肟酸铁反应(正确答案)BA-萘酚-浓硫酸反应C浓硫酸-没食子酸D浓硫酸-变色酸4、以橙皮苷为指标成分进行定性鉴别的中药是()[单选题] * A葛根B黄芩C槐花D陈皮(正确答案)5、具有挥发性的生物碱是()[单选题] *A吗啡碱B麻黄碱(正确答案)C苦参碱D小檗碱6、以下不属于吸附色谱法的操作步骤的是()[单选题] *A制板B洗脱(正确答案)C点样D显色7、下列溶剂中亲脂性最强的是()[单选题] *A甲醇B苯(正确答案)C三氯甲烷D丙酮8、下列方法哪一个不是按照色谱法的分离原理不同进行分类的是()[单选题] *A离子交换色谱B薄层吸附色谱(正确答案)C凝胶色谱D分配色谱9、检识黄酮类化合物首选()[单选题] *A盐酸-镁粉反应(正确答案)B四氢硼钠反应C硼酸显色反应D锆盐-枸橼酸反应10、以下哪种方法是利用混合中各成分在溶剂中的溶解度不同或在冷热情况下溶解度显著差异的原理而达到分离的()[单选题] *A沉淀法B分馏法C结晶法(正确答案)11、单萜和倍半萜在化学结构上的明显区别是()[单选题] *A氮原子数不同B碳原子数不同(正确答案)C碳环数不同D硫原子数不同12、药材虎杖中的醌结构类型为()[单选题] *A苯醌类B萘醌类C蒽醌类(正确答案)D菲醌类13、分馏法分离挥发油的主要依据是()[单选题] *A密度的差异B沸点的差异(正确答案)C溶解性的差异D旋光性的差异14、由两个苯环通过三碳链相互连接成的具有6C-3C-6C基本骨架的一系列化合物是()[单A苷类B黄酮类(正确答案)C醌类D生物碱类15、能影响黄酮类成分的溶解性的因素有(多选)()*A黄酮的类型(正确答案)B苷元上取代基的种类、数目和位置(正确答案)C糖基的数目和位置(正确答案)D分子立体结构(正确答案)16、能提取出中药中的大部分亲水性成分和绝大部分亲脂性成分的溶剂是()[单选题]* A乙醚B乙醇(正确答案)C水D苯17、在溶剂沉淀法中,主要是在溶液中加入另一种溶剂一改变混合溶剂的什么实现的()[单选题] *ApH值B溶解度C极性(正确答案)D体积18、以葛根素为指标成分进行定性鉴别的中药是()[单选题] *A葛根(正确答案)B黄芩C槐花D陈皮19、大黄素型蒽醌母核上的羟基分布情况是()[单选题] *A一个苯环的β位B苯环的β位C在两个苯环的α或β位(正确答案)D一个苯环的α或β位20、适用于队热及化学不稳定的成分、低极性成分的提取()[单选题] * A渗漉法B超声提取法C回流提取法D超临界流体提取法(正确答案)21、碱水提取芦丁时,若PH过高会使()[单选题] * A产品质量降低B产品收率降低(正确答案)C苷键水解断裂D内酯环开环22、下列哪个中药中含有机酸()[单选题] *A金银花(正确答案)B大黄C黄芩D乌头23、牛蒡子属于()[单选题] *A香豆素类B木脂内酯(正确答案)C苯丙酸类D黄酮类24、属于倍半萜的化合物是()[单选题] *A龙脑B莪术醇C薄荷醇D青蒿素(正确答案)25、处方中厚朴主要化学成分厚朴酚,其结构类型是()[单选题] * A黄酮B香豆素C木脂素(正确答案)D三萜皂苷26、极性最大的溶剂是()[单选题] *A酸乙酯(正确答案)B苯C乙醚D氯仿27、四氢硼钠反应变红的是()[单选题] *A山柰酚B橙皮素(正确答案)C大豆素D红花苷28、当一种溶剂无法结晶时,常常使用混合溶剂,下列不是常用的混合溶剂是()[单选题] *A甲醇-水B乙酸-水C乙醚-丙酮D石油醚-水(正确答案)29、萃取法是利用混合物中各成分在两相溶剂中的分配.系数不同而到达分离的方法,所谓两相溶剂是指()[单选题] *A两种相互接触而又不相溶的溶剂(正确答案)B两种不相互接触而又互相溶的溶剂C两种不相互接触而又不相容的溶剂D两种互相接触而又互相溶的溶剂30、不属于木脂素类化合物的物理性质的是()[单选题] *A一般没有挥发性B有光学活性C易溶于有机溶剂D有色晶体(正确答案)。
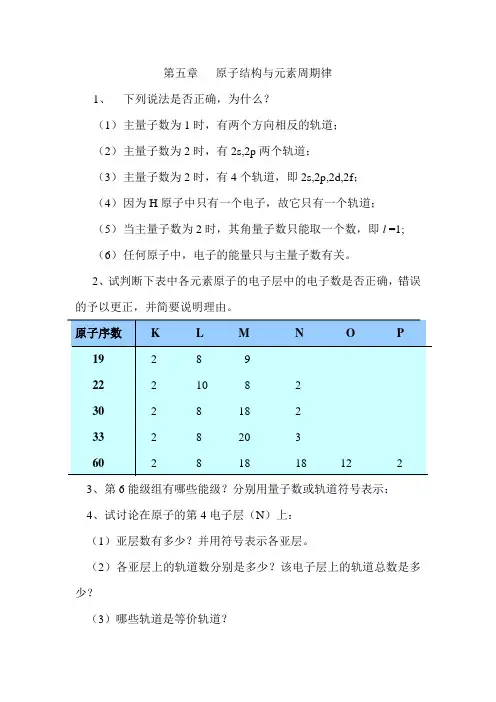
第五章原子结构与元素周期律1、下列说法是否正确,为什么?(1)主量子数为1时,有两个方向相反的轨道;(2)主量子数为2时,有2s,2p两个轨道;(3)主量子数为2时,有4个轨道,即2s,2p,2d,2f;(4)因为H原子中只有一个电子,故它只有一个轨道;(5)当主量子数为2时,其角量子数只能取一个数,即l =1;(6)任何原子中,电子的能量只与主量子数有关。
2、试判断下表中各元素原子的电子层中的电子数是否正确,错误的予以更正,并简要说明理由。
3、第6能级组有哪些能级?分别用量子数或轨道符号表示:4、试讨论在原子的第4电子层(N)上:(1)亚层数有多少?并用符号表示各亚层。
(2)各亚层上的轨道数分别是多少?该电子层上的轨道总数是多少?(3)哪些轨道是等价轨道?5、写出与下列量子数相应的各类轨道符号,并写出其在近似能级图中的前后能级所对应的符号:(1)n=2, l=1(2) n=3, l =2(3) n=4, l =0(4) n=4, l =36、在下列各项中,填入合适的量子数:(1)n=?, l=2, m=0, m s=±1/2(2)n=2, l=?, m=-1, m s=±1/2(3)n=4, l=?, m=+2, m s=±1/2(4)n=3, l=0, m=?, m s=±1/27、指出下列假设的电子运动状态(依次为n,l,m, m s),哪几种不可能存在?为什么?(1)3,2,+2,+1/2 (2)2, 2, -2, +1/2(3)2, 0, +1, -1/2 (4) 2, -1, 0, +1/2(5) 4, 3, -1, 18、原子吸收能量由基态变成激发态时,通常是最外层电子向更高的能级跃迁。
试指出下列原子的电子排布中,哪些属于基态或激发态,哪些是错误的。
(1)1s2 2s2 2p1(2)1s2 2s2 2p62d1(3) 1s22s22p43s1(4) 1s2 2s4 2p29、写出原子序数为45,52,79各元素的原子核外电子排布式及其价层电子构型。

第5章 溶液与电离平衡习题答案原子量取四位有效数字,计算过程采用“四舍六入五成双”取舍,热力学数据除题目给出外均引用自书后附录以及兰氏手册。
1. 实验室某些常用的试剂百分浓度及密度分别是:(1)浓盐酸:含HCl 37.0%,密度1.19 g ⋅cm -3;加至3位有效数字 (2)浓硫酸:含H 2SO 4 98.0%,密度1.98 g ⋅cm -3; (3)浓硝酸:含HNO 3 70.0%,密度1.42 g ⋅cm -3; (4)浓氨水:含NH 3 28.0%,密度0.900 g ⋅cm -3。
试分别计算它们的物质的量浓度。
解:(1) -33-3-131.19g cm 1000cm 37.0%12.0mol dm 36.5g mol 1.0dmn c V ⋅⨯⨯===⋅⋅⨯ (2)19.8 mol·dm -3(3)15.8 mol·dm -3 (4)14.8 mol·dm -3 2. 是非题(1) 0.10 mol .dm -3 HAc 溶液中c (H +) = 1.3⨯10-3 mol .dm -3,故0.050 mol .dm -3 HAc 溶液中c (H +) = 0.65⨯10-3 mol .dm -3;(2)向浓度均为0.10 mol .dm -3的NH 3⋅ H 2O- NH 4Cl 的缓冲溶液中,加入HCl 使c (HCl) = 0.099 mol .dm -3,则由于溶液的缓冲作用,pH 不变;(3)Na 2CO 3溶液中通入适量CO 2气体,便可得到一种缓冲溶液; (4)多元弱酸盐的水解(如Na 3PO 4),以第一步水解为主;(5)将浓度均为0.10 mol .dm -3的HAc 和NaAc 混合溶液冲稀至浓度均为0.05 mol .dm -3,则由于HAc 电离度增大,混合溶液的酸度降低; (6)在一定的温度下,改变溶液的pH ,水的离子积不变; (7)弱电解质的电离度随弱电解质浓度降低而增大;(8)NH 4Ac 为一元弱酸碱盐,水解程度很大,故其水溶液的酸碱性很大。

一、选择题1.氢气与下列物质反应中,氢气不作为还原剂的是( )A. 单质硫单质硫B. 金属锂金属锂C. 四氯化钛四氯化钛D. 乙烯乙烯解:选B 。
氢原子与碱金属结合生成金属氢化物,氢原子能得到电子,是作为氧化剂参与反应。
应。
2.下列各组物质可共存于同一溶液中的是( )A. NH 4+ , H 2PO 4-, K + , Cl -, PO 43- B. Pb 2+ , NO 3-, Na + , SO 42- C. Al(OH) 3, Cl -, NH 4+, NH 3·H 2O D. Sn 2+ , H + , Cr 2O 72- , K +, Cl -解:选A 。
选项B 中Pb 2+,SO 42-能够生成沉淀PbSO 4; 选项C 中,强电解质的存在,会促进Al(OH) 3的凝聚。
选项D 中Sn2+ 与Cr 2O 72-在H +下会发生氧化还原反应。
只有A 中各离子不会发生反应,能够稳定存在。
子不会发生反应,能够稳定存在。
3.下列叙述正确的是(.下列叙述正确的是( )A. 22O H 分子构型为直线形分子构型为直线形B. 22O H 既有氧化性又有还原性既有氧化性又有还原性C. 22O H 的水溶液很稳定的水溶液很稳定D. 22O H 与722O Cr K 的酸性溶液反应生成稳定的5CrO解:选B 。
22O H 分子中存在过氧链—O —O —,过氧链在相当于书本的书脊位置上,而两个氢原子在半展开的两页纸面位置上,所以22O H 分子构型不是直线形。
22O H 的水溶液不稳定,遇杂质易分解。
22O H 与722O Cr K 的酸性溶液反应生成3Cr +。
22O H 中O 的氧化态居中,所以既22O H 既有氧化性又有还原性。
既有氧化性又有还原性。
4.地方性甲状腺肿大引起的原因是(.地方性甲状腺肿大引起的原因是( )A. 氟过多氟过多B. 碘过多碘过多C. 碘不足碘不足D. 维生素不足维生素不足解:选C 。

第五章 习题5-2用质子理论判断下列物质哪些是酸?并写出它的共轭碱。
哪些是碱?也写出它的共轭酸。
其中哪些既是酸又是碱?H 2PO 4-,CO 32-,NH 3,NO 3-,H 2O ,HSO 4-,HS -,HCl解:酸HCl ,HSO 4- 碱CO 32-,NO 3-, 既是酸又是碱NH 3,H 2PO 4-,H 2O ,HS -, 5-3氨水是一弱碱,当氨水浓度为0.200 mol .L -1时,NH 3H 2O 的离解度α为0.946%,问当浓度为0.100 mol .L -1时NH 3H 2O 时电离度α为多少?解:222211ααθc c K a == %423.010.0%)946.0(02.0222112=⨯==c c αα 5-4 0.01 mol ⋅L -1 HAc 溶液的解离度为4.2%,求同一温度下,HAc 的解离常数和溶液的pH值。
解:5221076.1%)2.4(01.0-⨯=⨯==αθc K a∵{θc c /}﹒)(HAc K a θ=0.01×1.76×10-5>61.1210-,{θc c /}/)(HAc K a θ=0.01/1.76×10-5>81.210∴θc H c /)(+=θθc c K a /=01.01076.15⨯⨯-=4.2×10-3 pH=2.385-5水溶液中,强酸与强碱反应的离子反应式为 H + + OH -= H 2O , 反应的标准平衡常数Kθ=θwK 1; 强酸与弱一元碱反应的离子反应式为 B -+ H + = HB , 反应的标准平衡常数K θ=θ)(1HB a K , 弱一元酸与强碱反应的离子反应式为 HB +OH -= B -+ H 2O , 反应的标准平衡常数K θ=θθwHB a K K )( ; 弱一元酸与弱一元碱反应的离子反应式为HA + B - = A -+HB , 反应的标准平衡常数K θ=θθ)()(HB a HA a K K 。

无机化学(第四版)答案第一章物质的结构1-1 在自然界中氢有三种同位素,氧也有三种同位素,问:总共有种含不同核素的水分子?由于3H太少,可以忽略不计,问:不计3H时天然水中共有多少种同位素异构水分子?1-2 天然氟是单核素(19F)元素,而天然碳有两种稳定同位素(12C和13C),在质谱仪中,每一质量数的微粒出现一个峰,氢预言在质谱仪中能出现几个相应于CF4+的峰?1-3 用质谱仪测得溴得两种天然同位素的相对原子质量和同位素丰度分别为79Br 789183占50。
54%,81Br 80。
9163占49。
46%,求溴的相对原子质量(原子量)。
1-4 铊的天然同位素203Tl和205Tl的核素质量分别为202。
97u和204。
97u,已知铊的相对原子质量(原子量)为204。
39,求铊的同位素丰度。
1-5 等质量的银制成氯化银和碘化银,测得质量比m(AgCl):m(AgBr)=1。
63810:1,又测得银和氯得相对原子质量(原子量)分别为107。
868和35。
453,求碘得相对原子质量(原子量)。
1-6 表1-1中贝采里乌斯1826年测得的铂原子量与现代测定的铂的相对原子质量(原子量)相比,有多大差别?1-7 设全球有50亿人,设每人每秒数2个金原子,需要多少年全球的人才能数完1mol金原子(1年按365天计)?1-8 试讨论,为什么有的元素的相对质量(原子量)的有效数字的位数多达9位,而有的元素的相对原子质量(原子量)的有效数字却少至3~4位?1-9 太阳系,例如地球,存在周期表所有稳定元素,而太阳却只开始发生氢燃烧,该核反应的产物只有氢,应怎样理解这个事实?1-10 中国古代哲学家认为,宇宙万物起源于一种叫“元气”的物质,“元气生阴阳,阴阳生万物”,请对比元素诞生说与这种古代哲学。
1-11 “金木水火土”是中国古代的元素论,至今仍有许多人对它们的“相生相克”深信不疑。
与化学元素论相比,它出发点最致命的错误是什么?1-12 请用计算机编一个小程序,按1.3式计算氢光谱各谱系的谱线的波长(本练习为开放式习题,并不需要所有学生都会做)。

第五章氧化-还原反应无机化学习题解答(5)思考题1.什么是氧化数如何计算分子或离子中元素的氧化数氧化数是某一原子真实或模拟的带电数。
若某一原子并非真实得到若失去电子而带电荷,可以认为得到与之键合的电负性小于它的原子的电子或给予与之键合的电负性大于它的原子电子,然后计算出来的带电情况叫氧化数。
已知其他原子的氧化数,求某一原子的氧化数时可用代数和的方法,中性分子总带电数为零;离子总带电数为离子的电荷。
2.指出下列分子、化学式或离子中划线元素的氧化数:As2O3 KO2 NH4+ Cr2O72- Na2S2O3 Na2O2 CrO5 Na2PtCl6 N2H2 Na2S52.As2O3 +3,KO2 +1,NH4+ -3,Cr2O72-+3,Na2S2O3 +2,Na2O2 -1,CrO5 +10,Na2PtCl6 +4,N2H2 -1,Na2S5 -2/5,3.举例说明下列概念的区别和联系:⑴氧化和氧化产物⑵还原和还原产物⑶电极反应和原电池反应⑷电极电势和电动势3.⑴氧化是失去电子氧化数升高,所得氧化态较高产物即为氧化产物。
⑵还原是得到电子氧化数降低,所得氧化态较较产物即为还原产物。
⑶在某个电极上发生的反应为电极反应,分为正极的还原反应和负极的氧化反应,总反应为原电池反应。
⑷固体电极材料与所接触的溶液间的电势差即为该原电池的电极电势。
两电极构成原电池时两电极间的电势差为该原电池的电动势。
4.指出下列反应中何者为氧化剂,它的还原产物是什么何者为还原剂,它的氧化产物是什么⑴2FeCl3+Cu→FeCl2+CuCl2⑵Cu+CuCl2+4HCl→2H2[CuCl3]⑶Cu2O+H2SO4→Cu+CuSO4+H2O4.⑴氧化剂:FeCl3,还原产物:FeCl2,还原剂:Cu,氧化产物:CuCl2。
⑵氧化剂:CuCl2,还原产物:2H2[CuCl3],还原剂:Cu,氧化产物:2H2[CuCl3]。
⑶氧化剂:Cu2O,还原产物:Cu,还原剂:Cu2O,氧化产物:CuSO4。

第五章1.解释过渡金属的有机金属化合物的结构与金属d电子组态的关系:d6组态的有机金属化合物常采取六配位八面体结构;d8组态的采取五配位四方锥或三角双锥结构;d10组态的采取四配位四面体结构,并举出一些实例。
(提示:根据18电子规则)(P191)答:过渡金属有机金属化合物满足有效原子序数规则,即金属的全部电子数与所有配体提供的σ 电子的总和恰好等于金属所在周期中稀有气体的原子序数。
如果只考虑价层电子,那么金属价电子数加上配体σ 电子数的总和等于18 的分子是稳定的,即18 电子规则。
这一规则反映了过渡金属原子用它的5 个nd 轨道,一个(n+1)s 轨道和3个(n+1)p 轨道总共9个价轨道最大程度地成键,在每个价轨道中可容纳一对自旋相反的电子,共计18个电子形成稳定结构。
对于d6组态,其配位数为(18-6)/2 = 6 ,所以多采取六配位八面体结构,如[V(CO)6]-和Cr(CO)6等;对于d8组态,其配位数为(18-8)/2 = 5 ,所以采取五配位四方锥或三角双锥结构,如Fe(CO)5等;对于d10组态,其配位数为(18-10)/2= 4 ,所以采取四配位四面体结构,如Ni(CO)4等。
2.解释以下羰基伸缩振动频率的变化:[V(CO)6]-Cr(CO)5[Mn(CO)6]+cm-l1860 2000 2090答:配位化合物离子所带的电荷对νCO有影响,如上边的等电子系列中,负电荷增加,反馈作用增强,C≡O键削弱,使νCO 下降;反之正电荷阻止电173子从金属移向CO 的空轨道,反馈作用减弱,造成νCO 增加。
4.根据下列红外光谱图判断羰基的类型。
答:CO的不同配位方式可以通过红外光谱鉴定,已知中性分子中M-CO端基的CO伸缩振动频率在1900~2150cm-1范围内,而与正常双键性质相应的“酮式”CO,即μ2-桥基CO 的伸缩振动频率降低到1750~1850cm -1范围内,叁桥的μ3-CO 具有更低的伸缩振动频率。

⼤学⽆机化学第五章试题及解答第五章原⼦结构和元素周期表本章总⽬标:1:了解核外电⼦运动的特殊性,会看波函数和电⼦云的图形2:能够运⽤轨道填充顺序图,按照核外电⼦排布原理,写出若⼲元素的电⼦构型。
3:掌握各类元素电⼦构型的特征4:了解电离势,电负性等概念的意义和它们与原⼦结构的关系。
各⼩节⽬标:第⼀节:近代原⼦结构理论的确⽴学会讨论氢原⼦的玻尔⾏星模型213.6E eV n =。
第⼆节:微观粒⼦运动的特殊性1:掌握微观粒⼦具有波粒⼆象性(h h P mv λ==)。
2:学习运⽤不确定原理(2h x P mπ≥)。
第三节:核外电⼦运动状态的描述1:初步理解量⼦⼒学对核外电⼦运动状态的描述⽅法——处于定态的核外电⼦在核外空间的概率密度分布(即电⼦云)。
2:掌握描述核外电⼦的运动状态——能层、能级、轨道和⾃旋以及4个量⼦数。
3:掌握核外电⼦可能状态数的推算。
第四节:核外电⼦的排布1:了解影响轨道能量的因素及多电⼦原⼦的能级图。
2;掌握核外电⼦排布的三个原则:○1能量最低原则——多电⼦原⼦在基态时,核外电⼦尽可能分布到能量最低的院⼦轨道。
○2Pauli 原则——在同⼀原⼦中没有四个量⼦数完全相同的电⼦,或者说是在同⼀个原⼦中没有运动状态完全相同的电⼦。
○3Hund 原则——电⼦分布到能量简并的原⼦轨道时,优先以⾃旋相同的⽅式分别占据不同的轨道。
3:学会利⽤电⼦排布的三原则进⾏第五节:元素周期表认识元素的周期、元素的族和元素的分区,会看元素周期表。
第六节:元素基本性质的周期性掌握元素基本性质的四个概念及周期性变化1:原⼦半径——○1从左向右,随着核电荷的增加,原⼦核对外层电⼦的吸引⼒也增加,使原⼦半径逐渐减⼩;○2随着核外电⼦数的增加,电⼦间的相互斥⼒也增强,使得原⼦半径增加。
但是,由于增加的电⼦不⾜以完全屏蔽增加的核电荷,因此从左向右有效核电荷逐渐增加,原⼦半径逐渐减⼩。
2:电离能——从左向右随着核电荷数的增多和原⼦半径的减⼩,原⼦核对外层电⼦的引⼒增⼤,电离能呈递增趋势。

第五章答案1. (1) 3.8×10−17 mol·dm−3(2) 3.58×10−2 mol·dm−3(3) 3.3×10−3 mol·dm−32. 2.90×10−703. (1) 1.34×10−4 mol·dm−3(2) 1.8×10−7 mol·dm−3(3) 1.8×10−5 mol·dm−34. FeS能溶于1.00 mol·dm−3的盐酸中,HgS则不溶。
5. 1.19×10−46. [Ag+]=[Cl−]=1.3×10−5 mol·dm−3[Ba2+]=[SO42−]=1.3×10−5 mol·dm−37. 4.9×10−108. 无CaSO4沉淀产生,有BaSO4沉淀产生。
9. (1) 3.8×10−4 mol·dm−3(2) 不相等。
因为F-离子的存在,大大减少了Sr2+的存在,增加了CO32-的存在。
10. 平衡时无PbBr2固体存在。
11. 7.3×10−412. 无ZnS沉淀,有CuS沉淀。
[H+]=0.32 mol·dm−3[Zn2+]=0.01 mol·dm−3[Cu2+]=3.74×10−15 mol·dm−313. (1) 52.7 mg/100 cm3(2) 7.0×10−4 mol·dm−314. (1) 无CdS沉淀,(2) 有CdS沉淀。
15. (1) pH=1.08(2) 有CaC2O4沉淀,第一种沉淀后不会有BaC2O4沉淀。
16. (1) 有Mg(OH)2沉淀。
(2) 加入12.8 g NH4Cl(s)。
17. (1) 1.84×10−14 mol·dm−3(2) 5.8×10−11 mol·dm−318. [Ag+]=2.4×10−5 mol·dm−3[MoO42−]=4.6×10−2 mol·dm−319. 111 mL20. (1) [SO42−]=1.8×10−5 mol·dm−3(2) 18%(3) 2.16×10−3 mol 21. [Sr2+]=8.7×10−4 mol·dm−3[Ba2+]=1.7×10−6 mol·dm−3[SO42−]=8.7×10−4 mol·dm−322. (1) AgCl先沉淀(2) [Cl−]=4.03×10−5 mol·dm−3(3) 7.15×10−4 g23. 95.6 %24. (1) 3.67 (2) 6.3925. 无BaF2沉淀产生26. 无AgAc沉淀产生27.28. −1.37 < pH ≤ 1.3329. 1.06 g30. [Br−]=3.0×10−5 mol·dm−3[I−]=4.8×10−9 mol·dm−331. 1.0×10−5 mol·dm−332. 3.0×10−1033. 1.7 g34. [Ag+]=1.0×10−8 mol·dm−3[Cl−]=0.017 mol·dm−3[Br−]=5.0×10−5 mol·dm−3[Na+]=0.067 mol·dm−3[NO3−]=0.05 mol·dm−335. [Ag+]=0.0053 mol·dm−3[Cl−]=3.2×10−8 mol·dm−3[Ba2+]=5.6×10−7 mol·dm−3[SO42−]=0.0027 mol·dm−336. 有ZnS和NiS沉淀37. 0.35 g·dm−338. 无FeS沉淀产生39. [Ba2+]=1.4×10−8 mol·dm−3[SO42−]=1.3×10−4 mol·dm−3[Sr2+]=6.0×10−3 mol·dm−3[CrO42−]=6.0×10−3 mol·dm−340. [Ag+]=1.3×10−11 mol·dm−3[Cl−]=1.4×10−2 mol·dm−3[I−]=6.4×10−6 mol·dm−3[Tl+]=1.4×10−2 mol·dm−341. [I−]=1.0×10−8 mol·dm−342. [Ag+]=4.3×10−10 mol·dm−3[NO2−]=1.1×10−4 mol·dm−343. (1) K=5.88×10−3(2) K=1.18×104对于同种类型的难溶电解质,在某种离子浓度相近时,K sp大的沉淀可以转化成K sp小的沉淀。
第5章 溶液与电离平衡习题答案原子量取四位有效数字,计算过程采用“四舍六入五成双”取舍,热力学数据除题目给出外均引用自书后附录以及兰氏手册。
1. 实验室某些常用的试剂百分浓度及密度分别是:(1)浓盐酸:含HCl 37.0%,密度1.19 g ⋅cm -3;加至3位有效数字 (2)浓硫酸:含H 2SO 4 98.0%,密度1.98 g ⋅cm -3; (3)浓硝酸:含HNO 3 70.0%,密度1.42 g ⋅cm -3; (4)浓氨水:含NH 3 28.0%,密度0.900 g ⋅cm -3。
试分别计算它们的物质的量浓度。
解:(1) -33-3-131.19g cm 1000cm 37.0%12.0mol dm 36.5g mol 1.0dmn c V ⋅⨯⨯===⋅⋅⨯ (2)19.8 mol·dm -3(3)15.8 mol·dm -3 (4)14.8 mol·dm -3 2. 是非题(1) 0.10 mol .dm -3 HAc 溶液中c (H +) = 1.3⨯10-3 mol .dm -3,故0.050 mol .dm -3 HAc 溶液中c (H +) = 0.65⨯10-3 mol .dm -3;(2)向浓度均为0.10 mol .dm -3的NH 3⋅ H 2O- NH 4Cl 的缓冲溶液中,加入HCl 使c (HCl) = 0.099 mol .dm -3,则由于溶液的缓冲作用,pH 不变;(3)Na 2CO 3溶液中通入适量CO 2气体,便可得到一种缓冲溶液; (4)多元弱酸盐的水解(如Na 3PO 4),以第一步水解为主;(5)将浓度均为0.10 mol .dm -3的HAc 和NaAc 混合溶液冲稀至浓度均为0.05 mol .dm -3,则由于HAc 电离度增大,混合溶液的酸度降低; (6)在一定的温度下,改变溶液的pH ,水的离子积不变; (7)弱电解质的电离度随弱电解质浓度降低而增大;(8)NH 4Ac 为一元弱酸碱盐,水解程度很大,故其水溶液的酸碱性很大。
第五章 习题1.在-78℃的NiBr 2的CS 2溶液里加入PEtPh 2时生成一种分子式为(PEtPh)2NiBr 2的红色配合物,在室温下静置后,该配合物转变成一种具有相同分子式的绿色配合物。
红色配合物是反磁性的,而绿色配合物却具有3.2B.M.的磁矩.(1)这两个配合物哪个是平面正方形的?哪个是四面体形的?说明你选定的理由.(2)根据选定的结构,合理地说明这两个配合物的颜色. 2.解释下列物质产生颜色的原因:(1)Pb 3O 4;(2)Ag2S (3)KMnO4;(4)+362O)H (Ti ; (5)Cr(CO)6(6)Cu[CuCl 3].3.比较下列两组配离子荷移谱带频率的高低: (1)[Pt(Ⅱ)L 4]和[Au (Ⅲ)L 4]; (2)[PtCl 4]2-和[PtBr 4]2-.4.填写下表空格处:5.解释下列化合物颜色不同原因:(1)[Fe(H 2O)6]3+,极淡紫色,[Fe(CN)6]3-,黄色;(2)[Co(H 2O)6]2+,浅粉红色,[CoCl 4]2-,深蓝色; (3)[Cr(NH 3)6]3+,黄色,[Cr(H 2O)6]3+,蓝紫色;(4)-24CrO ,黄色,-4MnO ,紫红色; (5)-4FeCl ,黄色,-4FeBr ,红色.6. -24CoCl 和-24CoI 两种化合物,哪一种具有较大的磁矩?为什么?7.根据下列化合物的有效磁矩,描述它们的电子结构和几何构型: (1)K 2[NiF 6],0.0..B.M. ;(2)[Mn(NCS)6]4-,6.06B.M. ;(3)[PtCl 4]2-,0.0B.M. ; (4)-24CoCl ,4.3~4.7B.M.(Et – 乙基,Ph – 苯基)8.反磁性配离子+33en)(Co 及-362)Co(NO 的溶液显橙黄色,顺磁性配合物Co(H 2O)3F 3及-36CoF 的溶液呈蓝色,定性地解释上述颜色的差别. 9.当[Co(NH 3)5X]2+配离子中,卤离子从F -→I -变更时,配体场d -d 跃迁谱带仅有微弱的位移,而荷移光谱却移得很多,为什么? 10.解释:高自旋的CoF 63-在可见吸收光谱中有一个吸收带。
无机及分析化学第五章答案(供参考)第五章沉淀溶解平衡与沉淀滴定1、写出下列难溶电解质的溶度积常数表达式:AgBr,Ag2S, Ca3(PO4)2, MgNH4AsO4解:AgBr2:KθSP=c(Ag +)/cθ·[c(Br-)/ cθ]2Ag2S:KθSP=c[(Ag +)/cθ]2·c(S2-)/ cθCa3(PO4)2:KθSP= [c(Ca2 +)/cθ]3·[c(PO43-)/ cθ]2 MgNH4AsO4:KθSP=c(Mg2 +)/cθ·c(NH4+)/cθ·c (AsO4-)/ cθ2、根据难溶电解质在水中的溶解度,计算KθSP(1)AgI的溶解度为1.08μg/500ml(2)Mg(OH)2的溶解度为6.53mg/1000ml.解:(1)KθSP=[1.08×10-6/(M(AgI)×500×10-3)]2=8.45×10-17(2).6.53mg/1000ml=6.53×10-3/1=1.12×10-41.12×10-4×(2×1.12×10-4)=5.6×10-123、比较Mg(OH)2在纯水、0.1mol?L-1NH4Cl水溶液及0.1mol?L-1氨水中的溶解度?①纯水KθSP =1.8×10-11=S? (2S)2S=1.65×10-4mol/l②0.1 mol/l NH4Cl S=0.24 mol/l③0.1 mol/l的氨水C(OH-)=51.0-=1.32×10-3 mol/l1074.1S×(1.32×10-3)2=1.1×10-11∴S=6.3×10-6 mol/l4、(1)错,F-是弱酸根,溶液酸性越强,越容易生成HF,从而使CaF2溶解。
第5章原子结构与元素周期性习题参考答案1.解:(1)n ≥ 3正整数;(2)l = 1;(3)m s = +½(或-½);(4)m = 0。
2.解:(1)不符合能量最低原理;(2)不符合能量最低原理和洪德规则;(3)不符合洪德规则;(4)不符合泡利不相容原理;(5)正确。
3.解:(1)2p x、2p y、2p z为等价轨道;(2)第四电子层共有四个亚层,最多能容纳32个电子。
亚层轨道数容纳电子数s 1 2p 3 6d 5 10f 7 14324.解:(2)P(Z=15)(3)1s22s22p63s23p64s2(4)Cr [Ar](5)Cu(6)[Ar]3d104s24p65.解:(1)[Rn] 5f146d107s27p2, 第7周期,ⅣA族元素,与Pb的性质最相似。
(2)[Rn] 5f146d107s27p6,原子序数为118。
6.解:离子电子分布式S2-1s22s22p63s23p6K+1s22s22p63s23p6Pb2+ [Xe]4f145d106s2Ag+ [Kr]4d10Mn2+ 1s22s22p63s23p63d5Co2+1s22s22p63s23p63d77.解:- 39 -- 40 - 8.解:9.解:(1)A 、B ;(2)C 、A +; (3)A ;(4)离子化合物,BC 2。
10.解:(1)有三种,原子序数分别为19、24、29; (211.解:12.解:A B C D(1)原子半径 大小 (2)第一电离能 小 大 (3)电负性 小 大 (4)金属性 强 弱。
第五章原子结构和元素周期表本章总目标:1:了解核外电子运动的特殊性,会看波函数和电子云的图形2:能够运用轨道填充顺序图,按照核外电子排布原理,写出若干元素的电子构型。
3:掌握各类元素电子构型的特征4:了解电离势,电负性等概念的意义和它们与原子结构的关系。
各小节目标:第一节:近代原子结构理论的确立 学会讨论氢原子的玻尔行星模型213.6E eV n =。
第二节:微观粒子运动的特殊性1:掌握微观粒子具有波粒二象性(h h P mv λ==)。
2:学习运用不确定原理(2h x P mπ∆•∆≥)。
第三节:核外电子运动状态的描述1:初步理解量子力学对核外电子运动状态的描述方法——处于定态的核外电子在核外空间的概率密度分布(即电子云)。
2:掌握描述核外电子的运动状态——能层、能级、轨道和自旋以及4个量子数。
3:掌握核外电子可能状态数的推算。
第四节:核外电子的排布1:了解影响轨道能量的因素及多电子原子的能级图。
2。
掌握核外电子排布的三个原则:○1能量最低原则——多电子原子在基态时,核外电子尽可能分布到能量最低的院子轨道。
○2Pauli 原则——在同一原子中没有四个量子数完全相同的电子,或者说是在同一个原子中没有运动状态完全相同的电子。
○3Hund 原则——电子分布到能量简并的原子轨道时,优先以自旋相同的方式分别占据不同的轨道。
3:学会利用电子排布的三原则进行第五节:元素周期表认识元素的周期、元素的族和元素的分区,会看元素周期表。
第六节:元素基本性质的周期性掌握元素基本性质的四个概念及周期性变化1:原子半径——○1从左向右,随着核电荷的增加,原子核对外层电子的吸引力也增加,使原子半径逐渐减小;○2随着核外电子数的增加,电子间的相互斥力也增强,使得原子半径增加。
但是,由于增加的电子不足以完全屏蔽增加的核电荷,因此从左向右有效核电荷逐渐增加,原子半径逐渐减小。
2:电离能——从左向右随着核电荷数的增多和原子半径的减小,原子核对外层电子的引力增大,电离能呈递增趋势。
3:电子亲和能——在同一周期中,从左至右电子亲和能基本呈增加趋势,同主族,从上到下电子亲和能呈减小的趋势。
4:电负性——在同一周期中,从左至右随着元素的非金属性逐渐增强而电负性增强,在同一主族中从上至下随着元素的金属性依次增强而电负性递减。
习题一选择题1.3d电子的径向函数分布图有()(《无机化学例题与习题》吉大版)A.1个峰B.2个峰C. 3个峰D. 4个峰2.波函数一定,则原子核外电子在空间的运动状态就确定,但仍不能确定的是()A.电子的能量B.电子在空间各处出现的几率密度C.电子距原子核的平均距离D.电子的运动轨迹3.在下列轨道上的电子,在xy平面上的电子云密度为零的是()(《无机化学例题与习题》吉大版)A .3sB .3p xC . 3p zD .3d z24.下列各组量子数中,合理的一组是()A .n=3,l=1,m l=+1,m s= +1/2B .n=4,l=5,m l= -1,m s= +1/2C .n=3,l=3,m l=+1,m s= -1/2D .n=4,l=2,m l=+3,m s= -1/25.第四周期元素原子中未成对电子数最多可达()(《无机化学例题与习题》吉大版)A.4B.5C.6D.76.下列电子的量子数(n,l,m和m s)不合理的是()A .3,0,0,+1/2B .3,0,0,-1/2C .3,1,0,-1/2D .3,3,0,+1/27.对3d电子来说,下列各组量子数中不正确的是()A. 3,2,2,+1/2B. 3,2,1,-1/2C. 3,2,0,+1/2D. 3,1,1,+1/28.主量子数n=4能层的亚层数是()(《无机化学例题与习题》吉大版)A.3B.4C. 5D.69.电子的钻穿本领及其受其它电子屏蔽效应之间的关系()A.本领越大,效应越小B.本领越大,效应越大C.两者无关系D.以上都不对10.Pb2+离子的价电子层结构是()(《无机化学例题与习题》吉大版)A.6s26p2B.5s25p2C.6s2D.5s25p65d106s211.在多电子原子中,下列电子具有如下量子数,其中能量最高的电子是()(《无机化学例题与习题》吉大版)A. 2,1,0,-1/2B. 2,1,1,-1/2C. 3,1,1,+1/2D.3,2,-2,-1/212.当基态原子的第五电子层只有2个电子时,则原子的第四电子层的电子数为()(《无机化学例题与习题》吉大版)A .8 B. 18 C .8~18 D. 8~3213.下列离子中的电子构型可以用[A1]3d6表示的是()A.Mn2+B.Fe3+C .Co3+D .Ni2+14.下列元素原子半径的排列顺序正确的是()A. Mg>B>Si>ArB. Ar>Mg>Si>BC. Si>Mg>B >ArD. B >Mg>Ar >Si15.下列元素中,原子半径最接近的一组()(《无机化学例题与习题》吉大版)A. Ne 、Ar、Kr、XeB. Mg 、Ca、Sr、BaC. B、C、N、OD. Cr、Mn、Fe、Co16.镧系收缩是下列各对元素中性质最相似的是()(《无机化学例题与习题》吉大版)A .Zr和Hf B.Ru和RhC .Mn和Tc D.Nd和Ta17.已知某元素原子的价电子层结构为3d54s2,则该元素在周期表中位置为()A.第四周期第ⅡA族B.第四周期第ⅡB族C.第四周期第VⅡA族D.第四周期第VⅡB族18.在下列元素中,电负性大小顺序正确的是()(《无机化学例题与习题》吉大版)A.F>N>OB. O>Cl>OC.A S>P>HD.Cl>S>A S19.第二电离能最大的原子应该具有的电子构型是()A.1s22s22p5B.1s22s22p6C.1s22s22p63p1D.1s22s22p63s220.下列各组元素的第一电离能按递增的顺序正确的是()(《无机化学例题与习题》吉大版)A.Na Mg AlB.B C NC.Si P AsD.He Ne Ar21.下列元素中第一电子亲和能最大的是()(《无机化学例题与习题》吉大版)A.OB.FC.SD.Cl22.下列元素基态原子的第三电离能最大的是()(《无机化学例题与习题》吉大版)A.CB.BC.BeD.Li23.某元素基态原子失去三个电子后,角量字数为2的轨道半充满,其原子序数为()(《无机化学例题与习题》吉大版)A.24B. 25C.26D.2724.下列元素中,书镧系元素的是()(《无机化学例题与习题》吉大版)A.TaB. TiC.TlD.Tm25.下列元素中属于放射性元素的是()(《无机化学例题与习题》吉大版)A.TaB. TbC.TcD.Tm二填空题1.4P亚层中轨道的主量子数为,角量子数为,该亚层的轨道最多可以有种空间取向,最多可容纳个电子。
(《无机化学例题与习题》吉大版)ϕ的物理意义是,电子云是形2.波函数ϕ是描述数学函数式,它和是同义词,2象化表示。
3.周期表中最活泼的金属为,最活泼的非金属为,原子序数最小的放射性元素为第周期元素,其元素符号为。
(《无机化学例题与习题》吉大版)4.质量数是56,中子数是30的基态原子电子构型;质量数为209,中子数为126的基态原子电子构型。
5.第四周期元素中4P轨道半充满的是,3d轨道半充满的是,4s轨道半充满的是,价电层s电子数与d电子数相同的是。
(《无机化学例题与习题》吉大版)6.原子序数为24的原子,其价电子结构是。
7.元素的性质随着的递增而呈现周期性的变化,这是原子的变化的反映,第四、六周期分别是能级组和能级组。
8.在各类原子轨道中,轨道的钻穿能力最强,由此引起的后果是。
(《无机化学例题与习题》吉大版)9.第33号元素原子的核外电子排布为,基态时最外层各电子的量子数为:n=;l=;m=;m s=该元素最高氧化态为,在周期表中属区元素,它的低价氧化物的化学式为,俗称。
10.镧系元素包括原子序数从至共个元素,从La到Lu半径共减少ppm,这一事实称为,其结果是。
(《无机化学例题与习题》吉大版)11.造成第三过渡元素原子半径和第二过渡元素原子半径相近的原因是。
12.给出下列元素的原子核外价电子排列方式W,Nb,Ru,Rh,Pd,Pt。
(《无机化学例题与习题》吉大版)13.用元素符号填空:⑴最活泼的气态金属元素是⑵最活泼的气态非金属元素是⑶最不易吸收电子的元素是⑷第四周期的第六个元素电子构型是⑸第Ⅰ电离势能最大的元素是⑹第Ⅰ电子亲核势能最大的元素是⑺第2、3、4周期原子中P轨道半充满的元素是⑻3d半充满和全充满的元素分别是和⑼电负性相差最近的元素是⑽电负性相差最大的元素是14.根据现代结构理论,核外电子的运动状态可用来描述,它在习惯上被称为;︱ ︳2表示,它的形象化表示是。
(《无机化学例题与习题》吉大版)15.非放射性元素中,单电子数最多的元素单电子数为,它在周期表中位于第周期,第族。
(《无机化学例题与习题》吉大版)三问答题1.原子轨道、几率密度和电子云等概念有何联系和区别?2.根据钾、钙的电离势数据,从电子构型说明在化学反应过程中,钾表现+1价,钙表现+2价的原因?3.写出下列元素的符号、名称、价电子构型和惰性气体在周期表中的分区。
(《无机化学例题与习题》吉大版)A. 第四周期的惰性气体B. 第四周期的ⅣB族元素C. 5p电子半充满的元素4.K和Ca中的4s能量和3d能量哪个低?(试用斯莱特经验公式求算E值)电子排布式应是什么?5.回答下列问题:⑴写出原子序数为32的元素的核外电子排布、元素符号、元素名称以及此元素在周期表中的位置。
6.符号d、3dz2和3d1各代表什么意义?7.原子核外电子的运动有什么特性?8.什么叫屏蔽效应?什么叫钻穿效应?如何解释下列轨道能量的差别?(《无机化学例题与习题》吉大版)(1)E1s<E2s<E3s<E4s(2)E3s<E3p<E3d(3)E4s<E3d9.说明下列事实的原因:(1)元素最外层电子数不超过8个;(2)元素次外层电子数不超过18个;(3)各周期所包含的元素数分别为2、8、8、18、18、32个。
10.下列术语的含义是什么?电离势、电子亲合势、电负性。
它们和元素周期律有什么样的关系?11.在第四周期的A、B、C、D四种元素,其价电子数依次为1、2、2、7,其原子序数按A、B、C、D依次增大。
已知A和B的次外层电子数为8,而C与D 为18,根据原子结构判断:(1)哪些是金属元素;(2)D与A的简单离子是什么?(3)哪一元素的氢氧化物碱性最强?(4)B与D两原子间能形成何种化合物?写出化学式。
参考答案一选择题1.A2. D3.C4.A5.C6.D7.D8.B9. A 10.C11.D 12.C13.C 14.B 15.D16.D17.D 18.D19.C 20.B21.D 22.B 23.C 24.D 25.C二填空题1.4,1,3,62.核外电子空间运动状态;原子轨道;电子在核外空间出现的几率密度;波函数2ϕ的形象化表示3.Fr,F,五Tc4.[18]3d64s2;[78]6s26p35.As,Cr和Mn,K,Cr和Cu,Ti6.3d54s1。