高中化学十字交叉法
- 格式:doc
- 大小:74.50 KB
- 文档页数:3


高中化学计算题的常用解题技巧(13)---十字交叉法
十字交叉法:十字交叉法是专门用来计算溶液浓缩及稀释,混合气体的平均组成,混合溶液中某种离子浓度,混合物中某种成分的质量分数等的一种常用方法,其使用方法为:
组分A的物理量a差量c-b
平均物理量c(质量,浓度,体积,质量分数等)
组分B的物理量b差量a-c
则混合物中所含A和B的比值为(c-b):(a-c),至于浓缩,可看作是原溶液A中减少了质量分数为0%的水B,而稀释则是增加了质量分数为100%的溶质B,得到质量分数为c的溶液.
[例15]有A克15%的NaNO3溶液,欲使其质量分数变为30%,可采用的方法是
A.蒸发溶剂的1/2
B.蒸发掉A/2克的溶剂
C.加入3A/14克NaNO3
D.加入3A/20克NaNO3
根据十字交叉法,溶液由15%变为30%差量为15%,增大溶液质量分数可有两个方法:(1)加入溶质,要使100%的NaNO3变为30%,差量为70%,所以加入的质量与原溶液质量之比为15:70,即要3A/14克.(2)蒸发减少溶剂,要使0%的溶剂变为30%,差量为30%,所以蒸发的溶剂的质量与原溶液质量之比为15%:30%,即要蒸发A/2克.如果设未知数来求解本题,需要做两次计算题,则所花时间要多得多。

一、十字交叉相乘法这是利用化合价书写物质化学式的方法,它适用于两种元素或两种基团组成的化合物。
其根据的原理是化合价法则:正价总数与负价总数的代数和为0或正价总数与负价总数的绝对值相等。
现以下例看其操作步骤。
二、十字交叉相比法我们常说的十字交叉法实际上是十字交叉相比法,它是一种图示方法。
十字交叉图示法实际上是代替求和公式的一种简捷算法,它特别适合于两总量、两关系的混合物的计算(即2—2型混合物计算),用来计算混合物中两种组成成分的比值。
三、十字交叉消去法十字交叉消去法简称为十字消去法,它是一类离子推断题的解法,采用“十字消去”可缩小未知物质的范围,以便于利用题给条件确定物质,找出正确答案。
其实十字交叉法就是解二元一次方程的简便形式如果实在不习惯就可以例方程解但我还是给你说说嘛像A的密度为10 B的密度为8 它们的混合物密度为9 你就可以把9放在中间把10 和8 写在左边标上AB 然后分别减去9 可得右边为1 1 此时之比这1:1 了这个例子比较简单但难的也是一样你自己好好体会一下嘛这个方法其实很好节约时间特别是考理综的时候其实十字交叉法就是解二元一次方程的简便形式如果实在不习惯就可以例方程解但我还是给你说说嘛像A的密度为10 B的密度为8 它们的混合物密度为9 你就可以把9放在中间把10 和8 写在左边标上AB 然后分别减去9 可得右边为1 1 此时之比这1:1 了这个例子比较简单但难的也是一样你自己好好体会一下嘛这个方法其实很好节约时间特别是考理综的时候(一)混和气体计算中的十字交叉法【例题】在常温下,将1体积乙烯和一定量的某气态未知烃混和,测得混和气体对氢气的相对密度为12,求这种烃所占的体积。
【分析】根据相对密度计算可得混和气体的平均式量为24,乙烯的式量是28,那么未知烃的式量肯定小于24,式量小于24的烃只有甲烷,利用十字交叉法可求得甲烷是0.5体积(二)同位素原子百分含量计算的十字叉法【例题】溴有两种同位素,在自然界中这两种同位素大约各占一半,已知溴的原子序数是35,原子量是80,则溴的两种同位素的中子数分别等于。

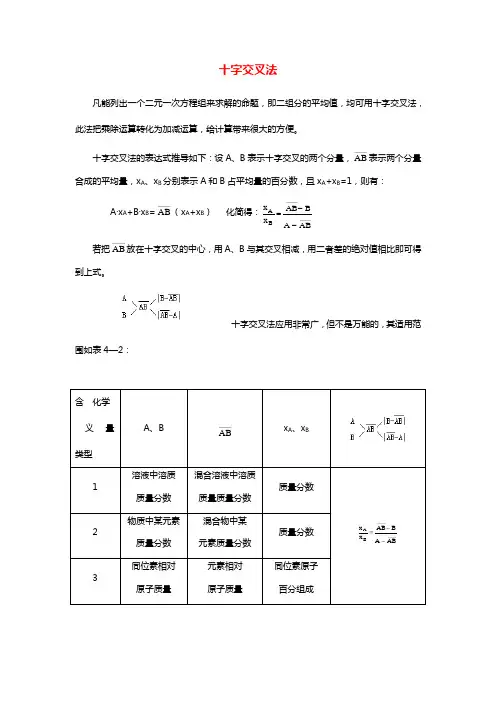
十字交叉法凡能列出一个二元一次方程组来求解的命题,即二组分的平均值,均可用十字交叉法,此法把乘除运算转化为加减运算,给计算带来很大的方便。
十字交叉法的表达式推导如下:设A 、B 表示十字交叉的两个分量,AB ——表示两个分量合成的平均量,x A 、x B 分别表示A 和B 占平均量的百分数,且x A +x B =1,则有: A ·x A +B ·x B =AB ——(x A +x B ) 化简得:x x AB B A ABA B =--———— 若把AB ——放在十字交叉的中心,用A 、B 与其交叉相减,用二者差的绝对值相比即可得到上式。
十字交叉法应用非常广,但不是万能的,其适用范围如表4—2:含 化学义 量类型A 、B AB —— x A 、x B 1 溶液中溶质质量分数混合溶液中溶质质量质量分数 质量分数 x x AB B A AB A B =--———— 2 物质中某元素质量分数混合物中某 元素质量分数 质量分数 3 同位素相对原子质量 元素相对 原子质量 同位素原子百分组成正确使用十字交叉法解题的关键在于:(1)正确选择两个分量和平均量;(2)明确所得比为谁与谁之比;(3)两种物质以什么为单位在比。
尤其要注意在知道质量平均值求体积或物质的量的比时,用此法并不简单。
1. 现有50g 5%的CuSO4溶液,把其浓度增大一倍,可采用的方法有:(1)可将原溶液蒸发掉g水;(2)可向原溶液中加入12.5% CuSO4溶液g;(3)可向原溶液中加入胆矾g;(4)可向原溶液中加入CuSO4白色粉末g。
2 . 今有NH4NO3和CO(NH2)2混合化肥,现测得含氮质量分数为40%,则混合物中NH4NO3和CO(NH2)2的物质的量之比为()(A)4∶3 (B)1∶1 (C)3∶4 (D)2∶33. (1)已知溶质质量分数分别为19x%和x%的两硫酸溶液,若将它们等体积混和,则所得混和液的溶质质量分数与10x的大小关系如何?(2)已知溶质质量分数为a%的氨水物质的量浓度是b mol·L-1,则a2%的氨水物质的量浓度与b2mol·L-1的大小关系如何?4. 将金属钠在空气中燃烧,生成Na2O与Na2O2的混合物。


化学十字交叉法化学十字交叉法化学十字交叉法是一种常用于有机合成中的化学反应设计方法。
该方法通过将多个反应条件、试剂和合成步骤交叉进行考虑,以达到优化反应的目的。
这种方法能够减少有机合成过程中的试剂使用量,同时降低反应所需的时间和成本,并优化反应结果。
化学十字交叉法的设计思路化学十字交叉法的设计包括四个方面:1. 反应物交叉条件:化学十字交叉法对反应物条件进行组合和匹配,以提高反应的化学收率和位选性。
在该方法中,反应物的组合不是随意选择的,而是依靠化学常识和实验经验,以避免无效或低效的反应。
2. 反应步骤交叉考虑:通过对反应步骤进行交叉考虑,可以找到化学合成中比较快速和有效的方法。
在很多实验条件下,反应步骤是可以交叉考虑的,这有助于优化反应的时间和成本,同时有助于提高合成的产率。
3. 反应温度和反应时间的考虑:化学十字交叉法还需要考虑反应的时间和温度,以使反应更加稳定和适存。
这些参数的设定通常需要依照各种不同的反应条件和情况来进行调整。
4. 推乳利用条件交叉:再比如说选择酰化反应中原料中二苯乙酸的化学常识和实验经验,在特定情况下有利于提高产量,而在其他情况下会导致反应效率的降低。
在此情况下,化学十字交叉法可以帮助实验者准确预测如何选择适当的反应条件,以达到更佳的结果。
化学十字交叉法的优势和应用化学十字交叉法的主要优势在于它可以优化反应条件,提高产量和降低成本。
在物质生产和有机合成方面,这种方法非常有用。
它可以通过优化试剂浓度、反应条件等参数来帮助提高反应速率和产量。
此外,在有机合成方面,该方法也具有重要的应用。
总的来说,化学十字交叉法在化学合成中具有广泛的应用和优势,可以帮助实验者准确地预测反应条件,以达到更优化和更有效的反应。
在不断突破化学合成技术的过程中,化学十字交叉法也将继续发挥着其独特的应用价值。

3 .十字交叉法十字交叉法又名混合规则法、杠杆原理等,它在化学计算中具有能简洁和迅速求解的特点。
1、十字交叉法的数学原理:凡能列出一个二元一次方程组来求解的命题,均可用十字交叉法。
如: 1211221x x a x a x a +=⎧⎨+=⎩平12a a a -平a平21a a a -平结论:2121a a x x a a -=-平平十字交叉法立足于二元一次方程的求解过程,并把该过程抽象为十字交叉的形式,所以凡能列出一个二元一次方程来求解的命题均可用此法。
2、使用范围列表如下:⎧⎪⎨⎪⎩溶液度混合十字交叉法平均化式量(原子量)平均耗氧量3、注意事项(1)适用于十字交叉法的量必须是具有加权平均意义的量,具体说是一些分数,如:质量分时、体积分数、物质的量分数或者是一些具有复合单位的量,如:摩尔质量、密度、燃烧热等。
(2)物理量必须具有简单的加和性。
如溶液质量等,而溶液混合时的体积不具有加和性,所以一般不可用物质的量浓度交叉求两溶液的体积比,只有稀溶液混合时近似处理忽略体积........变化..才可用十字交叉法求解。
(3)比的问题:什么比——基准物质以什么物理量为前提进行分量和平均量的确定得出的比,以物质的量为前提得出的是基准物质的物质的量之比;以一定质量为前提得出的是基准物质的质量之比。
练习1、质量百分比浓度溶液的混合如用的98%浓硫酸与7%的稀硫酸混合配成20%的硫酸溶液,则需浓硫酸与稀硫酸以质量比为混合恰好配成20%的硫酸。
2、物质的量浓度溶液的混合如用18mol/L的浓硫酸与2mol/L的稀硫酸混合成6mol/L的硫酸,则浓硫酸与稀硫酸的体积比是。
3、相对原子量的求算铜有两种天然同位素6529Cu和6329Cu,已知通的相对原子质量为63.5,估算6529Cu的百分含量(丰度)约为A、5%B、25%C、50%D、75%4、平均相对分子质量的计算甲烷和氧气混合后,其平均相对分子质量为24,则混合气体中甲烷与氧气的体积比为。

化学十字交叉简单计算公式化学是一门研究物质的组成、性质、结构和变化的科学,其中有许多复杂的计算公式。
在化学中,有一些简单的计算公式,可以通过化学十字交叉法来进行计算。
这些计算公式可以帮助化学家们快速准确地计算化学反应中的物质的量和质量,从而更好地理解和控制化学反应过程。
化学十字交叉法是一种简单的计算方法,它可以帮助我们快速计算化学反应中物质的量和质量。
这种方法通过交叉相乘的方式,将反应物和生成物之间的化学计量关系转化为数学计算关系,从而得到所需的结果。
在化学中,有许多不同的计算公式可以通过化学十字交叉法来进行计算。
其中包括摩尔计算、质量计算、体积计算等。
下面我们将分别介绍这些计算公式以及如何通过化学十字交叉法来进行计算。
首先是摩尔计算。
摩尔是化学中物质的量的单位,它表示1摩尔物质中包含的粒子数目为阿伏伽德罗常数(6.022×10^23)。
在化学反应中,我们经常需要计算反应物和生成物的摩尔数之间的关系。
通过化学十字交叉法,我们可以很容易地计算出反应物和生成物之间的摩尔数关系。
例如,对于化学方程式2H2 + O2 →2H2O,我们可以通过化学十字交叉法计算出1摩尔的H2可以和多少摩尔的O2反应生成多少摩尔的H2O。
其次是质量计算。
在化学反应中,我们经常需要计算反应物和生成物的质量之间的关系。
通过化学十字交叉法,我们可以很容易地计算出反应物和生成物之间的质量关系。
例如,对于化学方程式2H2 + O2 → 2H2O,我们可以通过化学十字交叉法计算出1克的H2可以和多少克的O2反应生成多少克的H2O。
最后是体积计算。
在化学反应中,我们经常需要计算反应物和生成物的体积之间的关系。
通过化学十字交叉法,我们可以很容易地计算出反应物和生成物之间的体积关系。
例如,对于化学方程式2H2 + O2 → 2H2O,我们可以通过化学十字交叉法计算出1升的H2可以和多少升的O2反应生成多少升的H2O。
通过化学十字交叉法,我们可以快速准确地计算化学反应中物质的量和质量,从而更好地理解和控制化学反应过程。

“十字交叉法”在化学计算中的应用“十字交叉法”是一种适用于二元混合体系的计算方法,常用于计算二元组成部分的比例关系。
现将其原理简介如下:由,可得(假设),即,则有。
为了便于记忆和运算,采用“十字交叉法”图式表示如下:其中,A1、A2、是具有比值含义的量,P1、P2是A1、A2、的分母对应的物理量(如当A1、A2、代表摩尔质量时,则P1与P2之比为物质的量之比),且P 1、P2具有加合性,只有满足上述条件,才能应用“十字交叉法”,否则便会造成错误。
“十字交叉法”可以广泛用于溶液的混合与稀释、有关元素的平均相对原子质量的计算、连续发生两步反应时产物组成的判断等多种类型的试题中,下面分别予以说明。
一、在溶液混合与稀释计算中的应用1. 在溶液混合计算中的应用。
例1. 现将质量分数为30%的食盐水60g与质量分数为10%的食盐水混合,所得溶液的质量分数为15%。
则所需质量分数为10%的食盐水的质量为___________。
解析:本题是同种溶质不同浓度的溶液混合问题,解决这类问题的依据是混合前溶液中溶质的质量之和等于混合后溶液中溶质的质量。
设所需质量分数为10%的食盐水的质量为x,则:有,解得x=180g。
故所需质量分数为10%的食盐水的质量为180g。
2. 在溶液稀释计算中的应用。
例2. 将质量分数为30%的溶液稀释,配成300g质量分数为10%的溶液。
则需质量分数为30%的溶液和水的质量分别为_______、________。
解析:利用稀释前后溶液中溶质的质量不变,把水看作质量分数为0的溶液,则:即每有1份质量分数为30%的溶液与2份质量分数为0的水混合,可配成(1+2)份质量分数为10%的溶液。
故需质量分数为30%的溶液的质量为×。
需水的质量为或为。
二、在有关元素的平均相对原子质量计算中的应用例3. 由(氯元素的平均相对原子质量为35.5)构成的11.7g NaCl固体中,的质量为____________。

化学十字交叉法原理化学十字交叉法是一种用于解决化学反应平衡问题的方法,它能够帮助我们快速而准确地求解化学方程式中的未知量。
在化学学习中,我们经常会遇到需要平衡化学方程式的情况,而十字交叉法就是一种非常有效的工具。
首先,我们来看一下十字交叉法的基本原理。
在化学反应中,我们常常需要平衡反应方程式,使得反应物和生成物的摩尔比能够符合实验结果。
而十字交叉法就是通过建立一个简单的表格,来帮助我们解决平衡方程式中的未知系数。
具体来说,我们可以通过以下步骤来运用十字交叉法解决化学方程式的平衡问题:首先,我们列出化学方程式中的反应物和生成物,并确定它们的摩尔比。
然后,我们可以建立一个简单的表格,将反应物和生成物的摩尔比填入表格中。
接下来,我们可以通过交叉相乘的方法,求解未知系数。
具体来说,我们可以将反应物和生成物的摩尔比分别作为分子和分母,进行交叉相乘,从而求解未知系数。
最后,我们可以将求解出的未知系数代入到化学方程式中,从而得到平衡的化学方程式。
通过以上步骤,我们可以看到,化学十字交叉法是一种简单而有效的方法,能够帮助我们快速解决化学方程式的平衡问题。
它不仅能够提高我们解题的效率,还能够帮助我们更好地理解化学反应的平衡原理。
除了以上的基本原理和步骤外,我们还需要注意一些使用十字交叉法时的注意事项。
首先,我们需要确保化学方程式的反应物和生成物的摩尔比是准确的,这样才能够得到正确的结果。
其次,我们需要注意交叉相乘时的符号问题,以确保计算的准确性。
最后,我们需要多加练习,通过反复的实践来提高运用十字交叉法的能力。
总的来说,化学十字交叉法是一种非常实用的工具,能够帮助我们解决化学方程式的平衡问题。
通过掌握其基本原理和运用步骤,我们可以更加轻松地解决化学反应平衡的问题,提高化学学习的效率和水平。
希望大家能够认真学习和掌握这一方法,为化学学习打下坚实的基础。
高中化学计算题常用技巧:十字交叉法导语:“未来的文盲不再是不识字的人,而是没有学会怎样学习的人。
”科学的学习方法就是我们打开知识宝库的金钥匙。
如果我们掌握了科学的学习,也就具备了获取知识的能力,将让我们终身受益。
在化学中凡可按a1x1+a2x2=ā(x1+x2)或(a1-ā)/(ā-a2)=x2/x1计算的问题,都可以应用“十字交叉法”计算。
“十字交叉法”是化学计算中广泛使用的解题方法之一,它具有形象,直观的特点。
如何计算呢?首先应先写出混合两组分对应的量a1 、a2 和交叉点的平均值ā,然后按斜线作差取绝对值即得出相应物质的配比关系,其“十字交叉法”为:组分1:a1 ā-a2 x1 x1为组分分数ā —―= —组分2: a2 a1-ā x2 x2为组分分数“十字交叉法”适用的范围是:凡是具有均一性、加和性的混合物,都可运用这种方法进行计算,但须注意,计算所得比值是质量比还是物质的量比,下面介绍几种常见“十字交叉法”的计算:一、质量分数“十字交叉法”混合物中某元素原子或原子团质量守恒,且具有加和性,所以可用“十字交叉法”求混合物中某元素或某物质的质量分数。
例3:含氯54.2%的氯化钠和氯化钾的混合物,其中含NaCl的质量分数是( )A、50%B、35%C、75%D、60%解析:设氯化钠质量是m1、氯化钾质量是m2,依据氯元素守恒,则有60.7%m1+47.7%m2=54.2%(m1+m2),所以可用“十字交叉法”求解NaCl:60.7 6.5 1 m 154.2 —– = —KCl: 47.7 6.5 1 m2所以w(Na Cl)=6.5/(6.5+6.5) ×100%=50%二、浓度“十字交叉法”溶液在稀释或浓缩时溶质的量守恒,如溶液浓度为质量分数有:m1a%+m2b%=(m1+m2)c%,或溶液浓度为物质的量浓度有:C1V1+C2V2=(V1+V2)C(稀溶液),所以混合溶液浓度的计算可以用“十字交叉法”。
化学计算中“十字交叉法”的数学原理和应用一. “十字交叉法”简介“十字交叉法”是二元混合物(或组成)计算中的一种特殊方法,若已知两组分量和这两个量的平均值,求这两个量的比例关系等,多可运用“十字交叉法”计算。
十字交叉法在化学计算中是一种常用的方法,在很多习题中采用十字交叉法可以简化计算过程,提高计算效率。
下面先从一道简单的例题来介绍何为十字交叉法。
例1、50克10%的硫酸溶液和150克30%的硫酸溶液混合后,所得硫酸溶液的质量分数是多少?采用十字交叉法计算的格式如下:设混合后溶液的质量分数为x%,则可列出如下十字交叉形式所得的等式:10%的溶液 10 30 — xX =30%的溶液 30 x — 10由此可得出 x = 25,即混合后溶液的质量分数为25%。
以上习题的计算过程中有一个十字交叉的形式,因此通常将这种方法叫做“十字交叉法”。
然而怎样的计算习题可以采用这种方法?且在用“十字交叉法”时,会涉及到最后差值的比等于什么的问题,即交叉后所得的差值之比是实际中的质量之比还是物质的量之比?这些问题如果不明确,计算中便会得出错误的结论。
针对以上问题,在以前的教学中,可能往往让学生从具体的习题类型死记差值之比的实际意义。
由于十字交叉法常用于:①核素“丰度”与元素相对原子质量的计算;②混合气体不同组分体积之比和混合气体平均相对分子质量的计算;③不同浓度的同种溶液混合后质量分数与组分溶液质量之比的计算等类型的习题中。
因此可以简单记忆为前两种类型中,差值之比为物质的量之比,第三种类型差值之比为质量之比。
这种记忆方法束缚了学生的思维,同时也限制了“十字交叉法”的使用范围。
实质上“十字交叉法”的运用范围很广,绝不仅仅只能在以上三种类型的习题中才可运用。
然而不同情况下,交叉后所得的差值之比的实际意义是什么?该怎样确定其实际意义?是我们应该探讨和明了的问题。
要解决此问题,就要明了“十字交叉法”的数学原理,然后再从原理的角度去分析,便能确定差值之比在何时为组分的质量之比,何时为组分的物质的量之比。
方法总论十字交叉法十字交叉法是进行二组分混合物平均量与组分计算的一种简便方法。
凡可按M1n1+M2n2=M(n2+n2)计算的问题,均可按十字交叉法计算。
式中,M表示混合物的某平均量,M1、M2则表示两组分对应的量。
如M表示平均相对分子质量,M1、M2则表示两组分各自的相对分子质量,n1、n2表示两组分在混合物中所占的份额,n1:n2在大多数情况下表示两组分的物质的量之比,有时也可以是两组分的质量之比,判断时关键看n1、n2表示混合物中什么物理量的份额,如物质的量、物质的量分数、体积分数,则n1:n2表示两组分的物质的量之比;如质量、质量分数、元素质量百分含量,则n1:n2表示两组分的质量之比。
十字交叉法常用于求算:(1)有关质量分数的计算;(2)有关平均相对分子质量的计算;十字交叉法计算的式子如下:(3)有关平均相对原子质量的计算; n1:M1 M2-M(4)有关平均分子式的计算; M(5)有关反应热的计算; n2:M2 M-M1(6)有关混合物反应的计算。
n1/n2=(M2-M)/(M-M1)一.有关质量分数的计算1.实验室用密度为1.84 g/cm398%的浓硫酸与密度为1.1 g/cm315%的稀硫酸混合配制密度为1.4 g/cm3 59%的硫酸溶液,取浓、稀硫酸的体积比最接近的值是A.1:2 B.2:1 C.3:2 D.2:32.在苯和苯酚组成的混合物中,碳元素的质量分数为90%,则该混合物中氧元素的质量分数是A.2.5% B.5% C.6.5% D.7.5%二.有关平均相对分子质量的计算3.标准状况下,在容积为1 L的干燥烧瓶中用向下排空气法充入NH3后,测得烧瓶中的气体对H2的相对密度为9.7,若将此气体进行喷泉实验,当喷泉停止后所得溶液体积为_____L。
4/5 L。
4.Li2CO3和BaCO3的混合物与盐酸反应所消耗盐酸的量同等质量的CaCO3和同浓度的盐酸反应所消耗盐酸的量相等,则混合物中Li2CO3和BaCO3的质量之比为A.3:5 B.5:3 C.7:5 D.5:7三.有关平均相等原子质量的计算5.晶体硼由10B和11B两种同位素构成,已知5.4 g晶体硼与H2反应全部转化为乙硼烷(B2H6)气体,可得标准状况下5.6 L,则晶体硼中10B和11B两种同位素原子个数比为A.1:1 B.1:3 C.1:4 D.1:26.已知Cl的平均相对原子质量为35.5。
十字交叉法一、适用范围:“十字交叉法”适用于两组分混合物(或多组分混合物,但其中若干种有确定的物质的量比,因而可以看做两组分的混合物),求算混合物中关于组分的某个化学量(微粒数、质量、气体体积等)的比值或百分含量。
例题:实验测得乙烯与氧气的混合气体的密度是氢气的14.5倍。
可知其中乙烯的质量分数为( )A.25.0%B.27.6%C.72.4%D.75.0% 解析:要求混合气中乙烯的质量分数可通过十字交叉法先求出乙烯与氧气的物质的量之比。
这样,乙烯的质量分数是: ω(C 2H 4)=321283283⨯+⨯⨯×100 %=72.4%答案:C 二、十字交叉法的应用与例析:1、把CaCO 3和MgCO 3组成的混合物充分加热到质量不再减少时,称得残留物的质量是原混合物质量的一半。
则残留物中钙和镁两元素原子的物质的量之比是A.1:4B.1:3C.1:1D.1:2解析:上述问题是计算两组分混合物中某两个化学量之比,可用十字交叉法解题。
解题时先设计混合物的平均化学量c ,该题中要求钙和镁两元素原子的物质的量之比(即原子个数比),而平均量中分母(即上述化学量y(组分2))与题给条件相差甚远,故以一摩尔组分质量为分母,一摩尔物质分解后残留物质量为分子而得如下的几个平均量:a=56g÷100g ;b=40g÷84g; c=1/2应用于十字交叉法:即: 所以,原混合物中两组分CaCO 3和MgCO 3物质的量之比(即残留物中Ca 和Mg 的物质的量之比为:n(Ca)∶n(Mg) = (1/42)g ÷100g/mol ∶(3/50) g÷84 g/mol = 1∶3答案:B2、硼的平均相对原子质量为10.8,硼在自然界中有种同位素:105B 与115B ,则这两种同位素105B 、115B 在自然界中的原子个数比为A. 1∶2B.1∶4C.1∶6D.1∶8解析:相对原子质量与原子的摩尔质量数值上相等,故元素或原子的相对原子质量可看做十字交叉法中的平均化学量,量纲为g •mol -1(即原子数)之比。
高中化学二元混合物的十字交叉法解法速解的前提:1、必须清楚“十字交叉法”运用后的比例比系——“看分母”法则。
即特性数值的分母所表示的物理量之比。
因为对于二元混合物而言,设x 1、x 2是混合物两组分的某化学量,α 1、α 2为两组分的特性数值,ā为混合物的特性数值,若满足方程式α 1x 1+α 2x 2== ā(x 1 + x 2)可知 x 1(α 1- ā) == x 2(ā-α 2)即 x 1/x 2 ==(ā-α 2)/(α 1- ā)。
凡满足上述方程式的化学量的求解都不得可以用特性数值的“十字交叉法”形式来表示:2、必须清楚“十字交叉法”的适用范围现举几例,若按常规方法解二元一次方程,虽好理解,但费时且麻烦,若能正确运用“十字交叉法”,便可方便、迅速、准确地解题。
例1 现有100克碳酸锂和碳酸钡的混和物,它们和一定浓度的盐酸反应时所消耗盐酸跟100克碳酸钙和该浓度盐酸反应时消耗盐酸量相同。
计算混和物中碳酸锂和碳酸钡的物质的量之比。
分析可将碳酸钙的式量理解为碳酸锂和碳酸钡的混和物的平均式量,利用十字交叉法计算可有:所以,碳酸锂和碳酸钡的物质的量之比为97∶26。
例2 天然的和绝大部分人工制造的晶体都存在各种缺陷。
例如在某种NiO晶体中就存在如右图所示的缺陷:1Ni 2+个空缺,另有2个Ni 3+取代,其结果晶体仍呈电中性,但化合物中Ni原子和O原子的比值却发生了变化。
该氧化镍样品组成为Ni 0.97O,试计算该晶体中的Ni 3+和Ni 2+的离子个数比。
分析本题所求的是Ni 3+和Ni 2+的离子个数比,所以我们所选的特性数值的分母必须是Ni 3+和Ni 2+的离子个数。
由此可知:所以,例3 某亚硫酸钠已部分被氧化成硫酸钠,经测定混合物中的质量分数为25%,求该混合物中亚硫酸钠与硫酸钠的物质的量之比。
分析本题目传统解法是解二元一次方程,但需要假设一些数据,比较费时,但如正确运用“十字交叉法”,弄清比例关系,则能很快地解决问题根据前面介绍的“看分母”法则可知计算出的比例是亚硫酸亚铁钠与硫酸钠中所含硫元素的质量比,但因是同种元素,且每个分子中均含1个硫原子,所以硫的质量比即等于其物质的量之比,所以二者物质的量之比为7∶1。
十字交叉
一、适用范围:
“十字交叉法”适用于两组分混合物(或多组分混合物,但其中若干种有确定的物质的量比,因而可以看做两组分的混合物),求算混合物中关于组分的某个化学量(微粒数、质量、气体体积等)的比值或百分含量。
例1:实验测得乙烯与氧气的混合气体的密度是氢气的14.5倍。
可知其中乙烯的质量分数为( )
A.25.0%
B.27.6%
C.72.4%
D.75.0%
解析:要求混合气中乙烯的质量分数可通过十字交叉法先求出乙烯与氧气的物质的量之比(当然也可以求两组分的质量比,但较繁,不可取),再进一步求出质量分数。
这样,乙烯的质量分数是:
ω(C 2H 4)=32
1283283⨯+⨯⨯×100 %=72.4% 答案:C 。
(解毕)
二、十字交叉法的解法探讨:
1.十字交叉法的依据:
对一个二元混合体系,可建立一个特性方程: ax+b(1-x)=c
(a 、b 、c 为常数,分别表示A 组分、B 组分和混合体系的某种平均化学量,如:单位为g/mol 的摩尔质量、单位为g/g 的质量分数等) ;x 为组分A 在混合体系中某化学量的百分数(下同)。
如欲求x/(1-x)之比值,可展开上述关系式,并整理得: ax -bx=c -b
解之,得:
b a
c a x b a b c x --=---=
1, 即:c
a b c x x --=-1 2.十字交叉法的常见形式:
为方便操作和应用,采用模仿数学因式分解中的十字交叉法,记为:
十字交叉法应用于解题快速简捷,一旦教给了学生,学生往往爱用,但是也往往出错。
究其原因,无外乎乱用平均量(即上述a 、b 、c 不知何物)、交叉相减后其差值之比不知为何量之比。
关于上述a 、b 、c 这些化学平均量,在这里是指其量纲为(化学量1 ÷化学量2)的一些比值,如摩尔质量(g/mol )、溶液中溶质的质量分数(溶质质量÷溶液质量)或关于物质组成、变化的其它化学量等等。
设计这些平均量时应优先考虑待求量和题给条件,一般情况下尽可能的将C 2H 4 O 2 29 3 1
待求量设计为上述化学量2(分数中的分母) ,至于化学量1则依题给条件选取最容易获得的化学量(分数中的分子),这样上述第1论点中的a 、b 、c 应该是分别这样的一些化学平均量(如下图):
而这些化学平均量a 、b 、c 交叉相减后所得差值之比,则是组分1和组分2的化学平均量的量纲中化学 量2 [如a 、b
、c 为摩尔质量(g/mol )时,便是物质的量 mol]的比值。
例2:把CaCO 3和MgCO 3组成的混合物充分加热到质量不再减少时,称得残留物的质量是原混合物质量的一半。
则残留物中钙和镁两元素原子的物质的量之比是
A.1:4
B.1:3
C.1:1
D.1:2
解析:上述问题是计算两组分混合物中某两个化学量之比,可用十字交叉法解题。
解题时先设计混合物的平均化学量c ,该题中要求钙和镁两元素原子的物质的量之比(即原子个数比),而平均量中分母(即上述化学量y(组分2))与题给条件相差甚远,故以一摩尔组分质量为分母,一摩尔物质分解后残留物质量为分子而得如下的几个平均量:
a=56g÷100g ; b=40g÷84g; c=1/2
应用于十字交叉法:
即: 所以,原混合物中两组分CaCO 3和MgCO 3物质的量之比(即残留物中Ca 和Mg 的物质的量之比为:n(Ca)∶n(Mg)
=(1/42)g ÷100g/mol ∶(3/50) g÷84 g/mol
=1∶3
答案:B (解毕)
注:熟练后或在要表达的计算题中可略去上图,而只以比例式表示,为防止出错,也可在草稿中画上述十字交叉图。
三、十字交叉法的应用与例析:
1.两组分混合物中已知组分及混合体系的摩尔质量(或式量),求组分的物质的量之比(或组分气体的体积比、组分物质的微粒数之比):
解答这类问题,需设计的平均化学量a 、b 、c 就直接用摩尔质量(g /mol )。
而用十字交叉法交叉相减后所得差值之比是组分的物质的量之比(或微粒数之比),或依阿伏加德罗定律,也等于(相同状态下)气态混合体系中组分气体的体积比。
例3.硼的平均相对原子质量为10.8,硼在自然界中有种同位素:10
5B 与115B ,则这两种同位素
10
5B 、115B 在自然界中的原子个数比为
A. 1∶2
B.1∶4
C.1∶6
D.1∶8
解析:相对原子质量与原子的摩尔质量数值上相等,故元素或原子的相对原子质量可看做十字交叉法中的平均化学量,量纲为g •mol -1,交叉相减后所得差值之比为两同位素的物质的量(即原子
组分CaCO 3 56/100 1/42 混合物
1/2 m(MgCO 10
5B 10 0.2
数)之比。
答案:B 解毕)
2.两种溶液(同溶质)相混合,已知两溶液及混合溶液中溶质的质量分数,求两溶液的质量比:
例4.将密度为1.84g•cm-3,质量分数为98%的浓硫酸与水配制成30%的稀溶液,应怎么配制?
解析:要配制这种硫酸,必须先求出浓硫酸与水的比例。
因为溶液中溶质的质量分数为溶质质量占溶液质量的分数,所以质量分数实际上也是一种平均化学量,可用于十字交叉法求出浓硫酸和水的质量比。
这样,上述平均化学量a、b、c中的化学量2最好就设计为溶液质量,而化学量1取最方便的就是溶质质量,即平均化学量a、b、c就是溶液中溶质的质量分数,应用于十字交叉法(图略),记为:
m(浓硫酸)∶m(水)=(30%-0)∶(98%-30%)=15∶34
即取15份质量的浓硫酸与34份质量的水混合得此稀硫酸。
(解毕)
3.两可燃物组成的混合体系,已知其组分及混合物的燃烧热,求组分的物质的量之比或百分含量。
例5.在一定条件下,CO和CH4燃烧的热化学方程式分别为:
2CO(气)+O2(气)=2CO2(气)+566KJ;
CH4(气)+2O2(气)=CO2(气)+2H2O(液)+890KJ
现有CO和CH4组成的气体混合物89.6L(标准状态下测定),在上述条件下燃烧,释放的热量为2953KJ,则CO和CH4的体积比为()
A. 1∶3
B. 3∶1
C.1∶2
D.2∶1
解析:可燃物的反应热以摩尔反应热来表示时,单位是:KJ/mol,因此也可以看做是一个平均化学量,两可燃组分及混合物的反应热可当做十字交叉法基本形式中的a、b、c进行十字交叉,交叉相减后所得差值之比即为两可燃组分的物质的量之比。
解题时设计并先求算气体混合物的反应热:
混合气体的物质的量:n=89.6L÷22.4L•mol-1=4.00mol
∴混合气体的平均反应热:Q(混合物)=2953KJ÷4.00mol=738.3KJ•mol-1
双两组分的反应热分别为:Q(CO)=566KJ÷2mol=283KJ•mo-1;Q(CH4)=890KJ•mol-1这样,十字交叉法就记为:n(CO)∶n(CH4)
=(890-738.3)∶(738.3-283)≈1∶3
答案:B。
(解毕)。