高中化学十字交叉法(供参考)
- 格式:doc
- 大小:20.00 KB
- 文档页数:4


高中化学计算题的常用解题技巧(13)---十字交叉法
十字交叉法:十字交叉法是专门用来计算溶液浓缩及稀释,混合气体的平均组成,混合溶液中某种离子浓度,混合物中某种成分的质量分数等的一种常用方法,其使用方法为:
组分A的物理量a差量c-b
平均物理量c(质量,浓度,体积,质量分数等)
组分B的物理量b差量a-c
则混合物中所含A和B的比值为(c-b):(a-c),至于浓缩,可看作是原溶液A中减少了质量分数为0%的水B,而稀释则是增加了质量分数为100%的溶质B,得到质量分数为c的溶液.
[例15]有A克15%的NaNO3溶液,欲使其质量分数变为30%,可采用的方法是
A.蒸发溶剂的1/2
B.蒸发掉A/2克的溶剂
C.加入3A/14克NaNO3
D.加入3A/20克NaNO3
根据十字交叉法,溶液由15%变为30%差量为15%,增大溶液质量分数可有两个方法:(1)加入溶质,要使100%的NaNO3变为30%,差量为70%,所以加入的质量与原溶液质量之比为15:70,即要3A/14克.(2)蒸发减少溶剂,要使0%的溶剂变为30%,差量为30%,所以蒸发的溶剂的质量与原溶液质量之比为15%:30%,即要蒸发A/2克.如果设未知数来求解本题,需要做两次计算题,则所花时间要多得多。

高中化学十字交叉法计算方法总结高中知识搜索小程序十字交叉法是进行二组分混合物平均量与组分计算的一种简便方法。
凡可按M1n1+M2n2=M(n2+n2)计算的问题,均可按十字交叉法计算。
式中,M表示混合物的某平均量,M1、M2则表示两组分对应的量。
如M表示平均相对分子质量,M1、M2则表示两组分各自的相对分子质量,n1、n2表示两组分在混合物中所占的份额,n1:n2在大多数情况下表示两组分的物质的量之比,有时也可以是两组分的质量之比,判断时关键看n1、n2表示混合物中什么物理量的份额,如物质的量、物质的量分数、体积分数,则n1:n2表示两组分的物质的量之比;如质量、质量分数、元素质量百分含量,则n1:n2表示两组分的质量之比。
十字交叉法常用于求算:(1)有关质量分数的计算;(2)有关平均相对分子质量的计算;(3)有关平均相对原子质量的计算;(4)有关平均分子式的计算;(5)有关反应热的计算;(6)有关混合物反应的计算。
十字交叉法计算的式子如下:十字交叉法计算的式子如下:十字交叉法巧解一.有关质量分数的计算1.设取用98%的浓硫酸X g,取用15%的稀硫酸Y g。
根据溶质质量守恒可得:98%X+15%Y=59%(X+Y),X和Y之比是溶液质量之比。
由十字交叉法可得:X/Y=44/39;再换算成体积比为:44/1.84:39/1.1=2/3。
2.M(C6H6)=78,其中碳质量分数为:C%=72/78=92.3%;M(C6H6O)=94,其中碳的质量分数为:C%=72/94=76.6%。
依据碳元素质量守恒和十字交叉法可得混合物中苯酚的质量分数,再进一步求出氧的质量分数。
m(C6H6O)/m(C6H6)=2.3/13.4;O%=(2.3×16/92)/(2.3+13.4)=2.5%。
(O%=1-90%×13/12)二.有关平均相对分子质量的计算3.M=2×9.7=19.4 > 17,说明混有空气;根据质量守恒和十字交叉法可得:n(NH3)/n(空气)=9.6/2.4=4/1;所以烧瓶内含NH3体积为4/5 L;空气不溶于水,当喷泉停止后,则烧瓶内的溶液为4/5 L。

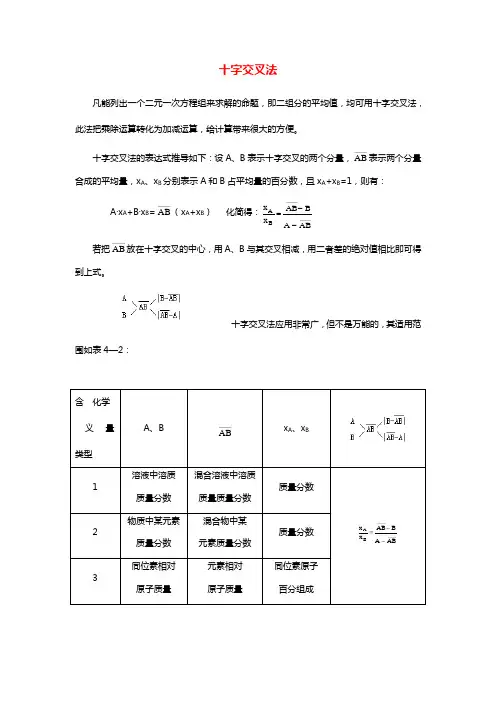
十字交叉法凡能列出一个二元一次方程组来求解的命题,即二组分的平均值,均可用十字交叉法,此法把乘除运算转化为加减运算,给计算带来很大的方便。
十字交叉法的表达式推导如下:设A 、B 表示十字交叉的两个分量,AB ——表示两个分量合成的平均量,x A 、x B 分别表示A 和B 占平均量的百分数,且x A +x B =1,则有: A ·x A +B ·x B =AB ——(x A +x B ) 化简得:x x AB B A ABA B =--———— 若把AB ——放在十字交叉的中心,用A 、B 与其交叉相减,用二者差的绝对值相比即可得到上式。
十字交叉法应用非常广,但不是万能的,其适用范围如表4—2:含 化学义 量类型A 、B AB —— x A 、x B 1 溶液中溶质质量分数混合溶液中溶质质量质量分数 质量分数 x x AB B A AB A B =--———— 2 物质中某元素质量分数混合物中某 元素质量分数 质量分数 3 同位素相对原子质量 元素相对 原子质量 同位素原子百分组成正确使用十字交叉法解题的关键在于:(1)正确选择两个分量和平均量;(2)明确所得比为谁与谁之比;(3)两种物质以什么为单位在比。
尤其要注意在知道质量平均值求体积或物质的量的比时,用此法并不简单。
1. 现有50g 5%的CuSO4溶液,把其浓度增大一倍,可采用的方法有:(1)可将原溶液蒸发掉g水;(2)可向原溶液中加入12.5% CuSO4溶液g;(3)可向原溶液中加入胆矾g;(4)可向原溶液中加入CuSO4白色粉末g。
2 . 今有NH4NO3和CO(NH2)2混合化肥,现测得含氮质量分数为40%,则混合物中NH4NO3和CO(NH2)2的物质的量之比为()(A)4∶3 (B)1∶1 (C)3∶4 (D)2∶33. (1)已知溶质质量分数分别为19x%和x%的两硫酸溶液,若将它们等体积混和,则所得混和液的溶质质量分数与10x的大小关系如何?(2)已知溶质质量分数为a%的氨水物质的量浓度是b mol·L-1,则a2%的氨水物质的量浓度与b2mol·L-1的大小关系如何?4. 将金属钠在空气中燃烧,生成Na2O与Na2O2的混合物。

二元混合物的快速解法--十字交叉法“十字交叉法”是高中化学计算题中巧解二元混合物问题的一种常用的有效方法,正确运用“十字交叉法”,可以帮助同学们方便、迅速地解决计算问题。
速解的前提:1、必须清楚“十字交叉法”运用后的比例比系——“看分母”法则。
即特性数值的分母所表示的物理量之比。
因为对于二元混合物而言,设x1、x2是混合物两组分的某化学量,α1、α2为两组分的特性数值,ā为混合物的特性数值,若满足方程式α1x1+α2x2== ā(x1 + x2)可知 x1(α1-ā) == x2(ā-α2)即 x1/x2 ==(ā-α2)/(α1-ā)。
凡满足上述方程式的化学量的求解都不得可以用特性数值的“十字交叉法”形式来表示:2、必须清楚“十字交叉法”的适用范围α1、α2āx1、x21相对分子质量平均相对分子质量物质的量、体积分数物质的量比、体积比麻烦,若能正确运用“十字交叉法”,便可方便、迅速、准确地解题。
例1 现有100克碳酸锂和碳酸钡的混和物,它们和一定浓度的盐酸反应时所消耗盐酸跟100克碳酸钙和该浓度盐酸反应时消耗盐酸量相同。
计算混和物中碳酸锂和碳酸钡的物质的量之比。
分析可将碳酸钙的式量理解为碳酸锂和碳酸钡的混和物的平均式量,利用十字交叉法计算可有:所以,碳酸锂和碳酸钡的物质的量之比为97∶26。
例2 天然的和绝大部分人工制造的晶体都存在各种缺陷。
例如在某种NiO晶体中就存在如右图所示的缺陷:1Ni2+个空缺,另有2个Ni3+取代,其结果晶体仍呈电中性,但化合物中Ni原子和O原子的比值却发生了变化。
该氧化镍样品组成为Ni0.97O,试计算该晶体中的Ni3+和Ni2+的离子个数比。
分析本题所求的是Ni3+和Ni2+的离子个数比,所以我们所选的特性数值的分母必须是Ni3+和Ni2+的离子个数。
由此可知:所以,例3 某亚硫酸钠已部分被氧化成硫酸钠,经测定混合物中的质量分数为25%,求该混合物中亚硫酸钠与硫酸钠的物质的量之比。

一、十字交叉相乘法这是利用化合价书写物质化学式的方法,它适用于两种元素或两种基团组成的化合物。
其根据的原理是化合价法则:正价总数与负价总数的代数和为0或正价总数与负价总数的绝对值相等。
现以下例看其操作步骤。
二、十字交叉相比法我们常说的十字交叉法实际上是十字交叉相比法,它是一种图示方法。
十字交叉图示法实际上是代替求和公式的一种简捷算法,它特别适合于两总量、两关系的混合物的计算(即2—2型混合物计算),用来计算混合物中两种组成成分的比值。
三、十字交叉消去法十字交叉消去法简称为十字消去法,它是一类离子推断题的解法,采用“十字消去”可缩小未知物质的范围,以便于利用题给条件确定物质,找出正确答案。
其实十字交叉法就是解二元一次方程的简便形式如果实在不习惯就可以例方程解但我还是给你说说嘛像A的密度为10 B的密度为8 它们的混合物密度为9 你就可以把9放在中间把10 和8 写在左边标上AB 然后分别减去9 可得右边为1 1 此时之比这1:1 了这个例子比较简单但难的也是一样你自己好好体会一下嘛这个方法其实很好节约时间特别是考理综的时候其实十字交叉法就是解二元一次方程的简便形式如果实在不习惯就可以例方程解但我还是给你说说嘛像A的密度为10 B的密度为8 它们的混合物密度为9 你就可以把9放在中间把10 和8 写在左边标上AB 然后分别减去9 可得右边为1 1 此时之比这1:1 了这个例子比较简单但难的也是一样你自己好好体会一下嘛这个方法其实很好节约时间特别是考理综的时候(一)混和气体计算中的十字交叉法【例题】在常温下,将1体积乙烯和一定量的某气态未知烃混和,测得混和气体对氢气的相对密度为12,求这种烃所占的体积。
【分析】根据相对密度计算可得混和气体的平均式量为24,乙烯的式量是28,那么未知烃的式量肯定小于24,式量小于24的烃只有甲烷,利用十字交叉法可求得甲烷是0.5体积(二)同位素原子百分含量计算的十字叉法【例题】溴有两种同位素,在自然界中这两种同位素大约各占一半,已知溴的原子序数是35,原子量是80,则溴的两种同位素的中子数分别等于。

十字交叉法十字交叉法是进行二组分混和物平均量与组分量计算的一种简便方法。
凡是一般的二元一次方程组(a1X + a2Y = a3( X +Y )关系式)的习题,均可用十字交叉法,但受我们所学知识的条件限制,这里只介绍其中的几种。
一、用组分的式量与混合气的平均式量做十字交叉,求组分体积比或含量。
例1:已知H2和CO 的混合气,其平均式量是20,求混合气中H2和CO 的体积比。
(4∶9)解:H2 2 28-20 4╲╱——20 ——╱╲CO 28 20-2 9例2:已知CO、CO2混合气的平均式量是32,耱混合气中CO 的体积百分数。
(75%)解:CO 28 12 3╲╱——32 ——╱╲CO228 4 1二、用同位素的原子量或质量数与元素原子量作交叉,求原子个数比或同位素百分数。
例3:已知铜有63Cu 和65Cu 两种同位素,铜元素的原子量是63.5,求63Cu 和65Cu的原子个数比。
(3∶1)解:63Cu 63 1.5 3╲╱——63.5 ——╱╲65Cu 65 0.5 1三、用组分的气体密度与混合气的密度作十字交叉,求组分的体积比或体积分数。
例4:标况下,氮气的密度为1.25 g·L-1,乙烷的密度为1.34 g·L-1,两种气体混合后,其密度为1.30 g·L-1,求混合气中氮气和乙烷的体积比(4∶5)解:氮气 1.25 0.04 4╲╱—— 1.30 ——╱╲乙烷 1.34 0.05 5四、用两种不同浓度溶液的质量分数与混合溶液的质量分数作十字交叉,求两种溶液的质量比例5:用60%和20%的两种NaOH 溶液混合配成30%的NaOH 溶液,则所用两种NaOH 溶液的质量比为多少(1∶3)解:60% 60% 10% 1╲╱——30% ——╱╲20% 20% 30% 3五、用两种物质中同一元素的质量分数求两物质的质量比例6:FeO 中和FeBr2的混合物中Fe 的质量百分率为50%,求两物质的质量比(13∶15)解:FeO 7/9 13/54 13╲╱——1/2 ——╱╲FeBr27/27 5/18 15练习:1、实验室用密度为1.84 g·cm-398%的浓硫酸与密度为1.1 g·cm-3 15%的稀硫酸混和配制密度为1.4 g·cm-3 59%的硫酸溶液, 取浓、稀硫酸的体积比最接近的值是( )A、1:2B、2:1C、3:2D、2:32、实验测得乙烯与氧气混合气体的密度是氢气的14.5倍,可知其中乙烯的质量百分比为( )A、25.0%B、27.6%C、72.4%D、75.0%3、已知白磷和氧气可发生如下反应:P4 +3O2 = P4O6 ,P4 +5O2 = P4O10在某一密闭容器中加入62克白磷和50.4升氧气(标准状况), 使之恰好完全反应, 所得到的P4O10与P4O6的物质的量之比为( )A、1∶3B、3∶2C、3∶1D、1∶14、由CO 2、H 2和CO 组成的混合气在同温同压下与氮气的密度相同。

十字交叉法写化学式
利用化合价写化学式
根据化合价写化学式的依据:
化合物中各元素正负化合价的代数和为零
常见的方法:最小公倍数法和十字交叉法
1、最小公倍数法写化学式
最小公倍数法———“一写、二求、三标、四验”
一写:一般把正价元素的符号(或根)写在左边,负价元素的符号(或根)写在右边,并把化合价写在元素符号(或根)的正上方
二求:求两种元素(或根)的最小公倍数,然后求出每种元素(或根)的原子个数。
即原子个数=最小公倍数÷∣化合价∣
三标:将原子个数写在相应元素符号(或根)的右下角
四验:检验各种元素正负化合价的代数和是否为零,确定化学式的正确性
2、十字交叉法写化学式
十字交叉法———“一排、二标、三交、四约、五查”
一排:元素符号(或根)一般按正价左,负价右顺序排列
二标:标出各元素的化合价,如果有根只需标出根的化合价
三交:将元素化合价(或根)的绝对值交叉写在另一元素符号(或根)的右下角
四约:将各元素(或根)的原子数约成最简整数比
五查:检查正负化合价代数和是否为零,确定化学式的正确性
这种方法也可以简单记忆为“正左负右标价数,十字交叉写个数”
说明:
①、只有确切知道某物质存在才能根据化合价书写化学式
②、一般把正价写在左边,负价写在右边。
但也有例外。
如NH3
③、如果标明根的个数时,应把根加上括号,再把数字写在右下角
1 / 11 / 1。

3 .十字交叉法十字交叉法又名混合规则法、杠杆原理等,它在化学计算中具有能简洁和迅速求解的特点。
1、十字交叉法的数学原理:凡能列出一个二元一次方程组来求解的命题,均可用十字交叉法。
如: 1211221x x a x a x a +=⎧⎨+=⎩平12a a a -平a平21a a a -平结论:2121a a x x a a -=-平平十字交叉法立足于二元一次方程的求解过程,并把该过程抽象为十字交叉的形式,所以凡能列出一个二元一次方程来求解的命题均可用此法。
2、使用范围列表如下:⎧⎪⎨⎪⎩溶液度混合十字交叉法平均化式量(原子量)平均耗氧量3、注意事项(1)适用于十字交叉法的量必须是具有加权平均意义的量,具体说是一些分数,如:质量分时、体积分数、物质的量分数或者是一些具有复合单位的量,如:摩尔质量、密度、燃烧热等。
(2)物理量必须具有简单的加和性。
如溶液质量等,而溶液混合时的体积不具有加和性,所以一般不可用物质的量浓度交叉求两溶液的体积比,只有稀溶液混合时近似处理忽略体积........变化..才可用十字交叉法求解。
(3)比的问题:什么比——基准物质以什么物理量为前提进行分量和平均量的确定得出的比,以物质的量为前提得出的是基准物质的物质的量之比;以一定质量为前提得出的是基准物质的质量之比。
练习1、质量百分比浓度溶液的混合如用的98%浓硫酸与7%的稀硫酸混合配成20%的硫酸溶液,则需浓硫酸与稀硫酸以质量比为混合恰好配成20%的硫酸。
2、物质的量浓度溶液的混合如用18mol/L的浓硫酸与2mol/L的稀硫酸混合成6mol/L的硫酸,则浓硫酸与稀硫酸的体积比是。
3、相对原子量的求算铜有两种天然同位素6529Cu和6329Cu,已知通的相对原子质量为63.5,估算6529Cu的百分含量(丰度)约为A、5%B、25%C、50%D、75%4、平均相对分子质量的计算甲烷和氧气混合后,其平均相对分子质量为24,则混合气体中甲烷与氧气的体积比为。

“十字交叉”法的妙用化学计算是从数量的角度研究物质的组成、结构、性质变化,涉及到的化学基本概念多,解法灵活多变,且需要跨学科的知识和思维方法,所以该知识点一直是中学化学教与学的难点,但因能较好地训练学生的逻辑思维能力和思维的敏捷性,又能考察学生的双基知识,所以是教学重点,也是各种考试的热点。
如何进行这方面知识的教学,使学生理解和掌握这些知识、发展学力,一直是各位老师研究的热门话题。
本文拟就教学中所得,粗浅地谈一谈“十字交叉法”在化学计算中的应用。
一、适用范围:“十字交叉法”适用于两组分混合物(或多组分混合物,但其中若干种有确定的物质的量比,因而可以看做两组分的混合物),求算混合物中关于组分的某个化学量(微粒数、质量、气体体积等)的比值或百分含量。
例1:实验测得乙烯与氧气的混合气体的密度是氢气的14.5倍。
可知其中乙烯的质量分数为( )A.25.0%B.27.6%C.72.4%D.75.0%解析:要求混合气中乙烯的质量分数可通过十字交叉法先求出乙烯与氧气的物质的量之比(当然也可以求两组分的质量比,但较繁,不可取),再进一步求出质量分数。
这样,乙烯的质量分数是:ω(C 2H 4)=321283283⨯+⨯⨯×100 %=72.4% 答案:C 。
(解毕)二、十字交叉法的解法探讨:1.十字交叉法的依据:对一个二元混合体系,可建立一个特性方程: ax+b(1-x)=c(a 、b 、c 为常数,分别表示A 组分、B 组分和混合体系的某种平均化学量,如:单位为g/mol 的摩尔质量、单位为g/g 的质量分数等) ;x 为组分A 在混合体系中某化学量的百分数(下同)。
如欲求x/(1-x)之比值,可展开上述关系式,并整理得: ax -bx=c -b 解之,得:b ac a x b a b c x --=---=1, 即:ca b c x x --=-1 2.十字交叉法的常见形式:为方便操作和应用,采用模仿数学因式分解中的十字交叉法,记为:3.解法关健和难点所在:c C 2H 4 28 O 2 32 29 3 1组分1 a c -b 混合物 组分2 b a -c C十字交叉法应用于解题快速简捷,一旦教给了学生,学生往往爱用,但是也往往出错。
被遗忘的十字交叉法
山东临清一中高泽岭
十字交叉法是进新型两组混合物平均量与组分量计算的一种简便方法。
但是由于两种量交叉出来后的比容易混淆,或者不知道是什么之比,在近年的高中化学教学中,一般老师都在回避这种方法,而改用列方程组法。
其实,如果我们把握好,十字交叉法依然是我们解题的一把利器。
凡可按a1X + a2Y = a ( X +Y ) 关系式的习题,均可用十字交叉法计算,其中a为a1和a2的平均量。
在计算过程中遵循守恒的原则。
一、有关质量分数的计算
二、有关物质的量浓度的计算
三、有关平均分子量的计算
四、有关相对平均原子质量的计算
五、有关反应热的计算
六、有关混合物反应的计算
现举例如下:
一、有关质量分数的计算
例1.实验室用98%的浓硫酸(密度为1.84g/cm3)与15%的稀硫酸(密度为1. 1g/cm3)混和,配制59%的硫酸溶液(密度为1.4g/cm3),取浓、稀硫酸的体积比最接近的值是()
A. 1∶2 B. 2∶1 C.3∶2 D.2∶3
[分析]用硫酸的质量分数作十字交叉:
根据溶质质量守恒, 满足此式的是:98%X + 15% Y = 59%(X+Y),X 和 Y 之比是溶液质量比,故十字交叉得出的溶液质量比为:44 ∶39 。
换算成体积比:(44/1.84)∶(39/1.1)≈ 2∶3,答案为D。
二、有关物质的量浓度的计算
例2.物质的量浓度分别为6mol/L和1mol/L的硫酸溶液,按怎样的体积比才能配成4mol/L的硫酸溶液?
[分析] 用物质的量浓度作十字交叉:
根据溶质物质的量守恒,满足此式的是6X + Y = 4 (X+Y),X 和 Y 之比是溶液体积比,故十字交叉得出的体积比为3∶2 ,答案:6mol/L,1mol/L的硫酸溶液按3∶2的体积比才能配成4mol/L的硫酸溶液。
三、有关平均分子量的计算
例3.实验测得,相同条件下乙烯与氧气混合气体的密度是氢气密度的14.5倍,可知其中乙烯的质量分数为()
A.25.0% B.27.6% C.72.4% D.75.0%
[分析] 乙烯与氧气混合气体的相对平均分子质量为29。
用乙烯、混合气体和氢气的相对分子质量作十字交叉:
根据质量守恒, 满足此式的是 28X + 32 Y = 29(X+Y),X 和 Y 之比是物质的量之比,故十字交叉得出的物质的量比为:3∶1。
四、有关相对平均原子质量的计算
例4.铜有两种天然同位素63Cu和65Cu ,铜的相对原子质量为63.5 ,63Cu 的原子个数百分含量为()
A.20% B.25% C.66.7% D.75%
[分析]用63Cu和65Cu的质量数作十字交叉:
根据质量守恒,满足此式的是 63X + 65 Y = 63.5 (X+Y),可知X∶ Y 应为原子个数比,故十字交叉法得出的原子个数比为1.5∶0.5。
五、有关反应热的计算
例5.已知:2H2(g) + O2(g) = 2H2O(l);△H= —571.6KJ·mol-1 CH4 (g) +2O2(g) = CO2(g) + 2H2O(l);△H= —890 KJ·mol-1。
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O,若实验测得反应放热3695KJ。
则原混合气体中H2与CH4的物质的量之比是()
A. 1∶1 B.1∶3 C.1∶4 D. 2∶3
[分析]标准状况下,112LH2与CH4的混合气体物质的量为5mol。
用CH4、H2与混合气体的燃烧热作十字交叉:
根据总热量守恒, 满足此式的是 890X + 285.8 Y = 739 (X+Y)。
可知X∶ Y 应为物质的量之比,故十字交叉法得出的是物质的量之比,即体积比。
V(H2)∶V(C H4)=151∶453.2≈ 1∶3。
答案为B。
六、有关混和物反应的计算
例6.已知白磷和氧气可发生如下反应:P4+3O2 = P4O6,P4 +5O2 = P4O10。
在某一密闭容器中加入62克白磷和50.4升氧气(标准状况),使之恰好完全反应,所得到的P4O10与P4O6的物质的量之比为()
A.1∶3 B.3∶2 C.3∶1 D.1∶1
[分析]用生成P4O10、P4O6的耗氧量和平均耗氧量作十字交叉:
根据O2物质的量守恒,满足此式的是5X + 3Y = (2.25/0.5)(X+Y),X 和 Y 之比是P4O10和P4O6物质的量之比,故十字交叉得出的物质的量之比为:1.5∶0.5 =3∶1。
答案为C。