备战2020年高考化学一轮复习第六章第二节原电池 化学电源-讲义
- 格式:doc
- 大小:1.14 MB
- 文档页数:16

第2讲原电池化学电源考纲要求:1.了解原电池的工作原理,能写出电极反应和电池反应方程式。
2.了解常见化学电源的种类及其工作原理。
考点一原电池原理[教材知识层面]1.概念把化学能转化为电能的装置。
2.构成条件(1)有两个活泼性不同的电极(常见为金属或石墨)。
(2)将电极插入电解质溶液中。
(3)两电极间构成闭合回路(两电极接触或用导线连接)。
(4)能自发发生氧化还原反应。
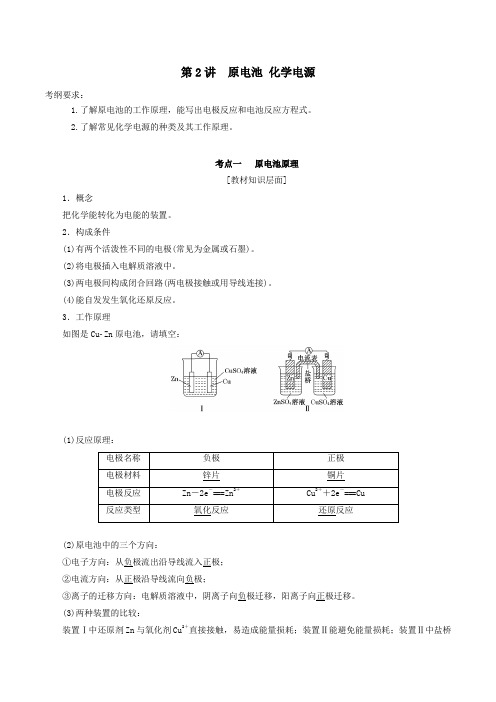
3.工作原理如图是CuZn原电池,请填空:(1)反应原理:(2)原电池中的三个方向:①电子方向:从负极流出沿导线流入正极;②电流方向:从正极沿导线流向负极;③离子的迁移方向:电解质溶液中,阴离子向负极迁移,阳离子向正极迁移。
(3)两种装置的比较:装置Ⅰ中还原剂Zn与氧化剂Cu2+直接接触,易造成能量损耗;装置Ⅱ能避免能量损耗;装置Ⅱ中盐桥的作用是提供离子迁移通路,导电。
[高考考查层面]命题点1 与原电池原理有关的辨析理解原电池的工作原理要注意的四点(1)只有放热的氧化还原反应才能通过设计成原电池将化学能转化为电能。
(2)电解质溶液中阴、阳离子的定向移动,与导线中电子的定向移动共同形成了一个完整的闭合回路。
(3)不论在原电池还是在电解池中,电子均不能通过电解质溶液。
(4)原电池负极失去电子的总数等于正极得到电子的总数。
[典题示例]1.在如图所示的8个装置中,属于原电池的是( )A.①④B.③④⑤C.④⑧ D.②④⑥⑦【答案】D【解析】根据原电池的构成条件可知:①中只有一个电极,③中两电极材料相同,⑤中酒精不是电解质,⑧中两电极材料相同且无闭合回路,故①③⑤⑧不能构成原电池。
2.如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )A.外电路的电流方向为:X→外电路→YB.若两电极分别为铁和碳棒,则X为碳棒,Y为铁C.X极上发生的是还原反应,Y极上发生的是氧化反应D.若两电极都是金属,则它们的活动性强弱为X>Y【答案】D【解析】外电路电子流向为X→外电路→Y,电流方向与其相反,X极失电子,作负极,Y极发生的是还原反应,X极发生的是氧化反应。



第二节原电池化学电源[高考备考指南]原电池的工作原理及应用(对应复习讲义第70页)1.概念及反应本质把化学能转化为电能的装置,其本质是发生了氧化还原反应。
2.构成条件(1)有两个活动性不同的电极(常见为金属或石墨)。
(2)将电极插入电解质溶液中。
(3)两电极间构成闭合回路(两电极接触或用导线连接)。
(4)能自发发生氧化还原反应。
3.工作原理如图是CuZn原电池,请填空:(1)反应原理(2)原电池中的三个方向①电子方向:从负极流出沿导线流入正极;②电流方向:从正极沿导线流向负极;③离子的迁移方向:电解质溶液中,阴离子向负极迁移,阳离子向正极迁移。
(3)两种装置的比较图Ⅰ中Zn在CuSO4溶液中直接接触Cu2+,会有一部分Zn与Cu2+直接反应,该装置中既有化学能和电能的转化,又有一部分化学能转化成了热能,装置的温度会升高。
图Ⅱ中Zn和CuSO4溶液分别在两个池中,Zn与Cu2+不直接接触,不存在Zn与Cu2+直接反应的过程,所以仅是化学能转化成了电能,电流稳定,且持续时间长。
(4)盐桥作用①连接内电路,形成闭合回路;②平衡电荷,使原电池不断产生电流。
4.原电池原理的应用(1)设计制作化学电源①首先将氧化还原反应分成两个半反应。
②根据原电池的反应特点,结合两个半反应找出正、负极材料和电解质溶液。
(2)比较金属活动性强弱两种金属分别作原电池的两极时,一般作负极的金属比作正极的金属活泼。
(3)加快氧化还原反应的速率一个自发进行的氧化还原反应,设计成原电池时反应速率加快。
例如,在Zn与稀H2SO4反应时加入少量CuSO4溶液能使产生H2的反应速率加快。
判断正误(1)在化学反应中,所有自发的放热反应均可以设计成原电池。
()(2)在原电池中,正极本身一定不参与电极反应,负极本身一定要发生氧化反应。
()(3)相同情况下,带有“盐桥”的原电池比不带“盐桥”的原电池电流持续时间长。
()(4)实验室制备H2时,用粗锌(含Cu、Fe等)代替纯锌与盐酸反应效果更佳。
第二讲 原电池 化学电源【真题速递】1.(2019.全国Ⅲ卷)为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn (3D −Zn )可以高效沉积ZnO 的特点,设计了采用强碱性电解质的3D −Zn —NiOOH 二次电池,结构如下图所示。
电池反应为Zn(s)+2NiOOH(s)+H 2O(l)−−−→←−−−放充电电ZnO(s)+2Ni(OH)2(s)。
A. 三维多孔海绵状Zn 具有较高的表面积,所沉积的ZnO 分散度高B. 充电时阳极反应为Ni(OH)2(s)+OH −(aq)−e −NiOOH(s)+H 2O(l)C. 放电时负极反应为Zn(s)+2OH −(aq)−2e−ZnO(s)+H 2O(l)D. 放电过程中OH −通过隔膜从负极区移向正极区 【答案】D 【解析】A 、三维多孔海绵状Zn 具有较高的表面积,吸附能力强,所沉积的ZnO 分散度高,A 正确;B 、充电相当于是电解池,阳极发生失去电子的氧化反应,根据总反应式可知阳极是Ni(OH)2失去电子转化为NiOOH ,电极反应式为Ni(OH)2(s)+OH -(aq)-e -=NiOOH(s)+H 2O(l),B 正确;C 、放电时相当于是原电池,负极发生失去电子的氧化反应,根据总反应式可知负极反应式为Zn(s)+2OH -(aq)-2e -=ZnO(s)+H 2O(l),C 正确;D 、原电池中阳离子向正极移动,阴离子向负极移动,则放电过程中OH -通过隔膜从正极区移向负极区,D 错误。
2.(2019.全国1卷)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV 2+/MV +在电极与酶之间传递电子,示意图如下所示。
下列说法错误的是A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能B. 阴极区,氢化酶作用下发生反应H 2+2MV2+2H ++2MV +C. 正极区,固氮酶催化剂,N 2发生还原反应生成NH 3D. 电池工作时质子通过交换膜由负极区向正极区移动 【答案】B 【解析】由生物燃料电池的示意图可知,左室电极为燃料电池的负极,MV +在负极失电子发生氧化反应生成MV 2+,电极反应式为MV +—e —= MV 2+,放电生成的MV 2+在氢化酶的作用下与H 2反应生成H +和MV +,反应的方程式为H 2+2MV 2+=2H ++2MV +;右室电极为燃料电池的正极,MV 2+在正极得电子发生还原反应生成MV +,电极反应式为MV 2++e —= MV +,放电生成的MV +与N 2在固氮酶的作用下反应生成NH 3和MV 2+,反应的方程式为N 2+6H ++6MV +=6MV 2++NH 3,电池工作时,氢离子通过交换膜由负极向正极移动。
考点(一) 原电池的工作原理 【点多面广精细研】1.原电池(1)概念:原电池是把化学能转化为电能的装置。
(2)构成条件①能自发进行的氧化还原反应发生(一般是活动性强的金属与电解质溶液反应)。
②活动性不同的两电极(金属或石墨)。
③形成闭合回路。
形成闭合回路需三个条件:电解质溶液;两电极直接或间接接触;两电极插入电解质溶液中。
2.原电池的工作原理 (1)两种装置图甲和图乙是铜锌原电池装置示意图。
[说明] ①图乙盐桥中通常装有含琼脂的KCl 饱和溶液。
②盐桥的作用:使整个装置构成闭合回路,代替两溶液直接接触;平衡电荷;提高电池效率。
(2)反应原理3.电子流向(外电路):负极→导线→正极(电流方向与电子流向相反)。
离子流向(内电路):阴离子向负极移动,阳离子向正极移动。
4.原电池正、负极的判断[小题练微点]判断下列说法的正误(正确的打“√”,错误的打“×”)。
(1)在原电池中,发生氧化反应的一极一定是负极()(2)由于CaO+H2O===Ca(OH)2可以放出大量的热,故可把该反应设计成原电池()(3)在锌铜原电池中,因为有电子通过电解质溶液形成闭合回路,所以有电流产生()(4)原电池工作时,溶液中的阳离子向负极移动,盐桥中的阳离子向正极移动()(5)两种活泼性不同的金属组成原电池的两极,活泼金属一定作负极()(6)一般来说,带有“盐桥”的原电池比不带“盐桥”的原电池效率高()答案:(1)√(2)×(3)×(4)×(5)×(6)√[学霸微提醒](1)不论在原电池中还是在电解池中,电子均不能通过电解质溶液。
(2)金属的活动性受所处环境的影响。
如Mg、Al的活动性:在中性或酸性溶液中活动性:Mg>Al;而在碱性溶液中,Al可以与OH-反应,而Mg不反应,所以Mg与Al用导线连接后放入NaOH溶液中,Al是负极,Mg是正极。
(3)Fe、Cu相连,浸入稀HNO3中,Fe作负极;浸在浓HNO3中,Cu作负极(Fe发生钝化)。
错误的是()A.负极反应式为Mg-2e-===Mg2+B.正极反应式为Ag++e-===AgC.电池放电时Cl-由正极向负极迁移D.负极会发生副反应Mg+2H2O===Mg(OH)2+H2↑解析:选B Mg—AgCl电池的电极反应:负极Mg-2e-===Mg2+,正极2AgCl+2e-===2Ag+2Cl-,A项正确,B项错误;在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极,C项正确;Mg是活泼金属,能和H2O发生反应生成Mg(OH)2和H2,D项正确。
2.(2015·全国卷Ⅰ)微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。
下列有关微生物电池的说法错误的是()A.正极反应中有CO2生成B.微生物促进了反应中电子的转移C.质子通过交换膜从负极区移向正极区D.电池总反应为C6H12O6+6O2===6CO2+6H2O解析:选A图示所给出的是原电池装置。
有氧气反应的一极为正极,发生还原反应,因为有质子通过,故正极电极反应式为O2+4e-+4H+===2H2O,C6H12O6在微生物的作用下发生氧化反应,电极反应式为C6H12O6-24e-+6H2O===6CO2+24H+,负极上有CO2产生,故A错误;微生物电池是指在微生物作用下将化学能转化为电能的装置,所以微生物促进了反应中电子的转移,故B正确;质子是阳离子,阳离子由负极区移向正极区,故C正确;正极的电极反应式为6O2+24e-+24H+12H2O,负极的电极反应式为C6H12O6-24e-+6H2O===6CO2+24H+,两式相加得电池总反应为C6H12O6+6O2===6CO2+6H2O,故D正确。
方法规律原电池电极反应式的书写(1)一般电极反应式的书写①书写步骤②常见介质①书写三步骤②书写技巧若某电极反应式较难写出时,可先写出较易写的电极反应式,然后根据得失电子守恒,用总反应式减去较易写的电极反应式,即可得出较难写的电极反应式。
3.M、N、P、E NaHSO4溶液中,M表面有大量气泡逸出;③N、E用导线连接放入E的硫酸盐溶液中,电极反应为E2++2e-===E,N-2e-===N2+。
则这四种金属的还原性由强到弱的顺序是() A.P>M>N>E B.E>N>M>PC.P>N>M>E D.E>P>M>N解析:选A由①知,金属活动性:M>N;M、P用导线连接放入NaHSO4溶液中,M表面有大量气泡逸出,说明M作原电池的正极,故金属活动性:P>M;N、E构成的原电池中,N作负极,故金属活动性:N>E。
4.(2013·广东高考节选)能量之间可相互转化:电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。
设计两种类型的原电池,探究其能量转化效率。
限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
(1)完成原电池甲的装置示意图(见右图),并作相应标注。
要求:在同一烧杯中,电极与溶液含相同的金属元素。
(2)铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极_______________________________________________。
(3)甲、乙两种原电池中可更有效地将化学能转化为电能的是________,其原因是________________________________________________________________________________________________________________________________________________________________________________________________________________________。
解析:(3)以Zn和Cu作电极为例分析,如果不用盐桥,则除了发生电化学反应外还发生Zn和Cu2+的置换反应,反应放热,会使部分化学能以热能形式散失,使其不能完全转化为电能,而盐桥的使用,可以避免Zn和Cu2+的直接接触,从而避免能量损失,提供稳定电流。
答案:(1)如图所示(2)电极逐渐溶解,表面有红色固体析出(3)甲电池乙的负极可与CuSO4溶液直接发生反应,导致部分化学能转化为热能;电池甲的负极不与所接触的电解质溶液反应,化学能在转化为电能时损耗较小[归纳拓展]原电池原理的四大应用(1)加快化学反应速率一个自发进行的氧化还原反应,形成原电池时会使反应速率加快。
如在Zn与稀硫酸反应时加入少量CuSO4溶液构成原电池,反应速率加快。
(2)金属的防护使被保护的金属制品作原电池正极而得到保护。
如要保护一个铁质的输水管道或钢铁桥梁等,可用导线将其与一块锌块相连,使锌作原电池的负极。
(3)比较金属活动性强弱两种金属分别作原电池的两极时,一般作负极的金属比作正极的金属活泼。
(4)设计制作化学电源①首先将氧化还原反应分成两个半反应。
②根据原电池的反应特点,结合两个半反应找出正、负极材料和电解质溶液。
如根据反应2FeCl3+Cu===2FeCl2+CuCl2设计的原电池为1.有关如图所示原电池的叙述不正确的是()A.电子沿导线由Cu片流向Ag片B.正极的电极反应式是Ag++e-===AgC.Cu片上发生氧化反应,Ag片上发生还原反应D.反应时盐桥中的阳离子移向Cu(NO3)2溶液[做一当十]点拨:原电池工作时,电解质溶液以及盐桥中的阳离子向正极移动,阴离子向负极移动。
解析:选D A项,该装置是原电池,铜作负极,银作正极,电子从铜片沿导线流向银片,正确;B项,正极电极反应式为Ag++e-===Ag,正确;C项,铜片上失电子发生氧化反应,银片上得电子发生还原反应,正确;D项,原电池工作时,电解质溶液以及盐桥中的阳离子向正极移动,阴离子向负极移动,所以反应时盐桥中的阳离子移向AgNO3溶液,错误。
2.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。
下列说法中正确的是()A.①②中Mg作负极,③④中Fe作负极B.②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑C.③中Fe作负极,电极反应式为Fe-2e-===Fe2+D.④中Cu作正极,电极反应式为2H++2e-===H2↑[做一当十]点拨:原电池正、负极的活泼与否是参照电解质溶液确定的。
如稀硫酸作电解质溶液,Mg作负极,NaOH溶液作电解质溶液,Al与NaOH反应,而Mg不反应,Al作负极。
解析:选B①中Mg作负极;②中Al作负极;③中铜作负极;④是铁的吸氧腐蚀,Cu作正极,电极反应式为O2+2H2O+4e-===4OH-。
3.一定量的稀盐酸跟过量锌粉反应时,为了加快反应速率又不影响生成H2的总量,可采取的措施是()A.加入少量稀NaOH溶液B.加入少量CH3COONa固体C.加入少量NH4HSO4固体D.加入少量CuSO4溶液解析:选D A中加入NaOH溶液,消耗盐酸,H2的生成量会减少,错误;B中加入CH3COONa固体,在溶液中CH3COO-会结合H+生成醋酸,减慢反应速率,错误;C中加入NH4HSO4固体,增加了H+的量,生成的H2会增多,错误;D中加入少量CuSO4溶液,Zn置换出少量Cu附着在锌表面,形成原电池可以加快反应速率,并且不影响H2的生成量,正确。
4.(2019·海淀区模拟)Mg—AgCl电池是一种能被海水激活的一次性贮备电池,电池的总反应如下:2AgCl+Mg===Mg2++2Ag+2Cl-,有关该电池的说法正确的是() A.该电池可用于海上应急照明供电B.负极反应式为AgCl+e-===Ag+Cl-C.该电池不能被KCl 溶液激活D.电池工作时,每消耗1.2 g Mg,溶液中的Cl-增多0.2 mol[做一当十]点拨:①负极上失电子发生氧化反应,电极反应式为Mg-2e-===Mg2+;②正极上得电子发生还原反应,电极反应式为AgCl+e-===Ag+Cl-。
解析:选A电池是一种能被海水激活的一次性贮备电池,电池工作时将化学能转化为电能,电能的产生可用于海上应急照明供电,故A正确;AgCl是正极,正极上得电子发生还原反应,电极反应式为AgCl+e-===Ag+Cl-,故B错误;电池是一种能被海水激活的一次性贮备电池,所以KCl溶液也可以激活电池,故C错误;电池工作时,每消耗1.2 g Mg即0.05 mol,溶液中的Cl-增多0.1 mol,故D错误。
5.(1)用零价铁(Fe)去除水体中的硝酸盐(NO-3)已成为环境修复研究的热点之一。