物质的量浓度及其应用
- 格式:docx
- 大小:27.43 KB
- 文档页数:5


2023高考化学《物质的量浓度在化学实验中的应用》教案设计及必考清单1.了解溶液浓度的表示方法。
2.理解溶液中溶质的质量分数和物质的量浓度的概念,并能进行有关计算。
3.掌握配制一定质量分数的溶液和物质的量浓度的溶液的方法。
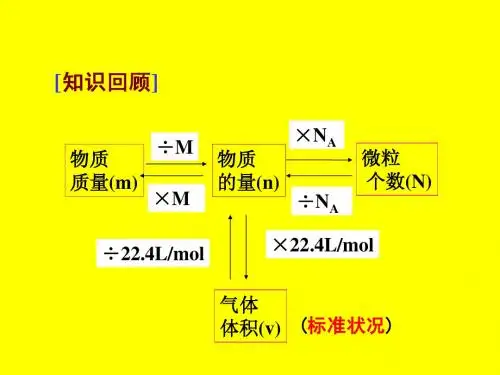
知识点一 物质的量浓度及其简单计算【考必备·清单】1.物质的量浓度(1)概念:表示单位体积溶液里所含溶质B 的物质的量的物理量。
(2)数学表达式:c B =n (B )V。
(3)常用单位为mol·L -1(或mol/L)。
(4)特点:对于某浓度的溶液,取出任意体积的溶液,其浓度、密度、质量分数相同,但所含溶质的质量、物质的量则因体积不同而改变。
2.溶质的质量分数(1)概念:以溶液里溶质质量m (B)与溶液质量的比值表示溶液组成的物理量,一般用百分数表示,也可用小数表示。
(2)表达式:w (B)=m (B )m (aq )×100%。
[名师点拨] (1)NH 3溶于水溶质为NH 3·H 2O ,质量分数要以溶解NH 3的质量计算。
(2)CuSO 4·5H 2O 溶于水溶质为CuSO 4,质量分数不能以CuSO 4·5H 2O 的质量计算。
【夯基础·小题】1.判断正误(正确的打“√”,错误的打“×”)(1)将58.5 g NaCl溶于1 L水中,所得溶液的物质的量浓度为1 mol·L-1( )(2)1 L 0.5 mol·L-1CaCl2溶液中,Ca2+与Cl-的物质的量浓度都是0.5 mol·L-1( )(3)将62 g Na2O溶于水,配成1 L溶液,所得溶液的物质的量浓度为1 mol·L-1( )(4)标准状况下,2.24 L HCl溶于水配成1 L溶液,所得溶液的物质的量浓度为0.1 mol·L -1( )答案:(1)×(2)×(3)×(4)√2.在标准状况下,将V L A气体(摩尔质量为M g·mol-1)溶于0.1 L水中,所得溶液的密度为ρg·cm-3,则此溶液的物质的量浓度(mol·L-1)为( )A.VρMV+2 240B.1 000VρMV+2 240C.MV22.4(V+0.1)ρD.1 000Vρ(MV+2 240)解析:选B 气体的物质的量为V22.4mol,所得溶液的质量为⎝⎛⎭⎪⎫V22.4×M+100g,则此溶液的物质的量浓度为V22.4mol÷⎣⎢⎡⎦⎥⎤⎝⎛⎭⎪⎫V22.4×M+100g÷1 000ρ g·L-1=1 000VρMV+2 240mol·L-1。


化学《物质的量浓度》教案案例优秀范文一、教学目标1. 让学生理解物质的量浓度的概念,掌握物质的量浓度计算方法。
2. 培养学生运用化学知识解决实际问题的能力。
3. 通过对物质的量浓度知识的学习,提高学生的科学素养。
二、教学内容1. 物质的量浓度定义2. 物质的量浓度计算公式3. 物质的量浓度换算与稀释4. 物质的量浓度在实际应用中的例子三、教学重点与难点1. 教学重点:物质的量浓度的概念、计算方法及应用。
2. 教学难点:物质的量浓度计算公式的灵活运用,实际问题中的浓度计算。
四、教学方法1. 采用问题驱动法,引导学生主动探究物质的量浓度知识。
2. 利用案例分析法,让学生学会将理论知识应用于实际问题。
3. 运用讨论法,培养学生团队合作精神,提高解决问题的能力。
五、教学过程1. 导入:通过生活中的实例,如饮料、药剂等,引出物质的量浓度概念。
2. 新课讲解:讲解物质的量浓度定义、计算公式及换算方法。
3. 案例分析:分析实际问题中的物质的量浓度计算,如溶液稀释、浓度测定等。
4. 课堂练习:布置相关练习题,让学生巩固所学知识。
5. 总结与拓展:总结本节课的主要内容,布置课后作业,引导学生进一步探究。
六、教学评价1. 课堂表现:观察学生在课堂上的参与程度、提问回答等情况。
2. 练习完成情况:检查学生课后练习的完成质量。
3. 案例分析报告:评估学生在实际问题分析中的表现。
4. 小组讨论:评价学生在团队合作中的表现。
七、教学资源1. PPT课件:展示物质的量浓度相关概念、公式及案例。
2. 练习题:提供多种难度的练习题,巩固学生知识。
3. 案例分析素材:选取实际问题,供学生分析讨论。
八、教学进度安排1. 第1-2课时:讲解物质的量浓度概念及计算公式。
2. 第3课时:案例分析,实际问题中的物质的量浓度计算。
3. 第4课时:课堂练习,巩固所学知识。
4. 第5课时:总结与拓展,布置课后作业。
九、教学反馈与调整1. 课后收集学生练习反馈,了解掌握情况。






物质的量浓度教案一、教学目标1. 让学生理解物质的量的概念及其应用。
2. 让学生掌握物质的量浓度的定义、计算方法及单位。
3. 培养学生运用物质的量浓度解决实际问题的能力。
二、教学内容1. 物质的量的概念:物质的量是表示微观粒子集合体的一个基本物理量,符号为n,单位为摩尔(mol)。
2. 物质的量浓度的定义:物质的量浓度是指单位体积(或单位质量)溶液中溶质的物质的量,符号为c,单位为摩尔每升(mol/L)或摩尔每千克(mol/kg)。
3. 物质的量浓度的计算方法:c = n/V(体积溶液)或c = n/(mM)(质量溶液),其中n为溶质的物质的量,V为溶液的体积,m为溶液的质量,M为溶质的摩尔质量。
4. 物质的量浓度的应用:通过物质的量浓度可以判断溶液的稀释程度、进行溶液的配制、计算溶液中溶质的质量等。
三、教学重点与难点1. 教学重点:物质的量的概念、物质的量浓度的定义及计算方法。
2. 教学难点:物质的量浓度的应用,溶液的稀释与配制。
四、教学方法1. 采用讲授法,讲解物质的量的概念、物质的量浓度的定义及计算方法。
2. 采用案例分析法,分析物质的量浓度在实际问题中的应用。
3. 采用小组讨论法,让学生分组讨论溶液的稀释与配制问题。
1. 第一课时:物质的量的概念及物质的量浓度的定义。
2. 第二课时:物质的量浓度的计算方法及单位。
3. 第三课时:物质的量浓度的应用(一):溶液的稀释。
4. 第四课时:物质的量浓度的应用(二):溶液的配制。
5. 第五课时:综合练习与总结。
六、教学活动1. 课堂讲授:物质的量的概念、物质的量浓度的定义及计算方法。
2. 案例分析:分析物质的量浓度在实际问题中的应用,如药品配置、溶液稀释等。
3. 小组讨论:讨论溶液的稀释与配制问题,让学生运用所学知识解决实际问题。
七、教学评估1. 课堂问答:检查学生对物质的量的概念、物质的量浓度的定义及计算方法的掌握程度。
2. 练习题:布置有关物质的量浓度计算和应用的练习题,让学生巩固所学知识。
专题3 物质的量浓度及其应用一、知识梳理1.物质的量浓度(1)概念描述:溶液里所含有的溶质B的;符号为,单位为;(2)表达式:C B=(3)描述对象为。
2.有关物质的量浓度的计算★物质的量浓度和溶质质量分数之间的换算:(其中ρ为溶液密度,ω为溶质质量分数,Μ为溶质的摩尔质量)3.一定物质的量浓度溶液的配制(1)主要仪器①托盘天平:称量之前先调零,“左物右码”,读数精确到0.1g。
【注意:常见仪器精确度——量筒精确到0.1ml,滴定管精确到0.01ml,PH试纸精确到整数值】②容量瓶:三大标志“刻度线、温度、容积”,常见规格“50ml、100ml、250ml、500ml、1000ml”使用前要检查是否漏水且用蒸馏水清洗。
【注意:根据所需溶液体积选取合适规格分的容量瓶。
如配制480ml 溶液应选用500ml 的容量 瓶,代入计算的也是500ml 。
即容量瓶只能配制规定容积的溶液,不能配制任意体积的溶液】 ③其他仪器:量筒、烧杯、胶头滴管、玻璃棒、药匙等 (2)配置过程 ①计算a. 溶质为固体m=nM=CVM(其中C 为物质的量浓度,V 为所选容量瓶的规格体积,M 为溶质的摩尔质量)b.溶质为液体(即稀释溶液)C 浓V 浓=C 稀V 稀②称量(易潮解、有腐蚀的试剂应放在小烧杯中快速称量)③溶解(将溶质倒入小烧杯,加入适量的水,用玻棒搅拌加速溶解,冷却至室温)④移液(将烧杯中冷却后的溶液转移到容量瓶中, 用玻棒引流,避免液体洒在瓶外。
) ⑤洗涤(移液后,用蒸馏水洗涤小烧杯和玻璃棒2~3次,并将洗涤液一并注入容量瓶。
) ⑥定容(在容量瓶中加水,至水面距刻度线1~2cm 处,改用胶头滴管滴加至液体凹液面最低处与刻度线相切。
)⑦摇匀(把定容好的容量瓶瓶塞塞紧,用食指顶住瓶塞,用另一只手的手指托住瓶底,将容量瓶倒转和摇动几次,使溶液混合均匀。
若摇匀后发现液面低于刻度线,不可再加水。
) (3)误差分析 ①原理:(V 不变,n 偏小则C 偏低,n 偏大则C 偏高;n 不变,V 偏小则C 偏高,V 偏大则C 偏低) ②详细分析三、随堂练习1.下列溶液中Cl-浓度最大的是()A. 100ml 0.1mol/L NaCl 溶液B. 75ml 0.2mol/L MgCl2溶液C. 50ml 0.5mol/L AlCl3溶液D. 10ml 1mol/L 盐酸2.将8g铁片放入100 mL硫酸铜溶液中,溶液中的Cu2+全部被还原时,铁片变为8.2 g,则原c(CuSO4)为()A.0.5 mol/L B.0.25 mol/LC.0.025 mol/L D.0.125 mol/L3. 100ml 0.3mol/L Na2SO4溶液和50ml 0.2mol/L Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为()【解题提示:C3V3 = C1V1+C2V2 】A.0.20mol/LB. 0.25mol/LC. 0.40mol/LD. 0.50mol/L4.在含有AlCl3、KCl、K2SO4三种溶质的溶液中,已知c(Cl-)=3.5mol/L、c(K+)=1.5mol/L、c(SO42- )=0.5mol/。
质量浓度和物质的量浓度
质量浓度和物质的量浓度是物理化学中的两个重要概念,用于描述溶
液中溶质的含量。
下面将分别介绍它们的定义、计算方法和实际应用。
一、质量浓度
质量浓度是指在溶液中单位体积(或单位质量)中所含的溶质质量。
通常用符号C表示,单位是g/L。
其计算公式为:
C = m/V
其中,m是溶质的质量,单位为g;V是溶液的体积,单位为L。
因此,质量浓度的单位可以理解为“克溶质/升溶液”。
例如,100g NaCl溶解在
1L水中,则其质量浓度为100g/L。
质量浓度在生活中的应用非常广泛,如医学中的药物配制、化妆品生产、食品加工等。
在日常生活中,我们常用酒精浓度来描述酒的酿制
和烈度。
二、物质的量浓度
物质的量浓度是指单位体积(或单位质量)中所含的物质的量。
通常
用符号c表示,单位是mol/L。
其计算公式为:
c = n/V
其中,n是溶质的物质的量,单位为mol;V是溶液的体积,单位为L。
因此,物质的量浓度的单位可以理解为“摩尔/升溶液”。
例如,将1mol
的NaCl溶解在1L的水中,则其物质的量浓度为1mol/L。
物质的量浓度在化学反应中有着广泛的应用。
例如,在酸碱反应中,
酸或碱的物质的量浓度可以用来计算反应的摩尔比或配比。
总之,质量浓度和物质的量浓度作为溶液浓度的两种描述方式,能够
方便地定量描述溶质在溶液中的含量。
在科学研究和工业生产中,它
们的应用十分广泛,为相关领域的发展和进步做出了重要贡献。
《物质的量浓度的定义及其应用》学案【本节重点】物质的量浓度的定义及其应用【交流•研讨】请设计一个物理量,将溶质的物质的量(n)和溶液的体积(V)联系起来,该物理量应该如何定义?1、物质的量浓度(c)定义:溶质的物质的量(n)、溶液的体积(V)与溶质B的物质的量浓度(C B)之间的关系:C B = ____________________ ,此公式可变形为n = ______________________________2、简单应用(1)100mL1.0mol/L的KOH溶液中所含溶质的质量是 _____________________________ 。
(2)200mL含H2SO98g的硫酸溶液的物质的量的浓度是_____________________________ 。
【问题讨论】1、将324gG2HhO i(蔗糖)溶解在1L水中,所得的溶液中溶质的物质的量浓度是否为1mol/L ?2、从1L1mol/L C 12H2O1 (蔗糖)溶液中取出100mL,取出的溶液中G2H22O1的物质的量浓度是多少?3、欲配制1mol/L的NaOH溶液250mL,完成下列步骤:①用天平称取氢氧化钠固体 _____________________ 克。
②将称好的氢氧化钠固体放入 _________________________ 中,加 ____________ 蒸馏水将其溶解,待后将溶液沿 ____________ 移入mL 的容量瓶中。
③用少量蒸馏水洗涤烧杯和玻璃棒__________________ 次,将洗涤液移入______________ 中,在操作过程中不能损失点滴液体,否则会使溶液的浓度偏____________________ (高或低)。
④向容量瓶加水至离刻度线 ___________________ 时,改用 __________________ 小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度偏_______________________ ,应该____________ 。
物质的量浓度及其应用一. 选择题(每小题有1个选项符合题意)1 .设心为阿伏加徳罗常数的值,下列关于0.2 mol/L Ba (NO 3)2溶液的说法中不正确的是( A ・ B ・ C ・ D ・ 2. A ・20°C 时,密度小于1.174 g-cm 3的KC1溶液是不饱和溶液 将此溶液蒸发部分水,再恢复到20C 时,溶液密度一泄大于1.174 g em 34.在无土栽培中,需配制 1L 含 0.50 mol-L “ 的 NHU 、0.16 mol 17*6 0.24 moI L KSCh 的混合溶液,但当时没有K 2SO 4固体,若用(NH 4)2SO 4固体代替,需用KC1、NH 4C1. (NHJ2SO4三 种固体的物质的呈:(单位为mol )分别为()A. 0・40. 0.50. 0」2 B ・ 0.66. 0.50. 0.24 5.某氯化镁溶液的密度为1.18 g em \其中镁离子的质量分数为5・%3OO mL 该溶液中C1 的物质的量约等于()B ・ 0.63 molC ・ 0.74mol6.将溶质的质量分数为14%的KOH 溶液加热蒸发掉100g 水后.得到溶质的质咼分数为28% 的溶液80 mL,此时溶液的物质的量浓度为()B ・ 6.25 moI L 1 D ・ 6.75 mol-L 1 7.将标准状况下的aLHCl (g )溶于1000 g 水中,得到的盐酸密度为b g-cm-\则该盐酸的物 质的量2L 溶液中阴、阳离子的总数为1・2心 500 mL 溶液中NO3的浓度为0.2 mol/L 500 mL 溶液中Ba?■的浓度为0.2 mol/L500 mL 溶液中NCh 的总数为0.2 N A 下列说法中正确的是() 1 L 水中溶解了 58.5gNaCb 该溶液的物质的量浓度为1 mol/L 从]L2 mol/L 的H 2SO 4溶液中取出0.5 L,该溶液的浓度为1 mol/L B.配制500 mL 0.5 mol/L 的CuSO 4溶液,需62.5 g 胆矶 中和 100 mL 1 mol/L 的 H 2SO 4溶液,需 NaOH 4g3. 20°C 时,饱和KC1溶液的密度为1.174g-cm -3,物质的疑浓度为4.0mol L *,则下列说法中 不正确的是() • • •25°C 时,饱和KC1溶液的浓度大于4.0 moI L'1C. D. A. B. 此溶液中KC1的质量分数为1 174x1 000)oC. D. C ・ 0.64、0.50. 0.24D ・ 0.64. 0.02. 0.24A. 0.37 mol D ・l ・5molA. 5 mol-L 1 C ・7mol ・L-】浓度是()A. a/22.4 mol-L-1B・ ab/22400mol・L-iC・ ab/(22400+36.5 a) mol/L D・ 1000 ab/(22400+36・5 a) mol/L8.某氯化镁溶液的密度为l・18g・cm-3,其中镁离子的质量分数为5.1%, 300 mL该溶液中CL离子的物质的量约等于()A. 0.37 mol B・ 0.63 mol C・ 0.74 mol D・ 1.5 mol9.用10 mL的0.1 mol-L 1 BaCb溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸领沉淀,则三种硫酸盐溶液的物质的量浓度之比是()。
A. 3 :2 :2B. 1 :2 :3C. 1 :3 :3D. 3 :1 :110.0.5Lmol L_,FeCh溶液与0.2 Lmol L 1 KC1溶液中的C「的数目之比为()。
A. 5 : 2B. 3 : 1C. 15 : 2D. 1 : 3二、填空题(1)______________________________________________________ 在400 mL2mol-L】的H2SO4溶液中,溶质的质量是______________________________________________ 。
此溶液中的H+的物质的量浓度为________ ,SO42-的物质的量浓度为 ________ 。
(2)___________________________________________ 在标准状况下,700 L NH3的物质的量为,全部溶解在1L水中,所得溶液中溶质的质量分数为________ c如果该氨水的密度为0.85 g-cm-3,则氨水的体积为______________ , NH3的物质的量浓度为________ 。
三、计算题1.向50 mLNa2SO4和NazCCh的混合溶液中加入过量的BaCl?溶液,得到14.51 g白色沉淀,向白色沉淀中加入过疑的稀HNCh,充分反应后,沉淀减少到4.66 g,并有气体产生。
(1)原混合溶液中Na2SO4和Na2CO3的物质的虽:浓度各是多少?(2)产生的气体的物质的量为多少?2.某研究性学习小组欲用化学方法测量一个不规则容器的体积。
把35.1 g NaCl放入500 mL的烧杯中,加入150 mL蒸憎水。
待NaCl完全溶解后,将溶液全部转移到容器中,用蒸餾水稀释至完全充满容器。
从中取出溶液100 mL.该溶液恰好与20 mLO.100 mol-L'1 AgNO3溶液完全反应。
试计算该容器的体积。
【答案与解析】1. 【答案】B【解析】据电离方程式:Ba(NO“2=B0+2NO 厂.n (NO 3-)=2n (Ba 2+)=2/? [BafNOi),], 2 L 溶液中阴、阳离 子的总数=2Lx0.2 mol/Lx3xA r A =1.2 N A : 500 mL 溶液中 NO 「的总数为 0.5 Lx0.2 mol/Lx2 A\=0.2 N A :离予浓度与 溶液体积无关,只与化学式中的角码(或角标〉有关,所以c (NO.. )=2c (Ba 2>2c |Ba(NO3)i]=2x0.2 mol/L=0・4 mol/L a2. 【答案】C【解析】A 中58.5 g NaCl 的物质的虽为I mol,但溶液的体枳并不是1L 水的体积.所以物质的虽浓度无法计 算:B 取出0.5L 的溶液,它的浓度并未发生变化.仍为2 mol/L.0.5 L 溶液中所含的溶质是1L 溶液中的一半:C 中伙I 为500mL0.5 mol/L 的CuSO 」溶液中,CuSO 4的物质的址为0.5 Lx0.5 mol/L=0.25 mol.所以胆矶的物质的虽 也应为 0.25 moL即质虽为 0.25 molx250g/mol=62.5 g : D 中因为 HzSCh 的物质的量为 O.lLxl mol/L=0.1 mol,中 和 0」mol H2SO4 需NaOH 应为 0.2 mol.即 0.2 molx40 g/mol=8 g 。
3・【答案】D【解析】 温度升商,KC1的溶解度増大,饱和溶液的浓度増大.A 正确:在一定温度条件下,饱和KC1溶液的密度一定比不饱和KC1溶液密度大,C 正确:将此饱和溶液蒸发部分水.再恢复到200会有晶体析出,但剩余溶液还是饱和溶液.其密度还是等于1」74g ・cm D 不正确。
4. 【答案】D【解折】 根据离子的物质的罐来判断:H (NH4+)=0.50 moh /t(CD=(0.50+0.16) mol=0.66moL n(K +)=(0.16+0.24x2)mol=0.64 mol m(SOF ) =0.24 moL0.64 mol K*來自 KC1,则 n(KCl)=0.64 moL SOP 只能來自(NH^SO, 则(NH4)2SO4为 0.24 mol.0.66 mol Cl 由 KC1 和 NHQ 共同提供,而 0.64 mol KC1 提供 f 0.64 mol CF,故 0.02 mol C 厂由 NHuCl 提供,此时 NH 广恰好为(0.02 +0.24x2)mol=0.50moL5. 【答案】D【解析】 因 *24 g-mol-i*则川c 「)=2x0・75 mol= 1.5 mol,故选 EL6. 【答案】B【解析】 设蒸发浓缩后溶液物质的址浓度为儿根据蒸发前后溶质质虽守恒.则(00*gm 。
.__io 。
g^x i4%=0.0S Lx*x56 乡mol"】-x= 6.25 mol-L -1.7・【答案】D【解析】欲求溶液的物质的址浓度,需知溶质的物质的虽和溶液的体积。
溶液的体积不等于HCl(g)的体积.也 不等于HCl(g)和HQ 的体枳之和,而要根据溶液的密度求得。
不同浓度的溶液混合或溶质和溶剂混合时,体积不 能加和.但质址可以加和。
因此可以通过混合后的总质址与密度來求混合后的总休积.进一步求得溶液的物质的 址浓度。
---------- --- x 36.5g- mol"1 4-lOOOg玖盐酸)=224L •皿, ------------------------ xlO-3bg- cm~3n (HCl)=a L/22.4 molL 1 c (HCl)=n (HC1)/V (盐酸)=1000 ab/(22400+36.5 a) mol/L&【答案】D【解析】木題考査落液溶质质虽分数与物质的虽浓度的换算。
W (KC1)=朋w _1.174 g-cm^xlOOO cm 5' °74.5x4.01.174x1 000xlOO% B 正确: 解析:m (Mg 2+)=3OO mL+1.18 g-cnr 3x5.1%=18 g>冷(Mg2+) =聊(盹2+)M 盹")所以MgCh 溶液中含有n (CF)=2-n (Mg2*)=2x0.75 mol=1.5 moL提示:通过计算溶液中含有的Mg”的质址和MgCk的组成.可直接求得n(Cl ),没有必要求浓度.再根据溶液体积求物质的虽。
9・【答案】C【解析】三个反应的木质是Ba”+SOF—=BaSOJ依题总Ba"的物质的虽相等.故三种盐溶液中SOF-的物质的址相等.物质的虽浓度相同,依此则可推出三种盐的物质的量浓度之比为1 :3:10.【答案】C【解析】0.5 L1 mol-L"1 FeCh溶液中的Cl一的数目为0.5 Lxl mo\ L^x3xN^\.5xN^ 0.2 L 1 mol・L一】KC1 溶液中Cl 一的数目为0.2Lxl mol LJlxNMQx^A.它们的C厂数目之比为15 : 2。
二.填空题【答案】(l)78.4g 4111O1.L-1 2 mol L-1(2) 31.25 mol 34.7% 1.8L 17.36 mol・L-】【解析】(1) /t=cV=2 mol・L-】x0.4 L=0.8 mol.m (H2SO4)=〃・M=0・8 molx98 g-mol〔=7&4 g:c (H*)=2c (H2SO4M mol-L~l:c (SOr~)=c (H:SO4)=2 mol L-1oy 7001(2) //(NH;) = —= —=31.25mol:3% 22.4 L mor1w = -------------- 31.2、mol:17g-mol -------------_X IQO% = 34.7%:31.25molxl7g mol +1x10 mLxlg cmV(NH・ H O)=巴=R x 17纣moL +1x1()“mL x 1 g 5“趴⑹ mL=l・8 L:3 20.85gem"3、1131-25mol ⑴ * i T-ic(NHJ = — = -------------- = 17.36mol・L °3V 1.8L三.计算题1・【答案】(1) 0・4mol・Li. lmolL-i (2) 0.05 mol【解析】根据题总知4.66 g沉淀即为硫酸顿沉淀,故硫酸钠的物质的址为n (Na2SO4)=n (BaSO4)=4.66g ,-------------- ----- =0.02 mol,其浓度为 c (Na2S04)=0.02 mol/0.05 L=0.4 mol L"1:碳酸顿沉淀的质虽为14.51 g—4.66 233g ・mol-9 85gg=9.85 刃/i (Na2COj=n (BaCOj)= ------------------ - - =0.05 mol.则 c (Na2C03)=0.05 mol/0.05 L=1 moLL"1:产生的二197g・mo「氧化碳气体的物质的虽为0.05 moL2.【答案】30L【解析】AgN0j+NaCl==AgClLNaN03,(NaCl)=/t (AgN03)=0.100 mol・L-】x0.02 L=0.002 mol.nt (NaCl)=0.002 molx58.5 g-mol *=0.117 g, V…=100m Lx2^ = 30000mL = 30L o。