急性毒性试验设计
- 格式:ppt
- 大小:330.50 KB
- 文档页数:37

《食品毒理学》经口急性毒性试验一、实验目的和要求掌握给药方法;了解一次或24小时内多次给予受试化学物后,动物所产生的急性毒性反应及其严重程度,中毒死亡的特征以及可能的死亡原因,观察受试动物毒性反应与剂量的关系,求出半数致死量。
二、主要仪器设备实验动物:成年昆明系实验小鼠(SPF级别)。
器材:注射器(0.25,1,2,5ml)、吸管(0.1,0.2,0.5,1,2,10ml)、容量瓶(10,25,50ml)、烧杯(10,25,50ml)、滴管、灌胃针12号、动物体重秤、解剖剪刀、镊子、手术手套,口罩。
试剂:受试化合物(氯化钡溶液,20mg/mL)。
三、实验原理氯化钡是强电解质,可完全电离出钡离子,导致钡离子在小鼠血液内部引发急性低钾血症,故小鼠会出现肌无力和发作性软瘫,心肌应激性减低,各种心律失常和传导阻滞,由于肌无力,严重中毒的小鼠还会出现呼吸困难乃至死亡等症状。
四、实验内容1.健康动物的选择和性别鉴定。
2.实验动物称重、编号和随机分组。
3.受试化学物溶液的配制。
4.小鼠灌胃操作技术。
(1)预实验,取小白鼠、称重、随机分为5组,每组3只,以灌胃的方式给予等体积、不同剂量的氯化钡溶液,摸索小鼠接近100%和0%死亡的剂量范围。
(2)小鼠随机分为5组,每组3只,以灌胃的方式给予等体积、不同剂量的氯化钡溶液。
小鼠灌胃法:将钝头的12号注射针(适用于小鼠),安装在适当容积的注射器上,吸取所需的受试物溶液,左手抓住动物双耳后至背部的皮肤(小鼠仅抓住耳后、颈部的皮肤,用无名指、小手指和大鱼际肌将其尾根部压紧),将动物固定成垂直体位,腹部面向操作者。
注意使动物的上消化道固定成一直线。
右手持注射器,将针头由动物口腔侧插入,避开牙齿,沿咽后壁缓缓滑人食管。
若遇阻力,可轻轻上下滑动探索,一旦感觉阻力消失,即可深入至胃部。
如遇动物挣扎,应停止进针或将针拔出,千万不能强行插入,以免操作穿破食管,甚至误人气管,导致动物立即死亡。
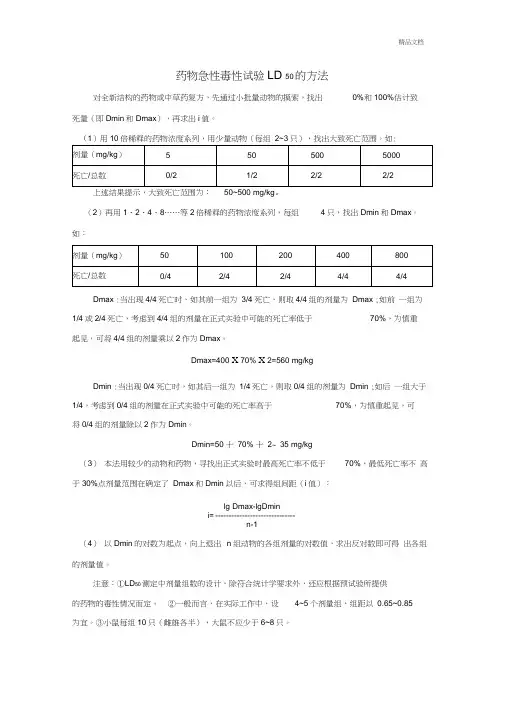
精品文档药物急性毒性试验LD 50的方法对全新结构的药物或中草药复方,先通过小批量动物的摸索,找出0%和100%估计致死量(即Dmin和Dmax),再求出i值。
(1)用10倍稀释的药物浓度系列,用少量动物(每组2~3只),找出大致死亡范围。
如:上述结果提示,大致死亡范围为:50~500 mg/kg。
(2)再用1、2、4、8……等2倍稀释的药物浓度系列,每组4只,找出Dmin和Dmax。
如:Dmax :当出现4/4死亡时,如其前一组为3/4死亡,则取4/4组的剂量为Dmax ;如前一组为1/4或2/4死亡,考虑到4/4组的剂量在正式实验中可能的死亡率低于70%,为慎重起见,可将4/4组的剂量乘以2作为Dmax。
Dmax=400 X 70% X 2=560 mg/kgDmin :当出现0/4死亡时,如其后一组为1/4死亡,则取0/4组的剂量为Dmin ;如后一组大于1/4,考虑到0/4组的剂量在正式实验中可能的死亡率高于70%,为慎重起见,可将0/4组的剂量除以2作为Dmin。
Dmin=50 十70% 十2~ 35 mg/kg(3)本法用较少的动物和药物,寻找出正式实验时最高死亡率不低于70%,最低死亡率不高于30%点剂量范围在确定了Dmax和Dmin以后,可求得组间距(i值):lg Dmax-lgDmini= ------------------------------n-1(4)以Dmin的对数为起点,向上退出n组动物的各组剂量的对数值,求出反对数即可得出各组的剂量值。
注意:①LD50测定中剂量组数的设计,除符合统计学要求外,还应根据预试验所提供的药物的毒性情况而定。
②一般而言,在实际工作中,设4~5个剂量组,组距以0.65~0.85为宜。
③小鼠每组10只(雌雄各半),大鼠不应少于6~8只。


实验二经口急性毒性LD50测定实验二经口急性毒性LD50测定一、试验目的1. 熟悉急性毒性LD50测定的剂量设计2. 掌握小鼠灌胃技术3. 掌握改进寇氏法计算LD50的方法二、试验原理选择健康的实验动物,依据LD50计算的设计原则,将实验动物随机分成数个染毒组和一个阴性对照组。
一次或24小时内多次给予实验组受试物后,观察动物所产生的急性毒性反应及其严重程度,中毒死亡的特征以及可能的死亡原因。
根据受试物毒性反应与剂量的关系,求出半数致死剂量(LD50),并根据LD50值将受试物进行急性毒性分级。
三、材料和试剂1. 实验动物:健康成年小鼠60只,雌雄各半2. 器材:灌胃针(小鼠适用)、注射器、吸管、容量瓶、烧杯、滴管、分析天平、台秤、外科手术剪、镊子3. 受试物:(敌百虫或克佰威)4. 染色剂:苦味酸酒精饱和溶液、0.5%品红溶液四、实验内容1. 实验动物称重、编号和随机分组2. 染毒剂量设计及试剂配制3. 小鼠灌胃染毒技术4. 毒性反应的观察及LD50计算五、试验方法(一)预实验1. 探索剂量范围先找出100%与0%的致死量(或阳性反应的剂量)为实验的上、下限剂量(Dmax和Dmin)。
据经验或文献定出一个估计量,取动物若干,每4只一组,按估计量给药,如出现4/4死亡时,下一组剂量降低,当出现3/4死亡时,则上一剂量为Dmax;如降低一档剂量出现的死亡率2/4或1/4时,应考虑到4/4死亡剂量组在正式实验时可能出现死亡率低于70%,为慎重起见可将4/4死亡剂量乘以1.4倍,作为Dmax。
以次类推,找出Dmin。
2. 剂量分组一般染毒组数(G)以5-8组为宜,组间剂量比值为r。
在确定组数后,按下列公式计算r。
1/(G-1)r = (Dmax/Dmin) 3. 受试物溶液的配制配制等比浓度的敌百虫溶液,并使每只动物在给药容量上相等(如0.5ml/20g)。
剂量按等比级数增减,相邻两剂量比值1:0.6,0.9,设5个剂量组。

简述| 药物急性毒性试验研究主要设计要点急性毒性(Acute toxicity)是指药物在单次或24小时内多次给予后一定时间内所产生的毒性反应。
拟用于人体的药物通常需要进行单次给药毒性试验。
单次给药毒性试验对初步阐明药物的毒性作用和了解其毒性靶器官具有重要意义。
单次给药毒性试验所获得的信息对重复给药毒性试验的剂量设计和某些药物临床试验起始剂量的选择具有重要参考价值,并能提供一些与人类药物过量所致急性中毒相关的信息。
实验设计注意事项01受试物受试物应采用工艺相对稳定、纯度和杂质含量能反映临床试验拟用样品和/或上市样品质量和安全性的样品,并注明受试物的名称、来源、批号、含量(或规格)、保存条件及配制方法等,并须有研制单位的COA。
来自于市售的辅料、溶媒等应具有相关的说明和规格。
02实验动物年龄| 试验应使用年轻健康成年的动物,如果是儿童用药,必要时采用幼年动物进行试验。
种属| 可根据药代或药效结果选择合适的动物种属,试验应采用至少两种哺乳动物,从多个方面暴露药物动物毒性,选择一种啮齿类和一种非啮齿类动物,如未采用非啮齿类动物进行动物试验,应该说明理由。
性别| 通常采用雌性和雄性动物进行试验,雌雄各半。
若采用单性别动物进行试验,应阐明其合理性。
动物数| 根据研究目的,选择合适的动物数,比如小动物每组动物10只,大动物每组动物4只。
动物数应符合试验方法及其结果分析评价的需要。
体重| 试验中的啮齿类动物初始给药时的每组平均体重差异不应超过或低于平均体重的20%。
03给药途径通常情况下给药途径应至少包括临床拟用途径,或者增加一种能使药物较为完全进入全身暴露的途径如静脉给药。
急性经口给药前啮齿类动物应禁食一段时间,但禁食时间可能会影响暴露量,受到药物代谢酶的活性和受试物肠道内吸收的影响。
04给药剂量水平常用的试验方法有最大给药量法、最大耐受量法、半数致死量法等。
根据不同的试验方法选择合适的剂量,为了充分暴露毒性,高剂量可选择出现严重毒性的给药剂量或达到最大给药量,低剂量可选择未见毒性剂量,同时设空白和/或溶媒(辅料)对照组。

试验目的:急性毒性试验是在24小时内给药1次或2次(间隔6-8小时),观察动物接受过量的受试药物所产生的急性中毒反应,为多次反复给药的毒性试验设计剂量、分析毒性作用的主要靶器官、分析人体过量时可能出现的毒性反应、I期临床的剂量选择和观察指标的设计提供参考信息等。
一、啮齿类动物单次给药的毒性试验(一)试验条件1.动物品系:常用健康的小鼠、大鼠。
选用其他动物应说明原因。
年龄一般为7-9周龄。
同批试验中,小鼠或大鼠的初始体重不应超过或低于所用动物平均体重的20%.实验前至少驯养观察1周,记录动物的行为活动、饮食、体重及精神状况。
2.饲养管理:动物饲料应符合动物的营养标准。
若用自己配制的饲料,应提供配方及营养成分含量的检测报告;若是购买的饲料,应注明生产单位。
应写明动物饲养室内环境因素的控制情况。
3.受试药物:应注明受试药物的名称、批号、来源、纯度、保存条件及配制方法。
(二)试验方法:由于受试药物的化学结构、活性成分的含量、药理、毒理学特点各异,毒性也不同,有的很难观察到毒性反应,实验者可根据受试药物的特点,由下列几种实验方法中选择一种进行急性毒性试验。
1.伴随测定半数致死量(LD50)的急性毒性试验方法。
2.最大耐受剂量(MTD)试验方法:最大耐受剂量,是引起动物出现明显的中毒反应而不产生死亡的剂量。
3.最大受试药物量试验方法:在合理的浓度及合理的容量条件下,用最大的剂量给予实验动物,观察动物的反应。
4.单次口服固定剂量方法(Fixed-dose procedure)。
选择5、50、500和2000mg/kg四个固定剂量。
实验动物首选大鼠,给药前禁食6-12小时,给受试药物后再禁食3-4小时。
如无资料证明雄性动物对受药试物更敏感,首先用雌性动物进行预试。
根据受试药物的有关资料,由上述四个剂量中选择一个作初始剂量,若无有关资料作参考,可用500mg/kg作初始剂量进行预试,如无毒性反应,则用2000mg/kg 进行预试,此剂量如无死亡发生即可结束预试。

试验目的:急性毒性试验是在24小时内给药1次或2次(间隔6-8小时),观察动物接受过量的受试药物所产生的急性中毒反应,为多次反复给药的毒性试验设计剂量、分析毒性作用的主要靶器官、分析人体过量时可能出现的毒性反应、I期临床的剂量选择和观察指标的设计提供参考信息等。
一、啮齿类动物单次给药的毒性试验(一)试验条件1.动物品系:常用健康的小鼠、大鼠。
选用其他动物应说明原因。
年龄一般为7-9周龄。
同批试验中,小鼠或大鼠的初始体重不应超过或低于所用动物平均体重的20%.实验前至少驯养观察1周,记录动物的行为活动、饮食、体重及精神状况。
2.饲养管理:动物饲料应符合动物的营养标准。
若用自己配制的饲料,应提供配方及营养成分含量的检测报告;若是购买的饲料,应注明生产单位。
应写明动物饲养室内环境因素的控制情况。
3.受试药物:应注明受试药物的名称、批号、来源、纯度、保存条件及配制方法。
(二)试验方法:由于受试药物的化学结构、活性成分的含量、药理、毒理学特点各异,毒性也不同,有的很难观察到毒性反应,实验者可根据受试药物的特点,由下列几种实验方法中选择一种进行急性毒性试验。
1.伴随测定半数致死量(LD50)的急性毒性试验方法。
2.最大耐受剂量(MTD)试验方法:最大耐受剂量,是引起动物出现明显的中毒反应而不产生死亡的剂量。
3.最大受试药物量试验方法:在合理的浓度及合理的容量条件下,用最大的剂量给予实验动物,观察动物的反应。
4.单次口服固定剂量方法(Fixed-dose procedure)。
选择5、50、500和2000mg/kg四个固定剂量。
实验动物首选大鼠,给药前禁食6-12小时,给受试药物后再禁食3-4小时。
如无资料证明雄性动物对受药试物更敏感,首先用雌性动物进行预试。
根据受试药物的有关资料,由上述四个剂量中选择一个作初始剂量,若无有关资料作参考,可用500mg/kg作初始剂量进行预试,如无毒性反应,则用2000mg/kg 进行预试,此剂量如无死亡发生即可结束预试。


水生生物急性毒性试验一般程序1、试验准备1)实验容器准备、清洁和消毒处理——容器:大小合适、材料无毒、不易吸附、对生物不造成损伤2)受试生物的采集与驯化3)稀释水(试验关键)——来源:无污染自然水、去氯自来水、配置标准水(OECD ASTM推荐配方)——质量控制:pH、温度、溶解氧、盐度、硬度、无其它污染物,有参比4)环境条件:控制系统2、实验设计1)测试方式选择——可选用静止、更新式和直流式。
——挥发性高、降解速率大化合物不能用静止式,选用更新式,最好用直流式——BOD高的废水不能用静止式,选用更新式,最好用直流式——生长速率快、代谢快的生物不能用静止式,选用更新式,最好用直流式2)试验生物选择3)被测毒物的配置——配成高浓度储备液——不溶或溶解度小用助溶试剂,如丙酮等,并设置溶剂对照,助溶试剂的毒性要小、溶解度高、实验系统用量要少,关键是要了解被测毒物的溶解度4)生物指标确定及试验重点5)试验浓度的设置(获得毒性数据的关键)——文献资料——预备试验——浓度确定方式:等对数浓度3、正式试验1)实验浓度的配置2)试验动物的数量——数量分配:5~10——生物量:<0.8g/L;个体小的热带种<0.1g/L3)实验组数——5个浓度+对照(稀释水)——5个浓度+对照(稀释水)+溶剂对照——对照组死亡率<10%——3~5个平行(不少于30个受试生物)4)实验周期(暴露时间)——根据试验目的和生物不同而不同——标准方法:藻类生长抑制试验,72h枝角类急性毒性试验,48h鱼类急性毒性试验,96h5)试验终点观察:不同生物不同,同一实验相同6)理化指标测定:温度、溶解氧、pH、硬度等7)受试毒物浓度确定(计算得的数值VS实测)8)实验记录P.S.急性毒性试验期间不喂食物4、LC50的求法1)直线内插法——图解计算LC50、EC50的一种简便方法。
在半对数纸上作图,即可求解。
2)概率单位法依据:浓度对数与概率单位呈直线关系方法一:查死亡率——概率单位换算表,然后作图(浓度对数——概率单位图)方法二:直接用对数——概率纸作图——求直线回归方程——求LC50的置信区间(范围)推荐软件:Trimmed Spearman-Karber Software/Excel/SPSS。


实验二经口急性毒性实验一、实验目的1、通过本次实验掌握经口灌胃技术,半数致死剂量的意义。
2、通过本次实验学习半数致死剂量的计算及毒性判定。
二、实验原理:化学物经口染毒的方法是毒理学中重要的基本技术之一,经口急性毒性试验是研究化学物毒性效应的基本试验。
通过该实验学习化学物毒性试验的实验设计原则和掌握经口灌胃技术。
三、仪器、试剂与材料1、器材帆布手套、橡胶手套、电子天平、剪刀、大头针、小鼠鼠笼、泡沫塑料板、棉签、纱布、脱脂棉、小鼠灌胃针、1ml注射器、电子天平、动物体重秤等2、试剂敌百虫、苦味酸饱和溶液。
3、实验动物成年、健康的雌、雄小鼠50只。
四、实验内容与步骤1、实验动物的性别鉴定、编号、称重和分组参考实验一中动物性别鉴定、编号和分组方法,50只小鼠,雌雄各半,随机分为Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、五组,各小鼠用电子天平称重,以g为单位,小数点后保留一位数字。
2、确定染毒剂量:经预试验获得敌百虫0%~100%的致死剂量范围,由公式计算各组剂量公比值r:1/-r,根据公比值确定各组正式剂=n ab量。
a:最低组剂量,mg/kgb:最高组剂量,mg/kg3、配制毒物溶液准确称取敌百虫2024mg,溶解并稀释至10 mL,取5 mL置于容器中,供第五组染毒;加入5 mL溶剂,稀释后取出5 mL供第四组动物染毒;再加入5 mL溶剂,稀释后取出5 mL供第三组动物染毒用,依此类推,可配制成按1:0.5递减的各剂量组不同浓度的溶液。
4、计算每只动物实际灌胃体积每只小鼠实际灌胃量=0.02 mL/g ×该小鼠体重g5、染毒(1)动物的禁食和复食:试验前,实验动物禁食过夜,不限制饮水,灌胃后2-3h后复食(2)灌胃操作技术:同实验一小鼠灌胃染毒法。
6、中毒体征和死亡情况观察染毒后观察和记录中毒体征及出现的时间、死亡数量和时间及死亡前的特征。
高剂量组动物的死亡常很快发生,染毒后应即刻密切观察。
根据观察情况分析中毒特点和毒作用靶器官。
急性毒性试验方案急性毒性试验是评估单次或短时间内暴露给动物或人类的某种物质引起的致死或可逆的严重生理或行为异常的试验。
该试验方法是衡量化学物质的毒性的基本方法。
本文将介绍急性毒性试验的实施流程、试验动物的选取、试验总体方案和数据分析。
一、试验动物的选取:一般采用小鼠、大鼠、兔子等常见实验动物进行急性毒性试验。
实验前可选用以体重为基础的随机方法进行面部体检和组织检查,确保被选中的动物状态正常,无明显异常。
建议使用健康、年龄相当、性别相同的同种动物。
二、试验总体方案:(一)实验前准备① 确定药物的理论毒性LD50值。
② 检查试验动物的健康状况,重量平均分布。
③ 毒物制备:根据LD50值计算出适量的毒物浓度,制备用于实验的溶液。
(二)实验操作① 实验动物按照体重分组,随机分配到实验组和对照组。
② 实验组的动物分别接受毒性物质,对照组的动物接受纯水或生理盐水等无害物质。
③ 观察动物在接受测试物后出现的任何不良反应和明显症状。
④ 测试持续时间应不超过14天,每日记录实验动物的体重和水分摄入量,并定期检查动物的状态。
(三)数据分析① 研究数据分析应该包括生理指标评价、心理行为表现、体重变化评估等多个方面。
② 分析实验组和对照组的体重变化、摄入量等数据,并比较实验组和对照组的差异。
三、急性毒性试验的实施流程:② 准备用于实验的试验动物,并确保它们健康、无明显异常。
⑦ 分析实验组和对照组的数据,并计算出药物的LD50值。
四、结论:急性毒性试验是评估化学物质毒性的基本方法。
选择健康的、年龄相当的、性别相同的同种动物作为试验对象,并制定出详细的实验方案。
在实验过程中,需要注意观察动物情况和记录关键数据。
最后,根据实验数据计算出药物的LD50值并分析毒物的毒性程度。
研究人员应该严格把握实验过程,保证实验结果的可靠性和准确性。
毒理学实验二经口急性毒性试验一、实验目的1、掌握实验动物分组方法2、测定LD50的试验设计原则3、小鼠的经口灌胃技术二、试剂和材料1、实验动物:(1)动物品种:健康成年ICR小鼠,体重18g~22g(2)样品来源:首都医科大学实验动物部2、器材:注射器(1ml)、灌胃针头、烧杯、吸管、容量瓶、烧杯、棉签、动物秤。
3、试剂:敌敌畏(1400mg/ml)、苦味酸染液(标记用)。
三、实验内容1、健康实验动物的选择和性别鉴定选择健康的雄性小鼠(健康标准:毛顺、毛顺、无分泌物、反应敏锐。
动物出现圆圈动作可能为中耳炎,废弃。
)肛门与生殖孔距离:大者为雄性,小者为雌性2、实验动物称重、编号和随机分组选择体重在18-22 g的小鼠,采用随机分组的方法(动物按体重分为几个体重段,再从每个体重段分出各组动物),每组10只小鼠,用黄色的苦味酸饱和液标号1~9,10号小鼠不标记。
3、受试化学物溶液的配制(1)确定灌胃量:0.1ml/10g(2)确定最高给药量,计算溶液浓度,估计给药总体积(3)药品称量及稀释4、小鼠灌胃技术左手固定,右手持灌胃器,插入动物口腔,沿咽后壁徐徐插入食道,深度为口腔至剑突的距离。
5、毒性体征的观察和LD50计算(1)毒性体征的观察:染毒后注意观察小鼠中毒的发生、发展过程及死亡数和死亡时间按表格记录动物体征及出现时间,记录死亡情况及时间,观察期为30 min组数:各组死亡率:数相邻两组对数剂量之差:最大剂量的对数 P d :X )P P (d 21X lg 150i i k i i k LD ∑++-=)lg 96.1(lg lg 95%:1)P 1(P d lg 50501-50LD S LD ni ni LD S i i ±--=∑可信区间:实验动物数。
标准误公式:(2)LD50的计算:a 、实验各组剂量的确定:设5组,每组雌雄动物各10只。
剂量组距 d 为:d 为相邻两个剂量组剂量对数之差利用lgLD0依次加d ,取反对数,即可得出各组剂量。
实验一急性毒性试验(Acute Cytotoxicity T est)一、实验目的:了解生物材料急性毒性的含义,掌握急性毒性试验的基本方法。
二、实验原理:医学上通常指的急性毒性试验是对药物而言的,并以半数致死量(median lethal dose, LD50)来衡量药物急性毒性的大小。
所谓LD50是指某一药物使试验动物总体死亡一半的剂量,由于LD50是剂量反应曲线上最敏感的一点,而且有易测、准确和重复性好的优点,以此作为药物使用的安全指标。
但对于生物材料而言,它与药物在体内的反应机理不同,大多数生物材料不能计算LD50,所以在试验过程中,通过对实验动物进行动物静脉或腹腔注射试验材料或其浸提液来观察实验动物体重在24、48和72h的变化、运动、呼吸状态以及死亡情况作为评价的指标,判定某种生物材料的急性毒性作用。
三、实验对象:小鼠四、实验器材和药品:聚甲基丙烯酸羟乙酯(PHEMA),蒸馏水,生理盐水(0.9%),注射器(1ml),量筒(10ml),小烧杯(50、100ml),高压消毒器。
五、实验步骤:1.浸提液制备:按评价标准裁剪试样,选择适当浸提温度制备浸提液。
2.将10只体重在17~23g间的健康、未做过其他实验的小鼠随机分为实验组和对照组,每组5只。
3.将浸提液按每公斤小鼠体重注射50ml于实验组小鼠尾静脉(50ml/kg),用生理盐水按同样方法作空白对照。
4.记录试样表面积和使用浸提液的容量;记录注射后24h、48h、72h两组小鼠的体重,观察其各种生物学反应情况。
六、评价方法:1.注射后动物反应观察指标:2.结果判断标准:2.1 在72h观察期内,注射材料浸提液的动物反应不大于对照组动物,则认为该材料符合急性毒性试验要求。
2.2在72h观察期内,注射材料浸提液动物中有2只以上出现轻度毒性症状或仅1只动物出现明显毒性症状死亡,或实验组5只动物的体重均下降,即使无其他中毒症状都要进行重复试验。
急性毒性实验
取健康小鼠24只,雌雄各半,禁食24h后,生药于次日灌胃给予痛风颗粒颗粒混悬液0.78ml(16.30g/kg,相当生药量86.88g/kg),观察小鼠活动、饮食、呼吸等情况,然后连续观察15天,纪录7天内的动物死亡数及毒性反应。
结果:灌胃后,小鼠活动减少,约1小时左右逐渐缓解,7天内24只小鼠无一只死亡及明显中毒反应。
计算过程:
常温下配的痛风颗粒最高浓度为0.417g/ml(16.30g/kg,相当生药量86.88g/kg),颗粒密度4.73g/ml。
20g小鼠胃内容积0.78ml。
按动物表面积比率换算等效剂量换算(20g小鼠:70Kg成人=381.9:1)
按最高浓度4.73g/ml(相当生药剂量22.23g/ml)及小鼠最大灌胃容量0.78ml计算:
小鼠最大给药剂量:4.73*0.78/0.02=207.87g/kg;
按动物表面积比率换算等效剂量换算,折算70Kg成人最大给药量:207.87*0.02*387.9=1612.66g/70kg,相当生药剂量7579.5g/70Kg。
成人每日口服痛风颗粒生药剂量30g/70kg,小鼠一次口服痛风颗粒为成人每日临床常用量的253倍:7579.5/30=253倍
小鼠一次口服痛风颗粒的最大耐受量为86.88g/kg,此为成人每日临床常用量的253倍,结果表明该药口服给药临床常用量使用安全。