高中化学 选修三 杂化轨道理论
- 格式:ppt
- 大小:1.24 MB
- 文档页数:21




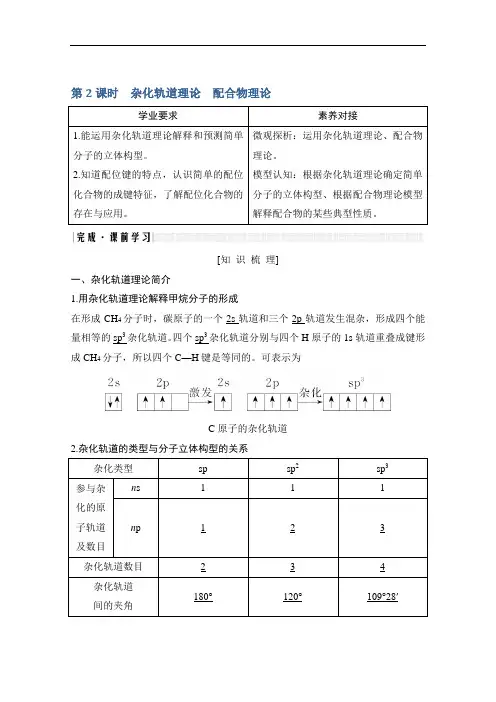
第2课时杂化轨道理论配合物理论学业要求素养对接1.能运用杂化轨道理论解释和预测简单分子的立体构型。
2.知道配位键的特点,认识简单的配位化合物的成键特征,了解配位化合物的存在与应用。
微观探析:运用杂化轨道理论、配合物理论。
模型认知:根据杂化轨道理论确定简单分子的立体构型、根据配合物理论模型解释配合物的某些典型性质。
[知识梳理]一、杂化轨道理论简介1.用杂化轨道理论解释甲烷分子的形成在形成CH4分子时,碳原子的一个2s轨道和三个2p轨道发生混杂,形成四个能量相等的sp3杂化轨道。
四个sp3杂化轨道分别与四个H原子的1s轨道重叠成键形成CH4分子,所以四个C—H键是等同的。
可表示为C原子的杂化轨道2.杂化轨道的类型与分子立体构型的关系杂化类型sp sp2sp3参与杂化的原子轨道及数目n s 1 1 1 n p 1 2 3杂化轨道数目 2 3 4 杂化轨道间的夹角180°120°109°28′杂化轨道示意图立体构型直线形平面三角形正四面体形实例BeCl2、CO2、CS2BCl3、BF3、BBr3CF4、SiCl4、SiH4【自主思考】1.用杂化轨道理论分析CH4的杂化类型和呈正四面体形的原因?提示在形成CH4分子时,碳原子的一个2s轨道与三个2p轨道混杂,形成4个能量相等的sp3杂化轨道,分别与四个氢原子的1s轨道重叠成键形成CH4分子,4个σ键之间作用力相等,键角相等形成正四面体形。
二、配合物理论简介1.配位键(1)概念:共用电子对由一个原子单方面提供而跟另一个原子共用的共价键,即“电子对给予-接受键”,是一类特殊的共价键。
(2)实例:在四水合铜离子中,铜离子与水分子之间的化学键是由水分子提供孤电子对给予铜离子,铜离子接受水分子的孤电子对形成的。
(3)表示:配位键可以用A→B来表示,其中A是提供孤电子对的原子,叫做配体;B是接受电子对的原子。
例如:①NH+4中的配位键表示为。


选修三第二章第2节分子的立体构型三、杂化轨道理论1.杂化轨道理论认为:在形成分子时,通常存在激发、杂化、轨道重叠等过程。
但应注意,原子轨道的杂化,只有在形成分子的过程中才会发生,而孤立的原子是不可能发生杂化的。
同时只有能量相近的原子轨道(如2s,2p等)才能发生杂化,而1s轨道与2p轨道由于能量相差较大,它是不能发生杂化的。
杂化:成键过程是由若干个能量相近的轨道经叠加、混合、重新调整电子云空间伸展方向,分配能量形成新的杂化轨道过程。
2、理论要点:①成键原子中几个能量相近的轨道杂化成新的杂化轨道;②参加杂化的原子轨道数= 杂化后的杂化轨道数。
总能量不变;③杂化时轨道上的成对电子被激发到空轨道上成为单电子,需要的能量可以由成键时释放的能量补偿。
3、杂化轨道的种类(1)按参加杂化的轨道分类s-p型:sp杂化、sp2杂化和sp3杂化s-p-d型:sp3d杂化、sp3d2杂化(2)按杂化轨道能量是否一致分类等性杂化,如C 的sp3杂化:4 个sp3杂化轨道能量一致。
形成3个能量相等的sp2杂化轨道,属于等性杂化。
判断是否是等性杂化,要看各条杂化轨道的能量是否相等,不看未参加杂化的轨道的能量。
4、各种杂化轨道在空间的几何分布杂化类型sp3sp2sp sp3d或dsp3sp3d2或d2sp3立体构型正四面体正三角形直线形三角双锥体正八面体杂化轨道成键时,要满足化学键间最小排斥原理,键与键间排斥力大小决定于键的方向,即决定于杂化轨道间的夹角。
由于键角越大化学键之间的排斥力越小,对sp杂化来说,当键角为180°时,其排斥力最小,所以sp杂化轨道成键时分子呈直线形;对sp2杂化来说,当键角为120°时,其排斥力最小,所以sp2杂化轨道成键时,分子呈平面三角形。
由于杂化轨道类型不同,杂化轨道夹角也不相同,其成键时键角也就不相同,故杂化轨道的类型与分子的空间构型有关。
5、用杂化轨道理论解释构型(1)sp杂化BeCl2分子,直线形,用杂化轨道理论分析其成键情况,说明直线形的原因。

高中化学人教版选修三第2章分子结构与性质杂化轨道理论选择题下列关于杂化轨道的叙述正确的是(? )A.杂化轨道可用于形成σ键,也可用于形成π键B.杂化轨道可用来容纳未参与成键的孤电子对C.NH3中N原子的sp3杂化轨道是由N原子的3个p轨道与H 原子的s轨道杂化而成的D.在乙烯分子中,1个碳原子的3个sp2杂化轨道与3个氢原子的s轨道重叠形成3个C?H σ键【答案】B【解析】杂化轨道只用于形成σ键,或用来容纳未参与成键的孤电子对,不能用来形成π键,故B项正确,A项不正确;NH3中N原子的sp3杂化轨道是由N原子的1个s轨道和3个p轨道杂化而成的,C项不正确;乙烯分子中的C原子采用sp2杂化,1个碳原子中的2个sp2杂化轨道与2个氢原子的s轨道重叠形成2个C?H σ键,剩下的1个sp2杂化轨道与另一个碳原子的sp2杂化轨道重叠形成1个C?C σ键,D项不正确。
选择题对H3O+的说法正确的是(? )A.O原子采取sp2杂化B.O原子采取sp3杂化C.离子中无配位键D.离子中配体为O原子【答案】B【解析】H3O+的中心原子的价层电子对数是4,采取的是sp3杂化,H2O和H+之间形成配位键。
选择题下列烃分子中,每个碳原子的杂化轨道数最多的是(? )A.C6H6B.C2H6C.C2H4D.C2H2【答案】B【解析】苯分子和乙烯分子中的C原子都是采取sp2杂化,生成3个杂化轨道;乙烷分子中的C原子采取sp3杂化,生成4个杂化轨道;乙炔分子的C原子采取sp杂化,生成2个杂化轨道。
选择题鲍林被认为是20世纪对化学科学影响最大的人之一,他也是两位获得诺贝尔奖不同奖项的人之一。
杂化轨道是鲍林为了解释分子的立体构型提出的,下列对sp3、sp2、sp杂化轨道的夹角的比较,得出结论正确的是(? )A.sp杂化轨道的夹角最大B.sp2杂化轨道的夹角最大C.sp3杂化轨道的夹角最大D.sp3、sp2、sp杂化轨道的夹角相等【答案】A【解析】sp3、sp2、sp杂化轨道的夹角分别为109°28’、120°、180°。


知识目标第一章分子结构与性质第二节分子的立体结构:(第二课时)能力目标1.认识杂化轨道理论的要点2.进一步了解有机化合物中碳的成键特征3.能根据杂化轨道理论判断简单分子或离子的构型过程重点杂化轨道理论的要点难点杂化轨道理论教学过程备注[复习]共价键类型:σ、π键,价层电子对互斥模型。
[质疑] 我们已经知道,甲烷分子呈正四面体形结构,它的4个C--H键的键长相同,H—C--H的键角为109~28°。
按照我们已经学过的价键理论,甲烷的4个C--H单键都应该是π键,然而,碳原子的4个价层原子轨道是3个相互垂直的2p轨道和1个球形的2s轨道,用它们跟4个氢原子的ls原子轨道重叠,不可能得到四面体构型的甲烷分子。
为什么?[讲]碳原子具有四个完全相同的轨道与四个氢原子的电子云重叠成键。
[引入]碳原子的价电子构型2s22p2,是由一个2s轨道和三个2p轨道组成的,为什么有这四个相同的轨道呢?为了解释这个构型Pauling提出了杂化轨道理论。
[板书]三、杂化轨道理论简介1、杂化的概念:在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化,产生的新轨道叫杂化轨道。
[讲]杂化轨道理论是一种价键理论,是鲍林为了解释分子的立体结构提出的。
为了解决甲烷分子四面体构型,鲍林提出了杂化轨道理论,它的要点是:当碳原子与4个氢原子形成甲烷分子时,碳原子的2s轨道和3个2p轨道会发生混杂,混杂时保持轨道总数不变,却得到4个相同的轨道,夹角109°28′,称为sp3杂化轨道,表示这4个轨道是由1个s轨道和3个p轨道杂化形成的。
当碳原子跟4个氢原子结合时,碳原子以4个sp3杂化轨道分别与4个氢原子的ls轨道重叠,形成4个C--Hσ键,因此呈正四面体的分子构型。
[投影][讲]杂化轨道理论认为:在形成分子时,通常存在激发、杂化、轨道重叠等过程。
但应注意,原子轨道的杂化,只有在形成分子的过程中才会发生,而孤立的原子是不可能发生杂化的。
杂化轨道理论简介思考:写出碳原子的核外电子排布图,思考为什么碳原子与氢原子结合形成CH4,而不是CH2 ?一.杂化轨道理论1.概念:在形成分子时,在外界条件影响下若干不同类型能量相近的原子轨道混合起来,重新组合成一组新轨道的过程叫做原子轨道的杂化,所形成的新轨道就称为杂化轨道。
2.杂化条件:(1)参与参加杂化的各原子轨道能量要相近(同一能级组或相近能级组的轨道);(2)只有在形成分子的过程中才能会发生杂化。
3、杂化轨道特点(1)杂化轨道前后轨道总数不变,形状发生改变,一头大,一头小,杂化后各轨道能量相同。
(2)杂化轨道成键时同样遵循互斥理论,满足化学键间排斥力最小,故杂化轨道之间在空间内尽可能远离,呈立体对称结构。
(3)杂化轨道只能用于形成σ键或者用来容纳未参与成键的孤电子对。
未参与杂化的P轨道可用于形成π键。
(4)一个轨道不管有没有电子,只要符合杂化的条件就可能参与杂化。
4、杂化轨道形成过程(1)sp3杂化sp3杂化:1个s 轨道与3个p 轨道进行的杂化,形成4个sp3 杂化轨道。
每个sp3杂化轨道的形状也为一头大,一头小,含有1/4 s 轨道和3/4 p 轨道的成分每两个轨道间的夹角为109 °28,。
空间构型为正四面体型。
价层电子对数为4的中心原子采用sp3杂化方式(2)sp2杂化sp2杂化:1个s 轨道与2个p 轨道进行的杂化,形成3个sp2 杂化轨道。
每个sp2杂化轨道的形状也为一头大,一头小,含有1/3 s 轨道和2/3 p 轨道的成分,每两个轨道间的夹角为120°,呈平面三角形。
例:用杂化轨道理论分析乙烯的杂化类型及分子空间构型?杂化轨道只能形成σ键或容纳未参与成键的孤电子对,不能形成π键;未参与杂化的p轨道可用于形成π键。
例:苯环的结构1.苯环中的碳均是以sp2杂化成夹角为1200三个sp2杂化轨道.2.苯环中六个碳之间形成6个σ键,每个碳与氢形成1个σ键.3.苯环中六个碳中未杂化的P轨道彼此形成一个大π键.4.形成大π键比一般的π键更稳定,因此苯环体现特殊的稳定性(3)sp杂化sp杂化:1个s 轨道与1个p 轨道进行的杂化,形成2个sp杂化轨道。