杂化轨道理论
- 格式:ppt
- 大小:1.25 MB
- 文档页数:92


杂化轨道理论杂化轨道理论基本介绍核外电子在一般状态下总是处于一种较为稳定的状态,即基态。
而在某些外加作用下,电子也是可以吸收能量变为一个较活跃的状态,即激发态。
在形成分子的过程中,由于原子间的相互影响,单个原子中,具有能量相近的两个电子亚层中,具有能量较低的电子亚层的一个或多个电子会激发而变为激发态,进入能量较高的电子亚层中去,即所谓的跃迁现象,从而新形成了一个或多个能量较高的电子亚层。
此时,这一个与多个原来处于较低能量的电子亚层的电子所具有的能量增加到与原来能量较高的电子亚层中的电子相同。
这样,这些电子的轨道便混杂在一起,这便是杂化,而这些电子的状态也就是所谓的杂化态。
概述1931年,Linus Carl Pauling提出轨道杂化理论。
实验事实基础是许多分子的键角不等于原子轨道间夹角。
如氧原子与氢原子组成的水分子H-O-H的键角是104.5o,不等于氧的2py与2pz轨道间的夹角90o。
类似的,NH3分子中H-N-H的键角也不等于90o,实际测得107.3o。
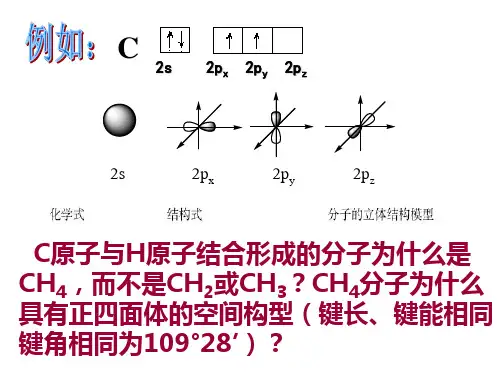
实验测得甲烷分子CH4是四面体结构,H-C-H键角为109.5o。
要点⑴ 在形成分子(主要是化合物)时,同一原子中几个能量相近的不同类型的原子轨道 (一般为同一能级组的原子轨道)可以进行线性组合(杂化),重新分配能量和确定空间方向,组成数目相等的新的一组原子轨道。
⑵杂化轨道成键能力大于原来的原子轨道。
因为杂化轨道的形状变成一头大一头小了,用大的一头与其他原子的轨道重叠,重叠部分显然会增大。
⑶ 形成的杂化轨道之间应尽可能地满足最小排斥原理(化学键间排斥力越小,体系越稳定),为满足最小排斥原理,杂化轨道之间的夹角应达到最大。
⑷ 分子的空间构型主要取决于分子中σ键形成的骨架,杂化轨道形成的键均为σ键,所以,杂化轨道的类型与分子的空间构型相关。
相关概念在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道线性组合成新的原子轨道,这个过程叫做原子轨道的杂化,产生的新轨道叫做杂化轨道。


杂化轨道理论(图解)一、原子轨道角度分布图S Px Py Pz dz2dx2-y2dxy dxz dyz二、共价键理论和分子结构㈠、共价键理论简介1、经典的化学键电子理论:1916年德国化学家柯塞尔(Kossel)和1919年美国化学家路易斯(Lewis)等提出了化学键的电子理论。
他们根据稀有气体原子的电子层结构特别稳定这一事实,提出各元素原子总是力图(通过得失电子或共用电子对)使其最外层具有8电子的稳定结构。
柯塞尔用电子的得失解释正负离子的结合。
路易斯提出,原子通过共用电子对而形成的化学键称为共价键(covalent [kǝu`veilent]bond[bכnd])。
用黑点代表价电子(即最外层s,p轨道上的电子),可以表示原子形成分子时共用一对或若干对电子以满足稀有气体原子的电子结构。
为了方便,常用短线代替黑点,用“-”表示共用1对电子形成的共价单键,用“=”表示2对电子形成的共价双键,“≡”表示3对电子形成的共价叁键。
原子单独拥有的未成键的电子对叫做孤对电子(lone[lǝun]pair[pεǝ]electron[i`lektrכn])。
Lewis结构式的书写规则又称八隅规则(即8电子结构)。
评价贡献:Lewis共价概念初步解释了一些简单非金属原子间形成共价分子的过程及其与离子键的区别。
局限性:①、未能阐明共价键的本质和特性;②、八隅规则的例外很多。
PCl5SF6BeCl2BF3NO,NO2…中心原子周围价电子数10 12 4 6 含奇数价电子的分子…③、不能解释某些分子的性质。
含有未成对电子的分子通常是顺磁性的(即它们在磁场中表现出磁性)例如O2。
2、1927年德国的海特勒Heitler和美籍德国人的伦敦London两位化学家建立了现代价键理论,简称VB理论(电子配对法)。
1931年,鲍林在电子配对的基础上提出了杂化轨道理论的概念,获1954年诺贝尔化学奖。
3、1928年-1932年,德国的洪特(F.Hund)和美国的马利肯(R.S.Mulliken)两位化学家提出分子轨道理论,简称MO 理论。




轨道杂化理论
杂化轨道理论是一种科学理论。
在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化,产生的新轨道叫做杂化轨道。
1、某原子在成键时,在键合原子的作用下,同一原子中不同类型能量相近的原子轨道可能改变原有的状态,混杂起来并重新组合成一组有利于成键的新轨道(即杂化轨道)。
这一过程称为原子轨道的杂化,简称杂化。
2 、同一原子中能量相近的n 个原子轨道,组合后只能得到n 个杂化轨道。
例如,同一原子的一个ns 轨道和一个npx轨道,只能杂化成两个sp杂化轨道。
这两个sp杂化轨道的形状一样,但其角度分布最大值在x轴上的取向相反。
3 、杂化轨道比原来未杂化的轨道成键能力强,形成的化学键键能大,使生成的分子更稳定。
由于成键原子轨道杂化后,轨道角度分布图的形状发生了变化,形成的杂化轨道一头大一头小。
大的一头与别的原子成键时电子云可以得到更大程度的重叠,所以形成的化学键比较牢固。

6-3-2 杂化轨道理论1. 杂化轨道理论的简要内容⑴在形成分子(主要是化合物)时,同一原子中若干能量相近的原子轨道(一般为同一能级组的原子轨道) 相互叠加(杂化)形成一组同样数目的新的原子轨道。
有关概念:杂化── 轨道的相互叠加过程叫原子轨道的杂化。
杂化轨道──原子轨道叠加后产生的新的原子轨道叫杂化轨道。
⑵杂化轨道比原来的轨道成键能力强,形成的化学键键能大,使生成的分子更稳定。
由于成键原子轨道杂化后,轨道角度分布图的形状发生了变化(形状是一头大,一头小),杂化轨道在某些方向上的角度分布,比未杂化的p轨道和s轨道的角度分布大得多,它的大头在成键时与原来的轨道相比能够形成更大的重叠,因此杂化轨道比原有的原子轨道成键能力更强。
⑶形成的杂化轨道之间应尽可能地满足最小排斥原理(化学键间排斥力越小,体系越稳定),为满足最小排斥原理, 杂化轨道之间的夹角应达到最大。
sp, sp2, sp3杂化轨道的形状如图所示。
⑷ 分子的空间构型主要取决于分子中σ键形成的骨架,杂化轨道形成的键为σ键,所以,杂化轨道的类型与分子的空间构型相关。
2.杂化类型与分子几何类型(1)sp杂化同一原子内由一个ns轨道和一个np轨道发生的杂化,称为sp杂化。
杂化后组成的轨道称为sp杂化轨道。
sp杂化可以而且只能得到两个sp杂化轨道。
实验测知,气态BeCl2是一个直线型的共价分子。
Be原子位于两个Cl原子的中间,键角180°,两个Be-Cl键的键长和键能都相等:Cl-Be-Cl基态Be原子的价层电子构型为2s2,表面看来似乎是不能形成共价键的。
但杂化理论认为,成键时Be原子中的一个2s电子可以被激发到2p空轨道上去,使基态Be原子转变为激发态Be原子(2s12p1):与此同时,Be原子的2s轨道和一个刚跃进的电子的2p轨道发生sp杂化,形成两个能量等同的sp杂化轨道:其中每一个sp杂化轨道都含有轨道和轨道的成分。
如图6-11所示,每个sp轨道的形状都是一头大,一头小。

分子结构(Sp杂化类型,化学键,共价键理论,价键理论,概念)【知识引入】杂化轨道理论(hybrid orbital theory)杂化轨道理论(hybrid orbitaltheory)是1931年由鲍林(Pauling L)等人在价键理论的基础上提出,它实质上仍属于现代价键理论,但是它在成键能力、分子的空间构型等方面丰富和发展了现代价键理论。
按参加杂化的原子轨道种类,轨道杂化有sp和spd两种主要类型,分为sp,sp2,sp3,dsp2,sp3d,sp3d2,d2sp3,按杂化后形成的几个杂化轨道的能量是否相同,轨道的杂化可分为等性和不等性杂化。
【正文】(一)杂化轨道理论的基本要点1.在成键过程中,由于原子间的相互影响,同一原子中参加成键的几个能量相近的原子轨道可以进行混合,重新分配能量和空间方向,组成数目相等的新原子轨道。
这种轨道重新组合的过程称为轨道杂化,简称杂化。
所组成的新原子轨道叫做杂化轨道。
2.杂化轨道之间互相排斥,力图在空间取得最大的键角,使体系能量降低。
原子轨道杂化以后所形成的杂化轨道更有利于成键。
因为杂化后原子轨道的开头发生了变化,如s轨道和p轨道杂化形成的杂化轨道,使本来平分在对称两个方向上的p轨道比较集中在一个方向上,变成一头大一头小,成键时在较大一头重叠,有利于最大重叠。
因此杂化轨道的成键能力比单纯轨道的成键能力强。
(二)杂化轨道类型根据原子轨道的种类和数目不同,可以组成不同类型的杂化轨道。
这里我们只介绍s轨道和p轨道之间的杂化。
1.Sp杂化一个s轨道和一个p轨道杂化可组成两个sp杂化轨道。
每个sp杂化轨道各含有1/2s和1/2p成分。
两个杂化轨道夹角为180°。
两个sp杂化轨道的对称轴在同一条直线上,只是方向相反(图4-12)。
因此sp杂化轨道又叫直线形杂化轨道。
图4-12 sp杂化轨道的形成图4-13BeCL2分子型2.sp2杂化一个s轨道和两个p轨道杂化可组成三个sp2杂化轨道。
史上最易理解杂化轨道理论(图解)•杂化轨道理论基本概念•s-p杂化轨道•p-p杂化轨道•d-p杂化轨道目•杂化轨道理论与分子构型关系•总结与展望录01杂化轨道理论基本概念原子轨道与杂化轨道原子轨道描述电子在原子核外空间出现概率的分布函数,即电子云形状。
常见的原子轨道有s、p、d、f等。
杂化轨道由同一原子中能量相近的不同类型原子轨道混合起来形成的一组新轨道。
杂化后的轨道具有与原轨道不同的形状、能量和对称性。
sp2杂化由1个ns 和2个np 轨道杂化形成3个sp2杂化轨道,呈平面三角形,如BF3、SO3等分子。
sp 杂化由1个ns 和1个np 轨道杂化形成2个sp 杂化轨道,呈直线型,如CO2、BeCl2等分子。
sp3杂化由1个ns 和3个np 轨道杂化形成4个sp3杂化轨道,呈正四面体型,如CH4、NH3等分子。
d2sp3杂化由1个nd2、1个ns 和3个np 轨道杂化形成6个d2sp3杂化轨道,呈正八面体型,如SF6等分子。
dsp2杂化由1个nd 、1个ns 和2个np 轨道杂化形成4个dsp2杂化轨道,呈平面正方形,如PtCl42-等分子。
杂化类型及特点参与杂化的原子轨道能量应相近,这样有利于电子在杂化后的新轨道中的重新分布和稳定。
能量相近原则最大重叠原则对称性匹配原则原子轨道在杂化过程中应尽可能重叠,以增强成键能力和降低体系能量。
原子轨道在杂化时,其对称性应与分子的对称性相匹配,以确保整个分子的稳定性。
030201杂化轨道形成原因02s-p杂化轨道原子在成键过程中,为了降低能量和增加稳定性,会将能量相近的s轨道和p轨道进行混合。
s-p杂化轨道是由s轨道和p轨道线性组合而成的新轨道,具有特定的形状、方向和能量。
在s-p杂化过程中,原子会重新分配电子云密度,使得杂化轨道更适应于成键。
s-p杂化原理及过程以甲烷(CH4)为例,碳原子的2s和2px, 2py, 2pz轨道进行sp3杂化,形成四个等价的sp3杂化轨道。
杂化轨道理论简介思考:写出碳原子的核外电子排布图,思考为什么碳原子与氢原子结合形成CH4,而不是CH2 ?一.杂化轨道理论1.概念:在形成分子时,在外界条件影响下若干不同类型能量相近的原子轨道混合起来,重新组合成一组新轨道的过程叫做原子轨道的杂化,所形成的新轨道就称为杂化轨道。
2.杂化条件:(1)参与参加杂化的各原子轨道能量要相近(同一能级组或相近能级组的轨道);(2)只有在形成分子的过程中才能会发生杂化。
3、杂化轨道特点(1)杂化轨道前后轨道总数不变,形状发生改变,一头大,一头小,杂化后各轨道能量相同。
(2)杂化轨道成键时同样遵循互斥理论,满足化学键间排斥力最小,故杂化轨道之间在空间内尽可能远离,呈立体对称结构。
(3)杂化轨道只能用于形成σ键或者用来容纳未参与成键的孤电子对。
未参与杂化的P轨道可用于形成π键。
(4)一个轨道不管有没有电子,只要符合杂化的条件就可能参与杂化。
4、杂化轨道形成过程(1)sp3杂化sp3杂化:1个s 轨道与3个p 轨道进行的杂化,形成4个sp3 杂化轨道。
每个sp3杂化轨道的形状也为一头大,一头小,含有1/4 s 轨道和3/4 p 轨道的成分每两个轨道间的夹角为109 °28,。
空间构型为正四面体型。
价层电子对数为4的中心原子采用sp3杂化方式(2)sp2杂化sp2杂化:1个s 轨道与2个p 轨道进行的杂化,形成3个sp2 杂化轨道。
每个sp2杂化轨道的形状也为一头大,一头小,含有1/3 s 轨道和2/3 p 轨道的成分,每两个轨道间的夹角为120°,呈平面三角形。
例:用杂化轨道理论分析乙烯的杂化类型及分子空间构型?杂化轨道只能形成σ键或容纳未参与成键的孤电子对,不能形成π键;未参与杂化的p轨道可用于形成π键。
例:苯环的结构1.苯环中的碳均是以sp2杂化成夹角为1200三个sp2杂化轨道.2.苯环中六个碳之间形成6个σ键,每个碳与氢形成1个σ键.3.苯环中六个碳中未杂化的P轨道彼此形成一个大π键.4.形成大π键比一般的π键更稳定,因此苯环体现特殊的稳定性(3)sp杂化sp杂化:1个s 轨道与1个p 轨道进行的杂化,形成2个sp杂化轨道。