有机化学炔烃
- 格式:ppt
- 大小:1.10 MB
- 文档页数:32
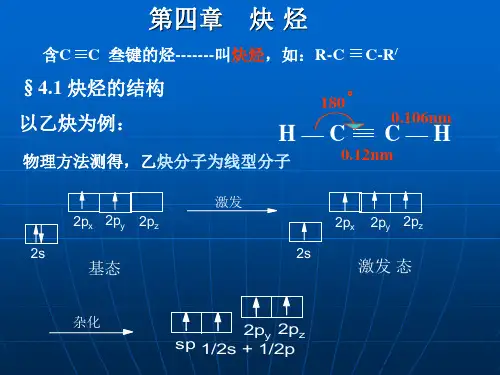

炔烃的结构通式炔烃是一类具有碳碳三键的有机化合物。
根据碳原子数的不同,炔烃可以分为乙炔、丙炔、丁炔等。
下面将分别对这些炔烃的结构通式进行介绍。
1. 乙炔(C2H2):乙炔是最简单的炔烃,由两个碳原子和两个氢原子组成。
其结构通式为CH≡CH。
乙炔是一种无色、有刺激性气味的气体,在室温下可以燃烧。
乙炔常被用作燃料和原料,广泛应用于金属切割和焊接等领域。
2. 丙炔(C3H4):丙炔由三个碳原子和四个氢原子组成。
其结构通式为HC≡CCH3。
丙炔是一种无色液体,在室温下能够燃烧。
丙炔常被用作溶剂和化学合成的原料。
3. 丁炔(C4H6):丁炔由四个碳原子和六个氢原子组成。
其结构通式为HC≡CCH2CH3。
丁炔是一种无色液体,在室温下能够燃烧。
丁炔常被用于化学合成和有机合成的反应中。
炔烃具有碳碳三键的特点,使其在化学反应中具有独特的反应性。
炔烃可以发生加成反应、氧化反应、卤化反应等。
其中,加成反应是炔烃最常见的反应类型之一,其反应产物是由两个反应物的分子结合而成的。
例如,乙炔可以和氢气发生加成反应,生成乙烯(C2H4)。
这种反应是一个重要的工业反应,用于合成乙烯。
除了加成反应,炔烃还可以发生氧化反应。
氧化反应是指炔烃与氧气发生反应,生成二氧化碳和水。
例如,乙炔可以在适当的条件下与氧气反应,生成二氧化碳和水。
这种反应是乙炔燃烧的过程,释放出大量的热能。
炔烃还可以发生卤化反应。
卤化反应是指炔烃与卤素发生反应,生成相应的卤代烃。
例如,乙炔可以和氯气发生反应,生成氯代乙烯(C2H2Cl2)。
这种反应常用于合成有机化合物和制备化学试剂。
炔烃是一类具有碳碳三键的有机化合物。
乙炔、丙炔和丁炔是常见的炔烃。
炔烃具有独特的反应性,可以发生加成反应、氧化反应和卤化反应。
炔烃在工业生产和化学合成中有着广泛的应用。





有机化学基础知识点炔烃的命名和结构炔烃是有机化合物中的一类,它们的分子结构中含有碳-碳叁键。
炔烃可以进一步分为单炔烃和多炔烃两类。
在本文中,我们将详细介绍炔烃的命名规则以及结构特点。
一、单炔烃的命名单炔烃是指分子中只含有一个碳-碳叁键的炔烃。
根据命名规则,单炔烃的命名分为三个步骤:首先确定烃的主链,其次标记炔烃叁键的位置,最后确定炔烃的名称。
为了更好地理解单炔烃的命名规则,我们以乙炔为例进行说明。
乙炔是由两个碳原子构成的炔烃,它的分子式为C₂H₂。
首先,我们确定主链长度为两个碳原子,因此它的名称为“乙”。
接下来,我们需要标记炔烃叁键的位置,乙炔中的碳原子编号为1和2,其中编号1上连接有炔烃叁键,因此我们用数字1来标记它的位置。
最后,将这两步结果结合起来,乙炔的名称就是“1-乙炔”。
二、多炔烃的命名多炔烃指的是分子中含有两个以上碳-碳叁键的炔烃。
与单炔烃的命名类似,多炔烃的命名也分为三个步骤:确定主链、标记叁键位置和确定名称。
以丙炔为例来介绍多炔烃的命名规则。
丙炔是由三个碳原子构成的炔烃,其分子式为C₃H₄。
首先,我们确定主链长度为三个碳原子,因此它的名称为“丙”。
接下来,我们需要标记叁键的位置。
丙炔中的碳原子编号为1、2和3,其中编号1和3上连接有炔烃叁键。
我们用数字1和3来标记这两个位置。
最后,将这两步结果结合起来,丙炔的名称就是“1,3-丙炔”。
三、炔烃的结构特点炔烃的分子结构中含有碳-碳叁键,这赋予了它们许多特殊的化学性质。
与其他有机化合物相比,炔烃的化学反应更为活泼,更容易发生加成反应、消除反应和取代反应。
由于叁键的存在,炔烃的分子间相互作用力较弱,使其具有较低的沸点和熔点。
这也导致了炔烃在常温下多呈现为气体或液体的状态。
在物理性质方面,炔烃还具有较强的燃烧性和较高的燃烧热。
由于炔烃分子中碳原子间含有叁键,燃烧时叁键的断裂释放了大量的能量,因此炔烃是优良的燃料。
此外,炔烃还常用于合成其他有机化合物,如合成橡胶、塑料和医药品等。

化学炔烃有机知识点总结炔烃是一类碳氢化合物,具有碳-碳三键结构。
它们通常具有较高的反应活性,因此在有机合成和工业生产中具有重要的地位。
炔烃的命名和结构特征,其物理性质和化学性质,以及它们在有机合成和工业中的应用都是化学研究的重要方面。
一、炔烃的结构和命名1. 结构特征炔烃分子中含有碳-碳三键,因此它们的通式为CnH2n-2,其中n表示碳原子数。
炔烃的分子中每个碳原子都含有一个sp杂化轨道,这种轨道的方向是线性的,使得碳-碳三键是直线的。
2. 命名规则炔烃的命名采用IUPAC命名法。
对于直链炔烃,根据主链的碳原子数和三键的位置进行命名。
对于支链炔烃,可以使用取代基的位置和数量来进行命名。
在有多个炔基的化合物中,可以采用前缀表示多个炔基的位置。
二、炔烃的物理性质1. 物态性质炔烃通常是无色气体或液体,但也有一些炔烃是固体。
它们的密度比空气大,通常不溶于水,但可以溶于非极性溶剂。
2. 燃烧性质炔烃非常易燃,在氧气或空气中燃烧时释放大量热能。
因此,在工业生产中会用作燃料,例如乙炔常用作切割和焊接金属。
三、炔烃的化学性质1. 加成反应炔烃中的碳-碳三键具有较高的活性,在存在适当的条件下可以发生加成反应,通常在存在催化剂的情况下进行。
例如,炔烃可以和氢气发生加成反应,生成烯烃。
此外,炔烃还可以和卤素发生加成反应,生成1,2-二卤代烷烃。
2. 氢化反应炔烃还可以发生氢化反应,将碳-碳三键还原为碳-碳双键或单键。
这通常需要催化剂的存在,例如,乙炔可以和氢气在钯催化剂的作用下发生氢化反应,生成乙烯。
3. 卤素化反应炔烃可以和卤素发生卤素化反应,生成1,2-二卤代炔烃。
这种反应通常需光照或热量的存在。
4. 炔烃的自发聚合反应炔烃中的双键具有较高的活性,因此可以发生聚合反应,生成高聚物。
例如,乙炔可以发生自发聚合反应,生成聚乙炔。
四、炔烃在有机合成中的应用1. 炔烃可以作为合成原料,用于合成其他有机化合物,例如,乙炔可以和醇反应,生成醛。


炔烃的性质总结炔烃是一类具有炔基(C≡C)的有机化合物。
由于炔基的存在,炔烃表现出一系列独特的性质。
本文将就炔烃的物理性质、化学性质以及一些重要的反应进行总结。
一、物理性质1.密度:炔烃的密度一般较小,且随碳链长度的增加而增大。
2.沸点和熔点:炔烃的沸点和熔点通常较低,随着碳链长度的增加,沸点和熔点逐渐升高。
3.溶解性:炔烃在水中极不溶解,但可溶于一些有机溶剂,比如乙醇、丙酮等。
二、化学性质炔烃具有较强的活性,容易参与各种化学反应。
1. 氧化反应炔烃可参与氧化反应,例如与氧气反应生成二氧化碳和水,反应通常是放热的。
C2H2 + 2.5O2 → 2CO2 + H2O ΔH = -1299.5 kJ/mol2. 加成反应炔烃的碳碳三键可以发生加成反应。
典型的例子是炔烃与氢气的加成反应,生成烯烃。
C2H2 + H2 → C2H4此外,炔烃还可以与卤素(如氯、溴)、氢卤酸(如盐酸、氢溴酸)等发生加成反应。
3. 氢化反应炔烃可以与氢气发生氢化反应,生成饱和烃。
C2H2 + 2H2 → C2H64. 炔烃的重要反应4.1 叠氮化反应炔烃可以与叠氮化物(如次氯酸钠)反应,生成底物中炔基上的氢被叠氮基取代的产物。
C2H2 + NaNO2 + HCl → C2H2N2Cl + NaCl + H2O4.2 重排反应炔烃在一定条件下可以发生重排反应,生成不同构的同分异构体。
4.3 氯化反应炔烃可以与氯气发生氯化反应,生成相应的氯代烃。
C2H2 + Cl2 → C2H2Cl24.4 烷化反应炔烃与醇或醛反应,可以发生烷化反应,生成相应的饱和化合物。
C2H2 + CH3OH → C2H2H4O5. 炔烃聚合反应炔烃可以发生聚合反应,生成具有碳碳双键的高分子化合物。
2C2H2 → (C2H2)n (n表示聚合度)三、结语炔烃的性质主要由其炔基决定,具有一系列特殊的物理性质和化学性质。
通过了解炔烃的性质,有助于我们更好地理解和应用这类重要的有机化合物。
炔烃名词解释
炔烃是一类有机化合物,其分子中含有碳-碳三键。
由于其分
子结构的特殊性质,炔烃具有独特的性质和应用。
炔烃可以分为两类:单炔和多炔。
单炔是指分子中只含有一个炔键,如乙炔(C2H2),丙炔(C3H4)等。
多炔则是指分子
中含有多个炔键,如二炔丁烷(C4H6),三炔丙烷(C6H8)等。
炔烃具有高度反应活性,可以进行多种化学反应。
其中,最常见的反应是加成反应,即炔烃中的碳-碳三键被破坏,与其他
原子或分子发生反应,形成新的化学键。
炔烃还可以发生聚合反应,多个炔烃分子相互结合形成长链或支链状化合物。
由于炔烃分子中碳-碳三键的存在,炔烃具有较高的能量密度,可以作为高效的燃料。
乙炔(C2H2)是一种常用的工业燃料,可以用于金属切割和焊接等工艺。
此外,炔烃还可以用于有机合成反应中的底物或试剂,如乙炔可以与溴反应得到二溴乙烷,二溴乙烷又可以与乙醇反应得到乙基乙炔醚等。
炔烃在有机合成中扮演着重要的角色。
总之,炔烃是一类含有碳-碳三键的有机化合物,具有高反应
活性和多种应用。
炔烃知识点总结文库一、炔烃的基本概念炔烃是一类含有碳碳三键的有机化合物,通式为CnH2n-2。
由于炔烃中含有碳碳三键,其分子结构比较特殊,因此具有一些特殊的性质和用途。
炔烃可以通过碱土金属(如钾、钠)与卤代烴反应制得,也可以通过卤代烴与碱溶液反应得到。
炔烃的分子式为CnH2n-2,其中n为炔烃的碳数。
二、炔烃的命名炔烃的命名是按照碳碳三键的位置及数量进行命名的。
一般情况下,炔烃的命名是根据碳碳三键的位置和数量进行的。
以乙炔为例,其分子式为C2H2,是由两个碳原子和两个氢原子组成的。
乙炔的分子结构中含有一个碳碳三键,因此其又称为二碳炔烃。
在命名时,通常采用代号25的形式来命名,即碳碳三键所在的位置及数量,如C2H2就是二碳炔烃。
三、炔烃的性质1. 物理性质(1)炔烃的密度较小,常温下呈气态或液态。
(2)炔烃的沸点和熔点较低,易挥发。
2. 化学性质(1)炔烃易发生加成反应,可以和溴水、卤代烴等发生加成反应。
(2)炔烃易发生氢化反应,可以和氢气发生氢化反应,生成烷烃。
3. 炔烃的应用(1)炔烃是有机合成的重要原料,可以作为烯烃的合成中间体,还可制备醇、羧酸等。
(2)炔烃可用于制备聚合物,如聚乙炔(Polyacetylene)。
四、炔烃的用途1. 炔烃在有机合成中的应用炔烃是有机合成中的重要原料,可以作为合成其他有机化合物的中间体。
例如,炔烃可以通过氢化反应制备烯烃,还可以作为聚合物的原料,如聚乙炔。
2. 炔烃在化工行业的应用炔烃在化工行业中有广泛的应用,主要是作为有机合成的原料,可以用于生产聚乙炔等聚合物,还可以用于生产乙炔醇、丙炔等。
3. 炔烃在医药行业的应用炔烃在医药行业中有一定的应用,可以作为一些药物的原料,如苯甲醛的合成中就需要使用炔烃。
五、结语炔烃是一类含有碳碳三键的有机化合物,具有较高的反应活性,可以作为有机合成的重要原料。
炔烃在化工、医药等行业都有广泛的应用,是一类重要的有机化合物。
认识和了解炔烃对于学习有机化学和应用有机化合物具有重要的意义,相信通过本文的介绍,读者对炔烃有了更深入的了解。