口服固体药用高密度聚乙烯瓶质量标准2015年版
- 格式:docx
- 大小:19.79 KB
- 文档页数:2
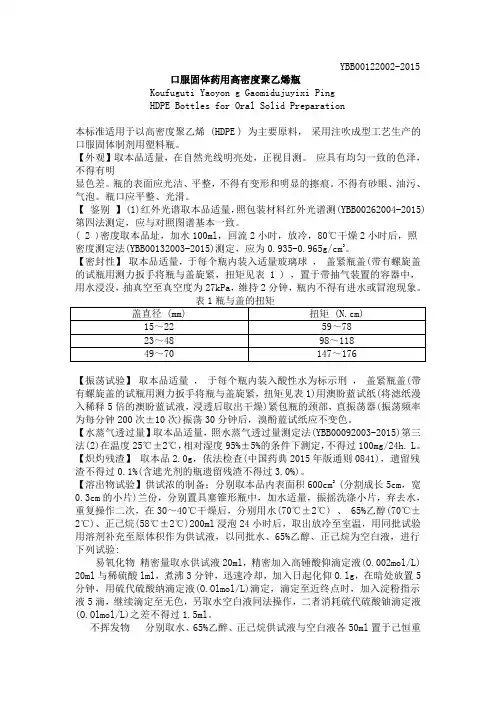
YBB00122002-2015口服固体药用高密度聚乙烯瓶Koufuguti Yaoyon g Gaomidujuyixi PingHDPE Bottles for Oral Solid Preparation本标准适用于以高密度聚乙烯 (HDPE ) 为主要原料,采用注吹成型工艺生产的口服固体制剂用塑料瓶。
【外观】取本品适量,在自然光线明亮处,正视目测。
应具有均匀一致的色泽,不得有明显色差。
瓶的表面应光洁、平整,不得有变形和明显的擦痕。
不得有砂眼、油污、气泡。
瓶口应平整、光滑。
【鉴别】 (1)红外光谱取本品适量,照包装材料红外光谱测(YBB00262004-2015) 第四法测定,应与对照图谱基本一致。
( 2 )密度取本品址,加水100ml,回流2小时,放冷,80℃干燥2小时后,照密度测定法(YBB00132003-2015)测定,应为0.935-0.965g/cm3。
【密封性】取本品适量,于每个瓶内装入适量玻璃球,盖紧瓶盖(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭矩见表 1 ) ,置于带抽气装置的容器中,用水浸没,抽真空至真空度为27kPa,维持2分钟,瓶内不得有进水或冒泡现象。
【振荡试验】取本品适量,于每个瓶内装入酸性水为标示刑,盖紧瓶盖(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭矩见表1)用澳盼蓝试纸(将滤纸漫入稀释5倍的澳盼蓝试液,浸透后取出干燥)紧包瓶的颈部,直振荡器(振荡频率为每分钟200次±10次)振荡30分钟后,溴酚蓝试纸应不变色。
【水蒸气透过量】取本品适量,照水蒸气透过量测定法(YBB00092003-2015)第三法(2)在温度25℃±2℃,相对湿度95%±5%的条件下测定,不得过100mg/24h. L。
【炽灼残渣】取本品2.0g,依法检查(中国药典2015年版通则0841),遗留残渣不得过0.1%(含遮光剂的瓶遗留残渣不得过3.0%)。
【溶出物试验】供试浓的制备;分别取本品内表面积60Ocm2(分割成长5cm,宽0.3cm的小片)兰份,分别置具塞锥形瓶中,加水适量,振摇洗涤小片,弃去水,重复操作二次,在30~40℃干燥后,分别用水(70℃±2℃) 、 65%乙醇(70℃±2℃)、正己烷(58℃±2℃)200ml浸泡24小时后,取出放冷至室温,用同批试验用溶剂补充至原体积作为供试液,以同批水、65%乙醇、正己烷为空白液,进行下列试验:易氧化物精密量取水供试液20ml,精密加入高锺酸仰滴定液(O.002mol/L) 20ml与稀硫酸lml,煮沸3分钟,迅速冷却,加入日起化仰O.lg,在暗处放置5 分钟,用硫代硫酸纳滴定液(O.Olmol/L)滴定,滴定至近终点时,加入淀粉指示液5滴,继续滴定至无色,另取水空白液同法操作,二者消耗硫代硫酸铀滴定液(O.Olmol/L)之差不得过1.5ml。

YBB00092002-2015口服液体药用高密度聚乙烯瓶Koufuyeti Yaoyong Gaomidujuyixi PingHDPE Bottles for Oral Liquid Preparation本标准适用于以高密度聚乙烯(HDPE)为主要原料,采用注吹成型工艺生产的口服液体制剂用塑料瓶。
【外观】取本品适量,在自然光线明亮处,正视目测。
应具有均匀一致的色泽,不得有明显色差。
瓶的表面应光洁、平整,不得有变形和明显的擦痕。
不得有砂眼、油污、气泡。
瓶口应平整、光滑。
【鉴别】(1)红外光谱取本品适量,照包装材料红外光谱测定法(YBB00262004-2015)第四法测定,应与对照图谱基本一致。
(2)密度取本品2g,加水100mL,回流2小时,放冷,80℃干燥2小时后,照密度测定法(YBB00132003-2015)测定,本品的密度应为0.935~0.965g/cm3。
【密封性】(1)取本品适量,用测力扳手(扭矩见表1)将瓶与盖旋紧,瓶口与瓶盖应配合适宜,不得滑牙。
(2)取本品适量,分别在瓶内装入适量玻璃珠,旋紧瓶盖(带有螺旋盖的试瓶,用测力扳手将瓶与盖旋紧,扭矩见表1),置于带抽气装置的容器中,用水浸没,抽真空至真空度为27KPa,维持2分钟,瓶内均不得有进水或冒泡现象。
表1 瓶与盖的扭力【抗跌性】取本品适量,加入水溶液至标示容量,从规定高度(表2)自然跌落至水平刚性光滑表面,应不得破裂。
表2 跌落高度【水蒸气透过量】取本品适量,照水蒸气透过量测定法(YBB00092003-2015)第三法(1)在温度20±2℃,相对湿度65±5%的条件下,放置14天,重量损失不得过0.2%。
【炽灼残渣】取本品2.0g,依法检查(中国药典2015年版通则0841),遗留残渣不得过0.1%(含遮光剂的瓶遗留残渣不得过3.0%)。
【溶出物试验】供试液的制备:分别取本品平整部分内表面积600cm2(分割成长5cm,宽0.3cm的小片)三份,分置具塞锥形瓶中,加水适量,振摇洗涤小片,弃去水,重复操作一次。
目的:明确固体药用聚烯烃塑料瓶的质量标准和规范药用聚烯烃塑料瓶的检验。
适用范围:适用于包装非芳酸性、非油酸性、非挥发性及易氧化的固体药品(片剂、胶囊、制剂)的塑料瓶。
责任者:化验员。
引用标准:YY0057-91GB2828 1、材料高密度聚乙烯树脂或聚丙烯树脂为主要原料。
2、技术要求2.1 药用塑料瓶的外观质量:应具有均匀一致的乳白色泽,不得有明显的色差。
瓶的表面应光洁、平整、不允许有变形和明显的擦痕。
不允许有砂痕、油污、气泡。
瓶口应平整、光滑。
2.2 物理性能应符合表1规定:表12.4菌检验应符合以下规定:小于108ml 的塑料细菌总数不超过1500个/瓶,霉菌总数不得超过150个/瓶;100ml至250ml的塑料瓶细菌总数不超过3000个/瓶,霉菌总数不得超过300个/瓶;大于250ml的塑料瓶细菌总数不得超过3500个/瓶,霉菌总数不得超过350个/瓶。
所有规定的塑料瓶大肠肝菌均不得检出。
2.5异常毒性:无异常毒性3、试验方法3.1外观在自然光线明亮处目测检验。
3.2密封性试验每个瓶装进一定量的玻璃球,紧盖后(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭力见表3)置于带有抽气装置的容器内,用水浸没,抽真空到26.67kpa维持2min,瓶内不得有进水或冒泡现象。
表33.3振荡试验每个瓶装入酸性水为标示剂、紧盖后(带有螺旋盖的试瓶用测力扳手将盖与瓶旋紧,扭力见表3)用溴酚蓝试纸(将滤纸浸入稀释5倍的溴酚蓝试液,浸透后取出干燥)紧包瓶的颈部,置振荡器(振荡器频率每分钟200次±5%)振荡30min后,溴酚蓝试纸不变色为合格。
3.4水蒸气渗透量试验每个试瓶用绸布擦净,将瓶盖连续开、关30次后,在试瓶内加入无水氯化钙干燥剂(除去过4目筛过细粉,置110°C干燥1h),20ml或20ml以上的试瓶,加干燥剂量为13mm高,小于20ml的试瓶,加入干燥剂量为容积2/3;如试瓶高度超过63mm,加入干燥剂量为50mm高,立即将盖盖紧。

上海标准文件
标题:药用聚烯烃塑料瓶质量标准
分发部门:总经理室、质量技术部、生产制造部、物资部、行政部(存档)
药用聚烯烃塑料瓶质量标准
【来源】固体药用聚烯烃塑料瓶必须符合YY0057-91质量标准。
【外观要求】 1.1 应具有均匀一致的乳白的色泽,不得有明显的色差,瓶的表面应光洁、平整、不允许有变形和明显的皱痕,不允许有砂眼、油污、气泡。
瓶口应平整光滑,不应有飞边和缺陷。
(不合格率允许≤2.0%)
1.2 瓶盖和瓶口吻合严密,保险圈与瓶体咬合准确到位,且保险圈应随瓶盖的旋开而断裂分离。
(注:瓶盖不合格率允许≤
2.0%)
1.3 瓶盖及瓶体的文字、商标、规格刻印清晰无误。
【微生物限度】细菌总数不得超过1000个/瓶
霉菌总数不得超过25个/瓶
【原辅料生产厂报告单检验项目】生产厂家提供的出厂检验报告上必须符合本质量标准所有项目。
【原辅料进厂检验项目】感官、微生物限度。

药用包装材料质量标准(一)聚酯/铝/聚乙烯药品包装用复合膜、袋来源国家药品监督管理局YBB00172002本品系指聚酯(PET)与铝箔(Al)及聚乙烯(PE)通过黏合剂复合而成的膜。
本品的袋系将上述膜通过热合的方法制成。
本标准适用于固体药品包装用的复合膜、袋。
[外观] 取本品适量,照药品包装用复合膜、袋通则(试行)(YBB00132002)外观项下的方法检查,应符合规定。
[鉴别]红外光谱取本品适量,采用内表面反射方法,照分光光度法(中华人民共和国药典2000年版附录ⅣC)测定,PET及PE层应分别与对照图谱基本一致。
[阻隔性能] 水蒸气透过量照塑料薄膜和片材透水蒸气性试验方法杯式法(GBl037-88)的规定进行。
试验时PE层向湿度低的一侧,试验温度(38±2)℃,相对湿度(90±5)%,不得过0.5(g/m2·24h)。
氧气透过量照塑料薄膜和薄片气体透过性试验方法压差法(GB/T 1038-2000)的规定进行。
试验时PE层向氧气低压侧,试验温度为(23±2)℃,不得过0.5cm3/(m2·24h·0.1MPa)。
[机械性能] PE层与A1层剥离强度照药品包装用复合膜、袋通则(试行)(YBB00132002)内层与次内层剥离强度项下的方法检查,纵、横向剥高强度平均值均不得低于2.5N/15mm。
[热合强度] 膜除另有规定外,裁取100mm×100mm试片四片,将任意两个试片PE面叠合,置热封仪上进行热合,热合温度150℃~170℃,压力0.2~0.3MPa,时间1秒。
从热合的中间部位各裁取3条15mm宽的试样,进行试验。
试样应在温度23℃±2℃,相对湿度50%±5%的环境中,放置4小时以上,并在上述条件下进行试验。
以热合部位为中心线,打开呈180度,把试样的两端夹在试验机的两个夹具上,试样轴线与上下夹具中心线相重合,并松紧适宜,夹具间距离为50mm,试验速度为(300±30)mm/min,读取试样断裂时的最大载荷,平均值不得低于12N/15mm。

医药瓶塑料塞验收标准
药用塑料瓶质量标准技术要求共有12个小项,1、其中外观质量:口服固体药用瓶一般为白色,口服液体药用塑料瓶一般为棕色透明,也可按客户要求生产其他颜色的产品。
色泽应均匀一致,无明显色差,表面应光洁,平整,无明显变形和擦痕,无砂眼、油污、气泡,瓶口平整光滑。
口服固体药用高密度聚乙烯塑料瓶
2、鉴别
(1) 红外光谱:英语对照图谱一致
(2) 药用塑料瓶的密度为:
口服固体和液体高密度聚乙烯瓶为0.935-0.965(g/cm³)
口服固体和液体聚酯瓶应为1.31-1.38(g/cm³)
口服液体药用聚酯瓶T001-60ml
口固体和液体聚丙烯瓶应为0.900-0.915(g/cm³)
3、密封性:抽真空,维持2分钟,瓶内不得进水或冒泡
4、水蒸气渗透
按试验条件口服液体药用塑料瓶重量损失不得过0.2%。
按试验条件口服固体药用塑料瓶水蒸气渗透量不得过
1000mg/24HL
5、抗跌性
按试验条件自然跌落至水平刚性光滑表面,不得破裂、此试验仅限于口服液体药用塑料瓶。
6、震荡实验
此试验仅限于口服固体药用塑料瓶,按试验条件应合格。

YBB00122002口服固体药用高密度聚乙烯瓶本标准适用于以高密度聚乙烯(HDPE)为主要原料,采用注吹成型工艺生产的口服固体药用塑料瓶。
[外观] 取本品适量,在自然光线明亮处,正视目测。
应具有均匀一致的色泽,不得有明显色差。
瓶的表面应光洁、平整,不得有变形和明显的擦痕。
不得有砂眼、油污、气泡。
瓶口应平整、光滑。
[鉴别] (1)红外光谱 取本品适量,敷于微热的溴化钾晶片上,照分光光度法(中华人民共和国药典2000年版二部附录ⅣC)测定,应与对照图谱基本一致。
(2)密度 取本品2g ,加水lOOml ,回流2小时,放冷,80℃干燥2小时后,精密称定(Wa)。
再置适宜的溶剂(密度为d)中,精密称定(Ws)。
按公式计算:× dHDPE 的密度应为0.935-0.965(g /cm 3)。
[密封性] 取本品适量,于每个瓶内装入适量玻璃球,旋紧瓶盖(带有螺旋盖的试瓶,用测力扳手将瓶与盖旋紧,扭力见表1),置于带抽气装置的容器中,用水浸没,抽真空至真空度为27kPa ,维持2分钟,瓶内不得有进水或冒泡现象。
表1 瓶与盖的扭力盖直径(mm)扭力(N·cm) 15~2259~78 23~4898~118 49~70147~176[振荡试验] 取本品适量,于每个瓶内装入酸性水为标示剂,旋紧瓶盖(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭力见表1)用溴酚蓝试纸(将滤纸浸入稀释5倍的溴酚蓝试液,浸透后取出干燥)紧包瓶的颈部,置振荡器(振荡器频率为每分钟200次±10次)振荡30分钟后,溴酚蓝试纸不得变色。
[水蒸气渗透] 取本品适量,用绸布擦净每个试瓶,将瓶盖连续开、关30次后,在试瓶内加入干燥剂无水氯化钙(除去过4目筛的细粉,置110℃干燥1小时):20ml WaWa - Ws或20ml 以上的试瓶,加入干燥剂至距瓶口13mm 处;小于20ml 的试瓶,加入的干燥剂量为容积的2/3,立即将盖盖紧。

口服固体药用高密度聚乙烯瓶 YBB00122002 国家药品监督管理局国家药品包装容器(材料)标准(试行)口服固体药用高密度聚乙烯瓶Koufuguti Yaoyong Gaomidujuyixi PingHDPE Bottles for Oral Solid Preparation本标准适用于以高密度聚乙烯(HDPE)为主要原料,采用注吹成型工艺生产的口服固体药用塑料瓶。
【外观】取本品适量,在自然光线明亮处,正视目测。
应具有均匀一致的色泽,不得有明显色差。
瓶的表面应光洁、平整,不得有变形和明显的擦痕。
不得有砂眼、油污、气泡。
瓶口应平整、光滑。
【鉴别】 (1)红外光谱取本品适量,敷于微热的溴化钾晶片上,照分光光度法(中华人民共和国药典2000年版二部附录?C)测定,应与对照图谱一致。
(2)密度取本品2g,加水100ml,回流2小时,放冷,80?干燥2小时后,精密称定(Wa)。
再置适宜的溶剂(密度为d)中,精密称定(Ws)。
按公式计算: Wa?d Wa-WbHDPE的密度应为0.935,0.965(g/cm3)。
【密封性】取本品适量,于每个瓶内装入适量玻璃球,旋紧瓶盖(带有螺旋盖的试瓶,用测力扳手将瓶与盖旋紧,扭力见表1),置于带抽气装置的容器中,用水浸没,抽真空至真空度为27kPa,维持2分钟,瓶内不得有进水或冒泡现象。
表1 瓶与盖的扭力【振荡试验】取本品适量,于每个瓶内装入酸性水为标示剂,旋紧瓶盖(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭力见表1)用溴酚蓝试纸(将滤纸浸入稀释5倍的溴酚蓝试液,浸透后取出干燥)紧包瓶的颈部,置振荡器(振荡频率为每分钟200?10次)振荡30分钟后,溴酚蓝试纸不得变色。
【水蒸气渗透】取本品适量,用绸布擦净每个试瓶,将瓶盖连续开、关30次后,在试瓶内加入干燥剂无水氯化钙(除去过4目筛的细粉,置110?干燥1小时):20ml或20ml以上的试瓶,加入干燥剂至距离瓶口13mm处;小于20ml的试瓶,加入的干燥剂量为容积的2/3,立即将盖盖紧。

国家食品药品监督管理总局公告2015年第164号――关于发布YBB 00032005—2015《钠钙玻璃输液瓶》等130项直接接触药品的包装材料和容器国家标准的公告【法规类别】药品管理【发文字号】国家食品药品监督管理总局公告2015年第164号【发布部门】国家食品药品监督管理总局【发布日期】2015.08.11【实施日期】2015.12.01【时效性】现行有效【效力级别】XE0303国家食品药品监督管理总局公告(2015年第164号)关于发布YBB 00032005-2015《钠钙玻璃输液瓶》等130项直接接触药品的包装材料和容器国家标准的公告根据《中华人民共和国药品管理法》及其实施条例规定,YBB 00032005-2015《钠钙玻璃输液瓶》等130项直接接触药品的包装材料和容器国家标准已经审定通过,现予以公布,自2015年12月1日起实施,由中国医药科技出版社出版发行。
标准内容可在国家食品药品监督管理总局网站()或中国食品药品检定研究院网站()进行查询,其标准编号、名称及替代对照表见附件。
特此公告。
附件:1.YBB 00032005-2015《钠钙玻璃输液瓶》等130项直接接触药品的包装材料和容器国家标准编号、名称2.标准替代对照表国家食品药品监管总局2015年8月11日附件1:YBB00032005-2015《钠钙玻璃输液瓶》等130项直接接触药品的包装材料和容器国家标准编号、名称1. YBB00032005-2015 钠钙玻璃输液瓶2. YBB00012004-2015低硼硅玻璃输液瓶3. YBB00022005-2-2015中硼硅玻璃输液瓶4. YBB00332002-2015低硼硅玻璃安瓿5. YBB00322005-2-2015中硼硅玻璃安瓿6. YBB00332003-2015 钠钙玻璃管制注射剂瓶7. YBB00302002-2015低硼硅玻璃管制注射剂瓶8. YBB00292005-2-2015中硼硅玻璃管制注射剂瓶9. YBB00292005-1-2015高硼硅玻璃管制注射剂瓶10. YBB00312002-2015 钠钙玻璃模制注射剂瓶11. YBB00322003-2015低硼硅玻璃模制注射剂瓶12. YBB00062005-2-2015中硼硅玻璃模制注射剂瓶13. YBB00032004-2015 钠钙玻璃管制口服液体瓶14. YBB00282002-2015低硼硅玻璃管制口服液体瓶15. YBB00022004-2015硼硅玻璃管制口服液体瓶16. YBB00272002-2015 钠钙玻璃模制药瓶17. YBB00302003-2015低硼硅玻璃模制药瓶18. YBB00052004-2015硼硅玻璃模制药瓶19. YBB00362003-2015 钠钙玻璃管制药瓶20. YBB00352003-2015低硼硅玻璃管制药瓶21. YBB00042004-2015硼硅玻璃管制药瓶22. YBB00282003-2015 药用钠钙玻璃管23. YBB00272003-2015 药用低硼硅玻璃管24. YBB00012005-2-2015 药用中硼硅玻璃管25. YBB00012005-1-2015 药用高硼硅玻璃管26. YBB00162005-2015口服固体药用陶瓷瓶27. YBB00152002-2015 药用铝箔28. YBB00162002-2015 铝质药用软膏管29. YBB00082005-2015 注射剂瓶用铝盖30. YBB00092005-2015 输液瓶用铝盖31. YBB00382003-2015 口服液瓶用撕拉铝盖32. YBB00012002-2015 低密度聚乙烯输液瓶33. YBB00022002-2015 聚丙烯输液瓶34. YBB00242004-2015 塑料输液容器用聚丙烯组合盖(拉环式)35. YBB00342002-2015 多层共挤输液用膜、袋通则36. YBB00102005-2015 三层共挤输液用膜(I)、袋37. YBB00112005-2015 五层共挤输液用膜(I)、袋38. YBB00062002-2015 低密度聚乙烯药用滴眼剂瓶39. YBB00072002-2015 聚丙烯药用滴眼剂瓶40. YBB00082002-2015 口服液体药用聚丙烯瓶41. YBB00092002-2015 口服液体药用高密度聚乙烯瓶42. YBB00102002-2015 口服液体药用聚酯瓶43. YBB00392003-2015 外用液体药用高密度聚乙烯瓶44. YBB00112002-2015 口服固体药用聚丙烯瓶45. YBB00122002-2015 口服固体药用高密度聚乙烯瓶46. YBB00262002-2015 口服固体药用聚酯瓶47. YBB00172004-2015 口服固体药用低密度聚乙烯防潮组合瓶盖48. YBB00132002-2015 药用复合膜、袋通则49. YBB00172002-2015 聚酯/铝/聚乙烯药用复合膜、袋50. YBB00182002-2015 聚酯/低密度聚乙烯药用复合膜、袋51. YBB00192002-2015 双向拉伸聚丙烯/低密度聚乙烯药用复合膜、袋52. YBB00192004-2015双向拉伸聚丙烯/真空镀铝流延聚丙烯药用复合膜、袋53. YBB00202004-2015 玻璃纸/铝/聚乙烯药用复合膜、袋54. YBB00212005-2015 聚氯乙烯固体药用硬片55. YBB00232005-2015 聚氯乙烯/低密度聚乙烯固体药用复合硬片56. YBB00222005-2015 聚氯乙烯/聚偏二氯乙烯固体药用复合硬片57. YBB00182004-2015 铝/聚乙烯冷成型固体药用复合硬片58. YBB00202005-2015聚氯乙烯/聚乙烯/聚偏二氯乙烯固体药用复合硬片59. YBB00242002-2015 聚酰胺/铝/聚氯乙烯冷冲压成型固体药用复合硬片60. YBB00372003-2015 抗生素瓶用铝塑组合盖61. YBB00402003-2015 输液瓶用铝塑组合盖62. YBB00212004-2015 药用铝塑封口垫片通则63. YBB00132005-2015 药用聚酯/铝/聚丙烯封口垫片64. YBB00142005-2015 药用聚酯/铝/聚酯封口垫片65. YBB00152005-2015 药用聚酯/铝/聚乙烯封口垫片66. YBB00252005-2015聚乙烯/铝/聚乙烯复合药用软膏管67. YBB00072005-2015 药用低密度聚乙烯膜、袋68. YBB00042005-2015 注射液用卤化丁基橡胶塞69. YBB00052005-2015 注射用无菌粉末用卤化丁基橡胶塞70. YBB00232004-2015 药用合成聚异戊二烯垫片71. YBB00222004-2015 口服制剂用硅橡胶胶塞、垫片72. YBB00112004-2015预灌封注射器组合件(带注射针)73. YBB00062004-2015预灌封注射器用硼硅玻璃针管74. YBB00092004-2015预灌封注射器用不锈钢注射针75. YBB00072004-2015预灌封注射器用氯化丁基橡胶活塞76. YBB00082004-2015预灌封注射器用溴化丁基橡胶活塞77. YBB00102004-2015预灌封注射器用聚异戊二烯橡胶针头护帽78. YBB00122004-2015 笔式注射器用硼硅玻璃珠79. YBB00132004-2015 笔式注射器用硼硅玻璃套筒80. YBB00142004-2015 笔式注射器用铝盖81. YBB00152004-2015 笔式注射器用氯化丁基橡胶活塞和垫片82. YBB00162004-2015 笔式注射器用溴化丁基橡胶活塞和垫片83. YBB00122005-2015固体药用纸袋装硅胶干燥剂84. YBB00262004-2015 包装材料红外光谱测定法85. YBB00272004-2015 包装材料不溶性微粒测定法86. YBB00282004-2015 乙醛测定法87. YBB00292004-2015 加热伸缩率测定法88. YBB00302004-2015 挥发性硫化物测定法89. YBB00312004-2015 包装材料溶剂残留量测定法90. YBB00322004-2015 注射剂用胶塞、垫片穿刺力测定法91. YBB00332004-2015 注射剂用胶塞、垫片穿刺落屑测定法92. YBB00342004-2015 玻璃耐沸腾盐酸侵蚀性测定法93. YBB00352004-2015 玻璃耐沸腾混合碱水溶液侵蚀性测定法94. YBB00362004-2015 玻璃颗粒在98℃耐水性测定法和分级95. YBB00372004-2015 砷、锑、铅、镉浸出量测定法96. YBB00382004-2015 抗机械冲击测定法97. YBB00392004-2015 直线度测定法98. YBB00402004-2015 药用陶瓷吸水率测定法99. YBB00412004-2015 药品包装材料生产厂房洁净室(区)的测试方法100. YBB00172005-2015 药用玻璃砷、锑、铅、镉浸出量限度101. YBB00182005-2015 药用陶瓷容器铅、镉浸出量限度102. YBB00192005-2015 药用陶瓷容器铅、镉浸出量测定法103. YBB00242005-2015 环氧乙烷残留量测定法104. YBB00262005-2015 橡胶灰分测定法105. YBB00012003-2015 细胞毒性检查法106. YBB00022003-2015 热原检查法107. YBB00032003-2015 溶血检查法108. YBB00042003-2015 急性全身毒性检查法109. YBB00052003-2015 皮肤致敏检查法110. YBB00062003-2015 皮内刺激检查法111. YBB00072003-2015 原发性皮肤刺激检查法112. YBB00082003-2015 气体透过量测定法113. YBB00092003-2015 水蒸气透过量测定法114. YBB00102003-2015 剥离强度测定法115. YBB00112003-2015 拉伸性能测定法116. YBB00122003-2015 热合强度测定法117. YBB00132003-2015 密度测定法118. YBB00142003-2015 氯乙烯单体测定法119. YBB00152003-2015 偏二氯乙烯单体测定法120. YBB00162003-2015 内应力测定法121. YBB00172003-2015 耐内压力测定法122. YBB00182003-2015 热冲击和热冲击强度测定法123. YBB00192003-2015 垂直轴偏差测定法124. YBB00202003-2015 平均线热膨胀系数测定法125. YBB00212003-2015 线热膨胀系数测定法126. YBB00232003-2015 三氧化二硼测定法127. YBB00242003-2015 121℃内表面耐水性测定法和分级128. YBB00252003-2015 玻璃颗粒在121℃耐水性测定法和分级129. YBB00342003-2015 药用玻璃成分分类及理化参数130. YBB00142002-2015 药品包装材料与药物相容性试验指导原则附件2:标准替代对照表标准名称代替标准号1YBB00032005-2015钠钙玻璃输液瓶YBB00032005钠钙玻璃输液瓶(试行)2YBB00012004-2015低硼硅玻璃输液瓶YBB00012004低硼硅玻璃输液瓶(试行)3YBB00022005-2-2015中硼硅玻璃输液瓶YBB00022005-2中性硼硅玻璃输液瓶(试行)4YBB00332002-2015低硼硅玻璃安瓿YBB00332002低硼硅玻璃安瓿(试行)5YBB00322005-2-2015中硼硅玻璃安瓿YBB00322005-2中性硼硅玻璃安瓿(试行)6YBB00332003-2015钠钙玻璃管制注射剂瓶YBB00332003钠钙玻璃管制注射剂瓶(试行)7YBB00302002-2015低硼硅玻璃管制注射剂瓶YBB00302002低硼硅玻璃管制注射剂瓶(试行)8YBB00292005-2-2015中硼硅玻璃管制注射剂瓶YBB00292005-2中性硼硅玻璃管制注射剂瓶(试行)9YBB00292005-1-2015高硼硅玻璃管制注射剂瓶YBB00292005-1高硼硅玻璃管制注射剂瓶(试行)10YBB00312002-2015钠钙玻璃模制注射剂瓶YBB00312002钠钙玻璃模制注射剂瓶(试行)11YBB00322003-2015低硼硅玻璃模制注射剂瓶YBB00322003低硼硅玻璃模制注射剂瓶(试行)12YBB00062005-2-2015中硼硅玻璃模制注射剂瓶YBB00062005-2中性硼硅玻璃模制注射剂瓶(试行)13YBB00032004-2015钠钙玻璃管制口服液YBB00032004钠钙玻璃管制口服液体瓶体瓶(试行)14YBB00282002-2015低硼硅玻璃管制口服液体瓶YBB00282002低硼硅玻璃管制口服液体瓶(试行)15YBB00022004-2015硼硅玻璃管制口服液体瓶YBB00022004硼硅玻璃管制口服液体瓶(试行)16YBB00272002-2015钠钙玻璃模制药瓶YBB00272002钠钙玻璃药瓶(试行)17YBB00302003-2015低硼硅玻璃模制药瓶YBB00302003低硼硅玻璃模制药瓶(试行)18YBB00052004-2015硼硅玻璃模制药瓶YBB00052004硼硅玻璃模制药瓶(试行)19YBB00362003-2015钠钙玻璃管制药瓶YBB00362003钠钙玻璃管制药瓶(试行)20YBB00352003-2015低硼硅玻璃管制药瓶YBB00352003低硼硅玻璃管制药瓶(试行)21YBB00042004-2015硼硅玻璃管制药瓶YBB00042004硼硅玻璃管制药瓶(试行)22YBB00282003-2015药用钠钙玻璃管YBB00282003钠钙玻璃药用管(试行)23YBB00272003-2015药用低硼硅玻璃管YBB00272003低硼硅玻璃药用管(试行)24YBB00012005-2-2015药用中硼硅玻璃管YBB00012005-2药用中性硼硅玻璃管(试行)25YBB00012005-1-2015药用高硼硅玻璃管YBB00012005-1药用高硼硅玻璃管(试行)26YBB00162005-2015口服固体药用陶瓷瓶YBB00162005药用口服固体陶瓷瓶(试行)27YBB00152002-2015药用铝箔YBB00152002药品包装用铝箔(试行)28YBB00162002-2015铝质药用软膏管YBB00162002铝质药用软膏管(试行)29YBB00082005-2015注射剂瓶用铝盖YBB00082005注射剂瓶用铝盖(试行)30YBB00092005-2015输液瓶用铝盖YBB00092005输液瓶用铝盖(试行)31YBB00382003-2015口服液瓶用撕拉铝盖YBB00382003口服液瓶用撕拉铝盖(试行)32。

药用塑料瓶质量标准药用塑料瓶是药品包装中常用的一种材料,其质量直接关系到药品的安全性和稳定性。
因此,药用塑料瓶的质量标准显得尤为重要。
在国家药典和相关标准的规范下,药用塑料瓶的质量标准主要包括以下几个方面:一、原料选择。
药用塑料瓶的原料应选择优质的医用级塑料颗粒,如聚丙烯(PP)、聚乙烯(PE)、聚对苯二甲酸乙二醇酯(PETG)等。
这些原料应符合国家相关标准,且不得含有对人体有害的物质,如重金属、荧光增白剂等。
二、外观质量。
药用塑料瓶的外观应无明显的气泡、缺陷、变色、污染等现象,瓶口应平整,无毛刺。
瓶身应平整光滑,无明显的凹凸和变形。
瓶身上的标识和文字应清晰、完整,不易磨损。
三、物理性能。
药用塑料瓶的物理性能包括抗拉强度、耐冲击性、耐压性等指标。
瓶身应具有一定的抗拉强度和耐冲击性,不易变形、破裂。
在一定的温度和压力下,瓶身应能保持稳定的形状,不发生变化。
四、化学性能。
药用塑料瓶的化学性能是指其在药品填充过程中不与药品发生化学反应,不释放有害物质。
因此,药用塑料瓶应具有良好的耐药品溶剂、酸碱的性能,不易吸附药品成分,不易释放有害物质。
五、密封性能。
药用塑料瓶的密封性能直接关系到药品的保存期限和质量。
瓶口和瓶盖应能够完全密封,不得有渗漏现象。
在一定的压力下,瓶口和瓶盖应能保持稳定的密封性能。
六、生产工艺。
药用塑料瓶的生产工艺应符合相关的规范要求,生产过程中应严格控制温度、压力、速度等参数,确保瓶体的一致性和稳定性。
生产过程中应定期对设备进行维护和检修,确保生产设备的正常运行。
综上所述,药用塑料瓶的质量标准涉及到原料选择、外观质量、物理性能、化学性能、密封性能和生产工艺等多个方面。
只有严格按照相关标准要求进行生产和质量控制,才能确保药用塑料瓶的质量达到国家标准,保障药品的安全性和有效性。
希望生产厂家和监管部门能够共同努力,加强对药用塑料瓶质量标准的监督和管理,为人民群众的用药安全保驾护航。
目的:建立药用聚乙烯塑料瓶内控质量标准,避免差错和混淆。
范围:适用药用聚乙烯塑料瓶接收和检验。
职责:质量管理部经理、物料管理部经理、检验室主任、QA。
规程:
检验依据:YY0057-91
质量标准:
1. 材质高密度聚乙烯或高密度药用聚氯乙烯.
2. 外观质量应具有均匀一致的色泽,不得有明显的色差,瓶的表面应光洁平整,不允许有变形
和明显的皱痕,不允许有砂眼、油污、气泡。
瓶口应平整光滑。
3. 规格尺寸请参见附表
4. 密封性抽真空26.67kPa,2分钟不得有进水或冒泡现象。
5. 微生物限度
细菌总数不得超过150个/瓶
霉菌总数不得超过50个/瓶
活螨不得检出
大肠杆菌不得检出
7. 标志、包装和贮存
7.1 标志每箱应有产品合格证,并注明生产厂名称、产品名称、规格、批号、数量检验员
代号以及生产日期和防潮标志。
7.2 包装产品的包装分内外二层,内层用清洁、防潮材料包装;外层用纸箱包装。
7.3 贮存
7.3.1 应存放在清洁、干燥通风处。
7.3.2 贮存期限一年。
本标准适用于包装口服固体制剂的口服固体药用高密度聚乙烯瓶。
该瓶由瓶身、瓶盖、封口垫片三部分组成。
瓶身部分以高密度聚乙烯(HDPE)为主要原料,采用注吹成型工艺生产,瓶盖部分以高密度聚乙烯(HDPE)为主要原料,采用注塑成型工艺生产。
封口垫片采用药用聚酯/铝/聚乙烯封口垫片,热合在口部达到密封目的。
取本品适量,在自然光线明亮处,正视目测。
应具有均匀一致的色泽,不得有明显色差。
瓶的表面应光洁、平整,不得有变形和明显的擦痕。
不得有砂眼、油污、气泡。
瓶口应平整、光滑。
封口垫片在盖子内,要求平整,无褶皱,复合膜的一面向外,封口垫片不能有从盖子内脱落的现象。
取本品适量,照包装材料红外光谱测定(YBB00262004-2015)第四法测定,应与对照图谱基本一致。
取本品 2g,加水 1OOml ,回流 2 小时,放冷,80℃干燥 2 小时后,照密度测定法(YBB00132003-2015)测定,应为 0.935~0.965g/cm3.取本品适量,于每个瓶内装入适量玻璃球,盖紧瓶盖 (用测力扳手将瓶与盖旋紧,扭矩见表 1),铝箔垫片封口机感应器贴近瓶盖顶部,采用铝箔垫片封口机(按表 2)封好瓶口,把瓶子置于带抽气装置的容器中,用水浸没,抽真空至真空度为 27kPa,维持 2 分钟,瓶内不得有进水或冒泡现象。
取本品适量,于每个瓶内装入适量玻璃球,盖紧瓶盖(用测力扳手将瓶与盖旋紧,扭矩见表 1),铝箔垫片封口机感应器贴近瓶盖顶部,采用铝箔垫片封口机封好瓶口,再旋开瓶盖,然后用标准试验指把热封层捅破,瓶盖连续开关 30 次后,盖紧瓶盖(用测力扳手将瓶与盖旋紧,扭矩见表 l),把瓶子置于带抽气装置的容器中,用水浸没,抽真空至真空度为 27kPa,维持 2 分钟,瓶内不得有进水或冒泡现象。
取本品适量,于每个瓶内装入酸性水为标示剂,盖紧瓶盖(用测力扳手将瓶与盖旋紧,扭矩见表 l),铝箔垫片封口机感应器贴近瓶盖顶部,采用铝箔垫片封口机封好瓶口,用溴酚蓝试纸 (将滤纸浸入稀释 5 倍的溴酚蓝试液,浸透后取出干燥) 紧包瓶的颈部,置振荡器 (振荡频率为每分钟 200 次士 10 次) 振荡 30 分钟后溴酚蓝试纸应不得变色。
XXXXXXX有限公司
一、目的:建立口服固体药用高密度聚乙烯瓶的质量标准,确保所用口服固体药用高密度聚乙烯瓶的质量。
二、范围:本规定适用于口服固体药用高密度聚乙烯瓶的质量控制。
三、责任:
四、内容:
1.标准来源:
国家药品包装容器(材料)标准YBB00122002-2015 口服固体药用高密度聚乙烯瓶。
2.技术要求
3.贮存条件:密封,存于干燥,清洁处处。
4.相关标准操作规程:口服固体药用高密度聚乙烯瓶检验操作规程(SOP-ZL-JG(BC)-009)、物料取样标准操作规程(SOP-ZL-QA-001)。
5.企业统一指定的物料名称:口服固体药用高密度聚乙烯瓶。
6.内部使用的物料代码:详见产品所对应的口服固体药用高密度聚乙烯瓶物料代码。
7.经批准的供应商:见合格供应商目录。
8.印刷包装材料的实样或样稿:见包装材料样稿。
9.注意事项:密闭,遮光。
10.复验期:执行“物料有效期及复验期管理规程(SMP-WL-008)”相关规定。
11.文件附件:共0份。
12.修订及变更历史:。
附件一:山东凤凰制药股份有限公司标准(内包材)口服固体药用聚乙烯塑料瓶Koufugutiyaoyongjuyixi Suliaoping标准依据:国家药品监督管理局《国家药品包装容器(材料)标准》YBB00122002。
【材质】以高密度聚乙烯(HD PE)为主要原料,采用吹注成型工艺生产的口服固体药用塑料瓶。
【外观】取本品适量,在自然光线明亮处,正视目测:应具有均匀一致的乳白色泽,不得有明显色差。
瓶的表面应光洁、平整,不得有变形和明显的擦痕,不得有砂眼、油污、气泡。
瓶口应平整、光滑。
【物理性能】密封性试验取本品适量,于每个试瓶内装入适量的玻璃球,旋紧瓶盖(带有螺旋盖的试瓶,用测力扳手将瓶与盖旋紧,扭力见表1),置于带抽气装置的容器中,抽真空至真空度为27kpa,维持2min,瓶内不得有进水或冒泡现象。
振荡试验取本品适量,于每个试瓶装入酸性水为标示剂,旋紧瓶盖(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭力见表1),用溴酚蓝试纸(将滤纸浸入稀释5倍的溴酚蓝试液,浸透后取出干燥)紧包瓶的颈部,置振荡器(振荡频率为每分钟200次±10次)振荡30分钟后,溴酚蓝试纸不得变色水蒸气透过量试验取本品适量,用绸布擦净每个试瓶,将瓶盖连续开、关30次后,在试瓶内加入无水氯化钙干燥剂(除去过4号目筛的细粉,置110℃干燥1小时),20ml或20ml以上的试瓶,加入干燥剂至距瓶口13mm处;小于20ml的试瓶,加入干燥剂量为容积的2/3,立即将盖盖紧。
另取两个试瓶装入与干燥剂相等量的玻璃小球,作对照用。
试瓶紧盖后分别称定重量。
然后将试瓶置于相对湿度为95%±5%,温度为25℃±2℃的环境中,放置72小时,取出,室温放置45分钟,分别称重。
按式(1)计算水蒸汽渗透量。
水蒸气透过量(mg/24h.L)=[1000/3V]×[(T t-T i)-(C t-C i)] (1)V:试瓶的容积,ml;T I:试瓶试验前的重量,mg;C I:对照瓶试验前的平均重量,mg;T t:试瓶试验后的重量,mg;C t:对照瓶试验后的平均重量,mg。
口服固体药用高密度聚乙烯热封垫瓶企标本标准的编写参照引用了《国家药包材变准》YBB00122002-2015口服固体药用高密度聚乙烯瓶的规定,适用于以高密度聚乙烯 (HDPE ) 为主要原料,采用注吹成型工艺生产的带封口垫片的口服固体制剂用塑料瓶。
【外观】取本品适量,在自然光线明亮处,正视目测。
应具有均匀一致的色泽,不得有明显色差。
瓶的表面应光洁、平整,不得有变形和明显的擦痕。
不得有砂眼、油污、气泡。
瓶口应平整、光滑。
【鉴别】 (1)红外光谱取本品适量,照包装材料红外光谱测(YBB00262004-2015)第四法测定,应与对照图谱基本一致。
( 2 )密度取本品址,加水100ml,回流2小时,放冷,80℃干燥2小时后,照密度测定法(YBB00132003-2015)测定,应为0.935-0.965g/cm3。
【密封性】取本品适量(瓶盖附上铝泊垫片),于每个瓶内装入适量玻璃球,盖紧瓶盖(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭矩见表 1 ) ,高频热封,置于带抽气装置的容器中,用水浸没,抽真空至真空度为27kPa,维持2分钟,瓶内不得有进水或冒泡现象。
表1瓶与盖的扭矩【振荡试验】取本品适量(瓶盖附上铝泊垫片),于每个瓶内装入酸性水为标示剂,盖紧瓶盖(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭矩见表1),高频热封,用溴酚蓝试纸(将滤纸漫入稀释5倍的溴酚蓝试液,浸透后取出干燥)紧包瓶的颈部,直振荡器(振荡频率为每分钟200次±10次)振荡30分钟后,溴酚蓝试纸应不变色。
【水蒸气透过量】取本品适量(瓶盖附上铝泊垫片),高频热封,照水蒸气透过量测定法(YBB00092003-2015)第三法(2)在温度25℃±2℃,相对湿度95%±5%的条件下测定,不得过100mg/(24h. L)。
【炽灼残渣】取本品2.0g,依法检查(《中国药典》2015年版四部通则0841),遗留残渣不得过0.1%(含遮光剂的瓶遗留残渣不得过3.0%)。
云南维和药业股份有限公司 检品编号:第 页 共 页微生物限度检查记录报告书号:品 名口服固体药用高密度聚乙烯瓶规 格 批 号 检品数量 检验日期 年 月 日 报告日期 年 月 日 检验者复核者检验依据 企业内控标准TS-ZL( BB) 003-01细 菌、 霉 菌、 酵 母 菌 检 测微生物限度检查:在无菌条件下,取供试品5瓶,每瓶加1∕3标示容量的0.9%无菌氯化钠溶液,将盖旋紧,振摇1分钟后,将各瓶提取液倒入灭菌锥形瓶中,充分混匀,作为供试液。
细菌数,霉菌、酵母菌数测定:各取相当于一个瓶子 1/10的提取液,经薄膜过滤处理后,取出滤膜,取滤膜贴于营养琼脂培养基和玫瑰红钠琼脂培养基平板上,平行制备2个皿,倒置摆放,细菌置30-35℃恒温培养箱培养72小时,霉菌、酵母菌置23-28℃恒温培养箱培养120小时。
均按平皿法培养测定其菌数。
根据供试品染菌程度,可取相当于可稀释至1:102、1:103等适宜稀释级进行薄膜过滤。
使用培养基来源:北京奥博星生物技术有限责任公司营养琼脂培养基 [批号: ] 玫瑰红钠琼脂培养 [批号: ]稀释液 0.9%无菌氯化钠溶液 [批号: ] 检测项目稀释倍数48h 72h 96h 120h平均 菌落数总数阴性对照标准规定结论 细菌数101cfu/瓶性不 得 过200cfu/瓶□符合规定□不符合规定霉菌、酵母菌数101cfu/瓶 性不 得 过40cfu/瓶□符合规定□不符合规定检品编号:云南维和药业股份有限公司控制菌检查[大肠埃希菌检查法]:取相当于一个瓶子的提取液(供试液总体积1∕5),经薄膜过滤处理,取出滤膜,置增菌液中培养后,吸取供试品0.2ml,加入MUG管中,培养,观察,有无蓝白色荧光,加靛基质试液于MUG管中,观察,MUG阳性(有荧光),靛基质阳性(玫瑰红色),报告检出大肠埃希菌;MUG阴性(无荧光),靛基质阴性(无色),报告未检出大肠埃希菌;若MUG、靛基质不一致时,划线于曙红亚甲蓝琼脂培养基或麦康凯琼脂培养基平板上,培养,平板上无菌落生长,判未检出大肠埃希菌,或有疑似菌落生长,应作纯培养。
YBB00122002-2015
口服固体药用高密度聚乙烯瓶
Koufuguti Yao yon g Gaomidujuyixi Pi ng
HDPE Bottles for Oral Solid Preparation
本标准适用于以高密度聚乙烯(HDPE )为主要原料,采用注吹成型工艺生产的口服固体制剂用塑料瓶。
【外观】取本品适量,在自然光线明亮处,正视目测。
应具有均匀一致的色泽,
不得有明
显色差。
瓶的表面应光洁、平整,不得有变形和明显的擦痕。
不得有砂眼、油污、气泡。
瓶口应平整、光滑。
【鉴别】(1)红外光谱取本品适量,照包装材料红外光谱测(YBB00262004-2015) 第四法测定,应与对照图谱基本一致。
(2 )密度取本品址,加水100ml,回流2小时,放冷,80C干燥2小时后,照密度测定法(YBB00132003-2015)测定,应为 0.935-0.965g/cm 3。
【密封性】取本品适量,于每个瓶内装入适量玻璃球,盖紧瓶盖(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭矩见表 1 ),置于带抽气装置的容器中,
用水浸没,抽真空至真空度为27kPa,维持2分钟,瓶内不得有进水或冒泡现象。
表1瓶与盖的扭矩
【振荡试验】取本品适量,于每个瓶内装入酸性水为标示刑,盖紧瓶盖(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭矩见表1)用澳盼蓝试纸(将滤纸漫入稀释5倍的澳盼蓝试液,浸透后取出干燥)紧包瓶的颈部,直振荡器(振荡频率为每分钟200次土10次)振荡30分钟后,溴酚蓝试纸应不变色。
【水蒸气透过量】取本品适量,照水蒸气透过量测定法(YBB00092003-2015)第三法⑵在温度25C± 2C,相对湿度95%± 5%勺条件下测定,不得过100mg/24h. L。
【炽灼残渣】取本品2.0g,依法检查(中国药典2015年版通则0841),遗留残渣不得过0.1%(含遮光剂的瓶遗留残渣不得过 3.0%)。
【溶出物试验】供试浓的制备;分别取本品内表面积60Ocm(分割成长5cm宽
0.3cm的小片)兰份,分别置具塞锥形瓶中,加水适量,振摇洗涤小片,弃去水,重复操作二次,在30〜40r干燥后,分别用水(70 C± 2C)、65%乙醇(70 C± 2C)、正己烷(58 C± 2C )200ml浸泡24小时后,取出放冷至室温,用同批试验用溶剂补充至原体积作为供试液,以同批水、65%L醇、正己烷为空白液,进行
下列试验:
易氧化物精密量取水供试液20ml,精密加入高锺酸仰滴定液(O.002mol/L) 20ml 与稀硫酸Iml,煮沸3分钟,迅速冷却,加入日起化仰O.lg,在暗处放置5 分钟,用硫代硫酸纳滴定液(O.Olmol/L)滴定,滴定至近终点时,加入淀粉指示液5滴,继续滴定至无色,另取水空白液同法操作,二者消耗硫代硫酸铀滴定液 (O.Olmol/L)之差不得过1.5ml。
不挥发物分别取水、65%^醉、正己烷供试液与空白液各50ml置于己恒重的蒸发皿中,水浴蒸干,105C干燥2小时,冷却后精密称定,水供试液不挥发物残渣与其空白液残
渣之差不得过12.0mg;65聽醇供试液不挥发物残渣与其空白液残渣之差不得过50.0mg;正己烷不挥发物残渣与其空白液残渣之差不得过 75.0mg。
重金属精密量取水供试液20ml,加醋酸盐缓冲液(pH3.5)2ml,依法检查〈中国药典2015年版通则0821第一法),含重金属不得过百万分之一。
【微生物限度】取本品数只,加入标示容量1/3的氯化制注射液,将盖盖紧,振摇
l分钟,即得供试液。
供试液进行薄膜过滤后,依法检查(中国药典2015
年版通则1105、1106),细菌数每瓶不得过1000cfu,霉菌和酵母菌数每瓶不得过100cfu,大肠埃希菌每瓶不得检出。
【异常毒性】*取本品数只,用水消洗干净后,剪碎,取500cm (以内表面积计),加
入氛化纳注射液50ml,置高压蒸汽灭菌器1l 0'C保持30分钟后取出,冷却后备用,
以同批氯化纳注射液做空白,静脉注射,依法检查(中国药典2015年版通则1141),应符合规定。
【贮藏】固体瓶的内包装用药用聚乙烯塑料袋密封,保存于干燥、清洁处。
附件:检验规则
1、产品检验分为全项检验和部分检验。
2、有下列情况之一时,应按标准的要求,进行全项检验。
(1)产品注册;
(2)产品出现重大质量事故后,重新生产;
(3)监督抽验;
(4)产品停产后,重新恢复生产;
3、产品批准注册后,药包材生产、使用企业在原料产地、添加剂、生产工艺等没有变
更的情形下,可按标准的要求,进行除 "加外项目检验。
4、外观、密封性、振荡试验、水蒸气透过量、微生物限度的检验,按计数抽样
检验程序第l部分:按接收质量限(AQL)检索的逐批检验抽样计划(GB/T2828.1 -2012)
规定进行,检验项目、检验水平及接收质量限表2。
注:
1、带*的项目半年内至少检验一次
2、与瓶身配套的瓶盖可根据需要选择不同的材料,按标准中的溶出物试验、异
常毒性项目进行试验,应符合有关规定。