大鼠灌胃给药标准操作规程
- 格式:docx
- 大小:57.07 KB
- 文档页数:3

1. 掌握腹腔注射和灌胃的操作方法;2. 了解腹腔注射和灌胃的优缺点;3. 掌握实验动物的基本操作技术。
二、实验材料1. 实验动物:大鼠(体重约200-300g);2. 实验药品:生理盐水、葡萄糖、抗生素等;3. 实验器材:注射器、针头、酒精棉球、镊子、剪刀、解剖盘、剪刀、纱布等;4. 实验环境:实验室。
三、实验方法1. 腹腔注射实验(1)准备工作:将实验动物固定在解剖盘上,用酒精棉球消毒实验动物腹部皮肤。
(2)注射操作:左手抓取大鼠腹部皮肤,右手持注射器,针头斜向上,沿腹中线方向进针,进入腹腔后回抽无血液,缓慢注入药物。
(3)注射完毕,用纱布覆盖注射部位,观察动物反应。
2. 灌胃实验(1)准备工作:将实验动物固定在解剖盘上,用酒精棉球消毒实验动物口腔及咽部皮肤。
(2)灌胃操作:左手抓住大鼠头部,右手持注射器,针头沿一侧口角进针,紧贴咽后壁,头后仰以便伸直消化道,缓慢注入药物。
(3)注射完毕,用纱布覆盖注射部位,观察动物反应。
四、实验结果1. 腹腔注射实验:注射过程中,大鼠无不良反应,注射完毕后,动物精神状态良好。
2. 灌胃实验:注射过程中,大鼠无明显不适,注射完毕后,动物精神状态良好。
1. 腹腔注射和灌胃是两种常见的实验动物给药方式,各有优缺点。
2. 腹腔注射的优点是操作简便,药物吸收迅速,但可能引起动物应激反应,且部分药物不适宜腹腔注射。
3. 灌胃的优点是给药量准确,适用于多种药物,但操作过程中可能损伤动物,且药物吸收速度较慢。
4. 在实验过程中,应严格遵守操作规程,确保动物安全。
六、实验结论1. 通过本次实验,掌握了腹腔注射和灌胃的操作方法。
2. 了解腹腔注射和灌胃的优缺点,为今后的实验研究提供参考。
3. 提高了实验动物的基本操作技能,为科研工作奠定基础。

目的规范实验人员进行大、小鼠给药的操作程序。
适用范围适用于对大、小鼠的给药操作。
职责.1 管理人员负责监督、管理;.2 实验动物中心技术员负责指导、教学;.3 实验人员选择合适的给药方法,并严格遵守本规程。
规程.1 大小鼠常用的给药方法有:灌胃给药、皮内注射、皮下注射、腹腔注射、尾静脉注射、肌肉注射。
.2 灌胃给药操作规程(如图).2.1 灌胃针、注射器规格的选择.2.1.1 小鼠:灌胃针针长 5-7cm,直径 0.9-1.5mm,1mL 注射器.2.1.2 大鼠:灌胃针针长 6-8cm,直径 1-2mm,2.5-5mL 注射器.2.2 将灌胃针与注射器连接好并吸入一定量药液放置一旁备用;.2.3 左手保定实验动物,使之身体呈垂直或略向后仰,颈部拉直。
.2.4 右手持灌胃器,沿体壁用灌胃针测量口角至最后肋骨之间的长度,作为插入灌胃针的深度。
然后经口角插入口腔,与食管呈一直线,轻轻转动针头,刺激动物的吞咽,再将灌胃针沿上颚壁缓慢插入食管,小鼠插入深度约为2-3cm,大鼠插入深度约为 3-4cm,通过食管的膈肌部位时略有抵抗感。
.2.5 如动物正常呼吸且无异常挣扎行为,即可注入受试物。
如遇阻力应抽出灌胃针重新插入。
.2.6 剂量:小鼠约为 0.1-0.3ml/10g 体重,大鼠约为 1-2ml/100g 体重。
.2.7 注意事项:灌胃时需要先了解食道和气管的结构避免误插进入气管4.3 皮内注射操作规程(如图).3.1 注射部位:选实验动物颈背部皮肤或小鼠腋下约 1cm 处皮肤;.3.2 提前剪毛,常规消毒注射部位的皮肤,注射针头与皮肤呈 15-30°角刺入皮肤浅层,向上挑起并稍刺入,将药液注入皮内。
.3.3 注射后皮肤隆起一白色小皮丘,皮肤上毛孔变大。
.3.4 剂量:小鼠不超过 0.05ml/次,大鼠不超过 0.1ml/次。
.4 皮下注射操作规程(如图).4.1 注射部位:选实验动物颈背部皮下;.4.2 常规消毒注射部位的皮肤,用注射针头取一锐角角度刺入皮下;.4.3 将针头轻轻左右摆动,易摆动表示已刺入皮下,再轻轻抽吸,如无回血,可缓慢地将药物注入皮下。

一、实验目的本实验旨在通过灌胃法对小鼠和大鼠进行药物给药,以观察药物在小鼠和大鼠体内的吸收、分布和代谢情况,并探讨不同给药途径对药物效果的影响。
二、实验材料1. 实验动物:昆明小鼠10只(体重20-25g),雄性大鼠5只(体重200-250g)。
2. 实验药物:某药物溶液(浓度1mg/ml)。
3. 实验仪器:电子天平、灌胃器、注射器、计时器、解剖显微镜、组织切片机等。
4. 实验试剂:生理盐水、盐酸、乙醇等。
三、实验方法1. 实验动物分组:将小鼠和大鼠随机分为实验组和对照组,每组5只。
2. 给药方法:实验组采用灌胃法给药,对照组采用生理盐水灌胃作为对照。
- 小鼠灌胃:左手抓取小鼠,使其头部略低,右手持灌胃器,将灌胃针头从口角插入,沿咽后壁缓慢推进至食道,注入药物溶液。
- 大鼠灌胃:左手抓取大鼠,使其头部略低,右手持灌胃器,将灌胃针头从口角插入,沿咽后壁缓慢推进至食道,注入药物溶液。
3. 观察指标:- 观察实验组和对照组小鼠和大鼠的精神状态、活动能力、进食情况等。
- 在给药后1小时、2小时、4小时、6小时、8小时分别采集实验组和对照组小鼠和大鼠的血液,检测药物浓度。
- 在给药后24小时处死实验组和对照组小鼠和大鼠,解剖观察其器官组织变化。
四、实验结果1. 实验组小鼠和大鼠在给药后,精神状态、活动能力、进食情况与对照组无明显差异。
2. 在给药后1小时、2小时、4小时、6小时、8小时,实验组小鼠和大鼠的血液药物浓度逐渐升高,至4小时时达到峰值,随后逐渐降低。
3. 在给药后24小时处死实验组和对照组小鼠和大鼠,解剖观察发现,实验组小鼠和大鼠的器官组织无明显病变。
五、实验讨论1. 灌胃法是一种常用的给药途径,适用于小鼠和大鼠等实验动物。
2. 本实验结果表明,灌胃法能够有效地将药物输送至小鼠和大鼠体内,使药物在体内达到有效浓度。
3. 在进行灌胃实验时,应注意事项:- 严格掌握灌胃技巧,避免损伤动物食道。
- 控制灌胃剂量,避免药物过量。

一、实验目的本实验旨在探究灌胃方法在动物实验中的应用效果,通过对大鼠进行灌胃实验,观察灌胃给药对大鼠生理指标、血液指标和病理组织学的影响,评估灌胃方法的可靠性和安全性。
二、实验材料1. 实验动物:SPF级SD大鼠,体重180-220g,雌雄各半。
2. 实验药物:已知药物,剂量为10mg/kg。
3. 试剂与仪器:灌胃针、注射器、电子天平、血液分析仪、病理切片机、显微镜等。
三、实验方法1. 将SD大鼠随机分为实验组和对照组,每组10只。
2. 实验组大鼠通过灌胃途径给予已知药物,剂量为10mg/kg,对照组大鼠给予等体积的生理盐水。
3. 灌胃操作:将大鼠固定在实验台上,用灌胃针将药物缓慢注入大鼠口腔,直至药物完全进入消化道。
4. 给药后,观察大鼠的生理指标、血液指标和病理组织学变化。
5. 实验结束后,对大鼠进行解剖,采集相关组织样本,进行病理切片和显微镜观察。
四、实验结果1. 生理指标:实验组大鼠在给药后出现轻微的呕吐、腹泻等症状,但症状持续时间为1-2天,未出现死亡现象。
对照组大鼠生理指标无明显变化。
2. 血液指标:实验组大鼠给药后血液白细胞计数、红细胞计数、血红蛋白浓度等指标无明显变化,与对照组相比无统计学差异。
3. 病理组织学观察:实验组大鼠胃黏膜、小肠黏膜、肝脏、肾脏等器官组织无明显病变,与对照组相比无统计学差异。
五、讨论与分析1. 灌胃方法是一种常用的动物实验给药途径,具有操作简便、给药剂量准确、对动物生理影响较小的特点。
2. 本实验结果显示,灌胃给药对大鼠生理指标、血液指标和病理组织学影响较小,说明灌胃方法在本实验中具有较高的可靠性和安全性。
3. 然而,灌胃方法也存在一定的局限性,如给药剂量难以精确控制、药物吸收速度较慢等。
在实际应用中,应根据实验目的和动物种类选择合适的给药途径。
六、结论本实验结果表明,灌胃方法在大鼠实验中具有较高的可靠性和安全性,可用于动物实验的给药途径。
在后续实验中,可根据具体实验目的和动物种类,选择合适的灌胃方法,以获得准确的实验结果。

表2两组治愈病例主要临床症状起效时间比较组别犬数发热腹痛里急后重脓血便腹部压痛治疗组230.85?0.32*1.10?0.41*1.08?0.36*1.13?0.451.51?0.47*对照组141.31?0.271.70?0.731.76?0.721.17?0.572.05?0.72注:与对照组比较*p<0.01表3两组治愈病例主要临床症状消失时间比较组别犬数发热腹痛里急后重脓血便腹部压痛治疗组231.97?0.75*3.10?1.02*2.79?1.05*2.87?1.113.16?1.17*对照组142.69?1.193.89?1.333.93?1.193.92?1.094.41?1.35注:与对照组比较*p<0.014小结犬的急性菌痢临床施治中,随着致病菌群的不断变化,耐药菌株的增长,给治疗带来一定的困难。
特别是基层兽医站无实验室,条件差,全凭目观和经验,无法对大便进行细菌培养,给用药带来了一定困难。
盲目滥用抗生素,而导致菌群失调,迁延不愈,给广大养殖户增加了支出,浪费了财力、物力、人力,造成不应有的损失。
而用中药治疗常可取得良好的疗效。
自拟葛根芩连汤中,主药葛根味甘平有解肌清热、升清止痢功用;黄芩、黄连则味苦、性寒、清热燥湿,抗菌消炎,除里急后重症;木香理气开胃、行止泻;马齿苋清热解毒止痢;茯苓、泽泻,渗湿利水、健脾和中;金银花清热解毒;甘草清热解毒、补中、调和诸药。
诸药相合,共奏清热解毒,燥湿坚阴止痢之功。
现代药理研究认为:葛根、黄芩、黄连、马齿苋对痢疾杆菌有较强的抑制作用,同时,葛根芩连汤有提高机体免疫力,增强小肠黏膜绒毛上皮细胞功能的作用。
文章编号:1003-8655(2006)03-0036-01中草药治疗宠物犬腹胀病赵沛林(山东省无棣县畜牧局2519007)中图分类号:S858.292文献标识码:B宠物犬的腹胀病,是由饲养管理不善或饲料品质低劣、变质等引起的一种原发或继发性疾病,临床比较多见。
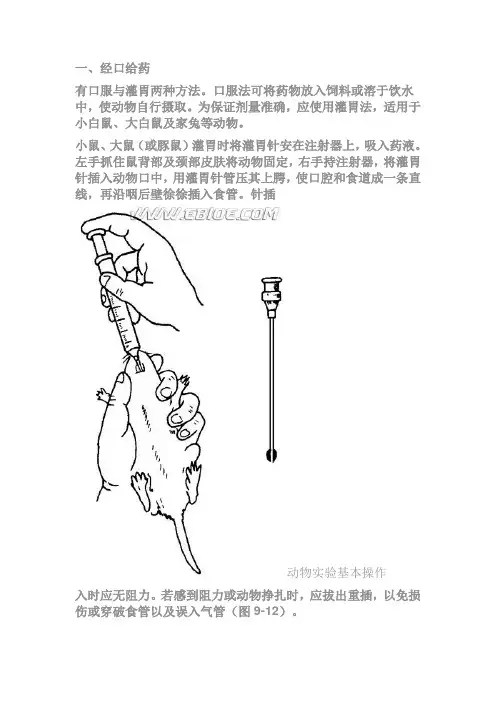
一、经口给药有口服与灌胃两种方法。
口服法可将药物放入饲料或溶于饮水中,使动物自行摄取。
为保证剂量准确,应使用灌胃法,适用于小白鼠、大白鼠及家兔等动物。
小鼠、大鼠(或豚鼠)灌胃时将灌胃针安在注射器上,吸入药液。
左手抓住鼠背部及颈部皮肤将动物固定,右手持注射器,将灌胃针插入动物口中,用灌胃针管压其上腭,使口腔和食道成一条直线,再沿咽后壁徐徐插入食管。
针插动物实验基本操作入时应无阻力。
若感到阻力或动物挣扎时,应拔出重插,以免损伤或穿破食管以及误入气管(图9-12)。
一般当灌胃针插入小鼠3~4cm,大鼠或豚鼠4~6cm后可将药物注入。
常用的灌胃量小鼠为0.2~1ml,大鼠1~4ml,豚鼠为1~5ml。
二、腹腔注射常用于大鼠或小鼠给药。
用左手捕捉固定动物,使腹部向上,鼠头略低于尾部,右手将注射针头自下腹部靠近腹白线的两侧刺入皮下,使针头向前推0.5~1.0cm,再以45°角穿过腹肌,缓缓注入药液。
为避免伤及内脏,可使动物处于头低位,使内脏移向上腹(图9-15)。
若实验动物为家兔,进针部位为下腹部的腹白线离开1cm处。
三、毛细管法小鼠内眦取血(眼眶静脉丛采血)左手拇指及食指紧紧握住小鼠颈部,压迫颈部两侧使眶后静脉丛充血,但用力要恰当,防止动物窒息死亡。
右手持玻璃毛细管从右眼或左眼以45度角插入结膜,再轻轻向眼底部方向刺入,刺入深度为2-3mm,轻轻旋转毛细管以划破静脉丛,让血液顺毛细管流出,接收入事先准备的容器中。
若遇阻力稍后调整角度后再刺入,如穿刺恰当,血液能自然流入毛细管内。
得到血后,即除去颈部压力,拔出毛细管,用干棉球或纱布轻压眼球止血。
数分钟后可在同一穿刺孔重复取血。
小鼠一次可采得血0.2-0.3ml。
注:实验前先将毛细管浸泡过肝素后烘干使用即可。

大、小鼠的抓取保定及灌胃操作规程
一、大小鼠的抓取保定
(1)先用右手抓取鼠尾提起。
(2)置于鼠笼或实验台向后拉。
(3)在鼠向前爬行时,用左手拇指和食指抓住大、小鼠的两耳和颈部皮肤。
(4)将鼠体置于左手心中,把后肢拉直。
(5)以无名指按住鼠尾,小指按住后腿即可;如果大鼠体积太大,可由第二个人协助固定后肢。
二、大小鼠的灌胃
(1)将针尖圆滑的灌胃针接在注射器上,吸入药液。
(2)一只手抓住鼠背部及颈部皮肤将动物抓取固定;体位为头高尾低(头高位)。
(3)另一只手持注射器,将灌胃针从动物嘴部侧面插入动物口中。
(4)然后轻轻摆正灌胃针并沿口腔顶壁和咽后壁徐徐插入食道,针插入时应无阻力;若感到阻力或动物挣扎时,应立即停止进针或将针拔出,以免损伤或穿破食道以及误入气管。
(5)一般当灌胃针插入小鼠3~4 cm,大鼠或豚鼠4~6 cm后轻轻回抽一下,见有胃液可将药物注入。
(6)用输血针头或小号腰穿针头,将其尖端斜面磨平,用焊锡在针尖周围焊一圆头,即成灌胃针,或购买现成的灌胃针。
常用的灌胃量小鼠为0.2~1 mL,大鼠1~4 mL,豚鼠为1~5 mL。

综述:实验大鼠灌胃给药方法简介徐意摘要:本文主要介绍了几种大鼠经口灌胃给药的方法。
并介绍各年龄段等方面大鼠(删)在灌胃中注意事项。
关键词:大鼠;灌胃;给药。
随着科学(医学)技术的发展,动物实验已成为医学实验研究的基本方法。
根据实验目的、实验动物的种类及药物剂量的不同,需对实验动物实施不同的给药方法。
经口灌胃给药方法是一种重要的给药途径。
[1]灌胃给药能够准确掌握给药剂量、控制给药时间,在营养学和药物学动物实验中有重要意义。
在此,作者根据操作经验,对各实验动物灌胃方法加以改良,并用于实验操作中,关于大鼠的灌胃方法介绍如下。
1 大鼠解剖生理特点: [2]SD大鼠与Wistar大鼠的解剖生理特点相似:①腔粘膜幼嫩,易受损伤引起出血。
②咽喉部神经反射较差,自我保护能力差。
药液溢出时极易呛入肺内而致死。
③管长,自口角至责门为5.5士0.5cm。
④解剖位置低,常达腹中部甚至腹下部。
胃的外形似蚕豆状,胃底部和幽门部均高于责门部。
责门括约肌紧张度较低,灌胃时药液易外溢。
⑤胃内容积为0.6士0.2ml,但胃内常常是积满汁液,压力较大,也是药液易于外溢的原因。
2 特制灌胃管的制作(与题无关)2.1软质灌胃器的制作选取临床用小儿头皮针(带针座)塑管一段。
放置60°C左右热水中浸泡2~3min,取出后迅速将其拉长,使该塑管变细,直径约为1mm。
剪取带针座的一段长约6cm,再将游离端磨光滑即成。
最后连干注射器上备用。
2.2硬质灌胃器的制作取12号普通注射针头,首先用粗锉刀把针头锉掉,然后用细锉刀把锉掉部位锉平、锉光、再用沙纸磨平。
加工成有一定弧度,针体长约5 cm并连接1 ml注射器,即成大鼠灌胃器。
灌胃时在针头处套上长2 cm 硅胶管,比针头稍微长0.1 cm,太长容易被动物咬掉。
以防灌胃时损伤动物食道。
另外在锉针头时或加工弧度时用力要均匀,否则就会把针管弄扁,以影响通畅。
3 大鼠(固定)保定操作[1~3] (文献要标注到具体的位置)3.1清醒大鼠的保定大鼠在未受到强烈刺激情况下性情虽较温顺,但捕捉时也要提防被其咬伤或抓伤手指,因此需要戴手套捕捉。

实验动物的给药途径和方法及药量计算方法一、经口给药法(一)灌胃法此法给药剂量准确,是借灌胃器将药物直接灌到动物胃内的一种常用给药法。
1、鼠类:鼠类的灌胃器由特殊的灌胃针构成。
左手固定鼠,右手持灌胃器,将灌胃针从鼠的右U角中,插入口中,沿咽后壁慢慢插入食道,使其前端到达膈肌位置,灌胃針插入时应无阻力,如有阻力或动物挣扎则应退针或将针拔出,以免损伤、穿破食道或误入气管。
2、兔、犬等:灌胃一般要借助于开口器、灌胃管进行。
先将动物固定,再将开口器固定于上下门齿之间。
然后将灌胃管(常用导尿管代替)从开口器的小孔插入动物口中,沿咽后壁而进入食道。
插入后应检查灌胃管是否确实插入食道。
可将灌胃管外开口放入盛水的烧杯中,若无气泡产生,表明灌胃管被正确插入胃中,未误入气管。
此时将注射器与灌胃管相连,注入药液。
(二)口服法口服给药是把药物混入饲料或溶干饮水中让动物自由摄取。
此法优点是简单方便,缺点是剂量不能保证准确,且动物个体间服药量差异较大。
大动物在给予片剂、丸剂、胶囊剂时,可将药物用镊子或手指送到舌根部,迅速关闭口腔,将头部稍稍抬高,使其自然吞咽。
二、注射给药法(一)皮下注射皮卜注射一般选取皮下组织疏松的部位,大鼠、小鼠和豚鼠可在颈后肩胛问、腹部两侧作皮下注射;家兔可在背部或耳根部作皮卜注射;猫、犬则在大腿外侧作皮下注射。
皮下注射用左手拇指和食指轻轻提起动物皮肤,右手持注射器,使针头水平刺入皮下。
推送药液时注射部位隆起。
拨针时,以手指捏住针刺部位,可防止药液外漏。
(二)肌肉注射肌肉注射一般选肌肉发达,无大血管通过的部位。
大鼠、小鼠、豚鼠可注射大腿外侧肌肉;家兔可在腰椎旁的肌肉、臀部或股部肌肉注射;犬等大型动物选臀部注射。
注射时针头宜斜刺迅速人肌肉,回抽针栓如无回血,即可注射。
(三)腹腔注射给大鼠、小鼠进行腹腔注射时,以左手固定动物,使腹部向上,为避免伤及内脏,应尽量使动物头处于低位,使内脏移向上腹,右手持注射器从下腹两侧向头方刺入皮下,针头稍向前,再将注射器沿45角斜向穿过腹肌进入腹腔,此时有落空感,回抽无回血或尿液,即可注入药液。


大、小鼠灌胃给药标准操作规程【操作规范】1.抓取实验动物,在手中要稳,使鼠不可随意挣扎。
2.保持鼠头部和颈部成一直线,方便灌胃针头进入口腔。
3.灌胃针头从动物嘴角进入,压住舌头,抵住上颚,轻轻向内推进,进入食管后会有一个刺空感。
4.将灌胃针沿咽后壁慢慢插入食道,回抽注射器无空气逆流方可注入药液。
5.灌胃针进入不宜过深,一般灌胃针插入深度为:小鼠2-3cm,大鼠4-6cm。
6.常用一次灌胃量:小鼠0.2 mL/10g(体重×20),大鼠1-2 mL/100g。
7.小鼠<30g,建议用8、9号;30g以上可选择12号灌胃针(配1ml注射器)。
其中9号针头直径小于常规的大头,特别适用幼鼠。
大鼠多用16号,20号,并根据注射药物的量配套2或5ml的注射器。
【灌胃针选择】【循环途径】食管→胃→小肠→小肠毛细血管(吸收入血)→空回肠静脉→肠系膜上静脉→肝门静脉→肝→肝静脉→下腔静脉→右心房→右心室的吸收进入血液循环。
【主要特点】●安全性高:各种给药方式中,口服给药是最安全的;●可选的剂型比较多:只要保证药物是均匀且稳定即可;●生物利用度低:药物经胃肠道吸收,并存在胃肠道首过代谢和肝脏首过代谢,生物利用率相对较低,仅为静脉的25-30%;对于部分化合物吸收不恒定,误差较大。
【常见问题】1.灌胃后,为何小鼠死亡?A.因为小鼠的气管靠近食管,若灌胃针误入气管,药物会进入气管导致小鼠当场窒息死亡;B.刺伤食道:若入针不当,损伤或穿破食管,会导致小鼠逐渐消瘦并死亡。
2.灌胃时为了避免小鼠死亡,最应该注意?一定要主要正确抓取和插入。
抓取时:小鼠体位一定要保持,头、颈部及身体一条线,尽量保证插入的是食管而不是气管。
插入时:嘴角进针,然后竖直向下,先试探性的稍微用力,慢慢向下,一旦感觉有阻碍就得停止,针无阻力才可注射。
3.大鼠灌胃和小鼠区别主要在于哪里?大鼠操作步骤与小鼠基本一样,但因大鼠个体很大,易挣扎,所以难度更大,所以一定要准确抓取;另外灌胃针型号不一样,多用16号,20号适合更大型大鼠,并根据注射药物的量配套2或5ml的注射器。
随着生命科学技术的发展,动物实验已成为医学实验研究的基本方法。
根据实验研究目的、实验动物的种类及药物剂型、剂量的不同,要求对实验动物实施不同的给药方法。
尤其对于药物的毒理、药效的研究和药物剂量的确定,经口灌胃给药方法是一种重要的途径。
在国内文献上却很少见到具体的描述。
在此,作者将在实践中摸索出的一套实用于小鼠、大鼠、豚鼠、家兔经口灌胃给药的方法介绍如下。
一、灌胃器具制作1.1小鼠、大鼠、豚鼠灌胃器的制作小鼠、大鼠灌胃器的来源有两个,一是从市面上购买特制的I2~l6号灌胃针。
二是自制。
自制方法为:取l2号普通注射针头,首先将针头尖部去掉,然后用细锉刀把去掉部分锉平、锉光,再用沙纸磨光滑,有条件时可在针尖处点焊成球型。
加工成有20度弧度的灌胃针,连接1ml或5ml的注射器,即成为大小鼠的灌胃器。
在打磨针头或加工弧度时用力一定要均匀,否则就会将针管弄扁,影响针管畅通。
豚鼠灌胃器,可采用大鼠灌胃器。
1.2家兔灌胃器的制作取12号腰椎穿刺针。
加工方法同小鼠、大鼠灌胃器的制作,针体长约9cm,并连接10ml或20ml注射器,即家兔灌胃器。
二、灌胃操作方法2.1小鼠经口灌胃给药方法先保定动物,即用右手将小鼠尾巴提起,置于鼠笼或粗糙的平面上,当小鼠向前挣扎时,用左手的拇指和食指捏住小鼠两耳后颈背皮肤,翻转小鼠置于掌心,拉直后肢,以小指压住小鼠尾巴即可。
在保定小鼠过程中,不要用力过大,勿握其颈部,以免窒息死亡。
以灌胃器轻轻压其头部,使口腔与食道成一条直线,再将灌胃针沿上腭壁轻轻进入食道,当灌胃针进入约3cm左右时即达胃内。
如果灌胃针的位置插入正确,小鼠可自行吞服药,灌胃针插入位置不正确,小鼠会强烈挣扎,必须拔出重插,否则可能将药物灌入气管,造成小鼠死亡。
注完药液后轻轻抽出灌胃针。
小鼠一次最大灌胃量为:0.4ml/10g.w。
2.2大鼠经口灌胃给药方法大鼠的捕捉方法与小鼠基本相同。
根据长期的实践经验,我们发现如用一块湿的纱布盖在大鼠身上,既可以防滑,又可以给初学者一种安全感。
灌胃1.准备药物和灌胃器械2.抓取老鼠3.灌胃注意事项:1)抓取老鼠时,可以戴大手套,但是操作起来会很不方便;建议只戴橡胶手套或不戴手套。
左手大拇指和食指从耳后固定老鼠头部,将颈部皮肤抓紧,使头部不能转到(但也不要窒息),剩余手指将老鼠背部皮肤抓紧,使其身体不能扭动。
使其和身体成一直线。
可以两人配合,但是会浪费时间,更增加灌胃难度;强烈建议一人独立操作。
2)老鼠抓好后,要正确持针,中指、无名指和大拇指夹住针体,食指放在推塞上;针务必要沿口角进入,大概进入针体的2/3即可将药物注射入胃,注意进针不顺时切忌用力,应重新进针。
如果当时药物没有流出,既可确认灌胃成功,如果流出则失败。
3)在正式实验灌胃前,务必先练习。
首先不要惧怕老鼠,其次不要先老鼠脏(清洁级老鼠很干净的),再次,不能生硬,不要让老鼠紧张。
4)熟能生巧,边学习边练习边思考方能学好。
有不足之处,敬请各位老师同学批评指正,以使该实验更加臻美。
若有不解之处,请询冯展波139****4731,或者免疫学技术交流群:85460640。
QQ:929108912谢谢。
2VO模型1.准备手术器械2.麻醉3.去除颈部毛4.切开中正颈部皮肤,分离肌肉、血管、神经5.分离目标血管,双线结扎,血管无需剪断6.缝合伤口注意事项:1)缝合线用4号线;2)麻药目前本实验室暂时使用水合氯醛,一般是10%的,按照350mg/kg量给药,由于老鼠对药物的耐受差异较大,麻醉把握不好死亡率较高;麻醉不足时,补药不超过前总量的10%,补药时非常容易导致死亡,且等待时间会明显延长;麻醉过度则可进行口腔插管和辅助呼吸,如果均不行,则死亡放弃。
3)分离血管时务必不能将神经损伤。
4)出麻醉状态的老鼠体温调节失衡,所以手术过程中注意保温;5)老鼠体重在250-280g左右最适合实验,死亡率最低;6)打麻药时注意:首先正确抓取老鼠(见灌胃操作规程),再次将老鼠头朝下倒置成30度角,右手持针,腹中线和两后腿中间连线相交处进针,回抽后,注射。
大鼠灌胃给药方法及两种灌胃方法的比较摘要:实验动物的给药对整个实验的成功起到关键的作用,然而,灌胃给药也是一种基本的给药途径。
所以,熟练掌握灌胃给药操作不仅有利于实验的进展,而且,可以减轻实验动物的痛苦。
本文通过对30只SD大鼠进行灌胃,阐述灌胃给药技巧及对两种灌胃方法进行比较。
关键词:大鼠;灌胃熟知SD大鼠解剖生理学特点对整个灌胃过程起到关键作用。
1口腔黏膜幼嫩,针管容易对其造成机械性损伤2咽喉部神经反射差,药物溢出时易呛入肺内而剧烈呛咳甚至致死3自口角至贲门距离为5.5±0.5cm4解剖位置低,胃的外形似蚕豆状,胃底部和幽门部均高于贲门部,贲门括约肌紧张度较低,灌胃时药液易外溢5胃内容积为0.6±0.2ml,但胃内常积满汁液,压力较大。
因此,灌胃时,灌胃针的进针角度和深度是非常关键的。
1.灌胃方法1.1 第一种灌胃方法。
大鼠在安静状态下非常温和,但对于初学者,由于没能熟练掌握抓取大鼠的技巧,更容易惹怒大鼠,因此初学者应该戴厚手套捉拿。
捉拿大鼠后,固定大鼠,尤其是大鼠的头部。
所以,左手应把大鼠头部固定好,使其不能随意摆动,这样可以避免大鼠咬伤。
首先,用右手把大鼠尾巴提起,置于鼠笼上,右手往后轻拉大鼠尾部,待大鼠抓紧鼠笼身体成一条直线时,左手拇指和食指抓住大鼠两耳后颈背皮肤,并尽量用拇指将大鼠左腮部往后拉,其余三指轻按大鼠背脊,使大鼠身体在一条直线上,使大鼠的腹部轻趴在试验台上。
实验者也可利用身体,单脚踩台阶或取坐位,大腿前侧与身体腹侧成直角或钝角,使大鼠后肢踩于实验者大腿前侧与鼠身垂直,大鼠上肢及腹侧贴于实验者身体。
仍以左手食指和拇指固定头部,左手前三指推直大鼠颈后部和枕部使其头后仰。
且往往利用实验者身体比使用试验台操作更便捷,大鼠更易耐受。
抓取力度适中,避免抓取颈部,以免使其窒息。
然后将大鼠置于左手心中,拉直后肢,大鼠体积较大,所以不能像小鼠一样可以把尾巴压住,根据本次灌胃经验,可将大鼠尾巴平放于试验台并面对左手偏右,用左手腕部位将尾巴压住固定,此时到灌胃结束左手不能移动。
大鼠灌胃操作方法灌胃是一种常用的实验操作方法,用于将试验物质直接灌入动物的胃部进行研究。
在进行大鼠灌胃操作时,需要注意以下步骤和操作技巧。
1. 实验前准备在进行大鼠灌胃操作前,首先要准备好所需的工具和材料,包括:大鼠、灌胃针、灌胃管、药物或试剂、麻醉剂、手套、擦皮纸、酒精等。
同时,还需要准备好实验室动物的伦理审查文件,并且根据实验设计制定相应的实验操作流程。
2. 动物选择和准备选择健康的大鼠进行实验,并提前进行饲养和适应。
在灌胃操作过程中,需要将大鼠固定在操作台上以保证操作的准确性和安全性。
饲养中的大鼠应该保持精神健康、无任何疾病症状,并且在实验前进行禁食,通常禁食时间为12-24小时。
3. 麻醉在进行灌胃操作时,大鼠需要处于麻醉状态下,以减少疼痛和不适。
常用的麻醉剂包括乙醚、异氟醚等。
使用麻醉剂时,应该注意剂量的控制,避免过量而导致动物的不适。
4. 准备灌胃针和灌胃管灌胃针和灌胃管是灌胃操作中的关键工具,需要提前准备好。
灌胃针用于将药物填充到灌胃管内,而灌胃管则是将药物导入动物胃部的工具。
选择合适大小的灌胃管,根据大鼠的大小来选择灌胃针的长度和直径。
5. 灌胃操作(1)将大鼠固定在操作台上,保持头部稍微仰起的姿势,以便于导管插入。
(2)用酒精擦拭大鼠口腔和颈部的皮肤,保持操作区域清洁。
(3)用手指托开大鼠口腔,将灌胃针或灌胃管插入大鼠喉咙。
(4)缓慢地将灌胃针或灌胃管插入食道,直至其达到胃部。
在插入过程中,要轻轻旋转导管,以便顺利通过食道。
(5)将需要灌胃的药物缓慢注入灌胃针或灌胃管中,确保药物充分进入大鼠胃部。
(6)在药物灌入后,将灌胃针或灌胃管缓慢取出,避免损伤大鼠食道和胃部。
6. 观察和处理在灌胃结束后,应该观察大鼠一段时间,以确保其复苏良好,并及时给予适当的处理。
根据实验的要求,可能需要给予大鼠液体和食物来帮助其恢复。
总结起来,大鼠灌胃操作属于一种常用的实验方法,需要仔细准备工具和材料、选择合适的动物以及进行适当的麻醉。
北京伽拓医药研究有限公司
JAT BioDiscovery Co., Ltd.
大鼠灌胃给药的标准操作规程
编号:SOP.QA.001.00
起草:熊伟日期:
修订:日期:
审核:日期:
批准:日期:
生效日期:拷贝号:
分发部门:部门待最终确定后补齐,昭衍和康龙化成的sop用后销毁,协和建昊的SOP交到我处!
大鼠灌胃给药的标准操作规程
1.目的
规范大鼠灌胃给药的具体操作,良好使用实验动物,保持实验质量的稳定性,合理控制因操作引起的实验误差,以确保实验的可靠性和准确性。
2.范围
适用于本机构实验大鼠灌胃给药的操作人员。
3.内容
3.1准备工作
3.1.1核对实验方案,按照实验计划规定时间准时进行灌胃给药。
3.1.2从供试品管理部领取受试物,核对专题名称和剂量。
3.1.3若操作在SPF级动物房进行,按照动物房的更衣SOP进行更衣,按人流路径行走,进入操作动物房。
3.2操作程序
3.2.1从笼内将大鼠取出,放在饲养盒的盒盖(或表面粗糙的物体)上,根据体表标记或者RFID识别动物编号。
3.2.2操作者用合适规格的灌胃注射器抽取所需受试物的剂量,排空注射器内的空气,放在操作台上或者交给辅助人员。
3.2.3操作者用一只手的拇指和中指从背侧伸入大鼠腋下,固定大鼠的手翻转,将大鼠头朝上,腹面对着操作者,同时食指抵住顶骨,确保食道平直。
3.2.4另一只手拿起准备好的灌胃注射器,大致定好灌胃针头应插到胃内后的位置。
3.2.5将灌胃针头由大鼠左侧口角,顺着上颚后壁插入咽部,轻轻移动灌胃针头前端,沿着平行于动物的纵轴,进入食道,没有抵触感,把灌胃针头插入胃部。
3.2.6若感到阻力或者动物挣扎时,应立即停止进针或将针拔出,稍作安抚后重新进行灌胃操作,以免损伤或穿破大鼠食道以及误入气管。
3.2.7将灌胃针头插入胃内后,稳定推动针芯,慢慢注入受试物。
3.3给药后程序
3.3.1在完成每只大鼠灌胃操作后,应立即填写“给药记录表”上相应内容,在完成该批大鼠灌胃操作后,必须立即在“给药记录表”上签名和注明日期,并作好核
查。
3.3.2仔细观察每只动物情况,检查是否有迟发的异常情况。
3.3.3核对各类标签指标、用药量以及记录,防止发生漏给药和错给药的情况。
3.3.4将剩余受试物及盛装受试物的容器交还供试品管理部。
3.3.5由项目负责人将“给药记录表”放入课题档案。
3.4注意事项
3.4.1开始给药之前,必须核对实验方案,确定不同剂量组的动物编号。
3.4.2除实验方案中另有规定外,各组的给药顺序应先雄后雌,先低剂量后高剂量,按照下列分组顺序给药:雄性对照,雌性对照,雄性低剂量,雌性低剂量,雄性中剂量,雌性中剂量,雄性高剂量,雌性高剂量等。
3.4.3 应根据灌胃大鼠的大小和操作人的习惯选择直杆或弯头的灌胃针头;使用前应仔细检查灌胃针头处有无缺痕或锋利之感。
一般应选择头部较圆且光滑的针头使用。
3.4.4每只大鼠在给药后,放回原来的笼具时应特别注意核对编号、性别等,盖好笼盖,观察大鼠是否出现与给药前明显不同状态。
3.4.5在进行不同剂量组给药时,必须用生理盐水清洗灌胃针头及注射器或更换注射器。
3.4.6受试物的标签、给药动物笼具标签、实验方案、时间设计和剂量水平都必须一一加以核对。
3.4.7根据GLP的实验要求对实验操作进行核查。
4.编制依据
[1]药物非临床研究质量管理规范
[2] 药物非临床研究质量管理规范认证标准
[3] 药物毒理学实验方法与技术
5.变更记载
版本号批准日期生效日期变更原因及目的。