异柠檬酸裂解酶(isocitrate lyase,ICL)试剂盒说明书
- 格式:doc
- 大小:59.00 KB
- 文档页数:2

细菌异柠檬酸脱氢酶活性比色法定量检测试剂盒产品说明书(中文版)主要用途细菌异柠檬酸脱氢酶(ISOCITRATE DEHYDROGENASE)活性比色法定量检测试剂是一种旨在通过反应系统中氧化型烟酰胺腺嘌呤二核苷磷酸酸(NADP)还原后峰值的变化,即采用比色法来测定细菌裂解样品中酶活性的权威而经典的技术方法。
该技术经过精心研制、成功实验证明的。
其适合于各种细菌细胞裂解悬液样品异柠檬酸脱氢酶的活性检测。
产品严格无菌,即到即用,操作简捷,性能稳定。
技术背景异柠檬酸脱氢酶(isocitrate dehydrogenase;IDH;EC1.1.1.42)是三羧酸循环(citric acid cycle)或克雷布斯循环(Krehes cycle)中的酶之一,存在于所有生物体内。
细菌异柠檬酸脱氢酶有2种同工酶:同源双体,40至45Kd分子量;单体,80至100Kd分子量。
在细菌体内,氧化型烟酰胺腺嘌呤二核苷磷酸(oxidizedβ-Nicotinamide adenine dinucleotide –phosphate;NADP)依赖性异柠檬酸脱氢酶获得辅酶NADP和辅助因子锰或镁离子(Mn)的推动,脱去底物异柠檬酸的氢和二氧化碳(氧化性脱羧基作用),转化为α-酮戊二酸(α-ketoglutarate),同时生成还原型烟酰胺腺嘌呤二核苷磷酸(reduced β-Nicotinamide adenine dinucleotide –phosphate;NADPH)。
一旦磷酸化或在乙酸环境中,以及有限的葡萄糖条件下,异柠檬酸脱氢酶则失活,从而控制三羧酸循环和乙醛酸旁路(glyoxylate bypass)之间碳的流动。
基于异柠檬酸脱氢酶的NADP依赖性,和作用后所产生的NADPH,通过分光光度仪的峰值变化(340nm 波长),来定量分析异柠檬酸脱氢酶的活性。
异柠檬酸脱氢酶反应系统为:产品内容裂解液(Reagent A)毫升活性液(Reagent B)微升缓冲液(Reagent C)毫升反应液(Reagent D)毫升底物液(Reagent E)毫升阴性液(Reagent F)毫升产品说明书1份保存方式保存活性液(Reagent B)、缓冲液(Reagent C)、反应液(Reagent D)和底物液(Reagent E)在-20℃冰箱里;其余的保存在4℃冰箱里;反应液(Reagent D)和底物液(Reagent E)避免光照;有效保证6月用户自备1.5毫升离心管:用于样品保存的容器15毫升锥形离心管:用于样品操作的容器超声仪:用于裂解细菌细胞(微型)台式离心机:用于样品制备比色皿或96孔板:用于比色的容器分光光度仪或酶标仪:用于比色分析实验步骤实验开始前,将-20℃冰箱里的试剂盒中的活性液(Reagent B)置入冰槽里融化。

乙醛酸循环的产物
题目:乙醛酸循环的产物是( )。
A.琥珀酸
B.乙醛酸
C.苹果酸
D.乙酰CoA
答案:C.苹果酸
乙醛酸循环是植物和某些微生物(大肠杆菌、醋酸杆菌等)及一些无脊椎动物细胞内脂肪酸氧化分解为乙酰CoA之后,在乙醛酸循环体(glyoxysome)内生成琥珀酸、乙醛酸和苹果酸;此琥珀酸可用于糖的合成的过程。
大多数动物和人类细胞中没有乙醛酸循环体,无法将乙酰CoA转变为糖。
油料植物种子(花生、油菜、棉籽等)萌发时存在着能够将脂肪转化为糖的乙醛酸循环。
水稻盾片中也分离出了乙醛酸循环中的两个关键酶——异柠檬酸裂解酶和苹果酸合酶。
脂肪酸经过β-氧化分解为乙酰CoA,在柠檬酸合成酶的作用下乙酰CoA与草酰乙酸缩合为柠檬酸,再经乌头酸酶催化形成异柠檬酸。
随后,异柠檬酸裂解酶(isocitratelyase)将异柠檬酸分解为琥珀酸和乙醛酸。
再在苹果酸合酶(malate synthetase)催化下,乙醛酸与乙酰CoA结合生成苹果酸。
苹果酸脱氢重新形成草酰乙酸,可以再与乙酰CoA缩合为柠檬
酸,于是构成一个循环。
其总结果是由2分子乙酰CoA生成1分子琥珀酸,反应方程式如下:2乙酰CoA+NAD+→琥珀酸+2CoA+NADH+H+ 琥珀酸由乙醛酸循环体转移到线粒体,在其中通过三羧酸循环的部分反应转变为延胡索酸、苹果酸,再生成草酰乙酸。
然后,草酰乙酸继续进入TCA循环或者转移到细胞质,在磷酸烯醇式丙酮酸羧激酶(PEP carboxykinase)催化下脱羧生成磷酸烯醇式丙酮酸(PEP),PEP 再通过糖酵解的逆转而转变为葡萄糖6磷酸并形成蔗糖。
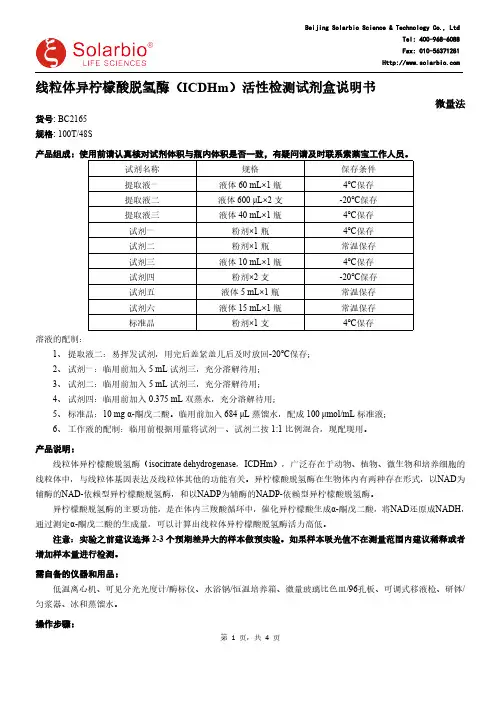
线粒体异柠檬酸脱氢酶(ICDHm )活性检测试剂盒说明书微量法货号: BC2165规格: 100T/48S 产品组成:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系索莱宝工作人员。
试剂名称规格保存条件提取液一液体60 mL×1瓶4℃保存提取液二液体600 μL×2支-20℃保存提取液三液体40 mL×1瓶4℃保存试剂一粉剂×1瓶4℃保存试剂二粉剂×1瓶常温保存试剂三液体10 mL×1瓶4℃保存试剂四粉剂×2支-20℃保存试剂五液体5 mL×1瓶常温保存试剂六液体15 mL×1瓶常温保存标准品粉剂×1支4℃保存溶液的配制:1、提取液二:易挥发试剂,用完后盖紧盖儿后及时放回-20℃保存;2、试剂一:临用前加入5 mL 试剂三,充分溶解待用;3、试剂二:临用前加入5 mL 试剂三,充分溶解待用;4、试剂四:临用前加入0.375 mL 双蒸水,充分溶解待用;5、标准品:10 mg α-酮戊二酸。
临用前加入684 μL 蒸馏水,配成100 μmol/m L 标准液;6、工作液的配制:临用前根据用量将试剂一、试剂二按1:1比例混合,现配现用。
产品说明:线粒体异柠檬酸脱氢酶(isocitrate dehydrogenase ,ICDHm ),广泛存在于动物、植物、微生物和培养细胞的线粒体中,与线粒体基因表达及线粒体其他的功能有关。
异柠檬酸脱氢酶在生物体内有两种存在形式,以NAD 为辅酶的NAD-依赖型异柠檬酸脱氢酶,和以NADP 为辅酶的NADP-依赖型异柠檬酸脱氢酶。
异柠檬酸脱氢酶的主要功能,是在体内三羧酸循环中,催化异柠檬酸生成α-酮戊二酸,将NAD 还原成NADH ,通过测定α-酮戊二酸的生成量,可以计算出线粒体异柠檬酸脱氢酶活力高低。
注意:实验之前建议选择2-3个预期差异大的样本做预实验。

结核分枝杆菌与巨噬细胞相互作用的研究进展王静娴;杨春【摘要】结核分枝杆菌是一种胞内感染菌,巨噬细胞是其寄生场所.结核分枝杆菌通过阻止吞噬溶酶体的融合、减少巨噬细胞凋亡、降低巨噬细胞对刺激应答的敏感性等途径逃避巨噬细胞的免疫监视和攻击,并在细胞内存活、增殖;而巨噬细胞又是抗菌免疫的主要效应细胞,通过直接杀伤和分泌多种细胞因子,对结核分枝杆菌具有免疫调节、呈递抗原等作用.深入研究结核分枝杆菌对巨噬细胞的免疫逃逸机制及巨噬细胞抗结核免疫作用,对研究宿主抗结核免疫机制及设计新型结核病疫苗有重要意义.【期刊名称】《微生物与感染》【年(卷),期】2010(005)003【总页数】5页(P181-185)【关键词】巨噬细胞;结核分枝杆菌;免疫逃逸;免疫作用【作者】王静娴;杨春【作者单位】重庆医科大学病原生物学教研室/神经科学研究中心,重庆400016;重庆医科大学病原生物学教研室/神经科学研究中心,重庆400016【正文语种】中文结核病(tuberculosis,TB)是由结核分枝杆菌(Mycobacterium tuberculosis)所致的以呼吸系统感染为主的慢性传染病。
近年来,结核病疫情严重,位居单一病原引起患者死亡的严重传染病之首。
目前全球结核感染者约占总人口的1/3,每年有930多万人发展为活动性结核病,并有180多万人死于该病[1]。
大多数情况下,只有少数结核分枝杆菌感染者发展为活动性肺结核病;绝大多数感染者属无症状和无传染性的,即潜伏性结核感染。
巨噬细胞是机体防御系统的第1道屏障,一方面发挥着抵抗结核分枝杆菌的作用,另一方面又是结核分枝杆菌体内滞留、造成潜伏感染的主要场所。
巨噬细胞与结核分枝杆菌的相互作用对结核病的发生、发展、预后起着非常重要的作用,因此探讨两者的相互作用机制对结核病的防治尤为重要。
本文就近年来该领域的研究进展作一综述。
1 结核分枝杆菌对巨噬细胞的免疫逃逸机制感染结核分枝杆菌后,只有少数感染者发展为活动性肺结核病,大多数为潜伏性结核感染。

结核病严重影响人类健康。
潜伏期感染是其化疗疗程偏长、疗效不佳及化疗后再次复发的主要原因,也是结核病控制形势严峻的主要因素之一。
异柠檬酸裂合酶(Isocitrate lyase, ICL)在结核菌的潜伏期致病中起至关重要作用,是一个潜在的药物靶标。
它作为乙醛酸循环的第一个关键酶,催化异柠檬酸裂解生成琥珀酸和乙醛酸,从而改变碳源的流向,有利于碳源的积累,为结核菌在以脂肪酸或乙酸为碳源的环境下生长提供了有利条件。
因此筛选新型的ICL抑制剂,有利于抗结核药物的开发。
本文通过PCR方法获得ICL的编码序列,克隆至原核表达载体pQE30;将重组质粒pICL-pQE30转化大肠杆菌JM109,优化可溶性重组蛋白的表达,Ni sepharose纯化可溶性重组蛋白。
研究酶反应的线性范围以及反应时间,考察DMSO对ICL活力的影响,对测活条件进行优化,确定反应体系,并对高通量筛选模型进行评价。
异柠檬酸裂合酶(Isocitrate lyase,缩写ICL,EC4.1.3.1)是以一种在乙醛酸循环中将异柠檬酸切割为乙醛酸和琥珀酸的酶。
其产物再通过苹果酸合酶合成苹果酸,跳过了三羧酸循环(TCA循环)中脱去CO2的两步。
这一途径广泛存在于细菌、真菌与植物中。
B12是几种变位酶的辅酶,如催化Glu转变为甲基Asp的甲基天冬氨酸变位酶、催化甲基丙二酰CoA转变为琥珀酰CoA的的甲基丙二酰CoA变位酶。
B12辅酶也参与甲基及其他一碳单位的转移反应。
生理功能主要有两个:①作为甲基转移酶的辅因子,参与蛋氨酸、胸腺嘧啶等的合成,如使甲基四氢叶酸转变为四氢叶酸而将甲基转移给甲基受体(如同型半胱氨酸),使甲基受体成为甲基衍生物(如甲硫氨酸即甲基同型半胱氨酸),反应如图所示。
因此维生素B12可促进蛋白质的生物合成,缺乏时影响婴幼儿的生长发育。
②保护叶酸在细胞内的转移和贮存。
维生素B12缺乏时,人类红细胞叶酸含量低,肝脏贮存的叶酸降低,这可能与维生素B12缺乏,造成甲基从同型半胱氨酸向甲硫氨酸转移困难有关,甲基在细胞内聚集,损害了四氢叶酸在细胞内的贮存,因为四氢叶酸同甲基结合成甲基四氢叶酸的倾向强,后者合成多聚谷氨酸。
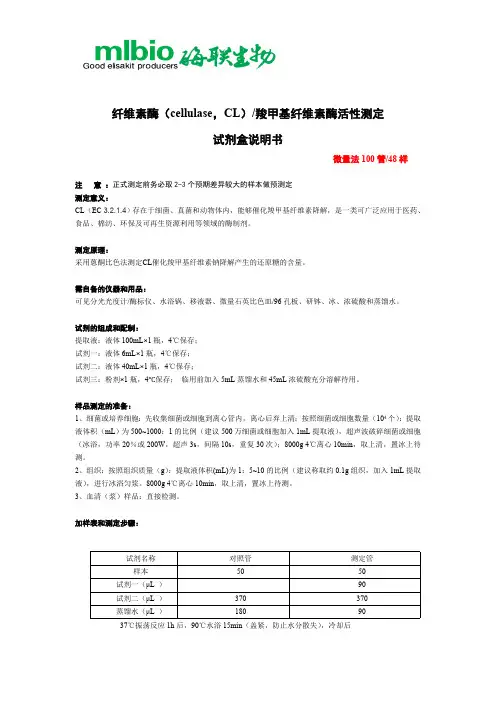
纤维素酶(cellulase ,CL )/羧甲基纤维素酶活性测定试剂盒说明书微量法100管/48样注 意 :正式测定前务必取2-3个预期差异较大的样本做预测定 测定意义:CL (EC 3.2.1.4)存在于细菌、真菌和动物体内,能够催化羧甲基纤维素降解,是一类可广泛应用于医药、食品、棉纺、环保及可再生资源利用等领域的酶制剂。
测定原理:采用蒽酮比色法测定CL 催化羧甲基纤维素钠降解产生的还原糖的含量。
需自备的仪器和用品:可见分光光度计/酶标仪、水浴锅、移液器、微量石英比色皿/96孔板、研钵、冰、浓硫酸和蒸馏水。
试剂的组成和配制:提取液:液体100mL×1瓶,4℃保存; 试剂一:液体6mL×1瓶,4℃保存; 试剂二:液体40mL×1瓶,4℃保存;试剂三:粉剂×1瓶,4℃保存; 临用前加入5mL 蒸馏水和45mL 浓硫酸充分溶解待用。
样品测定的准备:1、细菌或培养细胞:先收集细菌或细胞到离心管内,离心后弃上清;按照细菌或细胞数量(104个):提取液体积(mL )为500~1000:1的比例(建议500万细菌或细胞加入1mL 提取液),超声波破碎细菌或细胞(冰浴,功率20%或200W ,超声3s ,间隔10s ,重复30次);8000g 4℃离心10min ,取上清,置冰上待测。
2、组织:按照组织质量(g ):提取液体积(mL)为1:5~10的比例(建议称取约0.1g 组织,加入1mL 提取液),进行冰浴匀浆。
8000g 4℃离心10min ,取上清,置冰上待测。
3、血清(浆)样品:直接检测。
加样表和测定步骤:37℃振荡反应1h 后,90℃水浴15min (盖紧,防止水分散失),冷却后试剂名称 对照管 测定管 样本 50 50 试剂一(μL ) 90 试剂二(μL ) 370 370 蒸馏水(μL )180908000g 25℃离心10min,取上清,得糖化液糖化液(μL)140 140试剂三(μL)260 260 混匀,90℃水浴10min(盖紧,防止水分散失),冷却,取200μL至微量石英比色皿或96孔板中,测620nm下吸光值A,计算ΔA=A测定管-A对照管。



柠檬酸合酶、异柠檬酸脱氢酶、酮戊二酸脱氢酶复合体-概述说明以及解释1.引言1.1 概述概述部分的内容:柠檬酸合酶、异柠檬酸脱氢酶和酮戊二酸脱氢酶复合体是在生物体代谢中扮演重要角色的酶。
它们在细胞内参与柠檬酸循环中的反应,以确保能量的产生和有机物质的合成。
柠檬酸合酶是柠檬酸循环的第一步,在线粒体酶体中催化柠檬酸转化为异柠檬酸。
异柠檬酸脱氢酶则负责将异柠檬酸进一步转化为酮戊二酸。
最后,酮戊二酸脱氢酶复合体参与酮戊二酸的氧化反应,生成丙酮酸和二氧化碳,同时产生还原性能量。
这些酶的协同作用是柠檬酸循环正常进行的关键。
柠檬酸循环是细胞内能量供应的中心,它将食物中的化学能以ATP的形式储存起来,为细胞提供所需的能量。
此外,柠檬酸循环还提供了用于合成生物大分子(如脂肪酸、胆固醇等)所需的前体。
因此,对柠檬酸合酶、异柠檬酸脱氢酶和酮戊二酸脱氢酶复合体的研究有助于深入了解这些酶在能量代谢和有机物质合成中的重要作用。
本文将分别对柠檬酸合酶、异柠檬酸脱氢酶和酮戊二酸脱氢酶复合体进行深入的探讨,包括它们的结构、催化机制以及在细胞内的调控等方面。
通过对这些酶的研究,我们可以更好地理解细胞代谢的调控机制,并为相关疾病的治疗和药物研发提供理论依据。
1.2文章结构文章结构部分的内容可以按照以下方式编写:文章结构本文按照以下结构进行阐述:引言、正文和结论。
引言部分对选题进行了概述,并介绍了文章的结构。
在引言中首先简要描述了柠檬酸合酶、异柠檬酸脱氢酶和酮戊二酸脱氢酶复合体的相关背景和意义。
接下来,给出了本文的目的和研究意义。
最后,对本文的结构进行了介绍。
正文部分主要分为三个章节:柠檬酸合酶、异柠檬酸脱氢酶和酮戊二酸脱氢酶复合体。
每个章节中都包含了该酶的概述和相关性质、功能和应用等要点。
第一章节以柠檬酸合酶为主题。
在该章节中,首先介绍柠檬酸合酶的基本概念和特点。
接着详细讨论了柠檬酸合酶的功能和作用机制。
同时,列举了柠檬酸合酶在生物工程、食品工业和药物开发等方面的应用。

ICL活性测定1.标准曲线的制作:1)称取乙醛酸10 mg定容至100 ml (一水乙醛酸加入12.43mg)2)0.1 M Tris 50ml + 0.1 M HCl 36.6ml 定容至100ml3)称取0.1g二硝基苯肼溶于100ml2M盐酸(50%二硝基苯肼加入0.2g)4)称取0.6gNaOH定容至10ml5)用Tris-HCl缓冲液稀释乙醛酸母液至2、4、6、8、10 微克/毫升标准液各1 ml;同时以1 ml蒸馏水作为对照6)在各试管中加入0.2 ml 0.1% 二硝基苯肼,30℃恒温水浴保温30 min7)加入2 ml 1.5 M NaOH显色8)445 nm波长下比色,空白调零,以乙醛酸含量为横坐标,光密度为纵坐标制作标准曲线2.ICL粗酶液的制备:1) 研钵中(匀浆器)加入1ml 4℃预冷的Tris-HCl缓冲液2) 取0.25g拟南芥植株于研钵或匀浆器中冰浴研磨成浆3) 双层纱布过滤(抽滤)(离心)4) 将滤液用缓冲液定容至1ml5) 4℃12000r/min离心15min 取上清,立即测定ICL活性3. 异柠檬酸裂解酶活性测定1)称取4.71mg半胱氨酸盐酸蒸馏水定容至500ml (一水.半胱氨酸盐酸加入5.25mg)2)称取异柠檬酸三钠180.6mg 蒸馏水定容至100ml3)3.69g七水硫酸镁蒸馏水定容至100ml4)取四支试管,分别加入1 ml Tris-HCl缓冲液;0.2 ml 0.15 mM硫酸镁;0.2ml 0.06mM半胱氨酸-盐酸;0.2ml酶液5)30℃恒温水浴10min6)两支试管加0.2 ml 7mM异柠檬酸三钠;对照两管中先加0.2 ml 10% 三氯乙酸,再加0.2ml 7mM异柠檬酸三钠7)30℃恒温水浴30min8)各处理试管加入0.2 ml 10% 三氯乙酸终止反应(对照除外)9)3000r/min离心5min 取上清1ml加入0.2 ml 0.1%二硝基苯肼10)30℃恒温水浴30min11)加入2 ml 1.5M NaOH显色;显色时间?空白:1ml缓冲液+ 0.2ml 0.1% 二硝基苯肼+ 2ml 1.5M NaOH做空白12)445nm比色,读取光密度,校正后的光密度值=样品光密度-对照光密度根据校正后的光密度值在标准曲线上查得相应的乙醛酸含量3.ICL活性计算:4.所用试剂及母液的配制:乙醛酸、半胱氨酸-盐酸异柠檬酸三钠二硝基苯肼5.所用仪器及型号:6 注意事项:1.ICL极易失活,所用试剂均应提前预冷,提取过程严格冰上操作,提取后立即测定2.材料经高速离心后,吸取上清避免吸取上层悬浮油状物3.乙醛酸苯肼比色液颜色稳定时间在15分钟内,所以比色测定时间应在加入NaOH后15分钟内7.实验参考文献:McFadden, B. A. 1969. Isocitrate lyase. Methods Enzymol,13:163-170.Ching TM. Glyoxysomes in megagamethoph yte of germinating ponderosa pine seeds. Plant Physiol, 1970, 46: 475–482。

结核杆菌潜伏感染小鼠模型的制备及其评价指标师长宏【摘要】目前对于结核分枝杆菌进入潜伏期的机制以及再激化的原因知之甚少,一个重要的原因是缺乏潜伏感染(LTBI)动物模型,完整的LTBI模型应包括两种类型,一是低剂量荷菌的持续性感染模型,另一种为潜伏感染模型,即Cornell模型的改进型.综合使用柯氏量表评分、脾肺荷菌数、诱导的IFN-γ和TNF-α水平、组织中IL-10和IL-4的表达、脏器中特异性抗原负荷以及激素诱导TB复发的时间、潜伏感染相关基因的表达水平等指标可以比较准确、客观、特异性的评价小鼠LTBI模型的反应性.【期刊名称】《中国实验动物学报》【年(卷),期】2010(018)006【总页数】4页(P538-541)【关键词】潜伏感染;模型;评价【作者】师长宏【作者单位】第四军医大学实验动物中心,西安,710032【正文语种】中文【中图分类】Q95;Q891WHO公布的数据显示,全球约有1/3人口处于结核分枝杆菌(M.tuberculosis,MTB)感染状态,其中5% ~10%的感染者有可能发展为活动性结核[1](tuberculosis,TB),而 90%以潜伏感染(latent tuberculosis infection,LTBI)形式存在,形成无临床症状的隐性感染者[2]。
LTBI不同于急性感染,病因复杂,病程长,目前对于MTB进入潜伏期的机制以及再激化的原因知之甚少,一个重要的原因是缺乏标准化的LTBI动物模型,对模型的反应性缺乏准确、客观、灵敏的评价指标。
本文就LTBI小鼠模型的制备方法及特异性评价体系的建立进行了综述。
MTB感染机体后,一方面通过诱导T细胞产生Th1型细胞因子(如 IFN-γ),活化巨噬细胞,增强其杀灭MTB的能力,从而起到保护性免疫作用。
另一方面,Th2型细胞因子可通过抑制Th1型细胞因子,降低巨噬细胞杀灭MTB的能力,从而削弱MTB的免疫应答[3]。
这种 Th1型/Th2型细胞因子的动态平衡可有效控制MTB的感染,但平衡一旦被打破,将会导致TB的发生与发展。
以异柠檬酸裂解酶为靶点筛选抗持留结核分枝杆菌药物(作者:___________单位: ___________邮编: ___________)【摘要】进入21世纪,结核病仍然是临床上发病率和死亡率最高的传染病之一。
目前,结核分枝杆菌(Mycobacterium tuberculosis)的多重耐药,以及在抗结核药物作用过程中结核分枝杆菌的持留状态,已成为全世界结核病控制工作的主要障碍。
异柠檬酸裂解酶(isocitrate lyase,ICL)是乙醛酸循环途径中的关键限速酶之一,决定了结核分枝杆菌的持留性。
在文中我们将描述异柠檬酸裂解酶的基本性质及结构特征,希望能通过对ICL抑制剂作用区域的了解来推动抗持留结核分枝杆菌药物的研究。
【关键词】异柠檬酸裂解酶;结核分枝杆菌;持留状态ABSTRACT Getting into the 21st century, tuberculosis remains a leading cause of mortality worldwide. The main obstacles to the global control of the disease are emerging multi-drug resistant strains of Mycobacterium tuberculosis and the recalcitrance of persistent infections to treatment with conventional anti-TB drugs. Isocitrate lyase (ICL) is a keyrate-limiting enzyme in the glyoxylate bypass, and it is needed for persistent Mycobacterium tuberculosis to get energy. Consequently, isocitrate lyase is an attractive targets for the development of new antituberculosis agents. In this paper, the characteristion and structure of ICL were decribed. Our understanding of the inhibitor-bound sites will provide a springboard to find drugs which target the tuberculosis infection.KEY WORDS Isocitrate lyase; Mycobacterium tuberculosis; Persistent infections结核分枝杆菌的持留状态是治疗结核病的瓶颈之一。
中 文 说 明 书适用产品目录号:E1910 和E19602020版 CTM040原英文技术手册TM040Dual-Luciferase®Reporter Assay System普洛麦格(北京)生物技术有限公司Promega (Beijing) Biotech Co., Ltd 地址:北京市东城区北三环东路36号环球贸易中心B座907-909电话:************网址:技术支持电话:800 810 8133(座机拨打),400 810 8133(手机拨打)技术支持邮箱:*************************CTM0402020制作1Dual-Luciferase® Reporter Assay System所有技术文献的英文原版均可在/ protocols获得。
请访问该网址以确定您使用的说明书是否为最新版本。
如果您在使用该试剂盒时有任何问题,请与Promega 北京技术服务部联系。
电子邮箱:*************************1.产品描述 (2)1.A. Dual-Luciferase® Reporter Assay化学反应过程 (3)1.B. Dual-Luciferase® Reporter Assay检测模式 (6)1.C. Passive Lysis Buffer (7)2.产品组分和储存条件 (8)3.pGL4 萤光素酶报告基因载体 (9)3.A. pGL4 载体介绍 (9)3.B. 共转染实验的重要注意事项 (9)4.仪器注意事项 (10)4.A. 单样品发光检测仪 (10)4.B. 多样品读板发光检测仪 (10)4.C. 闪烁计数器 (10)5.使用Passive Lysis Buffer制备细胞裂解物 (11)5.A. 制备Passive Lysis Buffer (11)5.B. 培养于多孔板中细胞的被动裂解 (12)5.C. 通过刮取主动裂解细胞 (13)6.Dual-Luciferase® Reporter Assay操作步骤 (14)6.A. 制备 Luciferase Assay Reagent II (14)6.B. 制备Stop & Glo®试剂 (14)6.C. 标准检测步骤 (15)6.D. 清洗试剂进样器的重要注意事项 (17)6.E. 检测本底的测定 (18)7.参考文献 (20)8.附录 (21)8.A. 缓冲液和溶液的组成 (21)8.B. 相关产品 (21)9.内容变更总结 (24)普洛麦格(北京)生物技术有限公司Promega (Beijing) Biotech Co., Ltd 地址:北京市东城区北三环东路36号环球贸易中心B座907-909电话:************网址:技术支持电话:800 810 8133(座机拨打),400 810 8133(手机拨打)技术支持邮箱:*************************CTM0402020制作21. 产品描述遗传报告基因系统目前广泛用于真核基因表达和细胞生理学的研究。
柠檬酸检测试剂盒说明书
【药品名称】通用名称:柠檬酸测定试剂盒(酶法)
汉语拼音:NingMengSuanCeDingShiJiHe(MeiFa)
【成份】R1:试剂1 Tris 缓冲液40mmol/L,NADH 0.4mmol/L,叠氮钠
0.95g/LR2a:试剂2PIPES 600mmol/L,叠氮钠0.95g/L;
R2b:试剂3(干粉)苹果酸脱氢酶>40KU/L,柠檬酸裂解酶>1KU/L;
柠檬酸标准品:柠檬酸每批定值见瓶签(注:干粉试剂为溶解后浓度。
)
【适应症】本品用于体外定量测定人精浆样本中柠檬酸的浓度。
【规格】R1:40mL R2a:10mL R2b:1×10mL;R1:80mL R2a:20mL R2b:2×10mL;R1:200mL R2a:50mL R2b:5×10mL;R1:800mL R2a:200mL R2b:20×10mL;100T/盒;200T/盒。
【批准文号】渝食药监械(准)字20XX第2400XXX号。
乳酸脱氢酶是一种氧化还原酶,催化丙酮酸和乳酸的互相转化反应。
乳酸脱氢酶由4个亚单位构成,有两种类型:肌肉型和心肌型。
根据其亚单位成分,分为5种同功酶。
乳酸脱氢酶总活性比色法定量检测试剂是一种旨在通过乳酸脱氢酶反应系统中还原型烟酰胺腺嘌呤二核苷酸氧化后峰值的降低,即采用比色法来测定细胞萃取样品中
酶活性的权威而经典的技术方法。
该技术由大师级科学家精心研制、成功实验证明的。
其适用于各种细胞或组织裂解样品(动物、人体、植物、昆虫等)乳酸脱氢酶的总活性检测。
产品严格无菌,即到即用,操作简捷,性能稳定。
异柠檬酸检测
异柠檬酸(Isocitric acid)是柠檬酸的异构体,虽然量少,但广泛存在于生物界。
柠檬酸在乌头酸酶的作用下可逆地生成异柠檬酸和顺乌头酸。
在异柠檬酸脱氢酶的作用下变成α-酮戊二酸,在异柠檬酸裂合酶(isocitrate lyase)的作用下变成琥珀酸与乙醛酸。
迪信泰检测平台使用高效液相色谱的方法,使用Agilent 1260 Infinity型高效液相色谱仪对样品进行分离,DAD检测器鉴定,该方法可以高效、精准的检测异柠檬酸的含量变化。
此外,我们还提供其他三羧酸循环系列检测服务,以满足您的不同需求。
样品制备
三羧酸循环代谢物提取方法(此部分涉及到公司的核心工艺,以下提供常规的提取工艺)
1)取10 mL左右的样品;
2)5℃,12000rpm离心10 min;
3)取上清;
4)0.45 μm的微孔滤膜过滤,用HPLC检测。
HPLC测定异柠檬酸样本要求:
1. 请确保样本量大于0.2g或者0.2mL。
周期:2~3周
项目结束后迪信泰检测平台将会提供详细中英文双语技术报告,报告包括:
1. 实验步骤(中英文)
2. 相关质谱参数(中英文)
3.质谱图片
4. 原始数据
5. 异柠檬酸含量信息。
表面偶极离子亲水磁珠固定化异柠檬酸裂解酶及其表征段昌园;姜雪;曾宏威;杨晓兰【期刊名称】《食品与生物技术学报》【年(卷),期】2024(43)1【摘要】比较两种亲水磁珠固定化结核分枝杆菌异柠檬酸裂解酶(Mycobacterium tuberculosis isocitrate lyase,Mt ICL)并优化,为天然产物中Mt ICL先导抑制剂的亲和富集筛选提供适用的固定化酶。
构建6×His-pET28a-ICL,经E.coli BL21(DE3)重组表达、Ni2+-NTA柱纯化和酶学性质表征获得Mt ICL(重组蛋白质)。
用羧基功能化和Ni2+-NTA功能化制备两种表面偶极离子亲水磁珠固定化Mt ICL,比较其固载量、酶活力、稳定性及对已知抑制剂的响应。
羧基磁珠固定化酶表观保留比活显著高于Ni2+-NTA固定化酶。
当羧基磁珠与重组蛋白质加样质量比为60∶1时,固定化酶表观保留比活可达游离酶的85%,此时羧基磁珠对Mt ICL表观固载量为(7.2±0.2)mg/g(以磁珠质量计,n=3)。
羧基磁珠固定化Mt ICL 对衣康酸的亲和力与游离酶无显著差异(P>0.05),且稳定性更强。
此羧基磁珠固定化Mt ICL可望作为磁分离、亲和富集筛选天然产物中Mt ICL抑制剂类抗结核先导化合物。
【总页数】9页(P20-28)【作者】段昌园;姜雪;曾宏威;杨晓兰【作者单位】重庆医科大学检验医学院【正文语种】中文【中图分类】Q814【相关文献】1.单个银纳米聚合体的偶极表面等离子体共振灵敏表面增强拉曼散射2.非离子表面活性剂亲水-亲油平衡值的水数表征法3.FeXXI离子电偶级、磁偶极及电四极跃迁振子强度的计算4.兼性离子修饰亲水磁珠固定化谷胱甘肽-S-转硫酶P1及其表征5.砷化镓和其它砷化物对大豆种子萌发和异柠檬酸裂解酶(ICL)及超氧物歧化酶(SOD)活性的影响因版权原因,仅展示原文概要,查看原文内容请购买。
货号: QS3114 规格:50管/48样异柠檬酸裂解酶(isocitrate lyase,ICL)试剂盒说明书
紫外分光光度法
正式测定前务必取2-3 个预期差异较大的样本做预测定
测定意义:
ICL(EC4.1.3.1)主要存在于植物和微生物中,油料作物种子在萌发过程中,通过乙醛酸循环及其他过程将脂肪转变成碳水化合物。
ICL是乙醛酸循环的关键酶之一。
测定原理:
ICL催化异柠檬酸降解为乙醛酸和琥珀酸,乙醛酸和NADH在LDH的作用下生成乙醇和NAD,NADH在340nm下有特征吸收峰,监测340nm吸光度的减小速率可间接反应ICL活性。
自备实验用品及仪器:
紫外分光光度计、台式离心机、水浴锅、移液器、1mL石英比色皿、研钵、冰和蒸馏水
试剂组成和配制:
提取液:液体50mL×1瓶,4℃保存;
试剂一:液体15mL×1瓶,4℃保存;
试剂二:液体15mL×1瓶,4℃保存;
试剂三:粉剂×3瓶,-20℃保存;临用前每瓶加入5mL蒸馏水,充分混匀待用;用不完的试剂仍-20℃保存;
试剂四:粉剂×3瓶,-20℃保存;临用前每瓶加入5mL蒸馏水,充分混匀待用;用不完的试剂分装后-20℃保存,禁止反复冻融。
试剂五:液体×2支,4℃保存;临用前每支加入560μL蒸馏水,充分混匀待用;用不完的试剂仍4℃保存;
试剂六:粉剂×3瓶,4℃保存;临用前每瓶加入5mL蒸馏水,充分混匀待用。
用不完的试剂-20℃保存;
样本的前处理:
1、细菌或培养细胞:先收集细菌或细胞到离心管内,离心后弃上清;按照细菌或细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细菌或细胞加入1mL提取液),超声波破碎细菌或细胞(冰浴,功率20%或200W,超声3s,间隔10s,重复30次);15000g 4℃离心10min,取上清,置冰上待测。
2、组织:按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL提取液),进行冰浴匀浆。
15000g 4℃离心10min,取上清,置冰上待测。
第1页,共2页
340nm波长下记录20秒时的初始吸光度A1和2分20秒时的吸光度A2,计算ΔA=A1-A2。
注意:若一次性测定样本较多,可将试剂一、二、三、四、五和样本按比例配成混合液,在37℃(哺乳动物)或25℃(其它物种)水浴5min以上,测定时加入1220µL混合液和300µL 试剂六测定。
ICL活性计算:
(1)按样本蛋白浓度计算:
单位的定义:每mg组织蛋白中每分钟消耗1 nmol的NADH定义为一个酶活力单位。
ICL(nmol/min /mg prot)=[ΔA×V反总÷(ε×d)×109]÷(V样×Cpr) ÷T=2443×ΔA÷Cpr (2)按样本鲜重计算:
单位的定义:每g组织每分钟消耗1 nmol的NADH定义为一个酶活力单位。
ICL(nmol/min /g 鲜重)=[ΔA×V反总÷(ε×d)×109]÷(W× V样÷V样总) ÷T=2443×ΔA÷W
(3)按细菌或细胞密度计算:
单位的定义:每1万个细菌或细胞每分钟消耗1 nmol的NADH定义为一个酶活力单位。
ICL(nmol/min /104cell)=[ΔA×V反总÷(ε×d)×109]÷(500×V样÷V样总) ÷T=4.886×ΔA
V反总:反应体系总体积,1.52×10-3 L;ε:NADH摩尔消光系数,6.22×103 L / mol /cm;d:比色皿光径,1cm;V样:加入样本体积,0.05 mL;V样总:加入提取液体积,1 mL;T:反应时间,2 min;Cpr:样本蛋白质浓度,mg/mL;W:样本质量,g;500:细菌或细胞总数,500万。
第2页,共2页。